第九单元 第二节金属的化学性质 课件 18张幻灯片
文档属性
| 名称 | 第九单元 第二节金属的化学性质 课件 18张幻灯片 |  | |
| 格式 | zip | ||
| 文件大小 | 253.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-04-30 09:45:43 | ||
图片预览






文档简介
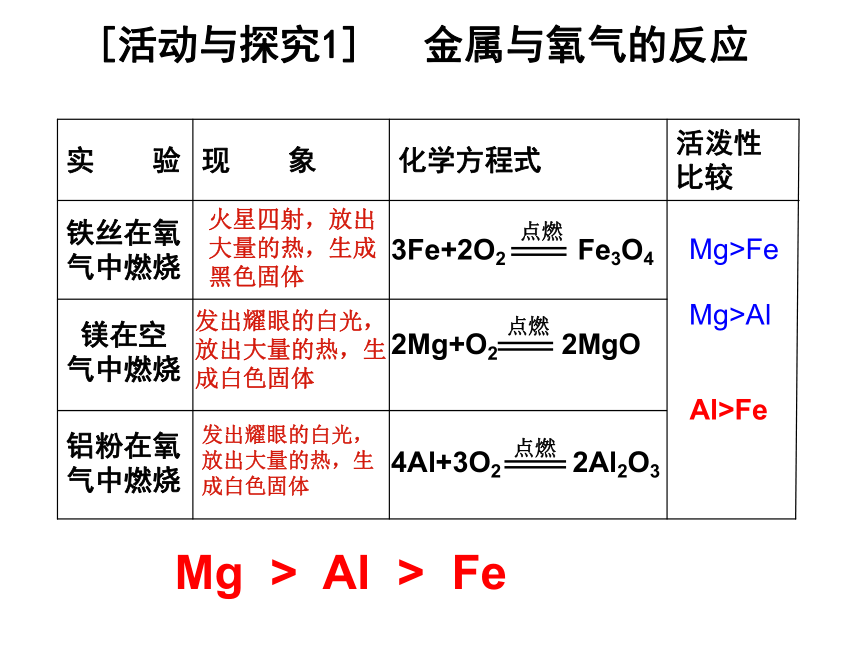
课件18张PPT。慧眼识金 黄金饰品中的假货常常鱼目混珠,社会上有些不法分子时常以黄铜(铜、锌合金)冒充黄金进行诈骗活动。你有哪些方法可以揭穿他们的骗局?第二节 金属的化学性质 镁在空气中燃烧铁丝在氧气中燃烧活泼性比较化学方程式现 象实 验火星四射,放出大量的热,生成黑色固体发出耀眼的白光,放出大量的热,生成白色固体铝粉在氧气中燃烧发出耀眼的白光,放出大量的热,生成白色固体Mg>FeAl>FeMg > Al > FeMg>Al[活动与探究1] 金属与氧气的反应 2.想一想,铝制品比铁制品有哪些优良的性能?为什么?3.分析“真金不怕火炼”蕴含的化学原理。4Al+3O2=2Al2O3交流共享1.对比镁、铁、铝分别与氧气发生反应的实验现象,分析一下可能有哪些原因导致了在这三个实验中金属与氧气反应的难易和剧烈程度不同?(1)氧气的浓度 (2)金属与氧气的接触面积
(3)金属本身的化学性质(即:金属的活泼性) (阅读:P62“多识一点”)结 论2. 判断金属活动性的方法一:1.大多数金属在一定条件下都能与氧气发生反应。 根据金属与氧气反应的难易和反应现象的剧烈程度判断。[活动与探究2] 金属与酸的反应 实验探究:
1.在试管里分别放入两小块镁、铝、铁、铜,再分别加入约2~3 mL稀盐酸,观察现象,比较反应的剧烈程度。如果有气体生成,判断反应后生成了什么气体?(用燃着的小木条放在试管口检验)
2. 用稀硫酸代替稀盐酸进行实验,并比较 发生的现象。 金属与稀HCl的反应大量气泡, 反应最快大量气泡, 反应较快少量气泡,反应较慢,溶液由无色变为浅绿色无现象Mg+2HCl=MgCl2+H2↑2Al+6HCl=2AlCl3+3H2↑Fe+2HCl=FeCl2+H2↑无金属与稀H2SO4的反应有少量气泡生成2Al+3H2SO4=Al2(SO4)3+3H2↑ 1. 活泼金属能与稀盐酸或稀硫酸反应;
2. 判断金属活动性的方法二:
可根据金属与稀盐酸(或稀硫酸)①是否反应②反应的快慢判断金属的活动性强弱。结 论K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au金 属 的 活 动 性 由 强 逐 渐 减 弱金属活动顺序表的意义:1.金属的位置越靠前,它的活动性就越强;2.排在氢前面的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。常见金属的活动性顺序表氢之前,能置换,越靠前,越明显;
钾钙钠,要避嫌,铁要生成亚铁盐;
常用酸,有两种,稀盐酸、稀硫酸。你知道吗 当欧洲炼金术士为发现铁钉放入硫酸铜溶液中得到“金”而欣喜若狂时,我国劳动人民在早于他们一千七百多年时,就已掌握这种方法并用于生产了。
西汉时代的《淮南万毕术》中就有“曾青得铁则化为铜”之说,意思是说:把铁放入硫酸铜溶液中,就可以置换出铜。 阅读上面的资料,你获得了什么样的信息?你还能提出什么用的问题?Fe+CuSO4=Cu+FeSO4湿法冶金22【活动与探究3】 金属与盐溶液的反应 将锌片、铁丝、铜丝分别放入硫酸铜、硝酸银、氯化钠溶液中,观察并记录实验现象。 铁丝表面有红色的铜析出,溶液由蓝色变为浅绿色。 铁丝表面变黑,溶液由无色变为浅绿色。无现象铜丝表面有银白色的金属析出,溶液由无色变为蓝色。无现象Fe+CuSO4=Fe+2AgNO3=Cu+2AgNO3=Cu+FeSO42Ag+Fe(NO3)22Ag+Cu(NO3)2 锌片表面变黑,溶液由蓝色变为无色锌片表面变黑无现象Zn+CuSO4=Zn+2AgNO3=Cu+ZnSO42Ag+Zn(NO3)2什么样的金属能和什么样的盐溶液反应?交流与讨论:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au溶液中金属遇到盐,前面能将后面换;
铁要生成亚铁盐,钾、钙、钠靠边站。 根据金属能不能把另一种金属从盐溶液中置换出来,判断金属活动性的强弱。2.判断金属活动性的方法三:在金属活动顺序表中结 论18 位置在前的金属可以把位于其后的金属从它们的盐溶液中置换出来。Zn + H2SO4 = ZnSO4 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
置换反应化合物 观察下列反应的化学方程式,分析这些反应有什么共同特点?单质单质化合物化学反应的基本类型两种或两种
以上一种一种两种或两种
以上一种单质,
一种化合物一种单质,
一种化合物两种化合物两种化合物交换成分1.与氧气反应
金属越活泼,反应越容易,越剧烈。
2.氢前金属+盐酸(稀硫酸)(置换反应)
金属越活泼,反应越容易,速度越快。
3.位于前面的金属能把位于其后的金属从它的盐溶液中置换出来。 学完本课题你应该知道一、金属的化学性质:二、置换反应三、金属活动顺序及其应用判断金属能否与酸和盐溶液发生置换反应,及反应的快慢。 A+BC=B+AC
(3)金属本身的化学性质(即:金属的活泼性) (阅读:P62“多识一点”)结 论2. 判断金属活动性的方法一:1.大多数金属在一定条件下都能与氧气发生反应。 根据金属与氧气反应的难易和反应现象的剧烈程度判断。[活动与探究2] 金属与酸的反应 实验探究:
1.在试管里分别放入两小块镁、铝、铁、铜,再分别加入约2~3 mL稀盐酸,观察现象,比较反应的剧烈程度。如果有气体生成,判断反应后生成了什么气体?(用燃着的小木条放在试管口检验)
2. 用稀硫酸代替稀盐酸进行实验,并比较 发生的现象。 金属与稀HCl的反应大量气泡, 反应最快大量气泡, 反应较快少量气泡,反应较慢,溶液由无色变为浅绿色无现象Mg+2HCl=MgCl2+H2↑2Al+6HCl=2AlCl3+3H2↑Fe+2HCl=FeCl2+H2↑无金属与稀H2SO4的反应有少量气泡生成2Al+3H2SO4=Al2(SO4)3+3H2↑ 1. 活泼金属能与稀盐酸或稀硫酸反应;
2. 判断金属活动性的方法二:
可根据金属与稀盐酸(或稀硫酸)①是否反应②反应的快慢判断金属的活动性强弱。结 论K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au金 属 的 活 动 性 由 强 逐 渐 减 弱金属活动顺序表的意义:1.金属的位置越靠前,它的活动性就越强;2.排在氢前面的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。常见金属的活动性顺序表氢之前,能置换,越靠前,越明显;
钾钙钠,要避嫌,铁要生成亚铁盐;
常用酸,有两种,稀盐酸、稀硫酸。你知道吗 当欧洲炼金术士为发现铁钉放入硫酸铜溶液中得到“金”而欣喜若狂时,我国劳动人民在早于他们一千七百多年时,就已掌握这种方法并用于生产了。
西汉时代的《淮南万毕术》中就有“曾青得铁则化为铜”之说,意思是说:把铁放入硫酸铜溶液中,就可以置换出铜。 阅读上面的资料,你获得了什么样的信息?你还能提出什么用的问题?Fe+CuSO4=Cu+FeSO4湿法冶金22【活动与探究3】 金属与盐溶液的反应 将锌片、铁丝、铜丝分别放入硫酸铜、硝酸银、氯化钠溶液中,观察并记录实验现象。 铁丝表面有红色的铜析出,溶液由蓝色变为浅绿色。 铁丝表面变黑,溶液由无色变为浅绿色。无现象铜丝表面有银白色的金属析出,溶液由无色变为蓝色。无现象Fe+CuSO4=Fe+2AgNO3=Cu+2AgNO3=Cu+FeSO42Ag+Fe(NO3)22Ag+Cu(NO3)2 锌片表面变黑,溶液由蓝色变为无色锌片表面变黑无现象Zn+CuSO4=Zn+2AgNO3=Cu+ZnSO42Ag+Zn(NO3)2什么样的金属能和什么样的盐溶液反应?交流与讨论:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au溶液中金属遇到盐,前面能将后面换;
铁要生成亚铁盐,钾、钙、钠靠边站。 根据金属能不能把另一种金属从盐溶液中置换出来,判断金属活动性的强弱。2.判断金属活动性的方法三:在金属活动顺序表中结 论18 位置在前的金属可以把位于其后的金属从它们的盐溶液中置换出来。Zn + H2SO4 = ZnSO4 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
置换反应化合物 观察下列反应的化学方程式,分析这些反应有什么共同特点?单质单质化合物化学反应的基本类型两种或两种
以上一种一种两种或两种
以上一种单质,
一种化合物一种单质,
一种化合物两种化合物两种化合物交换成分1.与氧气反应
金属越活泼,反应越容易,越剧烈。
2.氢前金属+盐酸(稀硫酸)(置换反应)
金属越活泼,反应越容易,速度越快。
3.位于前面的金属能把位于其后的金属从它的盐溶液中置换出来。 学完本课题你应该知道一、金属的化学性质:二、置换反应三、金属活动顺序及其应用判断金属能否与酸和盐溶液发生置换反应,及反应的快慢。 A+BC=B+AC
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
