【备考2023】浙教版科学中考第三轮冲刺讲义(二十二 ):物质的鉴别与推断【word,含答案】
文档属性
| 名称 | 【备考2023】浙教版科学中考第三轮冲刺讲义(二十二 ):物质的鉴别与推断【word,含答案】 |

|
|
| 格式 | doc | ||
| 文件大小 | 510.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-22 00:00:00 | ||
图片预览



文档简介
一、物质的鉴别
1. 原理:主要是利用物质的各种物理性质和化学性质,产生不同的实验现象,从而将物质区分开来。
2. 鉴别方法
(1)物理方法
①观察颜色
常见红色固体:氧化铁(红棕色)、铜(紫红色)、红磷;
常见黑色固体:四氧化三铁、氧化铜、铁粉、碳、二氧化锰;
常见溶液颜色:含Cu2+的溶液为蓝色、含Fe3+的溶液为黄色、含Fe2+的溶液为浅绿色。
②闻气味
常见具有刺激性气味的气体:二氧化硫、氨气、氯化氢。
③物质的溶解性
常见不溶于水的物质:CaCO3、BaCO3、Mg(OH)2、Al(OH)3、AgCl、BaSO4(白色),Cu(OH)2(蓝色),Fe(OH)3(红褐色)。
④溶解时的吸放热现象
NaOH固体溶于水放热(选填“吸热”或“放热”,下同),NH4NO3固体溶于水吸热。
⑤磁性:铁、四氧化三铁具有磁性,能被磁铁吸引。
(2)化学方法
①针对酸碱性不同的溶液,利用指示剂或pH试纸进行鉴别。
例:鉴别稀盐酸与氢氧化钠溶液,可选用酚酞溶液,观察到溶液变红的是氢氧化钠溶液,观察到溶液变红色的是稀盐酸。
【特别提醒】有些盐溶液显酸性或碱性,如鉴别碳酸钠溶液与氢氧化钠溶液,不能用酚酞溶液。
②根据反应的现象不同进行鉴别。通过加入常见试剂,使物质间发生反应并呈现不同现象,如生成气体或沉淀、溶液颜色有变化等。
例:鉴别Na2CO3溶液与NaCl溶液,可选用稀盐酸,观察到有气泡产生的是Na2CO3溶液,观察到无明显现象的是NaCl溶液。
二、推断题的“题眼”
(一)物质的俗名及主要成分
1. 物质的俗名
俗名 化学式
干冰 CO2
生石灰 CaO
熟石灰、消石灰 Ca(OH)2
苛性钠、火碱、烧碱 NaOH
纯碱、苏打 Na2CO3
小苏打 NaHCO3
2. 物质的主要成分
物质 主要成分的化学式
天然气、沼气 CH4
铁锈、赤铁矿 Fe2O3
食盐 NaCl
石灰石、大理石 CaCO3
(二)常见物质的颜色
1. 常见固体的颜色
(1)红色:铜(Cu)、氧化铁(Fe2O3)
(2)黑色:四氧化三铁(Fe3O4)、碳粉(C)、铁粉(Fe)、氧化铜(CuO)
2. 常见溶液的颜色
(1)蓝色溶液 含Cu2+的溶液,如CuSO4溶液、Cu(NO3)2溶液。
(2)浅绿色溶液 含Fe2+的溶液,如FeCl2溶液、FeSO4溶液。
(3)黄色溶液 含Fe3+的溶液,如FeCl3溶液、Fe(NO3)3溶液、Fe2(SO4)3溶液。
(4)紫红色溶液:KMnO4溶液。
3. 常见沉淀的颜色及酸溶性
颜色 化学式 是否溶于酸
白色沉淀 CaCO3、BaCO3、Mg(OH)2 溶
BaSO4、AgCl 不溶
蓝色沉淀 Cu(OH)2 溶
例1、下列关于物质的鉴别、除杂所选用的试剂或方法不正确的是( )
选项 实验目的 试剂或方法
A 鉴别FeCl3、NaCl、NaOH、MgCl2四种溶液 不另加试剂
B 除去二氧化碳中混有的氯化氢气体 将气体通过碱石灰
C 除去MgCl2溶液中少量的CuCl2 加入过量镁粉、充分反应、过滤
D 除去N2中的少量O2 将气体缓缓通过灼热的铜网
A.A B.B C.C D.D
例2、甲、乙、丙、丁四种溶液中,分别含有Ba2+、Mg2+、Na+、H+、Cl﹣、OH﹣、CO32﹣、SO42﹣中的一种阳离子和一种阴离子。为确定四种溶液中分别含有哪种阳离子或阴离子,进行了如下实验:
①将甲溶液分别与其他三种溶液混合,都观察到白色沉淀生成
②将乙、丁溶液混合,有气泡产生
③向丙溶液中滴入AgNO3溶液,可明显观察到白色沉淀,加稀硝酸后,沉淀不消失
分析实验得到的以下结论中错误的是( )
A.甲溶液中一定含有Ba2+
B.乙溶液中可能含有SO42﹣
C.丙溶液中一定含有Cl﹣
D.丁溶液中一定含有Na+
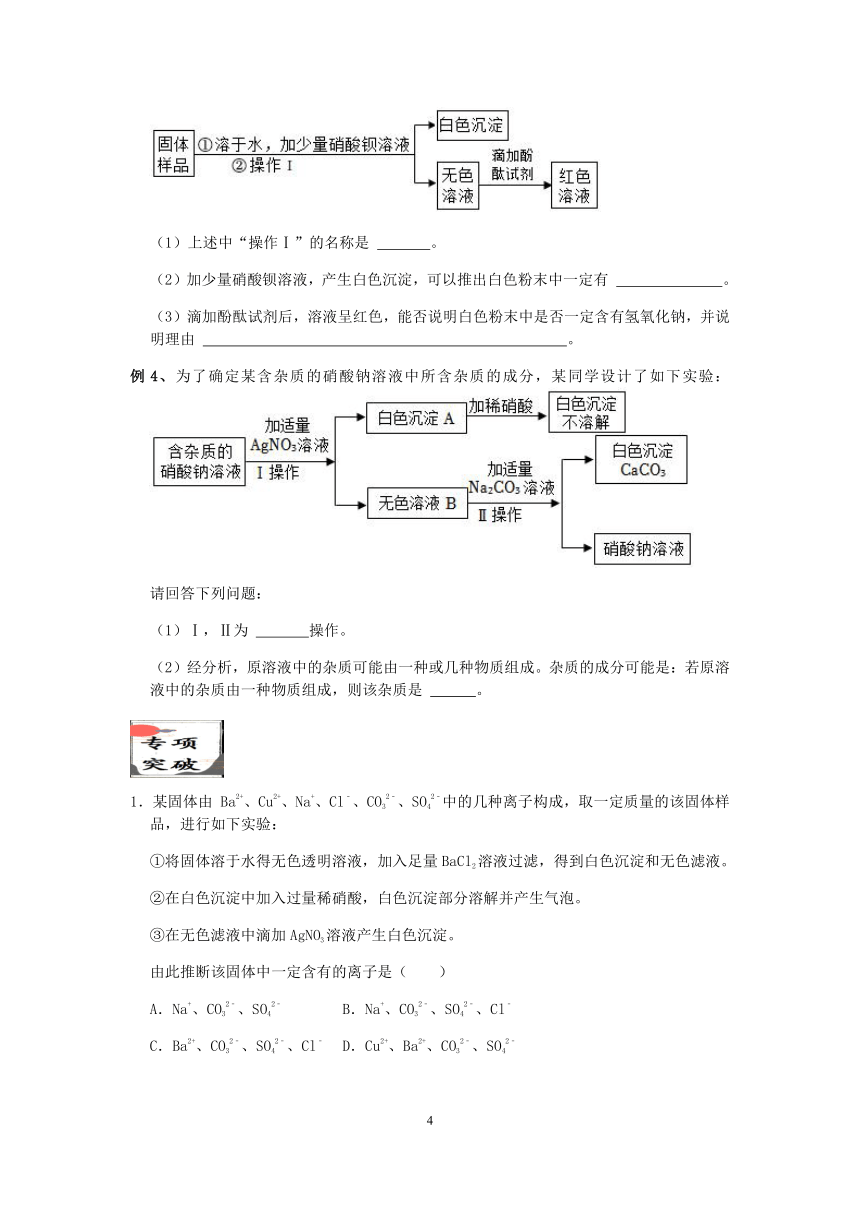
例3、实验室里有一包白色固体,可能由氯化钠、碳酸钠、氢氧化钠中的一种或几种组成,为了检测及成分,按如图所示流程进行操作:
(1)上述中“操作Ⅰ”的名称是 。
(2)加少量硝酸钡溶液,产生白色沉淀,可以推出白色粉末中一定有 。
(3)滴加酚酞试剂后,溶液呈红色,能否说明白色粉末中是否一定含有氢氧化钠,并说明理由 。
例4、为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如下实验:
请回答下列问题:
(1)Ⅰ,Ⅱ为 操作。
(2)经分析,原溶液中的杂质可能由一种或几种物质组成。杂质的成分可能是:若原溶液中的杂质由一种物质组成,则该杂质是 。
1.某固体由 Ba2+、Cu2+、Na+、Cl﹣、CO32﹣、SO42﹣中的几种离子构成,取一定质量的该固体样品,进行如下实验:
①将固体溶于水得无色透明溶液,加入足量BaCl2溶液过滤,得到白色沉淀和无色滤液。
②在白色沉淀中加入过量稀硝酸,白色沉淀部分溶解并产生气泡。
③在无色滤液中滴加AgNO3溶液产生白色沉淀。
由此推断该固体中一定含有的离子是( )
A.Na+、CO32﹣、SO42﹣ B.Na+、CO32﹣、SO42﹣、Cl﹣
C.Ba2+、CO32﹣、SO42﹣、Cl﹣ D.Cu2+、Ba2+、CO32﹣、SO42﹣
2.下列依据实验目的所进行的操作,正确的是( )
选项 实验目的 操作
A 测定碳酸钠溶液的pH值的大小 用镊子夹取pH试纸,蘸取待测液,待显色后与比色卡比较
B 用排水法收集氧气时,检验氧气是否收集满 用带火星的木条伸入集气瓶中,观察木条是否复燃
C 比较锌和铝的化学活动性顺序 将两种金属与等质量且同浓度的硫酸反应,观察是否产生气泡
D 鉴别氢氧化钠和氢氧化钡 取样后滴加稀硫酸溶液,观察是否变浑浊
A.A B.B C.C D.D
3.有一包固体,可能含有锌粉、碳粉、氧化铜、氢氧化钾、氯化钠中的一种或几种。为探究该固体组成,某科学兴趣小组的成员进行了如图所示的实验。
请回答下列问题:
(1)原固体中一定不含有一种物质,理由是 。
(2)原固体中一定含有的物质是 。
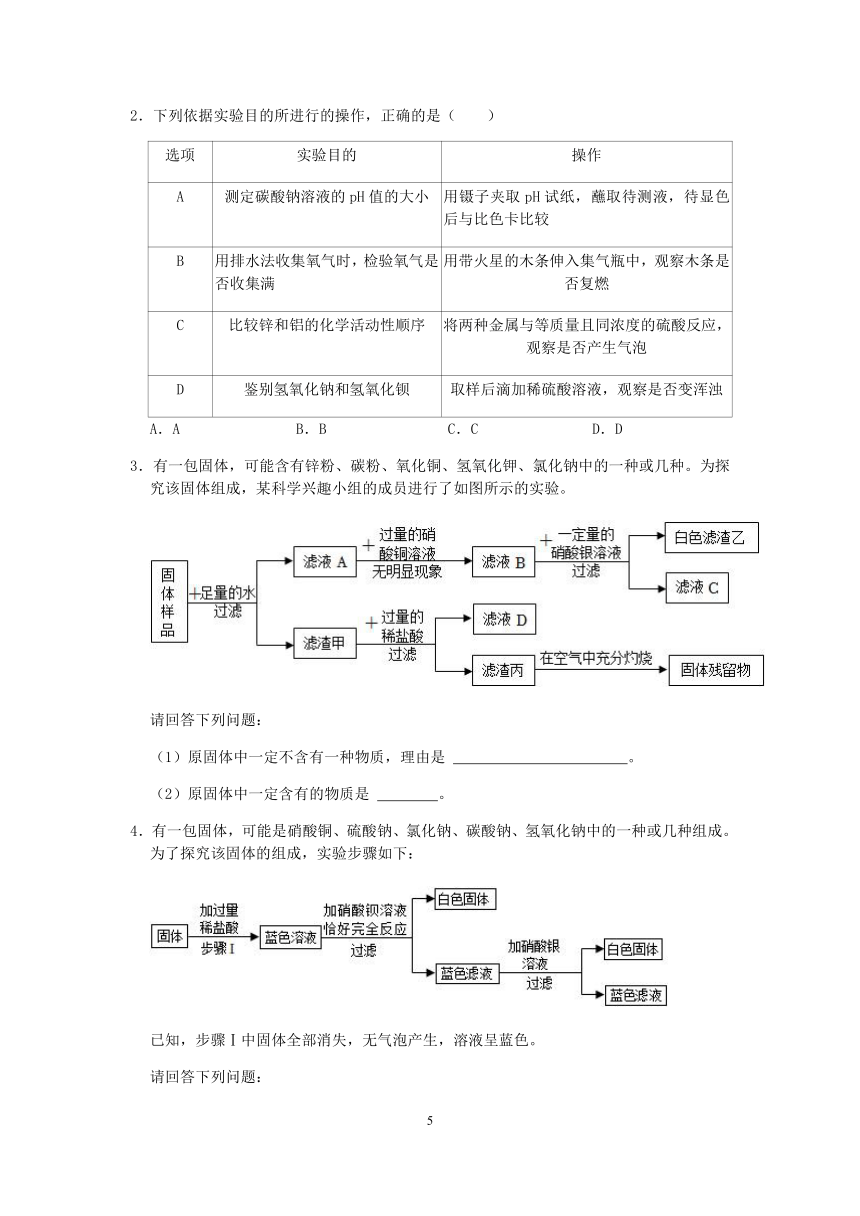
4.有一包固体,可能是硝酸铜、硫酸钠、氯化钠、碳酸钠、氢氧化钠中的一种或几种组成。为了探究该固体的组成,实验步骤如下:
已知,步骤Ⅰ中固体全部消失,无气泡产生,溶液呈蓝色。
请回答下列问题:
(1)原固体中一定不含碳酸钠,理由是 。
(2)最后得到蓝色滤液中一定含有的阳离子是 。
1.下列说法错误的是( )
A.除去N2中混有的O2,可以将混合气体通过灼热的足量铜网
B.只通过一步反应,能够实现由KNO3到KCl的转化
C.NH4Cl、Na2CO3、NaOH、Na2SO4不能在同一种水溶液中共存
D.不加其他试剂,可以一一鉴别H2SO4溶液、NaOH溶液、BaCl2溶液和CuSO4溶液这四种物质
2.在实验室里,区分下列各组物质的两种方法不完全正确的是( )
待区分的物质 方法一 方法二
A 水和双氧水 放入二氧化锰 加热
B 氮气和二氧化碳 用点燃的木条伸入集气瓶 通入澄清石灰水
C 氯酸钾和二氧化锰 观察颜色 加水溶解
D 木炭粉和铁粉 用磁铁吸引 在空气中点燃
A.A B.B C.C D.D
3.有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
请回答下列问题:
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 ,其中玻璃棒的作用是 。
(2)滤渣a的成分是 ,滤液中溶质的成分除氯化钠还有 ,白色沉淀b的成分是 。
(3)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中不能确定是否存在的物质是 。
4.有一包不纯的K2CO3粉末,可能含有Na2CO3、BaSO4、CuCl2、KCl、KNO3、Ca(NO3)2中的一种或几种,为分析含有的杂质,现进行如下实验
(1)取样溶于水,无固体残留,得无色溶液.则粉末中一定不含有 、 、 .
(2)取上述溶液适量,滴加AgNO3溶液,有白色沉淀,再加入足量稀HNO3,沉淀部分溶解,则此粉末中一定含有的杂质是 .
(3)为确定Na2CO3是否存在,某同学称取13.8g粉末溶于水,加入足量BaCl2溶液,充分反应生成19.7g沉淀质量,则原粉末中一定含有Na2CO3.你认为此结论 (选填“是”或“否”)正确.
参考答案
例1、解:A、FeCl3溶液是黄色的,能与FeCl3溶液反应产生红褐色沉淀的是NaOH溶液,能与NaOH溶液反应产生白色沉淀的是MgCl2溶液,无明显现象的是氯化钠溶液,不加其它试剂可以鉴别,故选项说法正确。
B、二氧化碳、氯化氢气体均能与碱石灰中的氢氧化钠反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项说法错误。
C、CuCl2溶液能与过量镁粉反应生成氯化镁溶液和铜,充分反应后过滤,故选项说法正确。
D、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项说法正确。
故选:B。
例2、解:甲、乙、丙、丁四种溶液中,分别含有Ba2+、Mg2+、Na+、H+、Cl﹣、CO32﹣、SO42﹣、OH﹣中的一种阳离子和一种阴离子,可以组成的物质有BaCl2、Ba(OH)2、MgCl2、MgSO4、HCl、H2SO4、NaCl、NaOH、Na2CO3、Na2SO4;
①将甲溶液分别与其他三种溶液混合,都观察到白色沉淀生成,能形成沉淀的离子组合是CO32﹣和Ba2+、Ba2+和SO42﹣、Mg2+和OH﹣;故甲可以是氢氧化钡;
②将乙、丁溶液混合,有气泡产生,则乙、丁溶液中分别含有H+和CO32﹣中的一种;乙、丁可以分别是硫酸和碳酸钠中的一种,无法具体判断分别是谁;
③向丙溶液中滴入AgNO3溶液,可明显观察到白色,加稀硝酸后,沉淀不消失,则丙溶液中含有Cl﹣,丙可以是氯化镁;
代入题干,推断合理;
A、甲溶液中一定含有Ba2+,说法正确;
B、乙溶液可能是硫酸溶液,也可能是碳酸钠溶液,因此可能含有SO42﹣,说法正确;
C、丙溶液是氯化镁溶液,一定含有Cl﹣,说法正确;
D、丁溶液可能是硫酸溶液,也可能是碳酸钠溶液,因此可能含有Na+,说法错误;
故选:D。
例3、解:(1)操作Ⅰ实现了固液分离,常用的方法为过滤;
故答案为:过滤。
(2)硝酸钡可与碳酸钠反应生成碳酸钡沉淀,所以此时白色粉末一定含有碳酸钠;
故答案为:碳酸钠。
(3)由于加入硝酸钡量不足,碳酸钠若有剩余,则溶液含有碳酸钠,此时加入酚酞试剂,溶液也会变红,无法判断是否含有氢氧化钠;
故答案为:不能,加入硝酸钡少量,若碳酸钠有残留,此时溶液也会显碱性,加入酚酞试剂后,溶液也变红。
例4、解:(1)Ⅰ、Ⅱ操作都是将不溶性固体与溶液分离,属于过滤;故答案为:过滤;
(2)由A与稀硝酸作用,A不溶解;A是由原溶液与硝酸银溶液反应生成的,根据质量守恒定律可以确定原溶液中一定含有氯离子;由B与碳酸钠溶液反应生成碳酸钙和硝酸钠,B是由原溶液与硝酸银溶液反应生成的,根据质量守恒定律可以确定原溶液中一定含有钙离子;由原溶液中存在硝酸,说明原溶液中一定没有碳酸根离子;通过上述分析可知原溶液中一定含有钙离子和氯离子,可能含有钠离子和硝酸根离子;因此组成杂质的物质最多有三种,即:CaCl2、Ca(NO3)2、NaCl;根据题设条件和这一推论,结合新的要求;只含一种杂质时,该杂质一定是由钙离子和氯离子构成的氯化钙;故答案为:氯化钙。
1.解:将固体溶于水得无色透明溶液,说明不含铜离子;加入足量BaCl2溶液,过滤后得到白色沉淀,说明固体中可能含有硫酸根离子、碳酸根离子等;在沉淀中加入过量稀硝酸,仍有白色沉淀,说明存在不溶于稀硝酸的白色沉淀,即说明白色沉淀中含有硫酸钡、碳酸钡;滤液中含有过量的稀硝酸,在滤液中滴加AgNO3溶液,产生白色沉淀,说明生成了不溶于稀硝酸的氯化银沉淀,说明固体中存在氯离子,由于加入足量BaCl2溶液,但无法确定原固体中是否含有氯离子;钡离子和铜离子都不存在,故该固体中一定含有Na+、CO32﹣、SO42﹣,可能存在Cl﹣,一定不存在Ba2+、Cu2+。
故选:A。
2.解:A、用pH试纸测定溶液的pH时,正确的操作方法为在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取待测液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出pH。不能用镊子夹取pH试纸蘸取待测液,故选项依据实验目的所进行的操作错误。
B、用排水法收集氧气时,检验氧气是否收集满,无需用带火星的木条,且不能伸入集气瓶中,待气泡从瓶口逸出时,说明已集满,故选项依据实验目的所进行的操作错误。
C、将两种金属与等质量且同浓度的硫酸反应,均产生气泡,不能应是否产生气泡的方法比较锌和铝的化学活动性顺序,故选项依据实验目的所进行的操作错误。
D、取样后滴加稀硫酸溶液,变浑浊的是氢氧化钡溶液,无明显现象的是氢氧化钠溶液,故选项依据实验目的所进行的操作正确。
故选:D。
3.解:(1)固体样品加水过滤得滤液和滤渣,滤液A中加过量硝酸铜溶液无明显现象,因氢氧化钾会与硝酸铜反应产生蓝色沉淀,所以一定不含氢氧化钾;故答案为:滤液A中加过量硝酸铜溶液无明显现象;
(2)滤液B中加适量硝酸银溶液生成白色滤渣乙和滤液C,说明滤液B中含有氯离子,样品中含有氯化钠;滤渣甲加入过量稀盐酸,得滤液D和滤渣丙,滤渣丙在空气中充分灼烧,得固体残留物,因锌、碳、氧化铜都不溶于水,但锌和氧化铜能溶于酸,且锌能与氯化铜溶液反应置换出铜,碳在空气中灼烧会生成气体,铜在空气中灼烧会生成氧化铜,所以原固体中一定含有氯化钠,氧化铜,锌;故答案为:氯化钠,氧化铜,锌。
4.解:(1)固体中加入过量的稀盐酸,固体全部消失,溶液呈蓝色,说明有硝酸铜;无气泡产生,说明一定没有碳酸钠;故答案为:向固体中加入过量的稀盐酸时,无气泡产生;
(2)步骤II所得蓝色滤液中一定含有的阳离子是铜离子、钠离子和氢离子,因为盐酸过量;故答案为:Cu2+、Na+、H+。
1.解:A、氮气不会与铜反应,氧气与铜反应生成氧化铜,可以去除氧气,选项A正确;
B、硝酸钾无法生成氯化钾,选项B不正确;
C、铵根离子和氢氧根离子反应生成氨气和水,不能共存,选项C正确;
D、硫酸铜溶液为蓝色,硫酸铜溶液分别加入其他三种溶液,产生蓝色沉淀为氢氧化钠溶液,产生白色沉淀为氯化钡溶液,没有明显现象的为硫酸溶液,可以区分四种溶液,选项D正确;
故选:B。
2.解:A、分别加入二氧化锰,水中加入二氧化锰,无明显现象,双氧水中加入二氧化锰,过氧化氢在二氧化锰的催化下分解为水和氧气,产生气泡,现象不同,可以区分;过氧化氢受热易分解生成水和氧气,产生气泡,水受热不分解,无明显现明;现象不同,可以用加热方法区分;故A不符合题意;
B、氮气和二氧化碳不燃烧、不支持燃烧,能使燃着的木条熄灭;氮气都不能使澄清石灰水变浑浊,二氧化碳能使澄清石灰水变浑浊,现象不同,可用澄清石灰水区分;故B符合题意;
C、氯酸钾是白色的,二氧化锰是黑色的,观察颜色,可以区分;氯酸钾能溶于水形成溶液,二氧化锰难溶于水,加水、溶解可以区分,故C不符合题意;
D、铁粉能被磁铁吸引,木炭粉不能被磁铁吸引,用磁铁吸引可以区分,在空气中点燃,木炭燃烧生成二氧化碳,逐渐减少,铁粉在空气中不能燃烧,现象不同,可以区分,故C不符合题意。
故选:B。
3.解:(1)过滤还需要漏斗,其中玻璃棒起到引流的作用;
故答案为:漏斗;引流;
(2)样品溶于水得到滤渣1.5g,能够全部溶于稀盐酸,且产生0.44g的二氧化碳,说明沉淀一定含有碳酸钙,一定没有硫酸钡;
设产生0.44g的二氧化碳需要碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.44g
x=1g<1.5g,因此沉淀还有氢氧化镁;则沉淀a是碳酸钙和氢氧化镁;
滤液通入二氧化碳产生沉淀,说明是二氧化碳和氢氧化钠反应产生碳酸钠,碳酸钠和氯化钡反应产生的碳酸钡沉淀,因此滤液中含有钠离子、钡离子、氯离子与氢氧根离子,所以溶质的成分除氯化钠,还有氢氧化钠、氯化钡;
故答案为:碳酸钙和氢氧化镁;氢氧化钠、氯化钡;碳酸钡;
(3)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,可以知道沉淀a一定含有碳酸钙和硫酸钡沉淀,就不一定含有氢氧化镁沉淀,因此无法确定氯化镁的存在;
故答案为:氯化镁。
4.解:硫酸钡不溶于水和酸,氯化铜在溶液中显蓝色,碳酸根离子和钙离子反应会生成碳酸钙沉淀,氯离子和银离子会生成氯化银沉淀.
(1)取样溶于水,无固体残留,得无色溶液,氯化铜在溶液中显蓝色,硝酸钙和碳酸钾会生成碳酸钙沉淀,不能共存,硫酸钡难溶于水,所以溶液中一定不含硫酸钡、氯化铜、硝酸钙;
(2)取上述溶液适量,滴加AgNO3溶液,有白色沉淀,再加入足量稀HNO3,沉淀部分溶解,氯离子和银离子生成的氯化银沉淀难溶于酸,则此粉末中一定含有的杂质是氯化钾;
(3)假设13.8g纯碳酸钾产生碳酸钙的质量为x,则有
K2CO3+BaCl2═BaCO3↓+2KCl
138 197
13.8g x
x=19.7g
假设13.8g纯碳酸钠产生碳酸钙的质量为y,则有
Na2CO3+BaCl2═BaCO3↓+2NaCl
106 197
13.8g y
y≈25.6g,
粉末中一定含有的杂质氯化钾,混合物含有碳酸钠时,生成的沉淀质量大于19.7g,而沉淀质量是19.7g,所以一定含碳酸钠.
故答案为:(1)BaSO4,CuCl2,Ca(NO3)2;(2)KCl;(3)是.
【备考2023】浙教版科学中考第三轮冲刺讲义(二十二)
物质的鉴别与推断
1. 原理:主要是利用物质的各种物理性质和化学性质,产生不同的实验现象,从而将物质区分开来。
2. 鉴别方法
(1)物理方法
①观察颜色
常见红色固体:氧化铁(红棕色)、铜(紫红色)、红磷;
常见黑色固体:四氧化三铁、氧化铜、铁粉、碳、二氧化锰;
常见溶液颜色:含Cu2+的溶液为蓝色、含Fe3+的溶液为黄色、含Fe2+的溶液为浅绿色。
②闻气味
常见具有刺激性气味的气体:二氧化硫、氨气、氯化氢。
③物质的溶解性
常见不溶于水的物质:CaCO3、BaCO3、Mg(OH)2、Al(OH)3、AgCl、BaSO4(白色),Cu(OH)2(蓝色),Fe(OH)3(红褐色)。
④溶解时的吸放热现象
NaOH固体溶于水放热(选填“吸热”或“放热”,下同),NH4NO3固体溶于水吸热。
⑤磁性:铁、四氧化三铁具有磁性,能被磁铁吸引。
(2)化学方法
①针对酸碱性不同的溶液,利用指示剂或pH试纸进行鉴别。
例:鉴别稀盐酸与氢氧化钠溶液,可选用酚酞溶液,观察到溶液变红的是氢氧化钠溶液,观察到溶液变红色的是稀盐酸。
【特别提醒】有些盐溶液显酸性或碱性,如鉴别碳酸钠溶液与氢氧化钠溶液,不能用酚酞溶液。
②根据反应的现象不同进行鉴别。通过加入常见试剂,使物质间发生反应并呈现不同现象,如生成气体或沉淀、溶液颜色有变化等。
例:鉴别Na2CO3溶液与NaCl溶液,可选用稀盐酸,观察到有气泡产生的是Na2CO3溶液,观察到无明显现象的是NaCl溶液。
二、推断题的“题眼”
(一)物质的俗名及主要成分
1. 物质的俗名
俗名 化学式
干冰 CO2
生石灰 CaO
熟石灰、消石灰 Ca(OH)2
苛性钠、火碱、烧碱 NaOH
纯碱、苏打 Na2CO3
小苏打 NaHCO3
2. 物质的主要成分
物质 主要成分的化学式
天然气、沼气 CH4
铁锈、赤铁矿 Fe2O3
食盐 NaCl
石灰石、大理石 CaCO3
(二)常见物质的颜色
1. 常见固体的颜色
(1)红色:铜(Cu)、氧化铁(Fe2O3)
(2)黑色:四氧化三铁(Fe3O4)、碳粉(C)、铁粉(Fe)、氧化铜(CuO)
2. 常见溶液的颜色
(1)蓝色溶液 含Cu2+的溶液,如CuSO4溶液、Cu(NO3)2溶液。
(2)浅绿色溶液 含Fe2+的溶液,如FeCl2溶液、FeSO4溶液。
(3)黄色溶液 含Fe3+的溶液,如FeCl3溶液、Fe(NO3)3溶液、Fe2(SO4)3溶液。
(4)紫红色溶液:KMnO4溶液。
3. 常见沉淀的颜色及酸溶性
颜色 化学式 是否溶于酸
白色沉淀 CaCO3、BaCO3、Mg(OH)2 溶
BaSO4、AgCl 不溶
蓝色沉淀 Cu(OH)2 溶
例1、下列关于物质的鉴别、除杂所选用的试剂或方法不正确的是( )
选项 实验目的 试剂或方法
A 鉴别FeCl3、NaCl、NaOH、MgCl2四种溶液 不另加试剂
B 除去二氧化碳中混有的氯化氢气体 将气体通过碱石灰
C 除去MgCl2溶液中少量的CuCl2 加入过量镁粉、充分反应、过滤
D 除去N2中的少量O2 将气体缓缓通过灼热的铜网
A.A B.B C.C D.D
例2、甲、乙、丙、丁四种溶液中,分别含有Ba2+、Mg2+、Na+、H+、Cl﹣、OH﹣、CO32﹣、SO42﹣中的一种阳离子和一种阴离子。为确定四种溶液中分别含有哪种阳离子或阴离子,进行了如下实验:
①将甲溶液分别与其他三种溶液混合,都观察到白色沉淀生成
②将乙、丁溶液混合,有气泡产生
③向丙溶液中滴入AgNO3溶液,可明显观察到白色沉淀,加稀硝酸后,沉淀不消失
分析实验得到的以下结论中错误的是( )
A.甲溶液中一定含有Ba2+
B.乙溶液中可能含有SO42﹣
C.丙溶液中一定含有Cl﹣
D.丁溶液中一定含有Na+
例3、实验室里有一包白色固体,可能由氯化钠、碳酸钠、氢氧化钠中的一种或几种组成,为了检测及成分,按如图所示流程进行操作:
(1)上述中“操作Ⅰ”的名称是 。
(2)加少量硝酸钡溶液,产生白色沉淀,可以推出白色粉末中一定有 。
(3)滴加酚酞试剂后,溶液呈红色,能否说明白色粉末中是否一定含有氢氧化钠,并说明理由 。
例4、为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如下实验:
请回答下列问题:
(1)Ⅰ,Ⅱ为 操作。
(2)经分析,原溶液中的杂质可能由一种或几种物质组成。杂质的成分可能是:若原溶液中的杂质由一种物质组成,则该杂质是 。
1.某固体由 Ba2+、Cu2+、Na+、Cl﹣、CO32﹣、SO42﹣中的几种离子构成,取一定质量的该固体样品,进行如下实验:
①将固体溶于水得无色透明溶液,加入足量BaCl2溶液过滤,得到白色沉淀和无色滤液。
②在白色沉淀中加入过量稀硝酸,白色沉淀部分溶解并产生气泡。
③在无色滤液中滴加AgNO3溶液产生白色沉淀。
由此推断该固体中一定含有的离子是( )
A.Na+、CO32﹣、SO42﹣ B.Na+、CO32﹣、SO42﹣、Cl﹣
C.Ba2+、CO32﹣、SO42﹣、Cl﹣ D.Cu2+、Ba2+、CO32﹣、SO42﹣
2.下列依据实验目的所进行的操作,正确的是( )
选项 实验目的 操作
A 测定碳酸钠溶液的pH值的大小 用镊子夹取pH试纸,蘸取待测液,待显色后与比色卡比较
B 用排水法收集氧气时,检验氧气是否收集满 用带火星的木条伸入集气瓶中,观察木条是否复燃
C 比较锌和铝的化学活动性顺序 将两种金属与等质量且同浓度的硫酸反应,观察是否产生气泡
D 鉴别氢氧化钠和氢氧化钡 取样后滴加稀硫酸溶液,观察是否变浑浊
A.A B.B C.C D.D
3.有一包固体,可能含有锌粉、碳粉、氧化铜、氢氧化钾、氯化钠中的一种或几种。为探究该固体组成,某科学兴趣小组的成员进行了如图所示的实验。
请回答下列问题:
(1)原固体中一定不含有一种物质,理由是 。
(2)原固体中一定含有的物质是 。
4.有一包固体,可能是硝酸铜、硫酸钠、氯化钠、碳酸钠、氢氧化钠中的一种或几种组成。为了探究该固体的组成,实验步骤如下:
已知,步骤Ⅰ中固体全部消失,无气泡产生,溶液呈蓝色。
请回答下列问题:
(1)原固体中一定不含碳酸钠,理由是 。
(2)最后得到蓝色滤液中一定含有的阳离子是 。
1.下列说法错误的是( )
A.除去N2中混有的O2,可以将混合气体通过灼热的足量铜网
B.只通过一步反应,能够实现由KNO3到KCl的转化
C.NH4Cl、Na2CO3、NaOH、Na2SO4不能在同一种水溶液中共存
D.不加其他试剂,可以一一鉴别H2SO4溶液、NaOH溶液、BaCl2溶液和CuSO4溶液这四种物质
2.在实验室里,区分下列各组物质的两种方法不完全正确的是( )
待区分的物质 方法一 方法二
A 水和双氧水 放入二氧化锰 加热
B 氮气和二氧化碳 用点燃的木条伸入集气瓶 通入澄清石灰水
C 氯酸钾和二氧化锰 观察颜色 加水溶解
D 木炭粉和铁粉 用磁铁吸引 在空气中点燃
A.A B.B C.C D.D
3.有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
请回答下列问题:
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 ,其中玻璃棒的作用是 。
(2)滤渣a的成分是 ,滤液中溶质的成分除氯化钠还有 ,白色沉淀b的成分是 。
(3)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中不能确定是否存在的物质是 。
4.有一包不纯的K2CO3粉末,可能含有Na2CO3、BaSO4、CuCl2、KCl、KNO3、Ca(NO3)2中的一种或几种,为分析含有的杂质,现进行如下实验
(1)取样溶于水,无固体残留,得无色溶液.则粉末中一定不含有 、 、 .
(2)取上述溶液适量,滴加AgNO3溶液,有白色沉淀,再加入足量稀HNO3,沉淀部分溶解,则此粉末中一定含有的杂质是 .
(3)为确定Na2CO3是否存在,某同学称取13.8g粉末溶于水,加入足量BaCl2溶液,充分反应生成19.7g沉淀质量,则原粉末中一定含有Na2CO3.你认为此结论 (选填“是”或“否”)正确.
参考答案
例1、解:A、FeCl3溶液是黄色的,能与FeCl3溶液反应产生红褐色沉淀的是NaOH溶液,能与NaOH溶液反应产生白色沉淀的是MgCl2溶液,无明显现象的是氯化钠溶液,不加其它试剂可以鉴别,故选项说法正确。
B、二氧化碳、氯化氢气体均能与碱石灰中的氢氧化钠反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项说法错误。
C、CuCl2溶液能与过量镁粉反应生成氯化镁溶液和铜,充分反应后过滤,故选项说法正确。
D、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项说法正确。
故选:B。
例2、解:甲、乙、丙、丁四种溶液中,分别含有Ba2+、Mg2+、Na+、H+、Cl﹣、CO32﹣、SO42﹣、OH﹣中的一种阳离子和一种阴离子,可以组成的物质有BaCl2、Ba(OH)2、MgCl2、MgSO4、HCl、H2SO4、NaCl、NaOH、Na2CO3、Na2SO4;
①将甲溶液分别与其他三种溶液混合,都观察到白色沉淀生成,能形成沉淀的离子组合是CO32﹣和Ba2+、Ba2+和SO42﹣、Mg2+和OH﹣;故甲可以是氢氧化钡;
②将乙、丁溶液混合,有气泡产生,则乙、丁溶液中分别含有H+和CO32﹣中的一种;乙、丁可以分别是硫酸和碳酸钠中的一种,无法具体判断分别是谁;
③向丙溶液中滴入AgNO3溶液,可明显观察到白色,加稀硝酸后,沉淀不消失,则丙溶液中含有Cl﹣,丙可以是氯化镁;
代入题干,推断合理;
A、甲溶液中一定含有Ba2+,说法正确;
B、乙溶液可能是硫酸溶液,也可能是碳酸钠溶液,因此可能含有SO42﹣,说法正确;
C、丙溶液是氯化镁溶液,一定含有Cl﹣,说法正确;
D、丁溶液可能是硫酸溶液,也可能是碳酸钠溶液,因此可能含有Na+,说法错误;
故选:D。
例3、解:(1)操作Ⅰ实现了固液分离,常用的方法为过滤;
故答案为:过滤。
(2)硝酸钡可与碳酸钠反应生成碳酸钡沉淀,所以此时白色粉末一定含有碳酸钠;
故答案为:碳酸钠。
(3)由于加入硝酸钡量不足,碳酸钠若有剩余,则溶液含有碳酸钠,此时加入酚酞试剂,溶液也会变红,无法判断是否含有氢氧化钠;
故答案为:不能,加入硝酸钡少量,若碳酸钠有残留,此时溶液也会显碱性,加入酚酞试剂后,溶液也变红。
例4、解:(1)Ⅰ、Ⅱ操作都是将不溶性固体与溶液分离,属于过滤;故答案为:过滤;
(2)由A与稀硝酸作用,A不溶解;A是由原溶液与硝酸银溶液反应生成的,根据质量守恒定律可以确定原溶液中一定含有氯离子;由B与碳酸钠溶液反应生成碳酸钙和硝酸钠,B是由原溶液与硝酸银溶液反应生成的,根据质量守恒定律可以确定原溶液中一定含有钙离子;由原溶液中存在硝酸,说明原溶液中一定没有碳酸根离子;通过上述分析可知原溶液中一定含有钙离子和氯离子,可能含有钠离子和硝酸根离子;因此组成杂质的物质最多有三种,即:CaCl2、Ca(NO3)2、NaCl;根据题设条件和这一推论,结合新的要求;只含一种杂质时,该杂质一定是由钙离子和氯离子构成的氯化钙;故答案为:氯化钙。
1.解:将固体溶于水得无色透明溶液,说明不含铜离子;加入足量BaCl2溶液,过滤后得到白色沉淀,说明固体中可能含有硫酸根离子、碳酸根离子等;在沉淀中加入过量稀硝酸,仍有白色沉淀,说明存在不溶于稀硝酸的白色沉淀,即说明白色沉淀中含有硫酸钡、碳酸钡;滤液中含有过量的稀硝酸,在滤液中滴加AgNO3溶液,产生白色沉淀,说明生成了不溶于稀硝酸的氯化银沉淀,说明固体中存在氯离子,由于加入足量BaCl2溶液,但无法确定原固体中是否含有氯离子;钡离子和铜离子都不存在,故该固体中一定含有Na+、CO32﹣、SO42﹣,可能存在Cl﹣,一定不存在Ba2+、Cu2+。
故选:A。
2.解:A、用pH试纸测定溶液的pH时,正确的操作方法为在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取待测液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出pH。不能用镊子夹取pH试纸蘸取待测液,故选项依据实验目的所进行的操作错误。
B、用排水法收集氧气时,检验氧气是否收集满,无需用带火星的木条,且不能伸入集气瓶中,待气泡从瓶口逸出时,说明已集满,故选项依据实验目的所进行的操作错误。
C、将两种金属与等质量且同浓度的硫酸反应,均产生气泡,不能应是否产生气泡的方法比较锌和铝的化学活动性顺序,故选项依据实验目的所进行的操作错误。
D、取样后滴加稀硫酸溶液,变浑浊的是氢氧化钡溶液,无明显现象的是氢氧化钠溶液,故选项依据实验目的所进行的操作正确。
故选:D。
3.解:(1)固体样品加水过滤得滤液和滤渣,滤液A中加过量硝酸铜溶液无明显现象,因氢氧化钾会与硝酸铜反应产生蓝色沉淀,所以一定不含氢氧化钾;故答案为:滤液A中加过量硝酸铜溶液无明显现象;
(2)滤液B中加适量硝酸银溶液生成白色滤渣乙和滤液C,说明滤液B中含有氯离子,样品中含有氯化钠;滤渣甲加入过量稀盐酸,得滤液D和滤渣丙,滤渣丙在空气中充分灼烧,得固体残留物,因锌、碳、氧化铜都不溶于水,但锌和氧化铜能溶于酸,且锌能与氯化铜溶液反应置换出铜,碳在空气中灼烧会生成气体,铜在空气中灼烧会生成氧化铜,所以原固体中一定含有氯化钠,氧化铜,锌;故答案为:氯化钠,氧化铜,锌。
4.解:(1)固体中加入过量的稀盐酸,固体全部消失,溶液呈蓝色,说明有硝酸铜;无气泡产生,说明一定没有碳酸钠;故答案为:向固体中加入过量的稀盐酸时,无气泡产生;
(2)步骤II所得蓝色滤液中一定含有的阳离子是铜离子、钠离子和氢离子,因为盐酸过量;故答案为:Cu2+、Na+、H+。
1.解:A、氮气不会与铜反应,氧气与铜反应生成氧化铜,可以去除氧气,选项A正确;
B、硝酸钾无法生成氯化钾,选项B不正确;
C、铵根离子和氢氧根离子反应生成氨气和水,不能共存,选项C正确;
D、硫酸铜溶液为蓝色,硫酸铜溶液分别加入其他三种溶液,产生蓝色沉淀为氢氧化钠溶液,产生白色沉淀为氯化钡溶液,没有明显现象的为硫酸溶液,可以区分四种溶液,选项D正确;
故选:B。
2.解:A、分别加入二氧化锰,水中加入二氧化锰,无明显现象,双氧水中加入二氧化锰,过氧化氢在二氧化锰的催化下分解为水和氧气,产生气泡,现象不同,可以区分;过氧化氢受热易分解生成水和氧气,产生气泡,水受热不分解,无明显现明;现象不同,可以用加热方法区分;故A不符合题意;
B、氮气和二氧化碳不燃烧、不支持燃烧,能使燃着的木条熄灭;氮气都不能使澄清石灰水变浑浊,二氧化碳能使澄清石灰水变浑浊,现象不同,可用澄清石灰水区分;故B符合题意;
C、氯酸钾是白色的,二氧化锰是黑色的,观察颜色,可以区分;氯酸钾能溶于水形成溶液,二氧化锰难溶于水,加水、溶解可以区分,故C不符合题意;
D、铁粉能被磁铁吸引,木炭粉不能被磁铁吸引,用磁铁吸引可以区分,在空气中点燃,木炭燃烧生成二氧化碳,逐渐减少,铁粉在空气中不能燃烧,现象不同,可以区分,故C不符合题意。
故选:B。
3.解:(1)过滤还需要漏斗,其中玻璃棒起到引流的作用;
故答案为:漏斗;引流;
(2)样品溶于水得到滤渣1.5g,能够全部溶于稀盐酸,且产生0.44g的二氧化碳,说明沉淀一定含有碳酸钙,一定没有硫酸钡;
设产生0.44g的二氧化碳需要碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.44g
x=1g<1.5g,因此沉淀还有氢氧化镁;则沉淀a是碳酸钙和氢氧化镁;
滤液通入二氧化碳产生沉淀,说明是二氧化碳和氢氧化钠反应产生碳酸钠,碳酸钠和氯化钡反应产生的碳酸钡沉淀,因此滤液中含有钠离子、钡离子、氯离子与氢氧根离子,所以溶质的成分除氯化钠,还有氢氧化钠、氯化钡;
故答案为:碳酸钙和氢氧化镁;氢氧化钠、氯化钡;碳酸钡;
(3)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,可以知道沉淀a一定含有碳酸钙和硫酸钡沉淀,就不一定含有氢氧化镁沉淀,因此无法确定氯化镁的存在;
故答案为:氯化镁。
4.解:硫酸钡不溶于水和酸,氯化铜在溶液中显蓝色,碳酸根离子和钙离子反应会生成碳酸钙沉淀,氯离子和银离子会生成氯化银沉淀.
(1)取样溶于水,无固体残留,得无色溶液,氯化铜在溶液中显蓝色,硝酸钙和碳酸钾会生成碳酸钙沉淀,不能共存,硫酸钡难溶于水,所以溶液中一定不含硫酸钡、氯化铜、硝酸钙;
(2)取上述溶液适量,滴加AgNO3溶液,有白色沉淀,再加入足量稀HNO3,沉淀部分溶解,氯离子和银离子生成的氯化银沉淀难溶于酸,则此粉末中一定含有的杂质是氯化钾;
(3)假设13.8g纯碳酸钾产生碳酸钙的质量为x,则有
K2CO3+BaCl2═BaCO3↓+2KCl
138 197
13.8g x
x=19.7g
假设13.8g纯碳酸钠产生碳酸钙的质量为y,则有
Na2CO3+BaCl2═BaCO3↓+2NaCl
106 197
13.8g y
y≈25.6g,
粉末中一定含有的杂质氯化钾,混合物含有碳酸钠时,生成的沉淀质量大于19.7g,而沉淀质量是19.7g,所以一定含碳酸钠.
故答案为:(1)BaSO4,CuCl2,Ca(NO3)2;(2)KCl;(3)是.
【备考2023】浙教版科学中考第三轮冲刺讲义(二十二)
物质的鉴别与推断
同课章节目录
