【备考2023】浙教版科学中考第三轮冲刺讲义(二十一 ):物质的分离与提纯【word,含答案】
文档属性
| 名称 | 【备考2023】浙教版科学中考第三轮冲刺讲义(二十一 ):物质的分离与提纯【word,含答案】 |

|
|
| 格式 | doc | ||
| 文件大小 | 775.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-22 00:00:00 | ||
图片预览

文档简介
一、除杂原则(不增、不减、易分离)
①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
二、除杂要领
①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
三、除杂方法:
(1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变为气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变为提纯的物质。
(5)吸收法:常用于气体的提纯。
四、混合物的分离:
(1)可溶性与难溶性物质的混合物——常用溶解、过滤、蒸发三步操作加以分离,分别得到纯净物。
如:粗盐的提纯;BaSO4和Na2SO4的混合物。
(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时,可考虑——结晶法。即冷却热饱和溶液的方法加以分离。
(3)两种物质均溶于水时,可考虑用化学方法分离。如BaCl2和NaCl的混合物。可将混合物先溶于水,加入适量Na2CO3溶液,得到BaCO3和NaCl溶液。
BaCl2+ Na2CO3=BaCO3↓+2NaCl。将沉淀过滤出,洗净后在沉淀中加入适量盐酸溶液,又得到BaCl2溶液,CO2逸出。BaCO3+2HCl =BaCl2+H2O+CO2↑。最后分别将NaCl溶液和BaCl2溶液蒸发,分别得到纯净的NaCl固体和BaCl2固体。
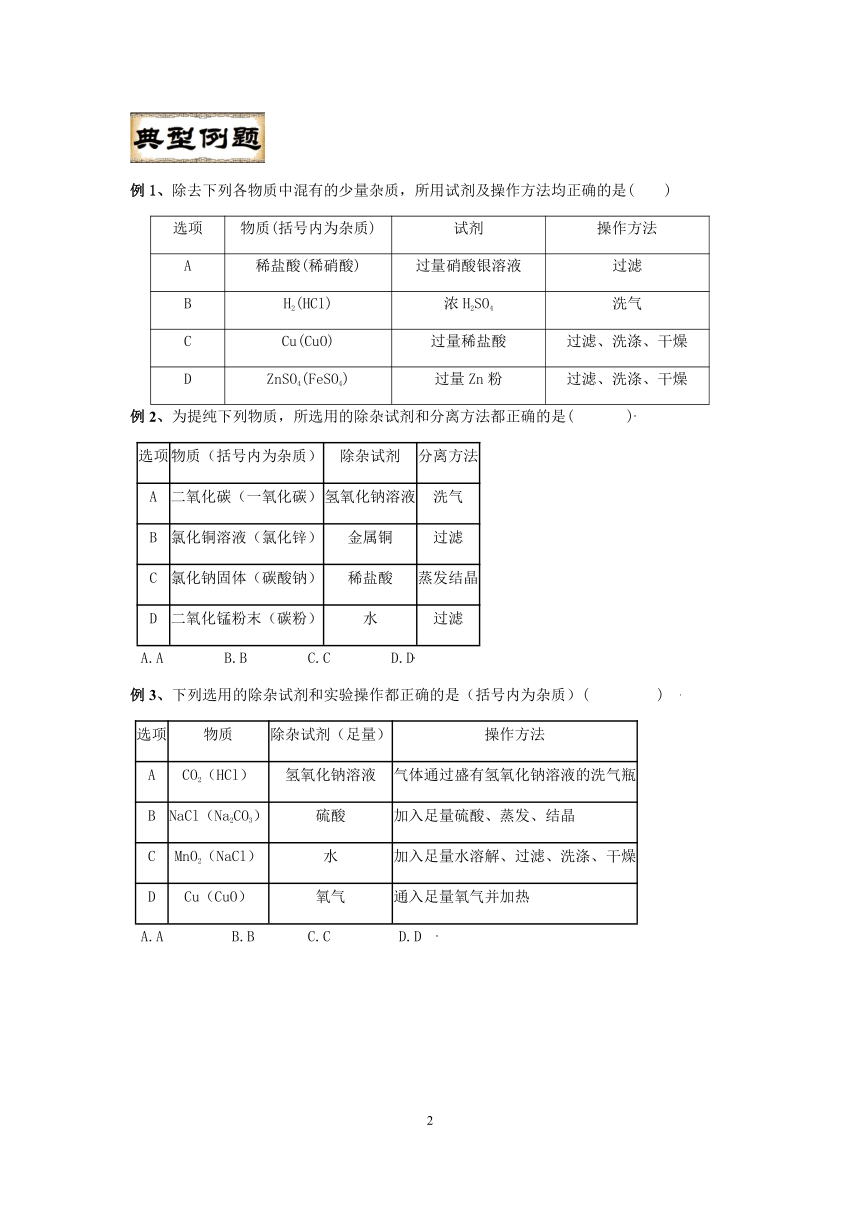
例1、除去下列各物质中混有的少量杂质,所用试剂及操作方法均正确的是( )
选项 物质(括号内为杂质) 试剂 操作方法
A 稀盐酸(稀硝酸) 过量硝酸银溶液 过滤
B H2(HCl) 浓H2SO4 洗气
C Cu(CuO) 过量稀盐酸 过滤、洗涤、干燥
D ZnSO4(FeSO4) 过量Zn粉 过滤、洗涤、干燥
例2、为提纯下列物质,所选用的除杂试剂和分离方法都正确的是( )
选项 物质(括号内为杂质) 除杂试剂 分离方法
A 二氧化碳(一氧化碳) 氢氧化钠溶液 洗气
B 氯化铜溶液(氯化锌) 金属铜 过滤
C 氯化钠固体(碳酸钠) 稀盐酸 蒸发结晶
D 二氧化锰粉末(碳粉) 水 过滤
A.A B.B C.C D.D
例3、下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)( )
选项 物质 除杂试剂(足量) 操作方法
A CO2(HCl) 氢氧化钠溶液 气体通过盛有氢氧化钠溶液的洗气瓶
B NaCl(Na2CO3) 硫酸 加入足量硫酸、蒸发、结晶
C MnO2(NaCl) 水 加入足量水溶解、过滤、洗涤、干燥
D Cu(CuO) 氧气 通入足量氧气并加热
A.A B.B C.C D.D
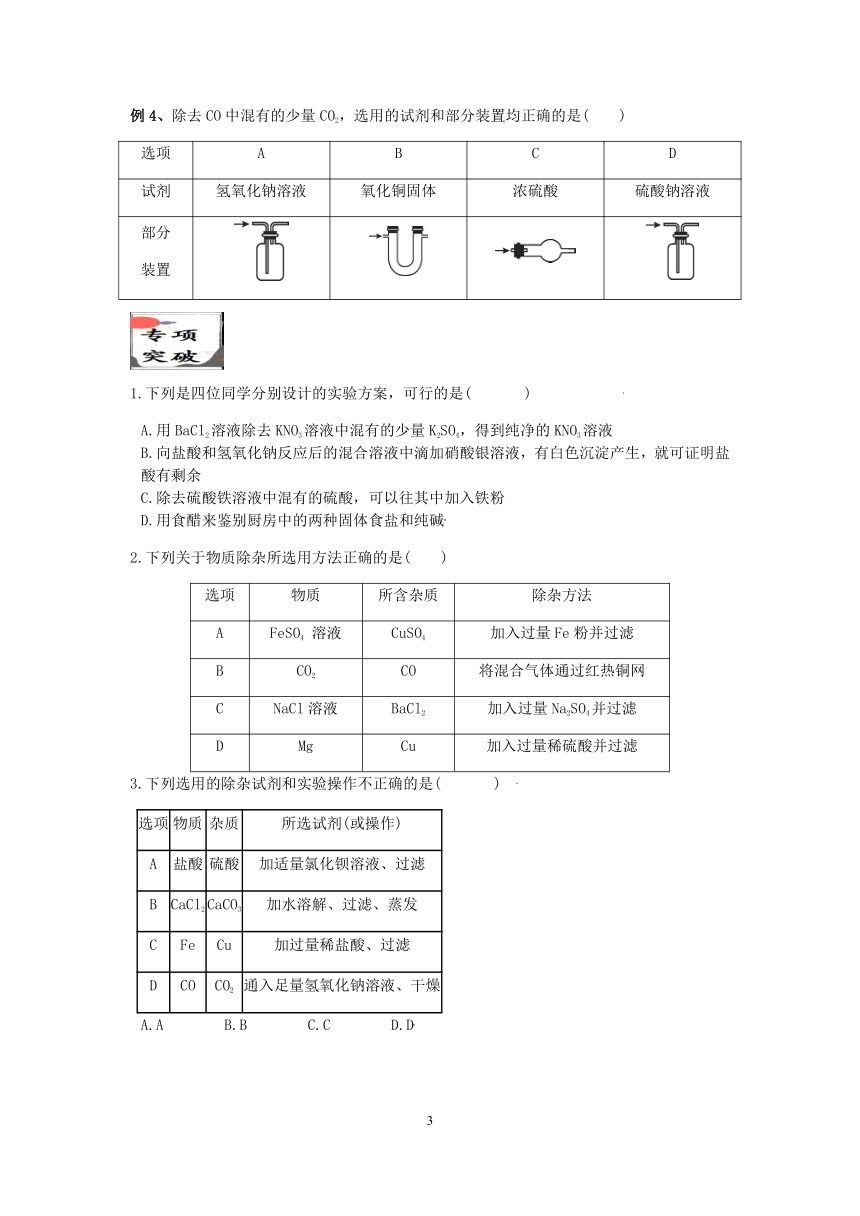
例4、除去CO中混有的少量CO2,选用的试剂和部分装置均正确的是( )
选项 A B C D
试剂 氢氧化钠溶液 氧化铜固体 浓硫酸 硫酸钠溶液
部分装置
1.下列是四位同学分别设计的实验方案,可行的是( )
A.用BaCl2溶液除去KNO3溶液中混有的少量K2SO4,得到纯净的KNO3溶液
B.向盐酸和氢氧化钠反应后的混合溶液中滴加硝酸银溶液,有白色沉淀产生,就可证明盐酸有剩余
C.除去硫酸铁溶液中混有的硫酸,可以往其中加入铁粉
D.用食醋来鉴别厨房中的两种固体食盐和纯碱
2.下列关于物质除杂所选用方法正确的是( )
选项 物质 所含杂质 除杂方法
A FeSO4 溶液 CuSO4 加入过量Fe粉并过滤
B CO2 CO 将混合气体通过红热铜网
C NaCl溶液 BaCl2 加入过量Na2SO4并过滤
D Mg Cu 加入过量稀硫酸并过滤
3.下列选用的除杂试剂和实验操作不正确的是( )
选项 物质 杂质 所选试剂(或操作)
A 盐酸 硫酸 加适量氯化钡溶液、过滤
B CaCl2 CaCO3 加水溶解、过滤、蒸发
C Fe Cu 加过量稀盐酸、过滤
D CO CO2 通入足量氢氧化钠溶液、干燥
A.A B.B C.C D.D
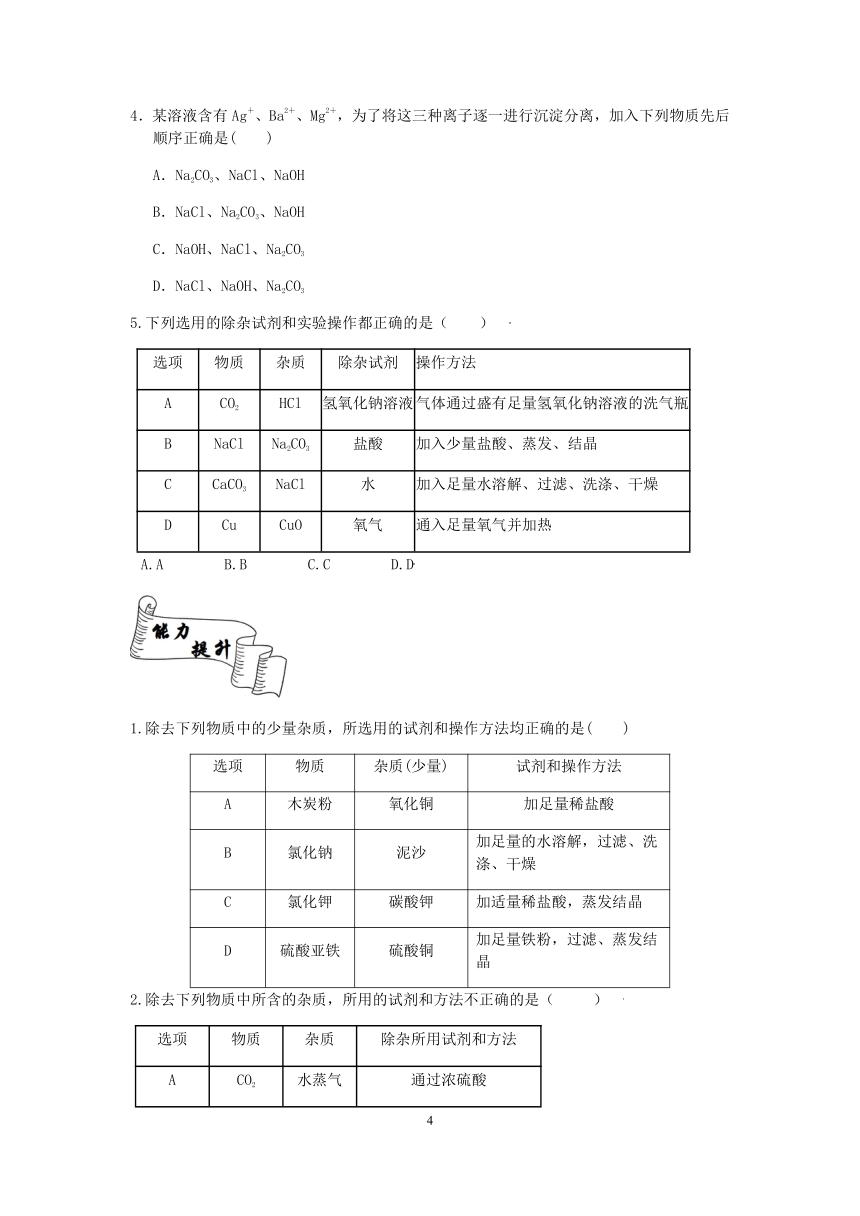
4.某溶液含有Ag+、Ba2+、Mg2+,为了将这三种离子逐一进行沉淀分离,加入下列物质先后顺序正确是( )
A.Na2CO3、NaCl、NaOH
B.NaCl、Na2CO3、NaOH
C.NaOH、NaCl、Na2CO3
D.NaCl、NaOH、Na2CO3
5.下列选用的除杂试剂和实验操作都正确的是( )
选项 物质 杂质 除杂试剂 操作方法
A CO2 HCl 氢氧化钠溶液 气体通过盛有足量氢氧化钠溶液的洗气瓶
B NaCl Na2CO3 盐酸 加入少量盐酸、蒸发、结晶
C CaCO3 NaCl 水 加入足量水溶解、过滤、洗涤、干燥
D Cu CuO 氧气 通入足量氧气并加热
A.A B.B C.C D.D
1.除去下列物质中的少量杂质,所选用的试剂和操作方法均正确的是( )
选项 物质 杂质(少量) 试剂和操作方法
A 木炭粉 氧化铜 加足量稀盐酸
B 氯化钠 泥沙 加足量的水溶解,过滤、洗涤、干燥
C 氯化钾 碳酸钾 加适量稀盐酸,蒸发结晶
D 硫酸亚铁 硫酸铜 加足量铁粉,过滤、蒸发结晶
2.除去下列物质中所含的杂质,所用的试剂和方法不正确的是( )
选项 物质 杂质 除杂所用试剂和方法
A CO2 水蒸气 通过浓硫酸
B CO2 CO 点燃
C CuO Cu 在空气中加热
D KCl MnO2 溶解、过滤、蒸发结晶
A.A B.B C.C D.D
3.除去下列各组物质中的杂质,所用试剂和方法均正确的是:( )
选项 物质 杂质 除杂所用的试剂和方法
A CaO固体 CaCO3固体 加入适量的稀盐酸
B NaOH溶液 Ca(OH)2溶液 先加入过量的Na2CO3溶液,再过滤
C CO2气体 CO气体 点燃
D H2气体 HCl气体 先通过NaOH溶液,再通过浓硫酸
A.A B.B C.C D.D
4.下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)( )
A.NaCl(Na2CO3)加足量稀盐酸、蒸发、结晶
B.CaCl2(CaCO3)加足量稀硫酸、蒸发、结晶
C.Fe(Cu)加足量稀盐酸、过滤、洗涤、干燥
D.Cu(OH)2 (CuO)加足量NaOH、过滤、洗涤、干燥
参考答案
例1、C
【解析】稀盐酸能与过量硝酸银溶液反应生成氯化银沉淀和硝酸,反而会把原物质除去。浓H2SO4不能与氯化氢气体反应,不能除去杂质。CuO能与稀盐酸反应生成氯化铜和水,铜不与稀盐酸反应,再过滤、洗涤、干燥,能除去杂质且没有引入新的杂质。过量Zn粉能与FeSO4溶液反应生成硫酸锌溶液和铁,过滤后将滤液蒸发结晶即可得到纯净的ZnSO4,无需进行洗涤、干燥。
例2、C
【解析】(1)在提纯物质时最终要将杂质全部除去,不能引入新的杂质;(2)在除去杂质时不能将需要的物质也除去。据此可以判断选项。
A、要除去二氧化碳中的一氧化碳,不能使用氢氧化钠溶液,氢氧化钠溶液会将二氧化碳除去,A错误;
B、要除去氯化铜溶液中的氯化锌,金属铜不能与杂质氯化锌反应,所以无法除去,B错误;
C、要除去氯化钠固体中的碳酸钠,稀盐酸能与碳酸钠反应不能与氯化钠反应,生成物为氯化钠、二氧化碳和水,过量的稀盐酸在蒸发结晶中可以除去,方法正确,C正确;
D、要除去二氧化锰粉末中的碳粉,二氧化锰和碳在水中都是不溶的,所以用水不能除去碳粉,D错误。
例3、C
【解析】除杂是指有效除去原物质中所含杂质且不与主要成分反应,且不会引进新的杂质成分的过程,比如:除去碳酸氢钠中的碳酸钠。
A、NaOH溶液与CO2和HCl都能发生反应;故A错误;
B、会生成新的杂质;故B错误;
C、MnO2不溶于水,NaCl溶于水,过滤后得到MnO2,干燥后即得到纯净的MnO2;故C正确;
D、Cu能与氧气发生反应,CuO不能与氧气发生反应;故D错误;
例4、A
【解析】通过A选项中的氢氧化钠溶液可以除去CO2;B选项中氧化铜会使CO转化为CO2;C选项中的装置不便盛放浓硫酸,且浓硫酸也不能吸收CO2;D选项中的硫酸钠溶液不能吸收CO2。
1.D
【解析】(1)除杂的基本原则:①不引入新的杂质;②不与除杂试剂反应;
(2)盐酸和氢氧化钠反应生成氯化钠和水,当滴加硝酸银溶液后,氯化钠和硝酸银反应会生成氯化银白色沉淀,因此有白色沉淀不能说明盐酸过量;
(3)铁和硫酸反应生成硫酸亚铁而不是硫酸铁;
(4)食醋与食盐不反应,而与纯碱反应生成二氧化碳气体。
【解答】A.氯化钡与硫酸钾反应生成硫酸钡沉淀和氯化钾,在除去硫酸钾的同时引入新的杂质氯化钾,故A不可行;
B.向盐酸和氢氧化钠反应后的混合溶液中滴加硝酸银溶液,有白色沉淀产生,不能证明盐酸有剩余,故B不可行;
C.铁和硫酸反应生成硫酸亚铁而不是硫酸铁,因此在除去硫酸的同时引入新的杂质硫酸亚铁,故C不可行;
D.用食醋来鉴别厨房中的两种固体食盐和纯碱,故D可行。
2.A
【解析】过量Fe粉与CuSO4溶液反应生成硫酸亚铁溶液和铜,能除去杂质且没有引入新的杂质;铜与一氧化碳不反应,不能将二氧化碳中的一氧化碳除去;BaCl2与过量Na2SO4溶液反应生成硫酸钡沉淀和氯化钠,能除去杂质,但引入了新的杂质硫酸钠;镁与硫酸反应生成硫酸镁和氢气,铜不与稀硫酸反应,反而会把原物质除去。
3.C
【解析】根据物质的除杂原则分析,物质除杂时选择的药品要只与杂质发生反应,不与原物质反应,且在除杂时不能引入新杂质。
A、加适量氯化钡溶液,杂质硫酸可与氯化钡反应生成硫酸钡沉淀和盐酸,过滤去沉淀,得到纯净盐酸,不符合题意;
B、碳酸钙不溶于水,氯化钙溶于水,加水溶解后过滤蒸发,可去掉杂质,不符合题意;
C、加过量的稀盐酸,杂质铜不反应,而原物质铁发生反应,符合题意;
D、通入足量的氢氧化钠溶液,可去掉二氧化碳杂质,干燥去掉水,得到纯净CO,不符合题意;
4.D
【解析】本题关键在于“逐一分离”,在分离一种离子时不能有其他离子共同分离出来。若先加Na2CO3则会有Ag2CO3、BaCO3、MgCO3(微溶)三种沉淀出现;若先加NaOH,则会有AgOH和Mg(OH)2共同沉淀出来,所以只能先加入NaCl,让Ag+沉淀,其次再加入NaOH让Mg2+沉淀,最后再加入Na2CO3让Ba2+沉淀。
5.C
【解析】(1)除杂的“四原则”:不增(提纯过程中不增加新的杂质);不减(不减少欲被提纯的物质);易分离(被提纯物与杂质容易分离);易复原(被提纯物质要复原);
(2)“三必须”:除杂试剂必须过量;过量试剂必须除尽(因为过量试剂带入新的杂质);除杂途径选最佳。
【解答】A.二氧化碳气体会和氢氧化钠溶液反应,使被提纯的物质减少,故A错误;
B.加入的除杂试剂稀盐酸不过量,会导致其中的杂质碳酸钠除不尽,故B错误;
C.加入足量的水后,氯化钠会溶于水,而碳酸钙会沉淀,二者完全分开,故C正确;
D.铜与加入的除杂试剂氧气反应,会导致被除杂物质减少,故D错误。
1.C
【解析】除杂的原则是所加试剂只与杂质反应,且不生成新的杂质。木炭粉中混有少量氧化铜,可加足量稀盐酸,过滤,但要将滤出物洗涤、干燥。氯化钠中混有少量泥沙,可加足量的水溶解、过滤、蒸发结晶。氯化钾中混有少量碳酸钾,可加适量稀盐酸,K2CO3+2HCl===2KCl+H2O+CO2↑,然后蒸发结晶。金属单质与盐发生的置换反应要在溶液中进行,固体之间不能反应。
2.B
【解析】除杂的基本原则:①不能引入新的杂质;②不能与提纯试剂反应,据此分析即可。
A.浓硫酸具有吸水性,可以除去二氧化碳中的水蒸气而不与它反应,故A正确不合题意;
B.如果二氧化碳中存在少量的一氧化碳,无法通过点燃的方法使一氧化碳燃烧生成二氧化碳,故B错误符合题意;
C.铜在空气中加热可与氧气反应生成氧化铜,可以除去杂质,故C正确不合题意;
D.氯化钾溶于水,而二氧化锰不溶于水,加水溶解后,再通过过滤可以去除二氧化锰,而将剩余的滤液蒸发结晶可以得到氯化钾晶体,故D正确不合题意。
3.D
【解析】本题主要考查物质分离与提纯。所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变,除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【解答】A、加稀盐酸,原物质氧化钙和杂质碳酸钙都会发生反应,不符合题意;
B、加入过量碳酸钠除去了杂质氢氧化钙,但引入了新杂质,不符合题意;
C、二氧化碳为灭火性气体,大量二氧化碳中少量CO,不能点燃,不符合题意;
D、通过氢氧化钠溶液,只杂质氯化氢发生反应,再通过浓硫酸干燥,得到纯净氢气,符合题意;
4.A
【解析】除杂质必须同时满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应时不能带入新的杂质。
A、Na2CO3能与稀盐酸反应生成氯化钠、水和二氧化碳,再蒸发、结晶,能除去杂质且没有引入新的杂质,故所采取的方法正确。
B、CaCO3能与稀硫酸反应生成硫酸钙钙、水和二氧化碳,能除去杂质但引入了新的杂质硫酸钙钙,故所采取的方法错误。
C、Fe能与稀盐酸反应生成氯化亚铁和氢气,铜不与稀盐酸反应,反而会把原物质除去,故所采取方法错误。
D、Cu(OH)2 和CuO都难溶于水,且氧化铜不与氢氧化钠反应,无法被除去,故所采取的方法错误。
【备考2023】浙教版科学中考第三轮冲刺讲义(二十一)
物质的分离与提纯
①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
二、除杂要领
①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
三、除杂方法:
(1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变为气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变为提纯的物质。
(5)吸收法:常用于气体的提纯。
四、混合物的分离:
(1)可溶性与难溶性物质的混合物——常用溶解、过滤、蒸发三步操作加以分离,分别得到纯净物。
如:粗盐的提纯;BaSO4和Na2SO4的混合物。
(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时,可考虑——结晶法。即冷却热饱和溶液的方法加以分离。
(3)两种物质均溶于水时,可考虑用化学方法分离。如BaCl2和NaCl的混合物。可将混合物先溶于水,加入适量Na2CO3溶液,得到BaCO3和NaCl溶液。
BaCl2+ Na2CO3=BaCO3↓+2NaCl。将沉淀过滤出,洗净后在沉淀中加入适量盐酸溶液,又得到BaCl2溶液,CO2逸出。BaCO3+2HCl =BaCl2+H2O+CO2↑。最后分别将NaCl溶液和BaCl2溶液蒸发,分别得到纯净的NaCl固体和BaCl2固体。
例1、除去下列各物质中混有的少量杂质,所用试剂及操作方法均正确的是( )
选项 物质(括号内为杂质) 试剂 操作方法
A 稀盐酸(稀硝酸) 过量硝酸银溶液 过滤
B H2(HCl) 浓H2SO4 洗气
C Cu(CuO) 过量稀盐酸 过滤、洗涤、干燥
D ZnSO4(FeSO4) 过量Zn粉 过滤、洗涤、干燥
例2、为提纯下列物质,所选用的除杂试剂和分离方法都正确的是( )
选项 物质(括号内为杂质) 除杂试剂 分离方法
A 二氧化碳(一氧化碳) 氢氧化钠溶液 洗气
B 氯化铜溶液(氯化锌) 金属铜 过滤
C 氯化钠固体(碳酸钠) 稀盐酸 蒸发结晶
D 二氧化锰粉末(碳粉) 水 过滤
A.A B.B C.C D.D
例3、下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)( )
选项 物质 除杂试剂(足量) 操作方法
A CO2(HCl) 氢氧化钠溶液 气体通过盛有氢氧化钠溶液的洗气瓶
B NaCl(Na2CO3) 硫酸 加入足量硫酸、蒸发、结晶
C MnO2(NaCl) 水 加入足量水溶解、过滤、洗涤、干燥
D Cu(CuO) 氧气 通入足量氧气并加热
A.A B.B C.C D.D
例4、除去CO中混有的少量CO2,选用的试剂和部分装置均正确的是( )
选项 A B C D
试剂 氢氧化钠溶液 氧化铜固体 浓硫酸 硫酸钠溶液
部分装置
1.下列是四位同学分别设计的实验方案,可行的是( )
A.用BaCl2溶液除去KNO3溶液中混有的少量K2SO4,得到纯净的KNO3溶液
B.向盐酸和氢氧化钠反应后的混合溶液中滴加硝酸银溶液,有白色沉淀产生,就可证明盐酸有剩余
C.除去硫酸铁溶液中混有的硫酸,可以往其中加入铁粉
D.用食醋来鉴别厨房中的两种固体食盐和纯碱
2.下列关于物质除杂所选用方法正确的是( )
选项 物质 所含杂质 除杂方法
A FeSO4 溶液 CuSO4 加入过量Fe粉并过滤
B CO2 CO 将混合气体通过红热铜网
C NaCl溶液 BaCl2 加入过量Na2SO4并过滤
D Mg Cu 加入过量稀硫酸并过滤
3.下列选用的除杂试剂和实验操作不正确的是( )
选项 物质 杂质 所选试剂(或操作)
A 盐酸 硫酸 加适量氯化钡溶液、过滤
B CaCl2 CaCO3 加水溶解、过滤、蒸发
C Fe Cu 加过量稀盐酸、过滤
D CO CO2 通入足量氢氧化钠溶液、干燥
A.A B.B C.C D.D
4.某溶液含有Ag+、Ba2+、Mg2+,为了将这三种离子逐一进行沉淀分离,加入下列物质先后顺序正确是( )
A.Na2CO3、NaCl、NaOH
B.NaCl、Na2CO3、NaOH
C.NaOH、NaCl、Na2CO3
D.NaCl、NaOH、Na2CO3
5.下列选用的除杂试剂和实验操作都正确的是( )
选项 物质 杂质 除杂试剂 操作方法
A CO2 HCl 氢氧化钠溶液 气体通过盛有足量氢氧化钠溶液的洗气瓶
B NaCl Na2CO3 盐酸 加入少量盐酸、蒸发、结晶
C CaCO3 NaCl 水 加入足量水溶解、过滤、洗涤、干燥
D Cu CuO 氧气 通入足量氧气并加热
A.A B.B C.C D.D
1.除去下列物质中的少量杂质,所选用的试剂和操作方法均正确的是( )
选项 物质 杂质(少量) 试剂和操作方法
A 木炭粉 氧化铜 加足量稀盐酸
B 氯化钠 泥沙 加足量的水溶解,过滤、洗涤、干燥
C 氯化钾 碳酸钾 加适量稀盐酸,蒸发结晶
D 硫酸亚铁 硫酸铜 加足量铁粉,过滤、蒸发结晶
2.除去下列物质中所含的杂质,所用的试剂和方法不正确的是( )
选项 物质 杂质 除杂所用试剂和方法
A CO2 水蒸气 通过浓硫酸
B CO2 CO 点燃
C CuO Cu 在空气中加热
D KCl MnO2 溶解、过滤、蒸发结晶
A.A B.B C.C D.D
3.除去下列各组物质中的杂质,所用试剂和方法均正确的是:( )
选项 物质 杂质 除杂所用的试剂和方法
A CaO固体 CaCO3固体 加入适量的稀盐酸
B NaOH溶液 Ca(OH)2溶液 先加入过量的Na2CO3溶液,再过滤
C CO2气体 CO气体 点燃
D H2气体 HCl气体 先通过NaOH溶液,再通过浓硫酸
A.A B.B C.C D.D
4.下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)( )
A.NaCl(Na2CO3)加足量稀盐酸、蒸发、结晶
B.CaCl2(CaCO3)加足量稀硫酸、蒸发、结晶
C.Fe(Cu)加足量稀盐酸、过滤、洗涤、干燥
D.Cu(OH)2 (CuO)加足量NaOH、过滤、洗涤、干燥
参考答案
例1、C
【解析】稀盐酸能与过量硝酸银溶液反应生成氯化银沉淀和硝酸,反而会把原物质除去。浓H2SO4不能与氯化氢气体反应,不能除去杂质。CuO能与稀盐酸反应生成氯化铜和水,铜不与稀盐酸反应,再过滤、洗涤、干燥,能除去杂质且没有引入新的杂质。过量Zn粉能与FeSO4溶液反应生成硫酸锌溶液和铁,过滤后将滤液蒸发结晶即可得到纯净的ZnSO4,无需进行洗涤、干燥。
例2、C
【解析】(1)在提纯物质时最终要将杂质全部除去,不能引入新的杂质;(2)在除去杂质时不能将需要的物质也除去。据此可以判断选项。
A、要除去二氧化碳中的一氧化碳,不能使用氢氧化钠溶液,氢氧化钠溶液会将二氧化碳除去,A错误;
B、要除去氯化铜溶液中的氯化锌,金属铜不能与杂质氯化锌反应,所以无法除去,B错误;
C、要除去氯化钠固体中的碳酸钠,稀盐酸能与碳酸钠反应不能与氯化钠反应,生成物为氯化钠、二氧化碳和水,过量的稀盐酸在蒸发结晶中可以除去,方法正确,C正确;
D、要除去二氧化锰粉末中的碳粉,二氧化锰和碳在水中都是不溶的,所以用水不能除去碳粉,D错误。
例3、C
【解析】除杂是指有效除去原物质中所含杂质且不与主要成分反应,且不会引进新的杂质成分的过程,比如:除去碳酸氢钠中的碳酸钠。
A、NaOH溶液与CO2和HCl都能发生反应;故A错误;
B、会生成新的杂质;故B错误;
C、MnO2不溶于水,NaCl溶于水,过滤后得到MnO2,干燥后即得到纯净的MnO2;故C正确;
D、Cu能与氧气发生反应,CuO不能与氧气发生反应;故D错误;
例4、A
【解析】通过A选项中的氢氧化钠溶液可以除去CO2;B选项中氧化铜会使CO转化为CO2;C选项中的装置不便盛放浓硫酸,且浓硫酸也不能吸收CO2;D选项中的硫酸钠溶液不能吸收CO2。
1.D
【解析】(1)除杂的基本原则:①不引入新的杂质;②不与除杂试剂反应;
(2)盐酸和氢氧化钠反应生成氯化钠和水,当滴加硝酸银溶液后,氯化钠和硝酸银反应会生成氯化银白色沉淀,因此有白色沉淀不能说明盐酸过量;
(3)铁和硫酸反应生成硫酸亚铁而不是硫酸铁;
(4)食醋与食盐不反应,而与纯碱反应生成二氧化碳气体。
【解答】A.氯化钡与硫酸钾反应生成硫酸钡沉淀和氯化钾,在除去硫酸钾的同时引入新的杂质氯化钾,故A不可行;
B.向盐酸和氢氧化钠反应后的混合溶液中滴加硝酸银溶液,有白色沉淀产生,不能证明盐酸有剩余,故B不可行;
C.铁和硫酸反应生成硫酸亚铁而不是硫酸铁,因此在除去硫酸的同时引入新的杂质硫酸亚铁,故C不可行;
D.用食醋来鉴别厨房中的两种固体食盐和纯碱,故D可行。
2.A
【解析】过量Fe粉与CuSO4溶液反应生成硫酸亚铁溶液和铜,能除去杂质且没有引入新的杂质;铜与一氧化碳不反应,不能将二氧化碳中的一氧化碳除去;BaCl2与过量Na2SO4溶液反应生成硫酸钡沉淀和氯化钠,能除去杂质,但引入了新的杂质硫酸钠;镁与硫酸反应生成硫酸镁和氢气,铜不与稀硫酸反应,反而会把原物质除去。
3.C
【解析】根据物质的除杂原则分析,物质除杂时选择的药品要只与杂质发生反应,不与原物质反应,且在除杂时不能引入新杂质。
A、加适量氯化钡溶液,杂质硫酸可与氯化钡反应生成硫酸钡沉淀和盐酸,过滤去沉淀,得到纯净盐酸,不符合题意;
B、碳酸钙不溶于水,氯化钙溶于水,加水溶解后过滤蒸发,可去掉杂质,不符合题意;
C、加过量的稀盐酸,杂质铜不反应,而原物质铁发生反应,符合题意;
D、通入足量的氢氧化钠溶液,可去掉二氧化碳杂质,干燥去掉水,得到纯净CO,不符合题意;
4.D
【解析】本题关键在于“逐一分离”,在分离一种离子时不能有其他离子共同分离出来。若先加Na2CO3则会有Ag2CO3、BaCO3、MgCO3(微溶)三种沉淀出现;若先加NaOH,则会有AgOH和Mg(OH)2共同沉淀出来,所以只能先加入NaCl,让Ag+沉淀,其次再加入NaOH让Mg2+沉淀,最后再加入Na2CO3让Ba2+沉淀。
5.C
【解析】(1)除杂的“四原则”:不增(提纯过程中不增加新的杂质);不减(不减少欲被提纯的物质);易分离(被提纯物与杂质容易分离);易复原(被提纯物质要复原);
(2)“三必须”:除杂试剂必须过量;过量试剂必须除尽(因为过量试剂带入新的杂质);除杂途径选最佳。
【解答】A.二氧化碳气体会和氢氧化钠溶液反应,使被提纯的物质减少,故A错误;
B.加入的除杂试剂稀盐酸不过量,会导致其中的杂质碳酸钠除不尽,故B错误;
C.加入足量的水后,氯化钠会溶于水,而碳酸钙会沉淀,二者完全分开,故C正确;
D.铜与加入的除杂试剂氧气反应,会导致被除杂物质减少,故D错误。
1.C
【解析】除杂的原则是所加试剂只与杂质反应,且不生成新的杂质。木炭粉中混有少量氧化铜,可加足量稀盐酸,过滤,但要将滤出物洗涤、干燥。氯化钠中混有少量泥沙,可加足量的水溶解、过滤、蒸发结晶。氯化钾中混有少量碳酸钾,可加适量稀盐酸,K2CO3+2HCl===2KCl+H2O+CO2↑,然后蒸发结晶。金属单质与盐发生的置换反应要在溶液中进行,固体之间不能反应。
2.B
【解析】除杂的基本原则:①不能引入新的杂质;②不能与提纯试剂反应,据此分析即可。
A.浓硫酸具有吸水性,可以除去二氧化碳中的水蒸气而不与它反应,故A正确不合题意;
B.如果二氧化碳中存在少量的一氧化碳,无法通过点燃的方法使一氧化碳燃烧生成二氧化碳,故B错误符合题意;
C.铜在空气中加热可与氧气反应生成氧化铜,可以除去杂质,故C正确不合题意;
D.氯化钾溶于水,而二氧化锰不溶于水,加水溶解后,再通过过滤可以去除二氧化锰,而将剩余的滤液蒸发结晶可以得到氯化钾晶体,故D正确不合题意。
3.D
【解析】本题主要考查物质分离与提纯。所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变,除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【解答】A、加稀盐酸,原物质氧化钙和杂质碳酸钙都会发生反应,不符合题意;
B、加入过量碳酸钠除去了杂质氢氧化钙,但引入了新杂质,不符合题意;
C、二氧化碳为灭火性气体,大量二氧化碳中少量CO,不能点燃,不符合题意;
D、通过氢氧化钠溶液,只杂质氯化氢发生反应,再通过浓硫酸干燥,得到纯净氢气,符合题意;
4.A
【解析】除杂质必须同时满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应时不能带入新的杂质。
A、Na2CO3能与稀盐酸反应生成氯化钠、水和二氧化碳,再蒸发、结晶,能除去杂质且没有引入新的杂质,故所采取的方法正确。
B、CaCO3能与稀硫酸反应生成硫酸钙钙、水和二氧化碳,能除去杂质但引入了新的杂质硫酸钙钙,故所采取的方法错误。
C、Fe能与稀盐酸反应生成氯化亚铁和氢气,铜不与稀盐酸反应,反而会把原物质除去,故所采取方法错误。
D、Cu(OH)2 和CuO都难溶于水,且氧化铜不与氢氧化钠反应,无法被除去,故所采取的方法错误。
【备考2023】浙教版科学中考第三轮冲刺讲义(二十一)
物质的分离与提纯
同课章节目录
