2023年河南中考化学金属与盐溶液反应后滤液、滤渣成分的分析课件(共24张PPT)
文档属性
| 名称 | 2023年河南中考化学金属与盐溶液反应后滤液、滤渣成分的分析课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 714.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-23 19:47:55 | ||
图片预览





文档简介
(共24张PPT)
2023河南中考:重点专题突破
金属与盐溶液反应后
滤液、滤渣成分的分析
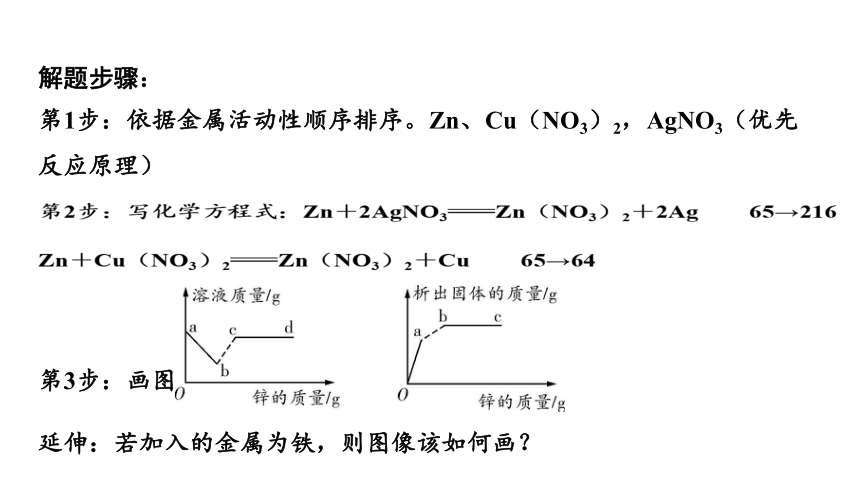
将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液和固体。
(1)写出会导致溶液质量变化的有关反应的化学方程式。
(2)随着锌粉的加入,溶液的质量和析出固体的质量将如何变化?
解题步骤:
第1步:依据金属活动性顺序排序。Zn、Cu(NO3)2,AgNO3(优先反应原理)
第2步:写化学方程式:Zn+2AgNO3Zn(NO3)2+2Ag 65→216
Zn+Cu(NO3)2Zn(NO3)2+Cu 65→64
第3步:画图
延伸:若加入的金属为铁,则图像该如何画?
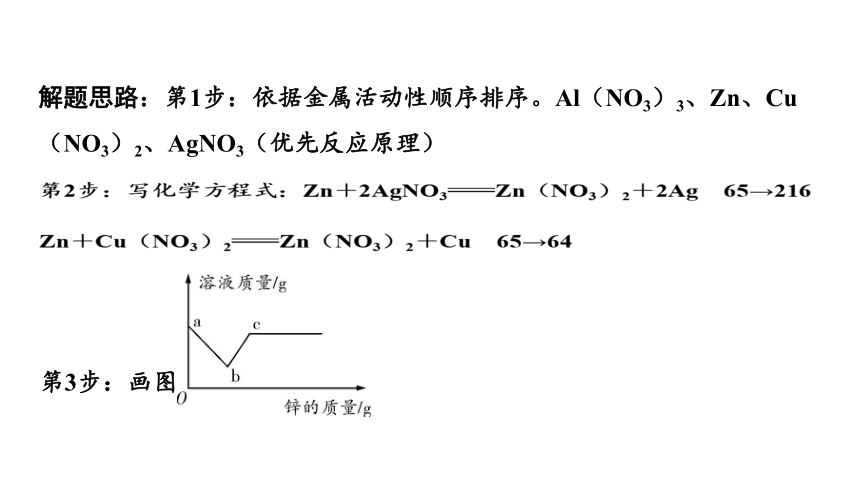
在Cu(NO3)2、Al(NO3)3和AgNO3的混合溶液中加入一定质量的锌粉,充分反应后过滤,向过滤后的溶液中滴加盐酸,无明显现象。则过滤后溶液中一定含有哪些溶质?请写出一定发生反应的化学方程式。
解题思路:第1步:依据金属活动性顺序排序。Al(NO3)3、Zn、Cu(NO3)2、AgNO3(优先反应原理)
第2步:写化学方程式:Zn+2AgNO3Zn(NO3)2+2Ag 65→216
Zn+Cu(NO3)2Zn(NO3)2+Cu 65→64
第3步:画图
【解析】滴加稀盐酸没有明显的现象,说明滤出的固体中没有锌,则一定发生了锌和硝酸银的反应,可能发生了锌和硝酸铜的反应。(锌和硝酸铝不反应)
答案:Al(NO3)3、Zn(NO3)2 Zn+2AgNO3Zn(NO3)2+2Ag
延伸思考:若纵坐标为固体的质量,则图像应如何画?变化与趋势:文字解释溶液增大?减少?若滴加稀盐酸有气泡产生,则滤出的固体中一定有什么?滤液中一定有什么?
注意:对金属性质的考查,一般放在简答题的第22或23题,属于难题,在训练中,无论题中的金属和盐溶液如何改变,建议考生一定按照以上思路进行分析,不盲目地简单地看答案,厘清思路很重要。
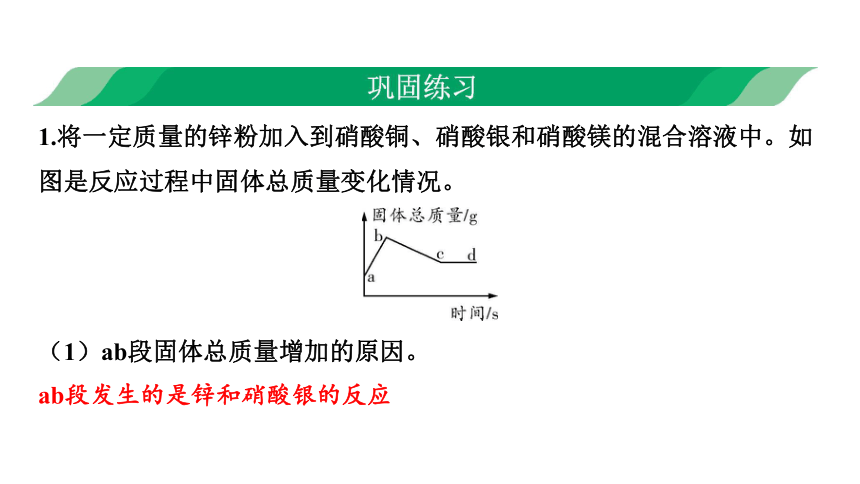
1.将一定质量的锌粉加入到硝酸铜、硝酸银和硝酸镁的混合溶液中。如图是反应过程中固体总质量变化情况。
(1)ab段固体总质量增加的原因。
ab段发生的是锌和硝酸银的反应
(2)写出bc段发生反应的化学方程式。
Zn+Cu(NO3)2Zn(NO3)2+Cu
(3)d点溶液中一定含有的溶质是什么?
硝酸镁、硝酸锌
2.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入锌粉,充分反应后过滤,得到固体和滤液。
(1)写出能使溶液质量增加的反应的化学方程式。
Zn+Cu(NO3)2Zn(NO3)2+Cu
(2)若所得滤液中只含一种溶质,试分析过滤后所得固体的成分。
一定含有Ag、Cu,可能含有Zn。
3.为了从硝酸亚铁和硝酸银的混合溶液中提取并回收银,某同学设计了如下的实验方案:
(1)溶液乙中含有的溶质是什么?
硝酸亚铁
(2)写出步骤②中发生反应的化学方程式。
Fe+H2SO4FeSO4+H2↑
4.将过量的铁粉加入到一定质量的硝酸锌、硝酸铜和硝酸银的混合溶液中,充分反应后过滤,得到滤液和滤渣。
(1)写出滤液中溶质的成分。
硝酸锌和硝酸亚铁。
(2)向滤渣中加入稀盐酸,可观察到什么现象?
有气泡产生,溶液由无色逐渐变为浅绿色。
(3)请分析反应后滤液的质量变化情况,并说明原因。
反应后滤液质量减小,因为铁的相对原子质量小于铜和银,所以铁分别与硝酸铜和硝酸银反应后,滤液质量均减小。
5.向一定质量AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入一定量的Zn,溶液质量随反应时间变化的情况如图所示。
(1)写出ab段有关反应的化学方程式。
Zn+2AgNO3Zn(NO3)2+2Ag
(2)若将反应至c点时的溶液过滤,请分析所得滤渣的成分。
Ag、Cu
(3)请解释bc段溶液质量增加的原因。
bc段发生的反应是锌和硝酸铜反应,溶液中的硝酸铜与锌反应生成硝酸锌和铜,铜的相对原子质量为64,锌的相对原子质量为65,故溶液质量增加。
【解析】金属与盐溶液反应,解题步骤如下:第一步,依据金属活动性顺序表,将题中涉及的物质排序:Zn、Fe(NO3)2、Cu(NO3)2、AgNO3;第二步,依据优先反应原理,依次写出相关反应的化学方程式,标出质量变化的关系:①Zn+2AgNO3Zn(NO3)2+2Ag 65→216
②Zn+Cu(NO3)2Zn(NO3)2+Cu 65→64
③Zn+Fe(NO3)2Zn(NO3)2+Fe 65→56
第三步,依据图像,根据有关反应的顺序和质量变化的关系,具体分析。
ab段发生的是反应①,溶液的质量减小,bc段发生的是反应②,溶液的质量增加,cd段发生的是反应③,溶液的质量增加。c点Cu(NO3)2反应完,还未发生反应③,故滤出的固体只有银和铜。
6.向含有Al(NO3)3、Fe(NO3)2、AgNO3三种物质的混合溶液的烧杯中加入一定量的锌粉,反应后过滤得到滤液和固体。
(1)若所得到的固体中含有两种金属,则滤液中肯定含有的溶质是什么?
Al(NO3)3、Zn(NO3)2
(2)若所得到的滤液中的溶质为两种,则固体中可能含有的金属是什么?
Zn
(3)反应过程中测得烧杯中溶液的质量随时间的变化如图所示,请写出bc段发生反应的化学方程式。
Zn+Fe(NO3)2Zn(NO3)2+Fe
7.向Cu(NO3)2、Zn(NO3)2和AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,得到固体和溶液。
(1)若向反应后的固体中滴加稀硫酸,有气泡产生,则该固体中成分有哪些?
铁、银、铜
(2)写出上述实验中一定发生反应的化学方程式。
Fe+2AgNO3Fe(NO3)2+2Ag
Fe+Cu(NO3)2Fe(NO3)2+Cu
(3)请分析反应前后溶液质量变化情况并说明原因。
反应后溶液的质量变小,因为铁的相对原子质量小于铜和银,所以铁分别与硝酸铜和硝酸银反应后,滤液质量均减小。
8.向一定质量的AgNO3、Fe(NO3)2、Al(NO3)3的混合溶液中逐渐加入足量的锌粒。如图是溶液中硝酸亚铁的质量随锌粒加入的变化曲线。请回答:
(1)写出a~b段发生反应的化学方程式。
Zn+2AgNO3Zn(NO3)2+2Ag
(2)c点溶液中含有的阳离子有哪些?
Zn2+、Al3+、Fe2+
(3)请说明b~d段溶液质量的变化及原因。
bd段溶液质量增加。因为锌的相对原子质量大于铁,所以锌与硝酸亚铁反应后,滤液质量增加。
9.在一定质量R(NO3)2、AgNO3和Al(NO3)3的混合溶液中加入一定量的Zn,充分反应后,过滤,可得到固体和溶液。已知R在金属活动性顺序中位于氢的后面。
(1)若向所得固体上滴加盐酸有气泡产生,分析固体的成分。
Ag,R,Zn
(2)反应后所得溶液的质量与反应前溶液的质量相比,若保持不变,原因是什么?
锌与AgNO3反应,使溶液质量减小,与R(NO3)2反应使溶液质量增大,当减小的质量等于增大的质量时,溶液的质量保持不变。
注:R若写成具体的金属(如Cu),第(1)小题不给分。
2023河南中考:重点专题突破
金属与盐溶液反应后
滤液、滤渣成分的分析
将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液和固体。
(1)写出会导致溶液质量变化的有关反应的化学方程式。
(2)随着锌粉的加入,溶液的质量和析出固体的质量将如何变化?
解题步骤:
第1步:依据金属活动性顺序排序。Zn、Cu(NO3)2,AgNO3(优先反应原理)
第2步:写化学方程式:Zn+2AgNO3Zn(NO3)2+2Ag 65→216
Zn+Cu(NO3)2Zn(NO3)2+Cu 65→64
第3步:画图
延伸:若加入的金属为铁,则图像该如何画?
在Cu(NO3)2、Al(NO3)3和AgNO3的混合溶液中加入一定质量的锌粉,充分反应后过滤,向过滤后的溶液中滴加盐酸,无明显现象。则过滤后溶液中一定含有哪些溶质?请写出一定发生反应的化学方程式。
解题思路:第1步:依据金属活动性顺序排序。Al(NO3)3、Zn、Cu(NO3)2、AgNO3(优先反应原理)
第2步:写化学方程式:Zn+2AgNO3Zn(NO3)2+2Ag 65→216
Zn+Cu(NO3)2Zn(NO3)2+Cu 65→64
第3步:画图
【解析】滴加稀盐酸没有明显的现象,说明滤出的固体中没有锌,则一定发生了锌和硝酸银的反应,可能发生了锌和硝酸铜的反应。(锌和硝酸铝不反应)
答案:Al(NO3)3、Zn(NO3)2 Zn+2AgNO3Zn(NO3)2+2Ag
延伸思考:若纵坐标为固体的质量,则图像应如何画?变化与趋势:文字解释溶液增大?减少?若滴加稀盐酸有气泡产生,则滤出的固体中一定有什么?滤液中一定有什么?
注意:对金属性质的考查,一般放在简答题的第22或23题,属于难题,在训练中,无论题中的金属和盐溶液如何改变,建议考生一定按照以上思路进行分析,不盲目地简单地看答案,厘清思路很重要。
1.将一定质量的锌粉加入到硝酸铜、硝酸银和硝酸镁的混合溶液中。如图是反应过程中固体总质量变化情况。
(1)ab段固体总质量增加的原因。
ab段发生的是锌和硝酸银的反应
(2)写出bc段发生反应的化学方程式。
Zn+Cu(NO3)2Zn(NO3)2+Cu
(3)d点溶液中一定含有的溶质是什么?
硝酸镁、硝酸锌
2.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入锌粉,充分反应后过滤,得到固体和滤液。
(1)写出能使溶液质量增加的反应的化学方程式。
Zn+Cu(NO3)2Zn(NO3)2+Cu
(2)若所得滤液中只含一种溶质,试分析过滤后所得固体的成分。
一定含有Ag、Cu,可能含有Zn。
3.为了从硝酸亚铁和硝酸银的混合溶液中提取并回收银,某同学设计了如下的实验方案:
(1)溶液乙中含有的溶质是什么?
硝酸亚铁
(2)写出步骤②中发生反应的化学方程式。
Fe+H2SO4FeSO4+H2↑
4.将过量的铁粉加入到一定质量的硝酸锌、硝酸铜和硝酸银的混合溶液中,充分反应后过滤,得到滤液和滤渣。
(1)写出滤液中溶质的成分。
硝酸锌和硝酸亚铁。
(2)向滤渣中加入稀盐酸,可观察到什么现象?
有气泡产生,溶液由无色逐渐变为浅绿色。
(3)请分析反应后滤液的质量变化情况,并说明原因。
反应后滤液质量减小,因为铁的相对原子质量小于铜和银,所以铁分别与硝酸铜和硝酸银反应后,滤液质量均减小。
5.向一定质量AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入一定量的Zn,溶液质量随反应时间变化的情况如图所示。
(1)写出ab段有关反应的化学方程式。
Zn+2AgNO3Zn(NO3)2+2Ag
(2)若将反应至c点时的溶液过滤,请分析所得滤渣的成分。
Ag、Cu
(3)请解释bc段溶液质量增加的原因。
bc段发生的反应是锌和硝酸铜反应,溶液中的硝酸铜与锌反应生成硝酸锌和铜,铜的相对原子质量为64,锌的相对原子质量为65,故溶液质量增加。
【解析】金属与盐溶液反应,解题步骤如下:第一步,依据金属活动性顺序表,将题中涉及的物质排序:Zn、Fe(NO3)2、Cu(NO3)2、AgNO3;第二步,依据优先反应原理,依次写出相关反应的化学方程式,标出质量变化的关系:①Zn+2AgNO3Zn(NO3)2+2Ag 65→216
②Zn+Cu(NO3)2Zn(NO3)2+Cu 65→64
③Zn+Fe(NO3)2Zn(NO3)2+Fe 65→56
第三步,依据图像,根据有关反应的顺序和质量变化的关系,具体分析。
ab段发生的是反应①,溶液的质量减小,bc段发生的是反应②,溶液的质量增加,cd段发生的是反应③,溶液的质量增加。c点Cu(NO3)2反应完,还未发生反应③,故滤出的固体只有银和铜。
6.向含有Al(NO3)3、Fe(NO3)2、AgNO3三种物质的混合溶液的烧杯中加入一定量的锌粉,反应后过滤得到滤液和固体。
(1)若所得到的固体中含有两种金属,则滤液中肯定含有的溶质是什么?
Al(NO3)3、Zn(NO3)2
(2)若所得到的滤液中的溶质为两种,则固体中可能含有的金属是什么?
Zn
(3)反应过程中测得烧杯中溶液的质量随时间的变化如图所示,请写出bc段发生反应的化学方程式。
Zn+Fe(NO3)2Zn(NO3)2+Fe
7.向Cu(NO3)2、Zn(NO3)2和AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,得到固体和溶液。
(1)若向反应后的固体中滴加稀硫酸,有气泡产生,则该固体中成分有哪些?
铁、银、铜
(2)写出上述实验中一定发生反应的化学方程式。
Fe+2AgNO3Fe(NO3)2+2Ag
Fe+Cu(NO3)2Fe(NO3)2+Cu
(3)请分析反应前后溶液质量变化情况并说明原因。
反应后溶液的质量变小,因为铁的相对原子质量小于铜和银,所以铁分别与硝酸铜和硝酸银反应后,滤液质量均减小。
8.向一定质量的AgNO3、Fe(NO3)2、Al(NO3)3的混合溶液中逐渐加入足量的锌粒。如图是溶液中硝酸亚铁的质量随锌粒加入的变化曲线。请回答:
(1)写出a~b段发生反应的化学方程式。
Zn+2AgNO3Zn(NO3)2+2Ag
(2)c点溶液中含有的阳离子有哪些?
Zn2+、Al3+、Fe2+
(3)请说明b~d段溶液质量的变化及原因。
bd段溶液质量增加。因为锌的相对原子质量大于铁,所以锌与硝酸亚铁反应后,滤液质量增加。
9.在一定质量R(NO3)2、AgNO3和Al(NO3)3的混合溶液中加入一定量的Zn,充分反应后,过滤,可得到固体和溶液。已知R在金属活动性顺序中位于氢的后面。
(1)若向所得固体上滴加盐酸有气泡产生,分析固体的成分。
Ag,R,Zn
(2)反应后所得溶液的质量与反应前溶液的质量相比,若保持不变,原因是什么?
锌与AgNO3反应,使溶液质量减小,与R(NO3)2反应使溶液质量增大,当减小的质量等于增大的质量时,溶液的质量保持不变。
注:R若写成具体的金属(如Cu),第(1)小题不给分。
同课章节目录
