化学人教版(2019)选择性必修2 3.3.2离子晶体 课件(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3.2离子晶体 课件(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-23 20:48:06 | ||
图片预览







文档简介
(共22张PPT)
第三节 金属晶体与离子晶体
第2课时 离子晶体
第三章 晶体结构与性质
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
【问题引入】
下列晶体构成微粒有什么共同点?
由阴离子和阳离子相互作用而形成的晶体
(1)概念:
(2)微粒间的作用力:
离子键(静电作用:包括静电引力和静电斥力)
一、离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
(3)常见的离子晶体:
离子键特征:无方向性和饱和性
实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。
拓展视野
CuSO4 · 5H2O
KAl (SO4 )2· 12H2O
有的还存在电中性分子( H2O、NH3等)。
1-乙基-3-甲基咪唑四氟硼酸盐
离子晶体中除了有离子键,有的还有共价键和氢键
盐焗鸡,由客家人迁徙途中用盐包裹的“盐煨咸鸡”演变而来,其中鸡熟了盐却没化掉。但是做菜时加一抔水盐却溶解了。
②揉捏食盐晶体,你的感受?
①盐焗时,发现食盐都未熔融,说明了什么?
硬度较大,难以压缩
熔点高
③离子晶体这些物理性质与离子间的相互作用是否有一定的关系?离子晶体熔化和沸腾,需要破坏什么作用力?
融化时破坏离子键
交流研讨
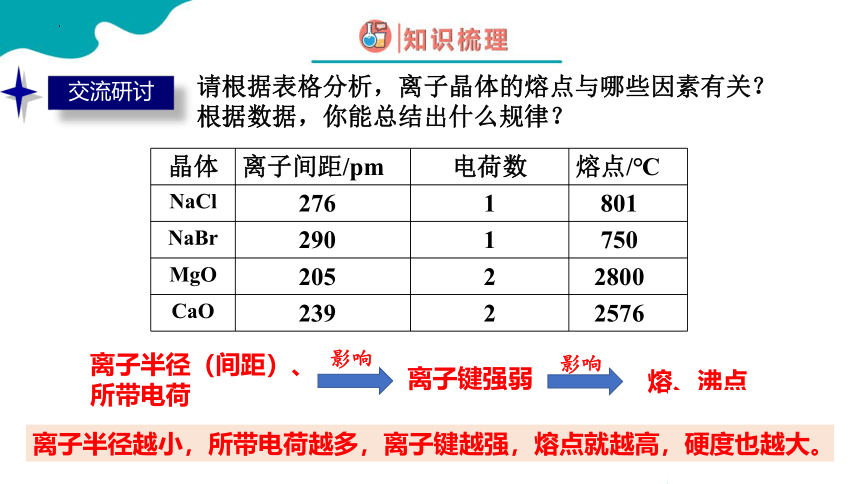
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
离子键强弱
熔、沸点
影响
离子半径(间距)、所带电荷
影响
离子半径越小,所带电荷越多,离子键越强,熔点就越高,硬度也越大。
交流研讨
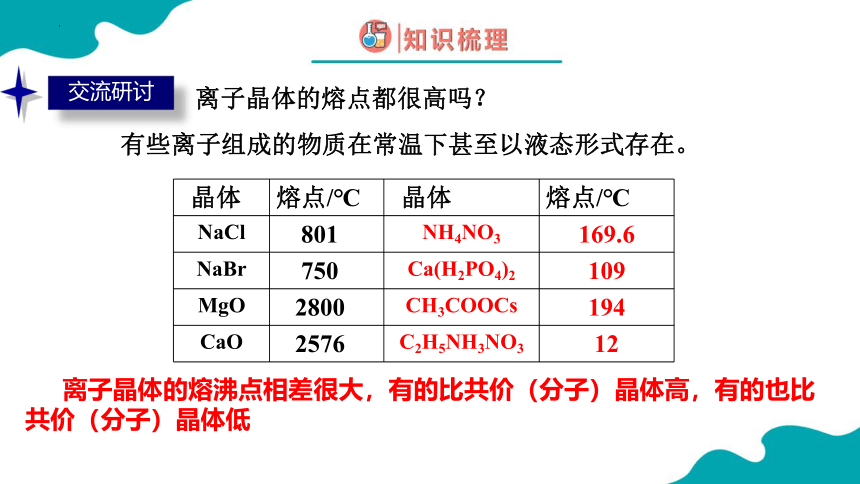
离子晶体的熔点都很高吗?
晶体 熔点/℃ 晶体 熔点/℃
NaCl 801 NH4NO3 169.6
NaBr 750 Ca(H2PO4)2 109
MgO 2800 CH3COOCs 194
CaO 2576 C2H5NH3NO3 12
离子晶体的熔沸点相差很大,有的比共价(分子)晶体高,有的也比共价(分子)晶体低
有些离子组成的物质在常温下甚至以液态形式存在。
一、离子晶体
(4)离子晶体的物理性质:
①熔沸点较高(差异也大)、硬度较大
②离子晶体一般不导电、但在熔融状态和水溶液中能导电
③绝大多数离子晶体能溶于水、难溶于有机溶剂
二、常见离子晶体的结构
观察氯化钠的晶胞模型,并思考:晶胞中各离子的位置分布?每个Na+周围有几个距离相等且最近的Cl-
CsCl晶体的微观结构
① Cs+和Cl-的空间位置关系?
③ Cs+周围等距离且最近的Cl-?Cl-周围等距离且最近的Cs+ ?
② 每个晶胞含Cs+、Cl-个数?
8
晶体类型 分子晶体 共价晶体 金属晶体 离子晶体
微粒种类
微粒间 相互作用
典型晶体
根据晶体构成微粒和微粒间相互作用不同分为四种类型
金属阳离子和自由电子
金属键
原子
离子键
共价键
分子
分子间
作用力
阴、阳离子
整理归纳
金属Cu
NaCl
CO2
共价晶体 分子晶体 离子晶体 金属晶体
晶体类型之间存在绝对的界限吗?
Na、Mg、Al、Si四种元素氧化物的化学键中离子键成分逐渐减少
氧化物 Na2O MgO Al2O3 SiO2
离子键百分数% 62 50 41 33
过渡晶体
介于某两种晶体类型之间的晶体
Na2O MgO Al2O3 SiO2
离子晶体 共价晶体
事实上,大多数离子晶体中的化学键具有一定的共价键成分。
过渡晶体
离子键的百分数和什么因素有关?
过渡型晶体
化合物 键型 离子键的百分数 电负性差值
CsCl 离子键 75% 3.16 ― 0.79 = 2.37
HCl 极性共价键 20% 3.16 ― 2.22 = 0.94
Cl2 非极性共价键 0 3.16 ― 3.16 = 0
电负性差值越大,离子键成分的百分数越高
结论一:四种典型晶体类型都存在过渡晶体
Na2O MgO Al2O3 SiO2
离子晶体 共价晶体
P2O5 SO3 Cl2O7
分子晶体
结论二:晶体性质偏向某一晶体类型的过渡晶体通常当作该晶体类型处理
混合型晶体
熔点均较高,金刚石硬度很高、不导电,石墨质软、能导电
结构决定性质
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?
你认为是什么造成了这种差异?
思考交流
金刚石部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3550℃ 10 2.11*10-13
石墨部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3850℃ 1 2.5*103
石墨性质特征
熔点高、质软、能导电
共价晶体特征
金属晶体特征
石墨结构特征
范德华力维系
分子晶体特征
混合型晶体
混合型晶体
石墨结构中未参与杂化的p轨道
层状结构
1.下列叙述正确的是( )
A.任何晶体中,若含有阳离子,就一定含有阴离子
B.金属晶体的形成是因为晶体中存在金属阳离子间的相互作用
C.价电子数越多,金属元素的金属性越强
D.含有金属元素的离子不一定是阳离子
D
2.金属晶体熔、沸点的高低和硬度大小一般取决于金属键的强弱,而金属键与金属阳离子所带电荷的多少及半径大小有关。由此判断下列说法正确的是( )
A.金属镁的熔点大于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐增大的
C.金属铝的硬度大于金属钠
D.金属镁的硬度小于金属钙
C
3.下列关于金属键的叙述中不正确的是( )
A.金属键是金属阳离子和自由电子这两种带异性电荷的微粒间强烈的相
互作用,其实质与离子键类似,也是一种电性作用
B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,
所以与共价键类似,也有方向性和饱和性
C.金属键是金属阳离子和“自由电子”间的相互作用,金属键无饱和性
和方向性
D.构成金属键的“自由电子”在整个金属内部的三维空间中做自由运动
B
4.下列物质的晶体一定属于离子晶体的是( )
A.在水中能电离出离子的物质
B.在水中能电离出SO42-的化合物
C.在水中能电离出Na+的化合物
D.熔化时化学键无变化的化合物
C
5.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
C
THANKS
谢谢聆听
第三节 金属晶体与离子晶体
第2课时 离子晶体
第三章 晶体结构与性质
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
【问题引入】
下列晶体构成微粒有什么共同点?
由阴离子和阳离子相互作用而形成的晶体
(1)概念:
(2)微粒间的作用力:
离子键(静电作用:包括静电引力和静电斥力)
一、离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
(3)常见的离子晶体:
离子键特征:无方向性和饱和性
实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。
拓展视野
CuSO4 · 5H2O
KAl (SO4 )2· 12H2O
有的还存在电中性分子( H2O、NH3等)。
1-乙基-3-甲基咪唑四氟硼酸盐
离子晶体中除了有离子键,有的还有共价键和氢键
盐焗鸡,由客家人迁徙途中用盐包裹的“盐煨咸鸡”演变而来,其中鸡熟了盐却没化掉。但是做菜时加一抔水盐却溶解了。
②揉捏食盐晶体,你的感受?
①盐焗时,发现食盐都未熔融,说明了什么?
硬度较大,难以压缩
熔点高
③离子晶体这些物理性质与离子间的相互作用是否有一定的关系?离子晶体熔化和沸腾,需要破坏什么作用力?
融化时破坏离子键
交流研讨
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
离子键强弱
熔、沸点
影响
离子半径(间距)、所带电荷
影响
离子半径越小,所带电荷越多,离子键越强,熔点就越高,硬度也越大。
交流研讨
离子晶体的熔点都很高吗?
晶体 熔点/℃ 晶体 熔点/℃
NaCl 801 NH4NO3 169.6
NaBr 750 Ca(H2PO4)2 109
MgO 2800 CH3COOCs 194
CaO 2576 C2H5NH3NO3 12
离子晶体的熔沸点相差很大,有的比共价(分子)晶体高,有的也比共价(分子)晶体低
有些离子组成的物质在常温下甚至以液态形式存在。
一、离子晶体
(4)离子晶体的物理性质:
①熔沸点较高(差异也大)、硬度较大
②离子晶体一般不导电、但在熔融状态和水溶液中能导电
③绝大多数离子晶体能溶于水、难溶于有机溶剂
二、常见离子晶体的结构
观察氯化钠的晶胞模型,并思考:晶胞中各离子的位置分布?每个Na+周围有几个距离相等且最近的Cl-
CsCl晶体的微观结构
① Cs+和Cl-的空间位置关系?
③ Cs+周围等距离且最近的Cl-?Cl-周围等距离且最近的Cs+ ?
② 每个晶胞含Cs+、Cl-个数?
8
晶体类型 分子晶体 共价晶体 金属晶体 离子晶体
微粒种类
微粒间 相互作用
典型晶体
根据晶体构成微粒和微粒间相互作用不同分为四种类型
金属阳离子和自由电子
金属键
原子
离子键
共价键
分子
分子间
作用力
阴、阳离子
整理归纳
金属Cu
NaCl
CO2
共价晶体 分子晶体 离子晶体 金属晶体
晶体类型之间存在绝对的界限吗?
Na、Mg、Al、Si四种元素氧化物的化学键中离子键成分逐渐减少
氧化物 Na2O MgO Al2O3 SiO2
离子键百分数% 62 50 41 33
过渡晶体
介于某两种晶体类型之间的晶体
Na2O MgO Al2O3 SiO2
离子晶体 共价晶体
事实上,大多数离子晶体中的化学键具有一定的共价键成分。
过渡晶体
离子键的百分数和什么因素有关?
过渡型晶体
化合物 键型 离子键的百分数 电负性差值
CsCl 离子键 75% 3.16 ― 0.79 = 2.37
HCl 极性共价键 20% 3.16 ― 2.22 = 0.94
Cl2 非极性共价键 0 3.16 ― 3.16 = 0
电负性差值越大,离子键成分的百分数越高
结论一:四种典型晶体类型都存在过渡晶体
Na2O MgO Al2O3 SiO2
离子晶体 共价晶体
P2O5 SO3 Cl2O7
分子晶体
结论二:晶体性质偏向某一晶体类型的过渡晶体通常当作该晶体类型处理
混合型晶体
熔点均较高,金刚石硬度很高、不导电,石墨质软、能导电
结构决定性质
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?
你认为是什么造成了这种差异?
思考交流
金刚石部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3550℃ 10 2.11*10-13
石墨部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3850℃ 1 2.5*103
石墨性质特征
熔点高、质软、能导电
共价晶体特征
金属晶体特征
石墨结构特征
范德华力维系
分子晶体特征
混合型晶体
混合型晶体
石墨结构中未参与杂化的p轨道
层状结构
1.下列叙述正确的是( )
A.任何晶体中,若含有阳离子,就一定含有阴离子
B.金属晶体的形成是因为晶体中存在金属阳离子间的相互作用
C.价电子数越多,金属元素的金属性越强
D.含有金属元素的离子不一定是阳离子
D
2.金属晶体熔、沸点的高低和硬度大小一般取决于金属键的强弱,而金属键与金属阳离子所带电荷的多少及半径大小有关。由此判断下列说法正确的是( )
A.金属镁的熔点大于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐增大的
C.金属铝的硬度大于金属钠
D.金属镁的硬度小于金属钙
C
3.下列关于金属键的叙述中不正确的是( )
A.金属键是金属阳离子和自由电子这两种带异性电荷的微粒间强烈的相
互作用,其实质与离子键类似,也是一种电性作用
B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,
所以与共价键类似,也有方向性和饱和性
C.金属键是金属阳离子和“自由电子”间的相互作用,金属键无饱和性
和方向性
D.构成金属键的“自由电子”在整个金属内部的三维空间中做自由运动
B
4.下列物质的晶体一定属于离子晶体的是( )
A.在水中能电离出离子的物质
B.在水中能电离出SO42-的化合物
C.在水中能电离出Na+的化合物
D.熔化时化学键无变化的化合物
C
5.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
C
THANKS
谢谢聆听
