上海市上交附高2022-2023学年高二下学期3月月考化学试题(含答案)
文档属性
| 名称 | 上海市上交附高2022-2023学年高二下学期3月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-24 08:42:28 | ||
图片预览


文档简介
上交附高2022-2023学年高二下学期3月月考化学试题
一、选择题
1.下列关于有机物的叙述不正确的是( ).
A.碳原子间能形成单键,也能形成双键或三键,进而形成碳链或碳环
B.易溶于汽油、酒精、苯等有机溶剂中的物质不一定是有机物
C.碳原子性质较活泼,除了碳原子之间可以成键外,与其他元素原子也可形成化学键
D.有机物所发生的反应,一般比较复杂,速度缓慢,并且还常伴有副反应发生
2.用氯气取代相对分子质量为44的烃分子上的一个氢原子,所得的化合物可能有( ).
A.3种 B.4种 C.5种 D.6种
3.环之间共用一个碳原子的化合物称为螺环化合物,螺戊烷是最简单的一种。下列关于该化合物的说法错误的是( ).
A.与环戊烯互为同分异构体 B.所有碳原子均处同一平面
C.二氯代物超过两种 D.理论上生成至少需要
4.以物质a为原料,制备物质d(金刚烷)的合成路线如下图所示。
关于以上有机物的说法中不正确的是( )。
A.物质b的分子式为 B.物质d的一氯代物有2种
C.物质c与物质d互为同分异构体 D.物质a最多有10个原子共平面
5.下列说法正确的是( )。
A.石油液化气的主要成分为甲烷 B.石油的分馏和蒸馏的原理是相似的
C.煤的干馏可分离出煤中含有的煤焦油 D.石油经过分馏得到的汽油是纯净物
6.保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述错误的是( )。
A.PE、PVC都属于链状高分子化合物,受热易熔化
B.废弃的PE和PVC均可回收利用以减少白色污染
C.焚烧PVC保鲜膜会放出有毒气体如
D.PE、PVC的单体都是不饱和经,能使溴水褪色
7.下图是以石油为原料的部分转化流程,下列关于4个反应的反应类型的说法正确的是( )。
A.反应①与反应③反应类型相同 B.反应②与反应④反应类型相同
C.反应③与反应④反应类型相同 D.反应①与反应④反应类型相同
8.在一定条件卞,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下:
对二甲苯 邻二甲苯 间二甲苯 苯
沸点/℃ 138 144 139 80
熔点/℃ 13 6
下列说法不正确的是( )。
A.该反应属于取代反应
B.甲苯的沸点高于144℃
C.用蒸馏的方法可将苯从反应所得产物中首先分离出来
D.从二甲苯混合物中,用冷却结晶的方法可将对二甲萃分离出来
9.对氨基苯甲酸可用申苯为原料合成。已知:①苯环上的硝基可被还原为氨基:,产物苯胺还原性强,易被氧化;②为邻、对位取代定位基,而为间位取代定位基。则由甲苯合成对氨基苯甲酸的步骤合理的是( )。
A.甲苯XY对氨基苯甲酸
B.甲苯XY对氨基苯甲酸
C.甲苯XY对氨基苯甲酸
D.甲苯XY对氨基苯甲酸
10.已知酸性:,综合考虑反应物的转化率和原料成本等因素,将完全转化为的最佳方法是( )。
A.与稀共热后,加入足量的溶液
B.与稀共热后,加入足量的溶液
C.与足量的溶液共热后,再通入足量
D.与足量的溶液共热后,再加入适量的溶液
11.膳食纤维具有突出的保健功能,是人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是( )。
A.芥子醇能发生的反应类型有氧化反应、取代反应、加成反应
B.芥子醇与足量浓溴水反应,最多消耗
C.芥子醇不能与 洛液发生显色反应
D.芥子醇的分子式是,属于芳香经
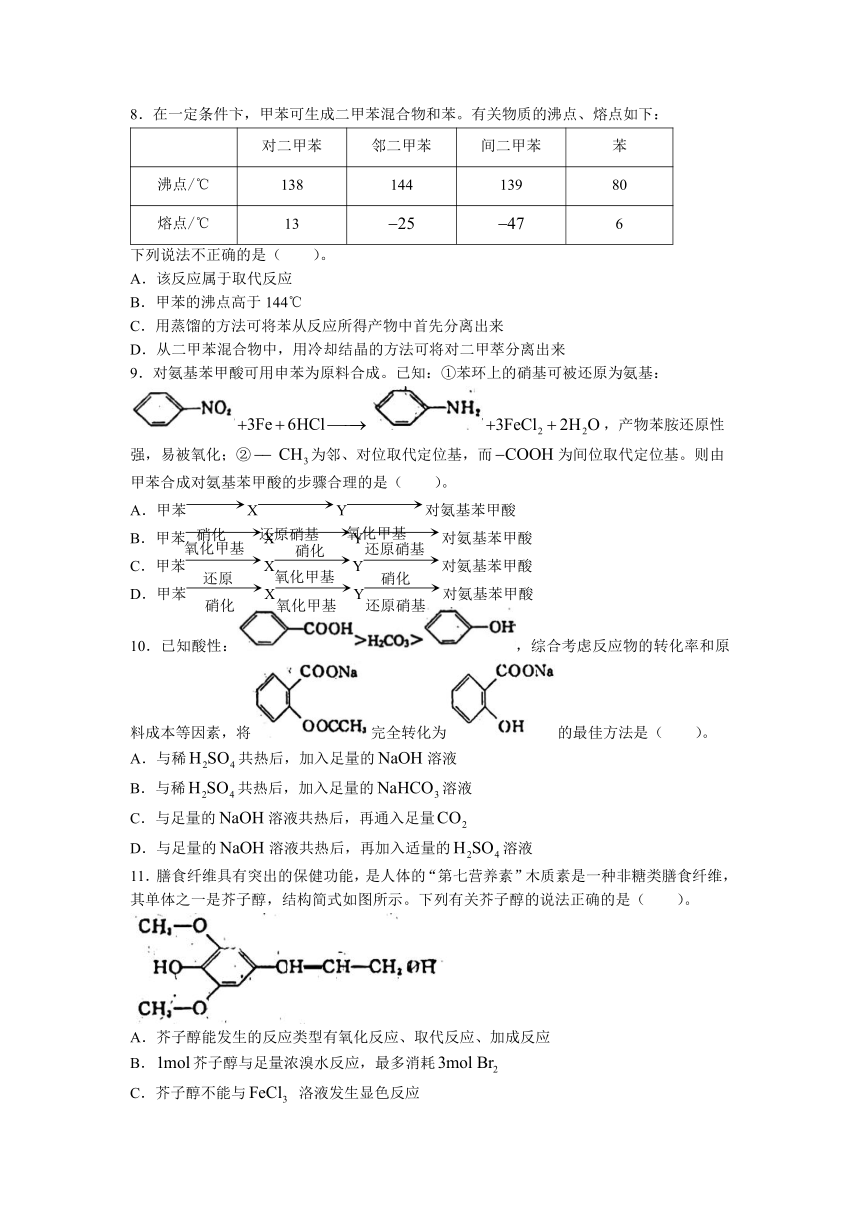
12.如图所示装置适宜进行的实验是( )。(右接装置未画出)
A。制取乙烯
B.制取氖化氢气体
C.分离水和碘的四氯化碳浴液(常压下沸点76.8℃)
D.分离乙醇和水
13.下列除去杂质的方法正确的是( )。
①除去乙烷中少量的乙烯:光照条件下通入,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去中少量的:气体通过盛有饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①② B.②③ C.③④ D.②④
14.已知实验室用浓硫酸和乙醇在一定温度下制备乙烯,某学习小组设计实验利用以下装置证明浓硫酸在该反应中的还原产物有,并制备1,2-二溴乙烷。
下列说法正确的是( )。
A﹒浓硫酸在该反应中主要作用是催化剂、脱水剂
B﹒装置Ⅲ、Ⅳ中的试剂依次为酸性高锰酸钾溶液、品红溶液
C﹒实验完毕后,采用萃取分液操作分离1,2-二溴乙烷
D.装置Ⅱ中品红溶液褪色体现了的还原性
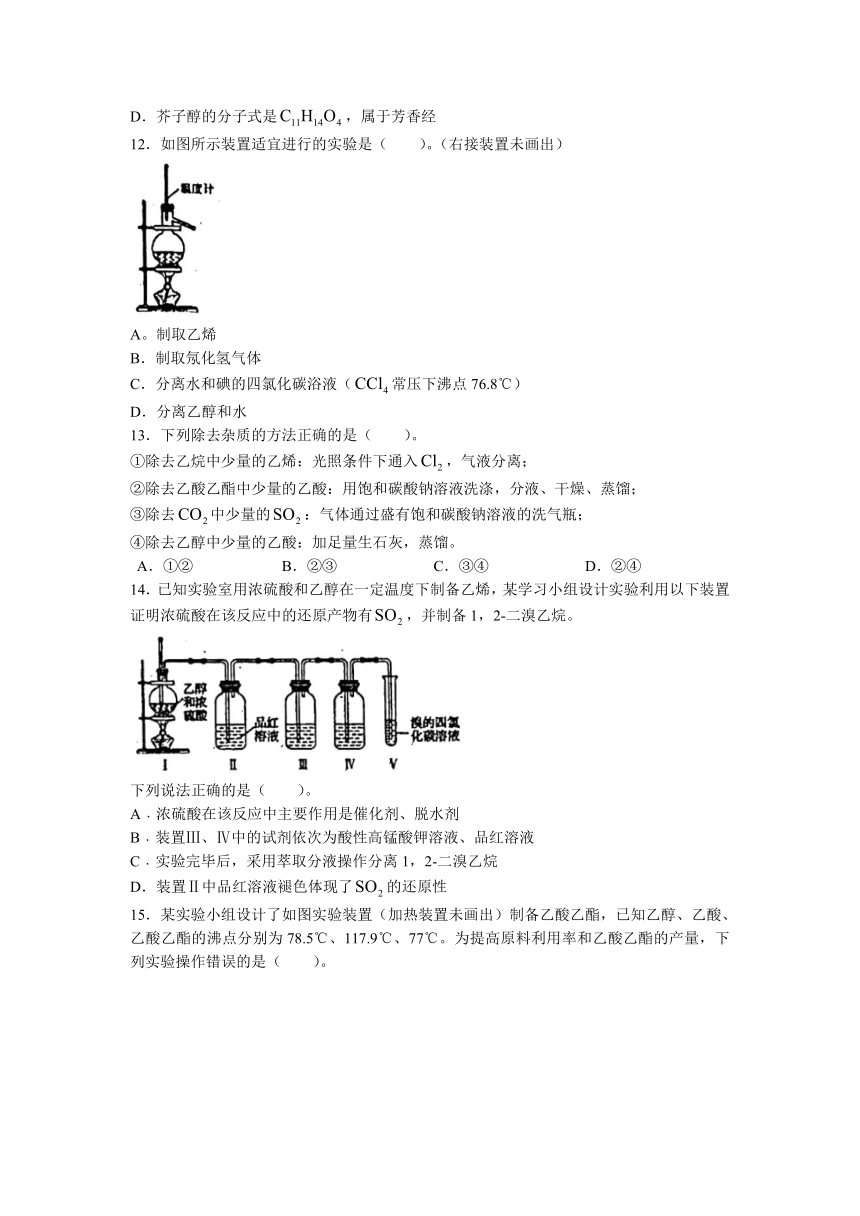
15.某实验小组设计了如图实验装置(加热装置未画出)制备乙酸乙酯,已知乙醇、乙酸、乙酸乙酯的沸点分别为78.5℃、117.9℃、77℃。为提高原料利用率和乙酸乙酯的产量,下列实验操作错误的是( )。
A.实验开始时应先打开,关闭
B.冷却水应分别从A、C口通入
C.锥形瓶中应先加入饱和碳酸钠溶液
D.关闭打开时,应控制温度计2的示数为77℃
16.下列说法正确的是( )。(均不考虑立体异构)
A.和互为同分异构体
B.的一氯代物有7种
C.的同分异构体有7种
D.分子式为且官能团与相同的物质共有5种
17.由石油裂解产物乙烯制取,需要经历的反应类型有( )。
A.加成——水解——氧化——氧化 B.氧化——氧化——取代——水解
C.氧化——取代——氧化——水解 D.水解——氧化——氧化——取代
18.己烷雌酚的一种合成路线如下,下列叙述不正确的是( )。
A.在氢氧化钠水溶液中加热,化合物可发生消去反应
B.Y的苯环上的二氯取代物有7种同分异构体
C.用溶液可以鉴别化合物X和Y
D.X转化为Y的反应类型为取代反应
19.电解精炼法提纯镓是工业上常用的方法,具体原理如图所示。已知金属活动性顺序:,镓的化学性质与铝相似。下列说法错误的是( )。
A.该装置中电流方向为:N极→粗溶液→高纯极
B.电解精炼镓时产生阳极泥的主要成分为、
C.阴极发生的电极反应为
D.电解过程中需控制合适的条件,否则阴极可能会产生导致电解效率下降
20.向相同容积的甲、乙两容器中都分别充入和,若甲容器保持温度、容积不变,乙容器保持温度、压强不变,分别达到平衡,下列说法正确的是( )。
A.平衡时,容器内的压强:甲>乙 B.反应达到平衡时所需时间:甲<乙
C.平衡时,氧气的浓度:甲<乙 D.平衡时,容器内的体积百分数:甲>乙
二、综合题
(一)电化学在生活中有着广泛的应用
Ⅰ.乙醛酸是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
(1)N电极上的电极反应式为__________。
(2)若有通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为______。
Ⅱ.某课外活动小组用如下图所示装置进行实验,试回答下列问题:
(3)若开始时开关K与a连接, 则B极的电极反应式为__________。
(4)若开始时开关K与b极连接,则B极的电极反应式为__________,总反应的离子方程式为__________。
(5)若开始时开关K与b连接,下列说法正确的是______。(填字母)
A.溶液中向A极移动
B.从A极处逸出的气体能使湿润的淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质溶液的浓度
D.若标准状况下B极产生气体,则浴液中转移电子
(6)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为__________。
②制得的氢氧化钾溶液从出口______导出(填“A”“B”“C”或“D”)。
(二)用活性炭还原处理氮氧化物,有关反应为。
(1)写出上述反应的平衡常数表达式__________。
(2)在恒容密闭容器中加入足量C与发生反应,所得数据如表,回答下列问题。
实验编号 温度/℃ 起始时的物质的量 平衡时的物质的量
1 700 0.40 0.09
2 800 0.24 0.08
①结合表中数据,判断该反应的______0(填“>”或“<”),理由是__________。
②判断该反应达到平衡的依据是______(填字母)。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.
(3)700℃时,若向体积恒定的密闭容器中充入一定量和发生反应:;其中、物质的量随时间变化的曲线如图所示。请回答下列问题。
①内的平均反应速率__________。
②图中A点______(填“>”“<”或“=”).
③第时,外界改变的条件可能是______(填字母)。
A.加催化剂 B.增大C的物质的量 C.减小的物质的量
D.升温 E.降温
(4)采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
容易得到的副产物有和,其中相对较多的副产物为__________;上述合成甲醇的反应速率较慢,要使反应速率加快,主要需降低下列变化中______(填字母)的能量变化。
A. B.
C. D.
(三)高聚物G是一种合成纤维,由A与E为原料制备J和的一种合成路线如下:
已知:①酯能被还原为醇;②;;③。
回答下列问题:
(1)A的结构简式为:__________,B生成C的反应条件为__________。
(2)J中含有的官能团名称为过氧键和__________。
(3)D生成H和I生成J反应类型分别为__________、__________。
(4)写出F+D→G的化学方程式:__________。
(5)芳香族化合物M是C的同分异构体,符合下列要求的M有______种(不考虑立体异构)。
①与碳酸钠溶液反应产生气体;②只有1种官能团;③苯环上有2个取代基。
其中核磁共振氢谱显示有4种不同化学环境的氢,且数目之比为的结构简式为__________。
(6)参照上述合成路线,写出用为原料制备化合物的合成路线(其他无机试剂任选)。
(7)苄基乙醛()是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).
已知:羰基可发生反应:
(四)米格列奈是一种非磺脲类胰岛素促分泌的药物,可由A(苯甲醛)为原料合成,部分合成路线如下(表示甲基):
完成下列填空:
(1)化合物C中含氧官能团为__________、__________(填名称)。
(2)由B→C、F→G的反应类型依次为__________、__________。
(3)D和E发生取代反应生成F的同时有生成,则E的结构简式是__________。
(4)X()为C的同系物,写出符合下列条件的X的一种同分异构体的结构简式:__________。
①能发生银镜反应,与不发生显色反应,但其水解产物之一能与溶液发生显色反应;
②分子中有4种化学环境不同的氢原子。
(5)已知:①;
②
根据已有知识并结合相关信息,写出以为原料制备的合成路线流程图(无机试剂任用)。合成路线流程图示例:
上交附高2022-2023学年高二下学期3月月考化学试题参考答案
一、选择题
1 2 3 4 5 6 7 8 9 10
C A B D B D D B D C
11 12 13 14 15 16 17 18 19 20
A D D A C C B A C D
二、综合题
(一)(11分)
(1)(2分)
(2)2(2分)
(3)(1分)
(4)(1分) (2分)
(5)B(1分)
(6)①(1分) ②D(1分)
(二)(10分)
(1)(1分)
(2)①>(1分) 计算700℃和800℃的平衡常数分别、,得,说明温度升高平衡向正反应方向移动,所以(2分)
②AB(1分)
(3)①(1分) ②>(1分) ③AD (1分)
(4)(1分) A(1分)
(三)(17分)
(1)(1分) 浓硫酸、加热(1分)
(2)醚键(1分)
(3)氧化反应(1分) 取代反应(1分)
(4)(2分)
或
(5)12(1分) (2分)
(6)(每步1分,共4分)
(7)
(每步1分,共4分)
(四)(12分)
(1)酣基(1分) 羧基(1分)
(2)加成(1分) 取代/水解(1分)
(3)(1分)
(4)或或
(写出一种即可,合理即给分)(2分)
(5)(每步1分,共5分)
一、选择题
1.下列关于有机物的叙述不正确的是( ).
A.碳原子间能形成单键,也能形成双键或三键,进而形成碳链或碳环
B.易溶于汽油、酒精、苯等有机溶剂中的物质不一定是有机物
C.碳原子性质较活泼,除了碳原子之间可以成键外,与其他元素原子也可形成化学键
D.有机物所发生的反应,一般比较复杂,速度缓慢,并且还常伴有副反应发生
2.用氯气取代相对分子质量为44的烃分子上的一个氢原子,所得的化合物可能有( ).
A.3种 B.4种 C.5种 D.6种
3.环之间共用一个碳原子的化合物称为螺环化合物,螺戊烷是最简单的一种。下列关于该化合物的说法错误的是( ).
A.与环戊烯互为同分异构体 B.所有碳原子均处同一平面
C.二氯代物超过两种 D.理论上生成至少需要
4.以物质a为原料,制备物质d(金刚烷)的合成路线如下图所示。
关于以上有机物的说法中不正确的是( )。
A.物质b的分子式为 B.物质d的一氯代物有2种
C.物质c与物质d互为同分异构体 D.物质a最多有10个原子共平面
5.下列说法正确的是( )。
A.石油液化气的主要成分为甲烷 B.石油的分馏和蒸馏的原理是相似的
C.煤的干馏可分离出煤中含有的煤焦油 D.石油经过分馏得到的汽油是纯净物
6.保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述错误的是( )。
A.PE、PVC都属于链状高分子化合物,受热易熔化
B.废弃的PE和PVC均可回收利用以减少白色污染
C.焚烧PVC保鲜膜会放出有毒气体如
D.PE、PVC的单体都是不饱和经,能使溴水褪色
7.下图是以石油为原料的部分转化流程,下列关于4个反应的反应类型的说法正确的是( )。
A.反应①与反应③反应类型相同 B.反应②与反应④反应类型相同
C.反应③与反应④反应类型相同 D.反应①与反应④反应类型相同
8.在一定条件卞,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下:
对二甲苯 邻二甲苯 间二甲苯 苯
沸点/℃ 138 144 139 80
熔点/℃ 13 6
下列说法不正确的是( )。
A.该反应属于取代反应
B.甲苯的沸点高于144℃
C.用蒸馏的方法可将苯从反应所得产物中首先分离出来
D.从二甲苯混合物中,用冷却结晶的方法可将对二甲萃分离出来
9.对氨基苯甲酸可用申苯为原料合成。已知:①苯环上的硝基可被还原为氨基:,产物苯胺还原性强,易被氧化;②为邻、对位取代定位基,而为间位取代定位基。则由甲苯合成对氨基苯甲酸的步骤合理的是( )。
A.甲苯XY对氨基苯甲酸
B.甲苯XY对氨基苯甲酸
C.甲苯XY对氨基苯甲酸
D.甲苯XY对氨基苯甲酸
10.已知酸性:,综合考虑反应物的转化率和原料成本等因素,将完全转化为的最佳方法是( )。
A.与稀共热后,加入足量的溶液
B.与稀共热后,加入足量的溶液
C.与足量的溶液共热后,再通入足量
D.与足量的溶液共热后,再加入适量的溶液
11.膳食纤维具有突出的保健功能,是人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是( )。
A.芥子醇能发生的反应类型有氧化反应、取代反应、加成反应
B.芥子醇与足量浓溴水反应,最多消耗
C.芥子醇不能与 洛液发生显色反应
D.芥子醇的分子式是,属于芳香经
12.如图所示装置适宜进行的实验是( )。(右接装置未画出)
A。制取乙烯
B.制取氖化氢气体
C.分离水和碘的四氯化碳浴液(常压下沸点76.8℃)
D.分离乙醇和水
13.下列除去杂质的方法正确的是( )。
①除去乙烷中少量的乙烯:光照条件下通入,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去中少量的:气体通过盛有饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①② B.②③ C.③④ D.②④
14.已知实验室用浓硫酸和乙醇在一定温度下制备乙烯,某学习小组设计实验利用以下装置证明浓硫酸在该反应中的还原产物有,并制备1,2-二溴乙烷。
下列说法正确的是( )。
A﹒浓硫酸在该反应中主要作用是催化剂、脱水剂
B﹒装置Ⅲ、Ⅳ中的试剂依次为酸性高锰酸钾溶液、品红溶液
C﹒实验完毕后,采用萃取分液操作分离1,2-二溴乙烷
D.装置Ⅱ中品红溶液褪色体现了的还原性
15.某实验小组设计了如图实验装置(加热装置未画出)制备乙酸乙酯,已知乙醇、乙酸、乙酸乙酯的沸点分别为78.5℃、117.9℃、77℃。为提高原料利用率和乙酸乙酯的产量,下列实验操作错误的是( )。
A.实验开始时应先打开,关闭
B.冷却水应分别从A、C口通入
C.锥形瓶中应先加入饱和碳酸钠溶液
D.关闭打开时,应控制温度计2的示数为77℃
16.下列说法正确的是( )。(均不考虑立体异构)
A.和互为同分异构体
B.的一氯代物有7种
C.的同分异构体有7种
D.分子式为且官能团与相同的物质共有5种
17.由石油裂解产物乙烯制取,需要经历的反应类型有( )。
A.加成——水解——氧化——氧化 B.氧化——氧化——取代——水解
C.氧化——取代——氧化——水解 D.水解——氧化——氧化——取代
18.己烷雌酚的一种合成路线如下,下列叙述不正确的是( )。
A.在氢氧化钠水溶液中加热,化合物可发生消去反应
B.Y的苯环上的二氯取代物有7种同分异构体
C.用溶液可以鉴别化合物X和Y
D.X转化为Y的反应类型为取代反应
19.电解精炼法提纯镓是工业上常用的方法,具体原理如图所示。已知金属活动性顺序:,镓的化学性质与铝相似。下列说法错误的是( )。
A.该装置中电流方向为:N极→粗溶液→高纯极
B.电解精炼镓时产生阳极泥的主要成分为、
C.阴极发生的电极反应为
D.电解过程中需控制合适的条件,否则阴极可能会产生导致电解效率下降
20.向相同容积的甲、乙两容器中都分别充入和,若甲容器保持温度、容积不变,乙容器保持温度、压强不变,分别达到平衡,下列说法正确的是( )。
A.平衡时,容器内的压强:甲>乙 B.反应达到平衡时所需时间:甲<乙
C.平衡时,氧气的浓度:甲<乙 D.平衡时,容器内的体积百分数:甲>乙
二、综合题
(一)电化学在生活中有着广泛的应用
Ⅰ.乙醛酸是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
(1)N电极上的电极反应式为__________。
(2)若有通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为______。
Ⅱ.某课外活动小组用如下图所示装置进行实验,试回答下列问题:
(3)若开始时开关K与a连接, 则B极的电极反应式为__________。
(4)若开始时开关K与b极连接,则B极的电极反应式为__________,总反应的离子方程式为__________。
(5)若开始时开关K与b连接,下列说法正确的是______。(填字母)
A.溶液中向A极移动
B.从A极处逸出的气体能使湿润的淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质溶液的浓度
D.若标准状况下B极产生气体,则浴液中转移电子
(6)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为__________。
②制得的氢氧化钾溶液从出口______导出(填“A”“B”“C”或“D”)。
(二)用活性炭还原处理氮氧化物,有关反应为。
(1)写出上述反应的平衡常数表达式__________。
(2)在恒容密闭容器中加入足量C与发生反应,所得数据如表,回答下列问题。
实验编号 温度/℃ 起始时的物质的量 平衡时的物质的量
1 700 0.40 0.09
2 800 0.24 0.08
①结合表中数据,判断该反应的______0(填“>”或“<”),理由是__________。
②判断该反应达到平衡的依据是______(填字母)。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.
(3)700℃时,若向体积恒定的密闭容器中充入一定量和发生反应:;其中、物质的量随时间变化的曲线如图所示。请回答下列问题。
①内的平均反应速率__________。
②图中A点______(填“>”“<”或“=”).
③第时,外界改变的条件可能是______(填字母)。
A.加催化剂 B.增大C的物质的量 C.减小的物质的量
D.升温 E.降温
(4)采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
容易得到的副产物有和,其中相对较多的副产物为__________;上述合成甲醇的反应速率较慢,要使反应速率加快,主要需降低下列变化中______(填字母)的能量变化。
A. B.
C. D.
(三)高聚物G是一种合成纤维,由A与E为原料制备J和的一种合成路线如下:
已知:①酯能被还原为醇;②;;③。
回答下列问题:
(1)A的结构简式为:__________,B生成C的反应条件为__________。
(2)J中含有的官能团名称为过氧键和__________。
(3)D生成H和I生成J反应类型分别为__________、__________。
(4)写出F+D→G的化学方程式:__________。
(5)芳香族化合物M是C的同分异构体,符合下列要求的M有______种(不考虑立体异构)。
①与碳酸钠溶液反应产生气体;②只有1种官能团;③苯环上有2个取代基。
其中核磁共振氢谱显示有4种不同化学环境的氢,且数目之比为的结构简式为__________。
(6)参照上述合成路线,写出用为原料制备化合物的合成路线(其他无机试剂任选)。
(7)苄基乙醛()是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).
已知:羰基可发生反应:
(四)米格列奈是一种非磺脲类胰岛素促分泌的药物,可由A(苯甲醛)为原料合成,部分合成路线如下(表示甲基):
完成下列填空:
(1)化合物C中含氧官能团为__________、__________(填名称)。
(2)由B→C、F→G的反应类型依次为__________、__________。
(3)D和E发生取代反应生成F的同时有生成,则E的结构简式是__________。
(4)X()为C的同系物,写出符合下列条件的X的一种同分异构体的结构简式:__________。
①能发生银镜反应,与不发生显色反应,但其水解产物之一能与溶液发生显色反应;
②分子中有4种化学环境不同的氢原子。
(5)已知:①;
②
根据已有知识并结合相关信息,写出以为原料制备的合成路线流程图(无机试剂任用)。合成路线流程图示例:
上交附高2022-2023学年高二下学期3月月考化学试题参考答案
一、选择题
1 2 3 4 5 6 7 8 9 10
C A B D B D D B D C
11 12 13 14 15 16 17 18 19 20
A D D A C C B A C D
二、综合题
(一)(11分)
(1)(2分)
(2)2(2分)
(3)(1分)
(4)(1分) (2分)
(5)B(1分)
(6)①(1分) ②D(1分)
(二)(10分)
(1)(1分)
(2)①>(1分) 计算700℃和800℃的平衡常数分别、,得,说明温度升高平衡向正反应方向移动,所以(2分)
②AB(1分)
(3)①(1分) ②>(1分) ③AD (1分)
(4)(1分) A(1分)
(三)(17分)
(1)(1分) 浓硫酸、加热(1分)
(2)醚键(1分)
(3)氧化反应(1分) 取代反应(1分)
(4)(2分)
或
(5)12(1分) (2分)
(6)(每步1分,共4分)
(7)
(每步1分,共4分)
(四)(12分)
(1)酣基(1分) 羧基(1分)
(2)加成(1分) 取代/水解(1分)
(3)(1分)
(4)或或
(写出一种即可,合理即给分)(2分)
(5)(每步1分,共5分)
同课章节目录
