安徽省滁州市定远县定远县育才学校2022-2023学年高二下学期3月月考化学试题(含答案)
文档属性
| 名称 | 安徽省滁州市定远县定远县育才学校2022-2023学年高二下学期3月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 474.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-24 09:23:45 | ||
图片预览


文档简介
(
班
级
姓
名
考号
)育才学校2022-2023学年度第二学期高二3月考
化学试卷 命题人:
可能用到的相对原子质量:O-16 F-19 Mg-24 K-39 Fe-56 Cu-64
As-75 Sm-150
一、单选题(共14小题,每小题4分共56分)
1.下列物质中,所有原子最外层均达到8电子稳定结构的化合物是( )
A. B.
C.(正四面体形) D.
2.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
A.简单氢化物的沸点:X>W>Z
B.第一电离能:W>X>Z>Y
C.X 与Z 形成的化合物均为非极性分子
D.1 mol Y 与足量X2的单质反应,所得物质中离子总数为1.5NA
已知下列四组短周期元素的电离能数据(kJ·mol-1), 下列判断不正确的是( )
电离能 W X Y Z
I1 496 573 738 899
I2 4562 1817 1451 1751
I3 6912 2745 7733 14848
I4 9543 11575 10540 21006
A.W单质的还原性最强 B.Y和Z可能位于同一族
C.X、Z的氢氧化物都具有两性 D.W、X、Y原子半径依次减小
4.运用推理、归纳、类比、对比的方法得出下列结论,其中合理的是( )
A.铝的金属活动性比铁强,则铝制品比铁制品更易锈蚀
B.水和过氧化氢的组成元素相同,则二者的化学性质相同
C.Na+、Mg2+、Cl-的最外层电子数均为8,由此得出离子的最外层电子数均为8
D.同温下分解氯酸钾,加催化剂的反应速率更快,说明催化剂可以改变反应速率
5.电子总数或价电子总数相等、原子数也相同的分子或离子的空间构型是相同的,下列各组微粒空间构型不相同的是( )
A.CO2和NO2 B.CO2和N2O C.SO3和NO D.SO和ClO
6.下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H4与C2H2
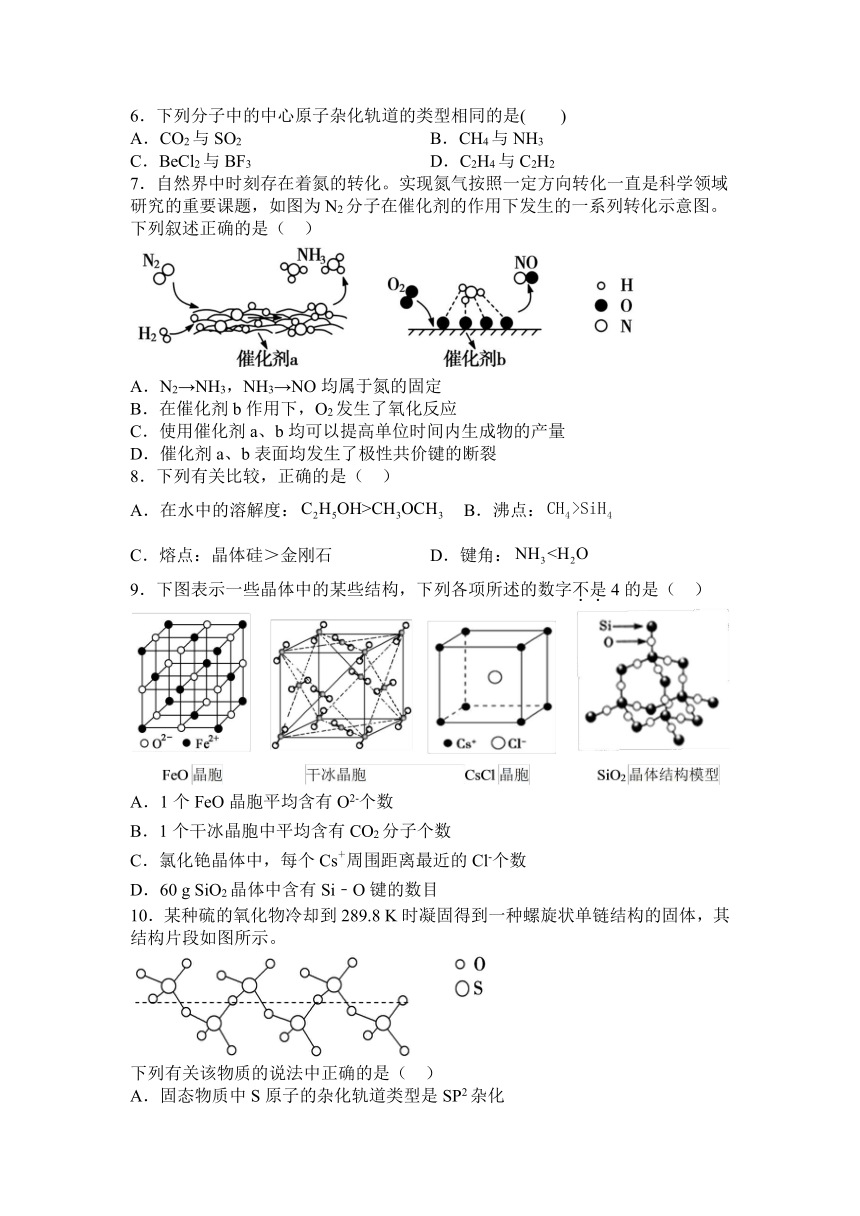
7.自然界中时刻存在着氮的转化。实现氮气按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图。下列叙述正确的是( )
A.N2→NH3,NH3→NO均属于氮的固定
B.在催化剂b作用下,O2发生了氧化反应
C.使用催化剂a、b均可以提高单位时间内生成物的产量
D.催化剂a、b表面均发生了极性共价键的断裂
8.下列有关比较,正确的是( )
A.在水中的溶解度: B.沸点:
C.熔点:晶体硅>金刚石 D.键角:
9.下图表示一些晶体中的某些结构,下列各项所述的数字不是4的是( )
A.1个FeO晶胞平均含有O2-个数
B.1个干冰晶胞中平均含有CO2分子个数
C.氯化铯晶体中,每个Cs+周围距离最近的Cl-个数
D.60 g SiO2晶体中含有Si﹣O键的数目
10.某种硫的氧化物冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构片段如图所示。
下列有关该物质的说法中正确的是( )
A.固态物质中S原子的杂化轨道类型是SP2杂化
B.该物质的化学式为SO3
C.从该结构片段分析可知所有的O原子和S原子在同一平面上
D.该结构片段中S-O键之间的夹角约为120
11.下列比较结果正确的是( )
A.电负性:K>Na B.离子半径:r(Al3+)>r(O2-)
C.能量:E(4s)>E(3d) D.第一电离能:I1(P)>I1(S)
12.下列对应关系不正确的是( )
选项 A B C D
中心原子所在族 IVA VA IVA VIA
分子通式 AB4 AB3 AB2 AB2
立体结构 正四面体形 平面三角形 直线形 V形
13.科学研究表明,PCl5在气态条件下为分子形态,在熔融条件下能发生电离: 2PCl5PCl+PCl,下列说法错误的是( )
A.PCl5分子中的化学键为极性键
B.PCl5在熔融状态下具有一定的导电性
C.PCl呈正四面体构型
D.PCl中P只用3s、3p轨道参与成键
14.《Nature》杂志评选出的2023年世界十大科技进展之一是我国科研人员发现用于“点击化学”的一种新化合物(如图所示),W、X、Y、Z为短周期主族元素且原子序数依次增大,Y原子的最外层电子数与W原子的核外电子总数相等,X、Z同主族。下列说法正确的是( )
原子半径:r(Z)>r(X)>r(Y)
B.四种元素中,最高价含氧酸酸性最强的为Y
最简单氢化物的沸点W>X
最简单氢化物的稳定性:W>X>Y
二、非选择题(4题共44分)
15.(14分)已知 A、B、C、D、E是原子序数依次增大的前四周期元素,其元素性质或原子结构如图:
A 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同
B 原子最高能级的不同轨道都有电子,且自旋方向相同
C 在周期表所有元素中电负性最大
D 位于周期表中第4纵列
E 基态原子M层全充满,N层只有一个电子
(1)A的最高价氧化物是___________分子(填“极性”或“非极性”)。
(2)B与其同周期相邻元素第一电离能由大到小的顺序为___________(请填元素符号);其一种气态氢化物分子的空间结构呈三角锥形,该分子的中心原子的杂化轨道类型为___________。
(3)C的气态氢化物沸点是同族元素氢化物沸点中最高的,其原因是___________。
(4)A、B、C 三种元素的原子半径由大到小的顺序:___________(请填元素符号)。
(5)D属于___________区的元素,其基态原子的价电子排布图为___________。
(6)E的基态原子电子排布式为___________。
16.(14分)卤族元素是非常重要的非金属元素,其单质和化合物有广泛用途,化学性质也非常丰富。
(1)基态氯原子的价电子排布式为__________________,其核外电子占据的最高能层的符号是_________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是___________。
(3)ClO2—的立体结构为_______形,中心氯原子的杂化轨道类型为_________,写出ClO2—一个等电子体的化学式 ______。
(4)下列分子中只存在s-p键的是_____________。
A. H2 B.F2 C.HCl D.HClO
(5)由F、K、Mg三种元素形成的某离子晶体的晶胞结构如下图所示,晶胞边长为a nm。
①该晶体的化学式为___________________。
②该晶体的密度为____________g cm—3。(结果保留1位小数)
17.(16分)(1)图甲是的拉维斯结构,以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的。图乙是沿立方格子对角面取得的截图。可见,原子之间最短距离_______,原子之间最短距离_______。设阿伏加德罗常数的值为,则的密度是_______(列出计算表达式)。
(2)一种四方结构的超导化合物的晶胞如图丙所示。晶胞中和原子的投影位置如图丁所示。
图中和共同占据晶胞的上下底面位置,若两者的比例依次用x和代表,则该化合物的化学式表示为_______;通过测定密度和晶胞参数,可以计算该物质的x值,完成它们关系表达式:_______,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图丙中原子1的坐标为,则原子2和3的坐标分别为_______、_______。
(3)苯胺()的晶体类型是_______。
(4)一个晶胞(如图戊)中,原子的数目为_______。
答案
1-5 BCDDA 6-10 BCACB 11-14 DBDA
非极性 N>O>C sp3 分子间有氢键 C>N>F d 1s22s22p63s23p63d104s1 (或[Ar]3d104s1)
16. (1) 3s23p5;M;
(2)氢键;
(3) V,sp3杂化;Cl2O或BrO2—等;
(4) C;
(5) KMgF3;。
17.(1);;;
(2);;;;
(3)分子晶体;
(4)4;
班
级
姓
名
考号
)育才学校2022-2023学年度第二学期高二3月考
化学试卷 命题人:
可能用到的相对原子质量:O-16 F-19 Mg-24 K-39 Fe-56 Cu-64
As-75 Sm-150
一、单选题(共14小题,每小题4分共56分)
1.下列物质中,所有原子最外层均达到8电子稳定结构的化合物是( )
A. B.
C.(正四面体形) D.
2.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
A.简单氢化物的沸点:X>W>Z
B.第一电离能:W>X>Z>Y
C.X 与Z 形成的化合物均为非极性分子
D.1 mol Y 与足量X2的单质反应,所得物质中离子总数为1.5NA
已知下列四组短周期元素的电离能数据(kJ·mol-1), 下列判断不正确的是( )
电离能 W X Y Z
I1 496 573 738 899
I2 4562 1817 1451 1751
I3 6912 2745 7733 14848
I4 9543 11575 10540 21006
A.W单质的还原性最强 B.Y和Z可能位于同一族
C.X、Z的氢氧化物都具有两性 D.W、X、Y原子半径依次减小
4.运用推理、归纳、类比、对比的方法得出下列结论,其中合理的是( )
A.铝的金属活动性比铁强,则铝制品比铁制品更易锈蚀
B.水和过氧化氢的组成元素相同,则二者的化学性质相同
C.Na+、Mg2+、Cl-的最外层电子数均为8,由此得出离子的最外层电子数均为8
D.同温下分解氯酸钾,加催化剂的反应速率更快,说明催化剂可以改变反应速率
5.电子总数或价电子总数相等、原子数也相同的分子或离子的空间构型是相同的,下列各组微粒空间构型不相同的是( )
A.CO2和NO2 B.CO2和N2O C.SO3和NO D.SO和ClO
6.下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H4与C2H2
7.自然界中时刻存在着氮的转化。实现氮气按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图。下列叙述正确的是( )
A.N2→NH3,NH3→NO均属于氮的固定
B.在催化剂b作用下,O2发生了氧化反应
C.使用催化剂a、b均可以提高单位时间内生成物的产量
D.催化剂a、b表面均发生了极性共价键的断裂
8.下列有关比较,正确的是( )
A.在水中的溶解度: B.沸点:
C.熔点:晶体硅>金刚石 D.键角:
9.下图表示一些晶体中的某些结构,下列各项所述的数字不是4的是( )
A.1个FeO晶胞平均含有O2-个数
B.1个干冰晶胞中平均含有CO2分子个数
C.氯化铯晶体中,每个Cs+周围距离最近的Cl-个数
D.60 g SiO2晶体中含有Si﹣O键的数目
10.某种硫的氧化物冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构片段如图所示。
下列有关该物质的说法中正确的是( )
A.固态物质中S原子的杂化轨道类型是SP2杂化
B.该物质的化学式为SO3
C.从该结构片段分析可知所有的O原子和S原子在同一平面上
D.该结构片段中S-O键之间的夹角约为120
11.下列比较结果正确的是( )
A.电负性:K>Na B.离子半径:r(Al3+)>r(O2-)
C.能量:E(4s)>E(3d) D.第一电离能:I1(P)>I1(S)
12.下列对应关系不正确的是( )
选项 A B C D
中心原子所在族 IVA VA IVA VIA
分子通式 AB4 AB3 AB2 AB2
立体结构 正四面体形 平面三角形 直线形 V形
13.科学研究表明,PCl5在气态条件下为分子形态,在熔融条件下能发生电离: 2PCl5PCl+PCl,下列说法错误的是( )
A.PCl5分子中的化学键为极性键
B.PCl5在熔融状态下具有一定的导电性
C.PCl呈正四面体构型
D.PCl中P只用3s、3p轨道参与成键
14.《Nature》杂志评选出的2023年世界十大科技进展之一是我国科研人员发现用于“点击化学”的一种新化合物(如图所示),W、X、Y、Z为短周期主族元素且原子序数依次增大,Y原子的最外层电子数与W原子的核外电子总数相等,X、Z同主族。下列说法正确的是( )
原子半径:r(Z)>r(X)>r(Y)
B.四种元素中,最高价含氧酸酸性最强的为Y
最简单氢化物的沸点W>X
最简单氢化物的稳定性:W>X>Y
二、非选择题(4题共44分)
15.(14分)已知 A、B、C、D、E是原子序数依次增大的前四周期元素,其元素性质或原子结构如图:
A 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同
B 原子最高能级的不同轨道都有电子,且自旋方向相同
C 在周期表所有元素中电负性最大
D 位于周期表中第4纵列
E 基态原子M层全充满,N层只有一个电子
(1)A的最高价氧化物是___________分子(填“极性”或“非极性”)。
(2)B与其同周期相邻元素第一电离能由大到小的顺序为___________(请填元素符号);其一种气态氢化物分子的空间结构呈三角锥形,该分子的中心原子的杂化轨道类型为___________。
(3)C的气态氢化物沸点是同族元素氢化物沸点中最高的,其原因是___________。
(4)A、B、C 三种元素的原子半径由大到小的顺序:___________(请填元素符号)。
(5)D属于___________区的元素,其基态原子的价电子排布图为___________。
(6)E的基态原子电子排布式为___________。
16.(14分)卤族元素是非常重要的非金属元素,其单质和化合物有广泛用途,化学性质也非常丰富。
(1)基态氯原子的价电子排布式为__________________,其核外电子占据的最高能层的符号是_________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是___________。
(3)ClO2—的立体结构为_______形,中心氯原子的杂化轨道类型为_________,写出ClO2—一个等电子体的化学式 ______。
(4)下列分子中只存在s-p键的是_____________。
A. H2 B.F2 C.HCl D.HClO
(5)由F、K、Mg三种元素形成的某离子晶体的晶胞结构如下图所示,晶胞边长为a nm。
①该晶体的化学式为___________________。
②该晶体的密度为____________g cm—3。(结果保留1位小数)
17.(16分)(1)图甲是的拉维斯结构,以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的。图乙是沿立方格子对角面取得的截图。可见,原子之间最短距离_______,原子之间最短距离_______。设阿伏加德罗常数的值为,则的密度是_______(列出计算表达式)。
(2)一种四方结构的超导化合物的晶胞如图丙所示。晶胞中和原子的投影位置如图丁所示。
图中和共同占据晶胞的上下底面位置,若两者的比例依次用x和代表,则该化合物的化学式表示为_______;通过测定密度和晶胞参数,可以计算该物质的x值,完成它们关系表达式:_______,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图丙中原子1的坐标为,则原子2和3的坐标分别为_______、_______。
(3)苯胺()的晶体类型是_______。
(4)一个晶胞(如图戊)中,原子的数目为_______。
答案
1-5 BCDDA 6-10 BCACB 11-14 DBDA
非极性 N>O>C sp3 分子间有氢键 C>N>F d 1s22s22p63s23p63d104s1 (或[Ar]3d104s1)
16. (1) 3s23p5;M;
(2)氢键;
(3) V,sp3杂化;Cl2O或BrO2—等;
(4) C;
(5) KMgF3;。
17.(1);;;
(2);;;;
(3)分子晶体;
(4)4;
同课章节目录
