1.1.1原子核 核素(教学课件)(共45张PPT)-2022-2023学年高一化学鲁科版(2019)必修二
文档属性
| 名称 | 1.1.1原子核 核素(教学课件)(共45张PPT)-2022-2023学年高一化学鲁科版(2019)必修二 |  | |
| 格式 | ppt | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-24 09:42:52 | ||
图片预览











文档简介
(共45张PPT)
化学
第1章 原子结构 元素周期律
第1节 原子结构与元素性质
第1课时 原子核 核素
01
学新知 素养奠基
02
解疑难 素养提升
03
固双基 素养达标
04
提智能 素养发展
课程标准 核心素养
1.了解原子的构成。了解质量数的定义。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
2.知道元素、核素和同位素的含义。 宏观辨识与微观探析:
能从元素和原子水平认识物质的组成和结构。深化对原子结构的认识,建立原子结构与元素性质之间的关系。
【教材梳理】
一、原子构成 质量数
1.原子及其构成微粒
质子
正
中子
负
质子
核外电子
原子核中一定有质子,但不一定有中子。
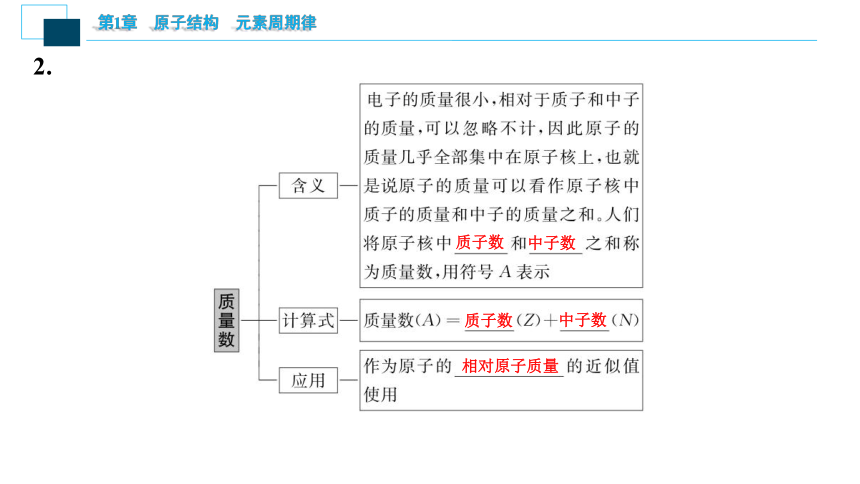
2.
质子数
中子数
质子数
中子数
相对原子质量
3.原子的表示方法
二、核素 同位素
1.核素:具有相同数目的______和相同数目的______的一类原子。
2.同位素
(1)定义:________相同而________不同的同一种元素的不同核素互为同位素。
(2)分类:稳定同位素和放射性同位素。
质子数
质子
中子
中子数
(3)氢元素的三种同位素
H
D
T
0
1
2
3.元素的相对原子质量
(1)定义:各种核素的_________________分别与各种核素在自然界里的_______ (某种核素在这种元素的所有天然核素中所占的比例)的_______之和。
相对原子质量
丰度
乘积
【自主检测】
1.判断正误
(1)某种氯原子的中子数是18,则其质量数是35,核外电子数是17。( )
(2)离子的核外电子数与其所带电荷数的和等于质子数。( )
(3)质量数就是相对原子质量。( )
(4)原子呈电中性是因为中子不带电。( )
√
×
×
×
×
√
√
×
√
√
√
√
3.我国科学家通过测量SiO2中26Al和10Be两种元素的比例,确定了“北京人”的年龄,这种测量方法叫“铝铍测年法”。10Be和9Be( )
A.是同一种原子 B.具有相同的中子数
C.具有相同的化学性质 D.具有相同的物理性质
解析: 10Be与9Be是同种元素的不同核素,二者互为同位素,具有相同的化学性质,物理性质不同。
√
4.47Ag 有两种同位素,在自然界所占的原子个数百分比几乎相同,若Ag元素的近似相对原子质量为108,则这两种同位素的中子数为( )
A.106和110 B.57和63
C.153和73 D.60和62
√
学习任务1 构成原子的微粒之间的关系
1.构成原子微粒的作用
(1)质子数决定元素的种类。
(2)质子数和中子数决定原子的质量。
(3)原子的最外层电子数决定元素的化学性质。
2.构成原子或离子的微粒间的三种关系
(1)质量关系:质量数(A)=质子数(Z)+中子数(N)。
(2)等量关系:核电荷数=质子数,对原子而言,核电荷数=质子数=核外电子数。
(3)大小关系
阳离子(Rm+) 质子数>电子数 质子数=电子数+m
阴离子(Rm-) 质子数<电子数 质子数=电子数-m
3.元素符号周围数字的含义
[归纳总结]
(1)元素的种类由原子核内的质子数决定,因此划分元素种类的唯一标准是质子数(核电荷数)。
(2)“同一类”指质子数相同的各种不同原子,以及各种状态(游离态或化合态)下的原子或离子,是广义的原子。
(3)元素只分种类,不能称个数,只能说某物质由几种元素组成,不能说由几个元素组成。
[解析] 原子 中左上角数字代表质量数,左下角数字代表质子数,故该原子的质量数是99,质子数=核外电子数=43,中子数=质量数-质子数=99-43=56,B项正确。
√
1.(2020·洛阳高一月考)下表符号中“2”的含义正确的一组是( )
选项 2H 2He 2Cl Ca2+
A 质量数 中子数 质子数 电荷数
B 质量数 质子数 原子个数 电荷数
C 质子数 中子数 原子个数 电荷数
D 质量数 质子数 中子数 电荷数
√
解析: 2H中的“2”代表质量数,2He中的“2”代表质子数,2Cl中的“2”代表原子个数,Ca2+中的“2”代表电荷数。
2.写出下列原子的符号。
(1)具有7个中子的碳原子:________。
(2)具有2个中子的氢原子:________。
(3)具有20个中子的氯原子:________。
(4)具有12个中子的钠原子:________。
学习任务2 元素、核素、同位素及同素异形体的辨析
1.区别
2.联系
[归纳总结] 同位素的“六同三不同”
√
同素异形体研究的对象是单质,A项错误;
1.2020年4月,我国自主设计,被称为“人造太阳”的“东方超环”核聚变实验装置取得重大突破,该核聚变的基础原料是海水中提取的氘和氚。下列叙述中错误的是( )
A.氘原子的相对原子质量为2
B.氚原子内中子数和核外电子数之差为1
C.氘原子和氚原子互为同位素
D.海水中的H2O与D2O互为同素异形体
√
2.(双选)下列有关13C、15N叙述正确的是( )
A.13C与15N的中子数不同
B.13C与C60互为同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
√
√
解析:13C的中子数是7,15N的中子数是8,A正确;同素异形体指由同种元素组成的具有不同性质的单质,而13C是碳元素的一种核素(原子),C60是碳元素的一种单质,则13C与C60不互为同素异形体,B错误;15N与14N 核内质子数相同为7,中子数分别为8和7,则15N与14N 互为同位素,C正确;15N的核外电子数是7,中子数是8,D错误。
1.下列关于原子结构的说法正确的是( )
A.所有原子都含有质子、中子和电子三种基本微粒
B.质子数决定元素的种类,中子数决定原子的种类
C.质子、中子和电子不可以进一步分成更小的微粒
D.电子的质量较小,原子的质量主要集中在原子核上
√
解析:A错,大多数原子含有质子、中子和电子三种基本微粒,但普通氢原子不含中子;
B错,质子数决定元素的种类,质子数与中子数决定原子的种类;
C错,随着科学的发展,人类对原子结构的认识会更加深入,目前研究表明质子和中子里面还有更小的微粒——夸克。
√
同位素的化学性质几乎完全相同,物理性质不同,故C错误;
√
√
√
√
6.(1)1H、2H、3H三种微粒都属于________,因为它们是具有相同________的同一类原子。
答案:
(1)氢元素 质子数(核电荷数)
(2)8 3
(3)互为同位素 相同质子数和不同中子数
本部分内容讲解结束
化学
第1章 原子结构 元素周期律
第1节 原子结构与元素性质
第1课时 原子核 核素
01
学新知 素养奠基
02
解疑难 素养提升
03
固双基 素养达标
04
提智能 素养发展
课程标准 核心素养
1.了解原子的构成。了解质量数的定义。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
2.知道元素、核素和同位素的含义。 宏观辨识与微观探析:
能从元素和原子水平认识物质的组成和结构。深化对原子结构的认识,建立原子结构与元素性质之间的关系。
【教材梳理】
一、原子构成 质量数
1.原子及其构成微粒
质子
正
中子
负
质子
核外电子
原子核中一定有质子,但不一定有中子。
2.
质子数
中子数
质子数
中子数
相对原子质量
3.原子的表示方法
二、核素 同位素
1.核素:具有相同数目的______和相同数目的______的一类原子。
2.同位素
(1)定义:________相同而________不同的同一种元素的不同核素互为同位素。
(2)分类:稳定同位素和放射性同位素。
质子数
质子
中子
中子数
(3)氢元素的三种同位素
H
D
T
0
1
2
3.元素的相对原子质量
(1)定义:各种核素的_________________分别与各种核素在自然界里的_______ (某种核素在这种元素的所有天然核素中所占的比例)的_______之和。
相对原子质量
丰度
乘积
【自主检测】
1.判断正误
(1)某种氯原子的中子数是18,则其质量数是35,核外电子数是17。( )
(2)离子的核外电子数与其所带电荷数的和等于质子数。( )
(3)质量数就是相对原子质量。( )
(4)原子呈电中性是因为中子不带电。( )
√
×
×
×
×
√
√
×
√
√
√
√
3.我国科学家通过测量SiO2中26Al和10Be两种元素的比例,确定了“北京人”的年龄,这种测量方法叫“铝铍测年法”。10Be和9Be( )
A.是同一种原子 B.具有相同的中子数
C.具有相同的化学性质 D.具有相同的物理性质
解析: 10Be与9Be是同种元素的不同核素,二者互为同位素,具有相同的化学性质,物理性质不同。
√
4.47Ag 有两种同位素,在自然界所占的原子个数百分比几乎相同,若Ag元素的近似相对原子质量为108,则这两种同位素的中子数为( )
A.106和110 B.57和63
C.153和73 D.60和62
√
学习任务1 构成原子的微粒之间的关系
1.构成原子微粒的作用
(1)质子数决定元素的种类。
(2)质子数和中子数决定原子的质量。
(3)原子的最外层电子数决定元素的化学性质。
2.构成原子或离子的微粒间的三种关系
(1)质量关系:质量数(A)=质子数(Z)+中子数(N)。
(2)等量关系:核电荷数=质子数,对原子而言,核电荷数=质子数=核外电子数。
(3)大小关系
阳离子(Rm+) 质子数>电子数 质子数=电子数+m
阴离子(Rm-) 质子数<电子数 质子数=电子数-m
3.元素符号周围数字的含义
[归纳总结]
(1)元素的种类由原子核内的质子数决定,因此划分元素种类的唯一标准是质子数(核电荷数)。
(2)“同一类”指质子数相同的各种不同原子,以及各种状态(游离态或化合态)下的原子或离子,是广义的原子。
(3)元素只分种类,不能称个数,只能说某物质由几种元素组成,不能说由几个元素组成。
[解析] 原子 中左上角数字代表质量数,左下角数字代表质子数,故该原子的质量数是99,质子数=核外电子数=43,中子数=质量数-质子数=99-43=56,B项正确。
√
1.(2020·洛阳高一月考)下表符号中“2”的含义正确的一组是( )
选项 2H 2He 2Cl Ca2+
A 质量数 中子数 质子数 电荷数
B 质量数 质子数 原子个数 电荷数
C 质子数 中子数 原子个数 电荷数
D 质量数 质子数 中子数 电荷数
√
解析: 2H中的“2”代表质量数,2He中的“2”代表质子数,2Cl中的“2”代表原子个数,Ca2+中的“2”代表电荷数。
2.写出下列原子的符号。
(1)具有7个中子的碳原子:________。
(2)具有2个中子的氢原子:________。
(3)具有20个中子的氯原子:________。
(4)具有12个中子的钠原子:________。
学习任务2 元素、核素、同位素及同素异形体的辨析
1.区别
2.联系
[归纳总结] 同位素的“六同三不同”
√
同素异形体研究的对象是单质,A项错误;
1.2020年4月,我国自主设计,被称为“人造太阳”的“东方超环”核聚变实验装置取得重大突破,该核聚变的基础原料是海水中提取的氘和氚。下列叙述中错误的是( )
A.氘原子的相对原子质量为2
B.氚原子内中子数和核外电子数之差为1
C.氘原子和氚原子互为同位素
D.海水中的H2O与D2O互为同素异形体
√
2.(双选)下列有关13C、15N叙述正确的是( )
A.13C与15N的中子数不同
B.13C与C60互为同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
√
√
解析:13C的中子数是7,15N的中子数是8,A正确;同素异形体指由同种元素组成的具有不同性质的单质,而13C是碳元素的一种核素(原子),C60是碳元素的一种单质,则13C与C60不互为同素异形体,B错误;15N与14N 核内质子数相同为7,中子数分别为8和7,则15N与14N 互为同位素,C正确;15N的核外电子数是7,中子数是8,D错误。
1.下列关于原子结构的说法正确的是( )
A.所有原子都含有质子、中子和电子三种基本微粒
B.质子数决定元素的种类,中子数决定原子的种类
C.质子、中子和电子不可以进一步分成更小的微粒
D.电子的质量较小,原子的质量主要集中在原子核上
√
解析:A错,大多数原子含有质子、中子和电子三种基本微粒,但普通氢原子不含中子;
B错,质子数决定元素的种类,质子数与中子数决定原子的种类;
C错,随着科学的发展,人类对原子结构的认识会更加深入,目前研究表明质子和中子里面还有更小的微粒——夸克。
√
同位素的化学性质几乎完全相同,物理性质不同,故C错误;
√
√
√
√
6.(1)1H、2H、3H三种微粒都属于________,因为它们是具有相同________的同一类原子。
答案:
(1)氢元素 质子数(核电荷数)
(2)8 3
(3)互为同位素 相同质子数和不同中子数
本部分内容讲解结束
