1.3.1认识同周期元素性质的递变规律(教学课件)(共39张PPT)-2022-2023学年高一化学鲁科版(2019)必修二
文档属性
| 名称 | 1.3.1认识同周期元素性质的递变规律(教学课件)(共39张PPT)-2022-2023学年高一化学鲁科版(2019)必修二 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-24 09:46:02 | ||
图片预览







文档简介
(共39张PPT)
化学
第1章 原子结构 元素周期律
第3节 元素周期表的应用
第1课时 认识同周期元素性质的
递变规律
01
学新知 素养奠基
02
解疑难 素养提升
03
固双基 素养达标
04
提智能 素养发展
课程标准 核心素养
1.以第3周期元素为例,掌握同周期元素性质的递变规律。
2.能运用原子结构理论初步解释同周期元素性质的递变规律。
3.通过“第3周期元素原子得失电子能力的比较”的探究,培养设计实验和实验操作的能力。 1.宏观辨识与微观探析:深化对原子结构的认识,建立原子结构、元素性质与物质性质之间的关系,从物质的微观结构说明同类物质具有相似性质的原因,解释同类物质的性质变化规律。
2.证据推理与模型认知:构建“位”“构”“性”关系认知模型,发展对元素及其化合物化学性质的认知模型。
3.科学探究与创新意识:形成实验探究元素性质递变规律、比较物质性质的思路方法,提高基于理论进行预测、提出假设的能力和基于实验事实概括、推理得出结论的能力。
【教材梳理】
一、元素原子得失电子能力的比较
1.判断元素原子失电子能力强弱的间接方法
(1)比较元素的单质与____ (或____)反应置换出氢气的难易程度。置换反应越容易发生,表明元素原子失电子的能力越____。
(2)比较元素最高价氧化物对应水化物的碱性强弱。一般来说,碱性越强,表明元素原子失电子的能力越_____。
水
酸
强
强
2.判断元素原子得电子能力强弱的间接方法
(1)比较元素的单质与氢气化合的难易程度,以及所生成的气态氢化物的稳定性。一般来说,反应越容易进行,生成的气态氢化物越_______,表明元素原子得电子的能力越强。
(2)比较元素最高价氧化物对应水化物的酸性强弱。一般来说,酸性越强,表明元素原子得电子的能力越强。
稳定
二、第3周期元素原子得失电子能力的比较
1.钠、镁、铝元素原子失电子能力的比较
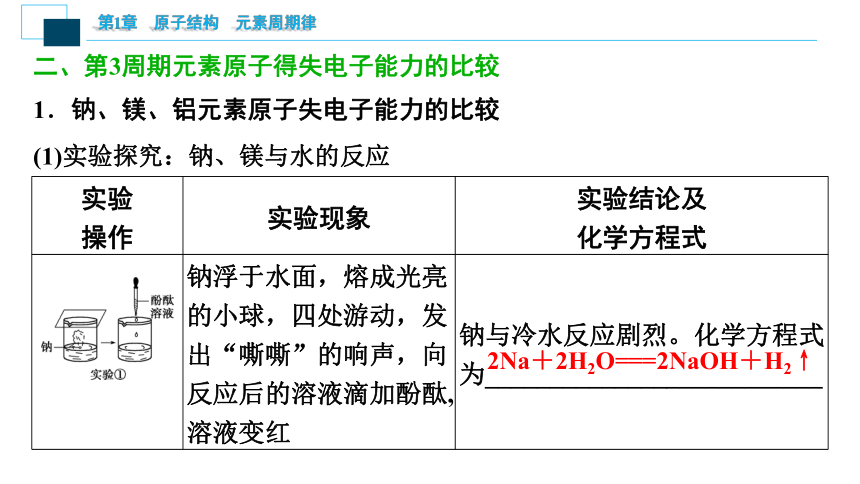
(1)实验探究:钠、镁与水的反应
实验
操作 实验现象 实验结论及
化学方程式
钠浮于水面,熔成光亮的小球,四处游动,发出“嘶嘶”的响声,向反应后的溶液滴加酚酞,溶液变红 钠与冷水反应剧烈。化学方程式为__________________________
2Na+2H2O===2NaOH+H2↑
实验操作 实验现象 实验结论及化学方程式
加热前,无明显现象,加热至沸腾后,有较多的无色气泡冒出,溶液变为粉红色 镁与冷水几乎不反应,能与热水反应。化学方程式为
Mg+2H2O H2↑+Mg(OH)2
结论:元素原子失电子能力为___________
Na>Mg
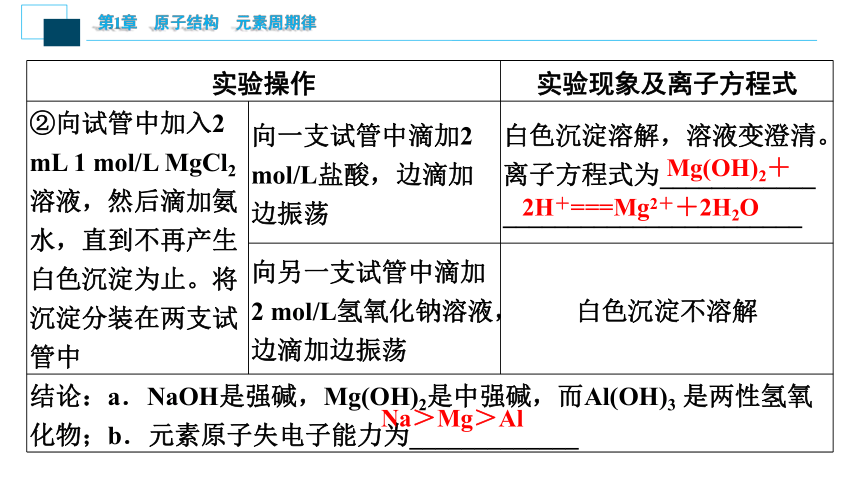
(2)实验探究:氢氧化铝、氢氧化镁分别和稀盐酸、氢氧化钠溶液的反应
实验操作 实验现象及离子方程式
①向试管中加入2 mL 1 mol/L AlCl3溶液,然后滴加氨水,直到不再产生白色絮状 沉淀为止。将沉淀分装在两支试管中 向一支试管中滴加2 mol/L盐酸,边滴加边振荡 白色沉淀溶解,溶液变澄清。离子方程式为_____________
___________________
向另一支试管中滴加2 mol/L氢氧化钠溶液,边滴加边振荡 白色沉淀溶解,溶液变澄清。离子方程式为______________
________________
Al(OH)3+3H+===Al3++3H2O
Al(OH)3+OH-===[Al(OH)4]-
实验操作 实验现象及离子方程式
②向试管中加入2 mL 1 mol/L MgCl2溶液,然后滴加氨水,直到不再产生白色沉淀为止。将沉淀分装在两支试管中 向一支试管中滴加2 mol/L盐酸,边滴加边振荡 白色沉淀溶解,溶液变澄清。离子方程式为____________
_______________________
向另一支试管中滴加2 mol/L氢氧化钠溶液,边滴加边振荡 白色沉淀不溶解
结论:a.NaOH是强碱,Mg(OH)2是中强碱,而Al(OH)3 是两性氢氧化物;b.元素原子失电子能力为_____________
Mg(OH)2+2H+===Mg2++2H2O
Na>Mg>Al
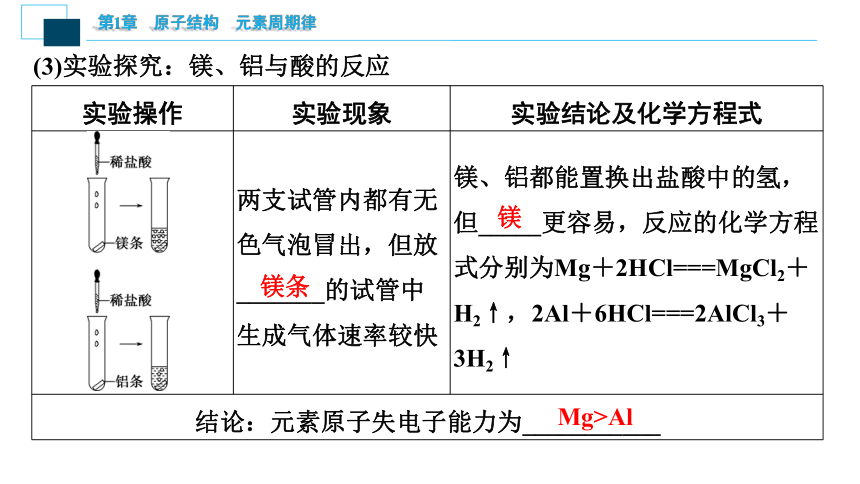
(3)实验探究:镁、铝与酸的反应
实验操作 实验现象 实验结论及化学方程式
两支试管内都有无色气泡冒出,但放_______的试管中生成气体速率较快 镁、铝都能置换出盐酸中的氢,但_____更容易,反应的化学方程式分别为Mg+2HCl===MgCl2+H2↑,2Al+6HCl===2AlCl3+3H2↑
结论:元素原子失电子能力为___________
镁条
镁
Mg>Al
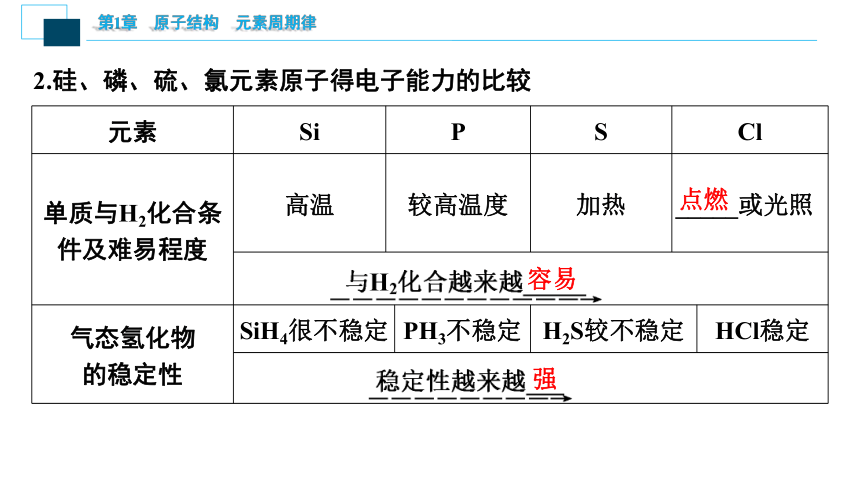
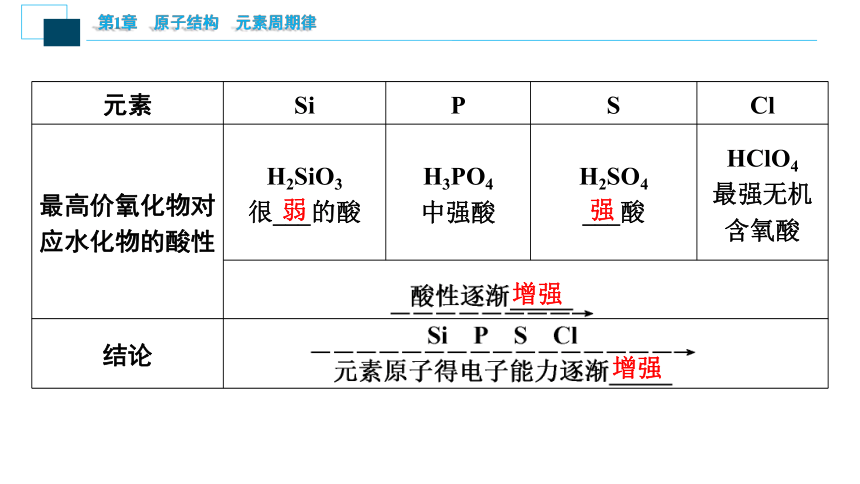
元素 Si P S Cl
单质与H2化合条件及难易程度 高温 较高温度 加热 _____或光照
气态氢化物
的稳定性 SiH4很不稳定 PH3不稳定 H2S较不稳定 HCl稳定
2.硅、磷、硫、氯元素原子得电子能力的比较
容易
强
点燃
元素 Si P S Cl
最高价氧化物对应水化物的酸性 H2SiO3
很___的酸 H3PO4
中强酸 H2SO4
___酸 HClO4
最强无机含氧酸
结论
弱
强
增强
增强
三、同周期主族元素原子得失电子能力的递变规律
1.规律:同一周期主族元素,从左往右,随着原子序数的递增,元素原子的失电子能力逐渐_______、得电子能力逐渐_______。
2.理论解释:同一周期主族元素,从左到右,原子的核外电子层数相同,核电荷数依次增多,原子半径逐渐_______,原子核对核外电子的吸引力逐渐_______,元素原子的失电子能力逐渐_______、得电子能力逐渐_______。
减弱
增强
减小
增强
减弱
增强
四、元素周期表中金属元素与非金属元素的分区
分界线附近的元素既能表现出一定的___________的性质,又能表现出一定的____________的性质。例如,硅元素属于非金属元素,锗元素属于金属元素,但它们的单质均具有__________的性质。
金属元素
非金属元素
半导体
【自主检测】
1.判断正误
(1)得电子能力:C>N>O>F。( )
(2)失电子能力:Na>Mg>Al。( )
(3)稳定性:CH4>NH3>H2O>HF。( )
(4)碱性:NaOH>Mg(OH)2>Al(OH)3。( )
(5)酸性:H2SiO3>H3PO4>H2SO4>HClO4。( )
×
√
×
√
×
(6)很难失电子的原子一定易得到电子。( )
(7)酸性:HCl>H3PO4,故得电子能力:Cl>P。( )
(8)碱性:NaOH>Mg(OH)2,故失电子能力:Na>Mg。( )
(9)元素原子得电子越多,非金属性越强;失电子越多,金属性越
强。( )
(10)热稳定性:NH3<H2O,故非金属性:N<O。( )
×
×
√
×
√
2.已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>D>C
B.原子的最外层电子数目:A>B>D>C
C.原子序数:d>c>b>a
D.离子半径:C2->D->B+>A2+
√
原子半径:B>A>C>D;
离子半径:C2->D->B+>A2+;
原子的最外层电子数目:D>C>A>B。
3.(双选)下列关于元素周期律和元素周期表的说法错误的是( )
A.Na、Mg、Al元素的原子核外最外层电子数随着核电荷数的增大而增多
B.第2周期元素从Li到F,原子半径逐渐增大
C.因为Na比Mg容易失去电子,所以Na的还原性更强
D.C、N2、O2、F2与H2化合越来越难
解析:第2周期元素从Li到F,原子半径逐渐增大,B项错误。C、N2、O2、F2与H2化合越来越容易,D项错误。
√
√
学习任务 同周期主族元素原子结构与性质的递变规律
1.同周期主族元素原子结构与性质的递变规律
项目 同周期(从左到右)
最外层电子数 1→7(第1周期除外)
主要化合价 最高正价+1→+7(O、F除外),最低负价-4→-1
原子半径 逐渐减小
项目 同周期(从左到右)
原子得失电子能力 失电子能力逐渐减弱,得电子能力逐渐增强
单质的氧化性、还原性 还原性逐渐减弱,氧化性逐渐增强
元素的金属性和非金属性 金属性逐渐减弱,非金属性逐渐增强
最高价氧化物
对应水化物的酸碱性 碱性逐渐减弱,酸性逐渐增强
气态氢化物 生成由难到易,稳定性由弱到强
原子的失电子能力越强,对应单质的还原性越强;原子的得电子能力越强,对应单质的氧化性越强。
2.元素金属性和非金属性强弱的判断方法
(双选)四种短周期元素在周期表中的位置如图所示。T的最高价氧化物对应的水化物是酸性最强的无机含氧酸。下列推断正确的是( )
A.原子半径:X>Y>Z>T
B.气态氢化物的还原性:Z<T
C.X的氢氧化物既能与酸反应,又能与碱反应
D.Y和T可以形成YT3
X Y Z T
√
√
[解析] 由题意可知T为Cl,再根据其他元素在周期表中的位置可以推出Z为S、Y为Si、X为Al。四种元素位于同一周期,电子层数相同,核电荷数越大,原子半径越小,则原子半径大小关系为T<Z<Y<X,A项正
确;Z、T分别为S、Cl,它们的非金属性强弱顺序为Cl>S,非金属性越强,气态氢化物的还原性越弱,所以气态氢化物的还原性强弱关系为Z>T,B项错误;X为Al,Al(OH)3具有两性,既能与酸反应,又能与碱反应,C项正确;Y和T可以形成SiCl4,D项错误。
1.现有金属元素A、B、C,B的最高价氧化物对应水化物的碱性比A的最高价氧化物对应水化物的碱性强;A可以从C的盐溶液中置换出C。则这三种元素的金属性由强到弱的顺序正确的是( )
A.A>B>C B.B>A>C
C.B>C>A D.C>B>A
√
解析:B的最高价氧化物对应水化物的碱性比A的最高价氧化物对应水化物的碱性强,则元素B的金属性比元素A的强;
A可以从C的盐溶液中置换出C,则元素A的金属性比元素C的强。
2.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应水化物显碱性,且碱性:B>A;C、D两种元素对应的简单气态氢化物的稳定性:C>D;E是这五种元素中形成的简单离子中半径最小的元素。则它们的原子序数由小到大的顺序是( )
A.B<A<C<D<E B.A<E<B<C<D
C.E<B<A<C<D D.B<A<E<D<C
√
解析:因A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应水化物显碱性,且碱性:B>A,则金属性:B>A;
C、D两种元素对应简单气态氢化物的稳定性:C>D,则非金属性:
C>D;
同周期从左到右,主族元素的金属性逐渐减弱、非金属性逐渐增强,则A、B、C、D的原子序数由小到大的顺序为B<A<D<C;E是这五种元素中形成的简单离子中半径最小的元素,A、B、E均为金属元素,其简单离子具有相同的电子排布,根据离子半径的比较规律:“序大径小”,则三者中E的原子序数最大;
故这五种元素的原子序数由小到大的顺序为B<A<E<D<C。
1.下列说法错误的是( )
A.Na是短周期元素中活泼性最强的金属元素
B.F是短周期元素中活泼性最强的非金属元素
C.第2周期元素从左到右其最高正化合价逐渐增大
D.从硅到氯,最低负化合价从-4到-1
√
解析:根据元素性质的递变规律可知,Na是短周期元素中活泼性最强的金属元素,F是短周期元素中活泼性最强的非金属元素,A、B项正确;
O没有最高正化合价,F没有正化合价,C项错误;
从硅到氯,最低负化合价从-4到-1,D项正确。
2.下列事实不能用于判断元素金属性强弱的是( )
A.金属间发生的置换反应
B.1 mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物对应水化物的碱性强弱
D.金属元素的单质与水或酸置换出氢的难易
解析:金属单质在反应中失去电子的多少不能用于判断元素金属性强
弱。例如:与酸反应时,1 mol Al失电子数比1 mol Mg多,但Al的金属性比Mg弱。
√
3.下列元素的单质中,最容易跟氢气反应生成氢化物的是( )
A.硼 B.氮
C.氟 D.碳
解析:四种元素均位于第2周期,同周期主族元素从左往右非金属性逐渐增强,结合氢气生成氢化物越来越容易,故选C。
√
4.下列氧化物按其水化物的酸性由弱到强的顺序排列的是( )
A.SiO2B.SiO2C.P2O5D.P2O5解析:Si、P、S、Cl四种元素位于第3周期,从左往右依次排列,非金属性依次增强,最高价氧化物对应水化物的酸性依次增强,故选B。
√
5.用“>”或“<”填空。
(1)酸性:H2SiO3________H3PO4。
(2)碱性:Mg(OH)2________Al(OH)3。
(3)气态氢化物稳定性:H2S________HCl。
(4)还原性:H2S________HCl。
(5)酸性:HClO4________HClO。
(6)从以上答案中可以归纳出:
①元素的非金属性越强,其最高价氧化物对应水化物的酸性越______;
②元素的金属性越强,其最高价氧化物对应水化物的碱性越________;
③元素的________性越强,其对应气态氢化物的稳定性越________;
④非金属性越强的元素,形成的气态氢化物的还原性越________;
⑤同种非金属元素形成的含氧酸中,该非金属元素的价态越高,其酸性越________。
答案:
(1)< (2)> (3)< (4)> (5)>
(6)①强 ②强 ③非金属 强 ④弱 ⑤强
本部分内容讲解结束
按ESC键退出全屏播放
化学
第1章 原子结构 元素周期律
第3节 元素周期表的应用
第1课时 认识同周期元素性质的
递变规律
01
学新知 素养奠基
02
解疑难 素养提升
03
固双基 素养达标
04
提智能 素养发展
课程标准 核心素养
1.以第3周期元素为例,掌握同周期元素性质的递变规律。
2.能运用原子结构理论初步解释同周期元素性质的递变规律。
3.通过“第3周期元素原子得失电子能力的比较”的探究,培养设计实验和实验操作的能力。 1.宏观辨识与微观探析:深化对原子结构的认识,建立原子结构、元素性质与物质性质之间的关系,从物质的微观结构说明同类物质具有相似性质的原因,解释同类物质的性质变化规律。
2.证据推理与模型认知:构建“位”“构”“性”关系认知模型,发展对元素及其化合物化学性质的认知模型。
3.科学探究与创新意识:形成实验探究元素性质递变规律、比较物质性质的思路方法,提高基于理论进行预测、提出假设的能力和基于实验事实概括、推理得出结论的能力。
【教材梳理】
一、元素原子得失电子能力的比较
1.判断元素原子失电子能力强弱的间接方法
(1)比较元素的单质与____ (或____)反应置换出氢气的难易程度。置换反应越容易发生,表明元素原子失电子的能力越____。
(2)比较元素最高价氧化物对应水化物的碱性强弱。一般来说,碱性越强,表明元素原子失电子的能力越_____。
水
酸
强
强
2.判断元素原子得电子能力强弱的间接方法
(1)比较元素的单质与氢气化合的难易程度,以及所生成的气态氢化物的稳定性。一般来说,反应越容易进行,生成的气态氢化物越_______,表明元素原子得电子的能力越强。
(2)比较元素最高价氧化物对应水化物的酸性强弱。一般来说,酸性越强,表明元素原子得电子的能力越强。
稳定
二、第3周期元素原子得失电子能力的比较
1.钠、镁、铝元素原子失电子能力的比较
(1)实验探究:钠、镁与水的反应
实验
操作 实验现象 实验结论及
化学方程式
钠浮于水面,熔成光亮的小球,四处游动,发出“嘶嘶”的响声,向反应后的溶液滴加酚酞,溶液变红 钠与冷水反应剧烈。化学方程式为__________________________
2Na+2H2O===2NaOH+H2↑
实验操作 实验现象 实验结论及化学方程式
加热前,无明显现象,加热至沸腾后,有较多的无色气泡冒出,溶液变为粉红色 镁与冷水几乎不反应,能与热水反应。化学方程式为
Mg+2H2O H2↑+Mg(OH)2
结论:元素原子失电子能力为___________
Na>Mg
(2)实验探究:氢氧化铝、氢氧化镁分别和稀盐酸、氢氧化钠溶液的反应
实验操作 实验现象及离子方程式
①向试管中加入2 mL 1 mol/L AlCl3溶液,然后滴加氨水,直到不再产生白色絮状 沉淀为止。将沉淀分装在两支试管中 向一支试管中滴加2 mol/L盐酸,边滴加边振荡 白色沉淀溶解,溶液变澄清。离子方程式为_____________
___________________
向另一支试管中滴加2 mol/L氢氧化钠溶液,边滴加边振荡 白色沉淀溶解,溶液变澄清。离子方程式为______________
________________
Al(OH)3+3H+===Al3++3H2O
Al(OH)3+OH-===[Al(OH)4]-
实验操作 实验现象及离子方程式
②向试管中加入2 mL 1 mol/L MgCl2溶液,然后滴加氨水,直到不再产生白色沉淀为止。将沉淀分装在两支试管中 向一支试管中滴加2 mol/L盐酸,边滴加边振荡 白色沉淀溶解,溶液变澄清。离子方程式为____________
_______________________
向另一支试管中滴加2 mol/L氢氧化钠溶液,边滴加边振荡 白色沉淀不溶解
结论:a.NaOH是强碱,Mg(OH)2是中强碱,而Al(OH)3 是两性氢氧化物;b.元素原子失电子能力为_____________
Mg(OH)2+2H+===Mg2++2H2O
Na>Mg>Al
(3)实验探究:镁、铝与酸的反应
实验操作 实验现象 实验结论及化学方程式
两支试管内都有无色气泡冒出,但放_______的试管中生成气体速率较快 镁、铝都能置换出盐酸中的氢,但_____更容易,反应的化学方程式分别为Mg+2HCl===MgCl2+H2↑,2Al+6HCl===2AlCl3+3H2↑
结论:元素原子失电子能力为___________
镁条
镁
Mg>Al
元素 Si P S Cl
单质与H2化合条件及难易程度 高温 较高温度 加热 _____或光照
气态氢化物
的稳定性 SiH4很不稳定 PH3不稳定 H2S较不稳定 HCl稳定
2.硅、磷、硫、氯元素原子得电子能力的比较
容易
强
点燃
元素 Si P S Cl
最高价氧化物对应水化物的酸性 H2SiO3
很___的酸 H3PO4
中强酸 H2SO4
___酸 HClO4
最强无机含氧酸
结论
弱
强
增强
增强
三、同周期主族元素原子得失电子能力的递变规律
1.规律:同一周期主族元素,从左往右,随着原子序数的递增,元素原子的失电子能力逐渐_______、得电子能力逐渐_______。
2.理论解释:同一周期主族元素,从左到右,原子的核外电子层数相同,核电荷数依次增多,原子半径逐渐_______,原子核对核外电子的吸引力逐渐_______,元素原子的失电子能力逐渐_______、得电子能力逐渐_______。
减弱
增强
减小
增强
减弱
增强
四、元素周期表中金属元素与非金属元素的分区
分界线附近的元素既能表现出一定的___________的性质,又能表现出一定的____________的性质。例如,硅元素属于非金属元素,锗元素属于金属元素,但它们的单质均具有__________的性质。
金属元素
非金属元素
半导体
【自主检测】
1.判断正误
(1)得电子能力:C>N>O>F。( )
(2)失电子能力:Na>Mg>Al。( )
(3)稳定性:CH4>NH3>H2O>HF。( )
(4)碱性:NaOH>Mg(OH)2>Al(OH)3。( )
(5)酸性:H2SiO3>H3PO4>H2SO4>HClO4。( )
×
√
×
√
×
(6)很难失电子的原子一定易得到电子。( )
(7)酸性:HCl>H3PO4,故得电子能力:Cl>P。( )
(8)碱性:NaOH>Mg(OH)2,故失电子能力:Na>Mg。( )
(9)元素原子得电子越多,非金属性越强;失电子越多,金属性越
强。( )
(10)热稳定性:NH3<H2O,故非金属性:N<O。( )
×
×
√
×
√
2.已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>D>C
B.原子的最外层电子数目:A>B>D>C
C.原子序数:d>c>b>a
D.离子半径:C2->D->B+>A2+
√
原子半径:B>A>C>D;
离子半径:C2->D->B+>A2+;
原子的最外层电子数目:D>C>A>B。
3.(双选)下列关于元素周期律和元素周期表的说法错误的是( )
A.Na、Mg、Al元素的原子核外最外层电子数随着核电荷数的增大而增多
B.第2周期元素从Li到F,原子半径逐渐增大
C.因为Na比Mg容易失去电子,所以Na的还原性更强
D.C、N2、O2、F2与H2化合越来越难
解析:第2周期元素从Li到F,原子半径逐渐增大,B项错误。C、N2、O2、F2与H2化合越来越容易,D项错误。
√
√
学习任务 同周期主族元素原子结构与性质的递变规律
1.同周期主族元素原子结构与性质的递变规律
项目 同周期(从左到右)
最外层电子数 1→7(第1周期除外)
主要化合价 最高正价+1→+7(O、F除外),最低负价-4→-1
原子半径 逐渐减小
项目 同周期(从左到右)
原子得失电子能力 失电子能力逐渐减弱,得电子能力逐渐增强
单质的氧化性、还原性 还原性逐渐减弱,氧化性逐渐增强
元素的金属性和非金属性 金属性逐渐减弱,非金属性逐渐增强
最高价氧化物
对应水化物的酸碱性 碱性逐渐减弱,酸性逐渐增强
气态氢化物 生成由难到易,稳定性由弱到强
原子的失电子能力越强,对应单质的还原性越强;原子的得电子能力越强,对应单质的氧化性越强。
2.元素金属性和非金属性强弱的判断方法
(双选)四种短周期元素在周期表中的位置如图所示。T的最高价氧化物对应的水化物是酸性最强的无机含氧酸。下列推断正确的是( )
A.原子半径:X>Y>Z>T
B.气态氢化物的还原性:Z<T
C.X的氢氧化物既能与酸反应,又能与碱反应
D.Y和T可以形成YT3
X Y Z T
√
√
[解析] 由题意可知T为Cl,再根据其他元素在周期表中的位置可以推出Z为S、Y为Si、X为Al。四种元素位于同一周期,电子层数相同,核电荷数越大,原子半径越小,则原子半径大小关系为T<Z<Y<X,A项正
确;Z、T分别为S、Cl,它们的非金属性强弱顺序为Cl>S,非金属性越强,气态氢化物的还原性越弱,所以气态氢化物的还原性强弱关系为Z>T,B项错误;X为Al,Al(OH)3具有两性,既能与酸反应,又能与碱反应,C项正确;Y和T可以形成SiCl4,D项错误。
1.现有金属元素A、B、C,B的最高价氧化物对应水化物的碱性比A的最高价氧化物对应水化物的碱性强;A可以从C的盐溶液中置换出C。则这三种元素的金属性由强到弱的顺序正确的是( )
A.A>B>C B.B>A>C
C.B>C>A D.C>B>A
√
解析:B的最高价氧化物对应水化物的碱性比A的最高价氧化物对应水化物的碱性强,则元素B的金属性比元素A的强;
A可以从C的盐溶液中置换出C,则元素A的金属性比元素C的强。
2.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应水化物显碱性,且碱性:B>A;C、D两种元素对应的简单气态氢化物的稳定性:C>D;E是这五种元素中形成的简单离子中半径最小的元素。则它们的原子序数由小到大的顺序是( )
A.B<A<C<D<E B.A<E<B<C<D
C.E<B<A<C<D D.B<A<E<D<C
√
解析:因A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应水化物显碱性,且碱性:B>A,则金属性:B>A;
C、D两种元素对应简单气态氢化物的稳定性:C>D,则非金属性:
C>D;
同周期从左到右,主族元素的金属性逐渐减弱、非金属性逐渐增强,则A、B、C、D的原子序数由小到大的顺序为B<A<D<C;E是这五种元素中形成的简单离子中半径最小的元素,A、B、E均为金属元素,其简单离子具有相同的电子排布,根据离子半径的比较规律:“序大径小”,则三者中E的原子序数最大;
故这五种元素的原子序数由小到大的顺序为B<A<E<D<C。
1.下列说法错误的是( )
A.Na是短周期元素中活泼性最强的金属元素
B.F是短周期元素中活泼性最强的非金属元素
C.第2周期元素从左到右其最高正化合价逐渐增大
D.从硅到氯,最低负化合价从-4到-1
√
解析:根据元素性质的递变规律可知,Na是短周期元素中活泼性最强的金属元素,F是短周期元素中活泼性最强的非金属元素,A、B项正确;
O没有最高正化合价,F没有正化合价,C项错误;
从硅到氯,最低负化合价从-4到-1,D项正确。
2.下列事实不能用于判断元素金属性强弱的是( )
A.金属间发生的置换反应
B.1 mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物对应水化物的碱性强弱
D.金属元素的单质与水或酸置换出氢的难易
解析:金属单质在反应中失去电子的多少不能用于判断元素金属性强
弱。例如:与酸反应时,1 mol Al失电子数比1 mol Mg多,但Al的金属性比Mg弱。
√
3.下列元素的单质中,最容易跟氢气反应生成氢化物的是( )
A.硼 B.氮
C.氟 D.碳
解析:四种元素均位于第2周期,同周期主族元素从左往右非金属性逐渐增强,结合氢气生成氢化物越来越容易,故选C。
√
4.下列氧化物按其水化物的酸性由弱到强的顺序排列的是( )
A.SiO2
√
5.用“>”或“<”填空。
(1)酸性:H2SiO3________H3PO4。
(2)碱性:Mg(OH)2________Al(OH)3。
(3)气态氢化物稳定性:H2S________HCl。
(4)还原性:H2S________HCl。
(5)酸性:HClO4________HClO。
(6)从以上答案中可以归纳出:
①元素的非金属性越强,其最高价氧化物对应水化物的酸性越______;
②元素的金属性越强,其最高价氧化物对应水化物的碱性越________;
③元素的________性越强,其对应气态氢化物的稳定性越________;
④非金属性越强的元素,形成的气态氢化物的还原性越________;
⑤同种非金属元素形成的含氧酸中,该非金属元素的价态越高,其酸性越________。
答案:
(1)< (2)> (3)< (4)> (5)>
(6)①强 ②强 ③非金属 强 ④弱 ⑤强
本部分内容讲解结束
按ESC键退出全屏播放
