2.1 化学键与物质构成 (教学课件)(共42张PPT)- 2022-2023学年高一化学鲁科版(2019)必修二
文档属性
| 名称 | 2.1 化学键与物质构成 (教学课件)(共42张PPT)- 2022-2023学年高一化学鲁科版(2019)必修二 | 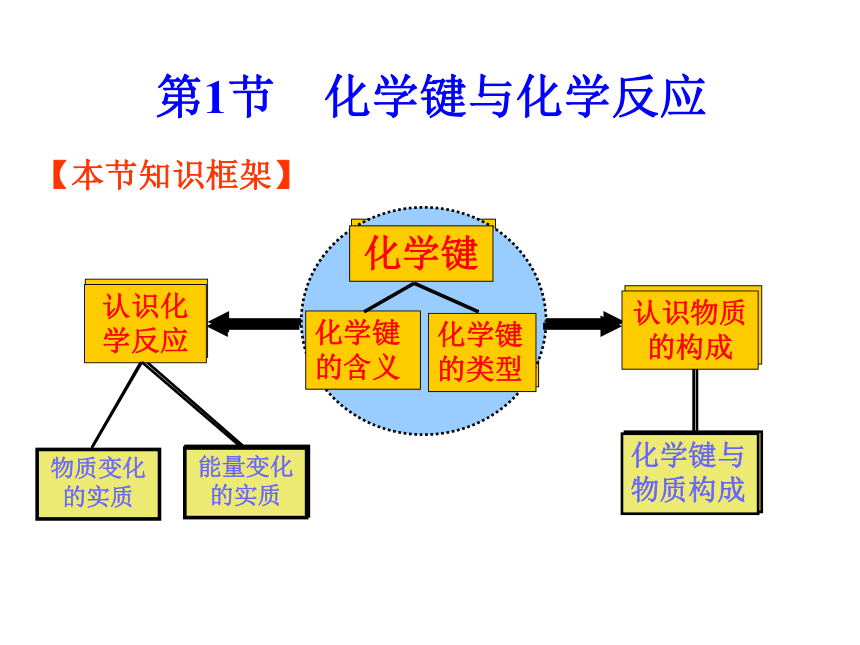 | |
| 格式 | ppt | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-24 09:47:06 | ||
图片预览



文档简介
(共42张PPT)
第1节 化学键与化学反应
【本节知识框架】
物质变化的实质
化学键
化学键的含义
化学键的类型
认识物质的构成
认识化学反应
化学键与物质构成
能量变化的实质
化学键
化学键的含义
化学键的类型
认识物质的构成
认识化学反应
化学键与物质构成
能量变化的实质
*
研修班
*
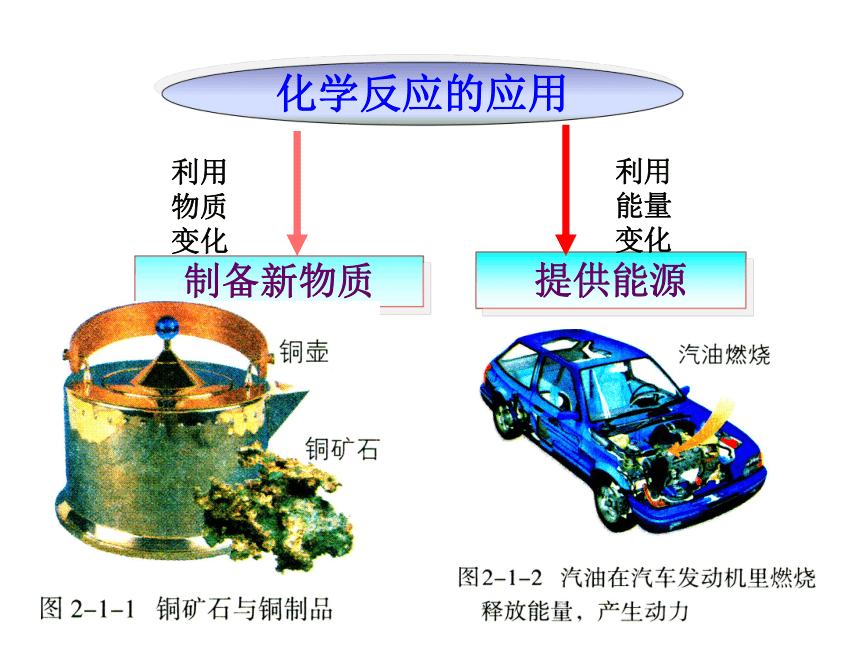
化学反应的应用
制备新物质
利用
物质
变化
提供能源
利用
能量
变化
*
研修班
*
*
研修班
*
第1课时:化学键与化学反应中的物质变化
1.化学键与物质变化
化学反应的实质是:
原子的重新组合。
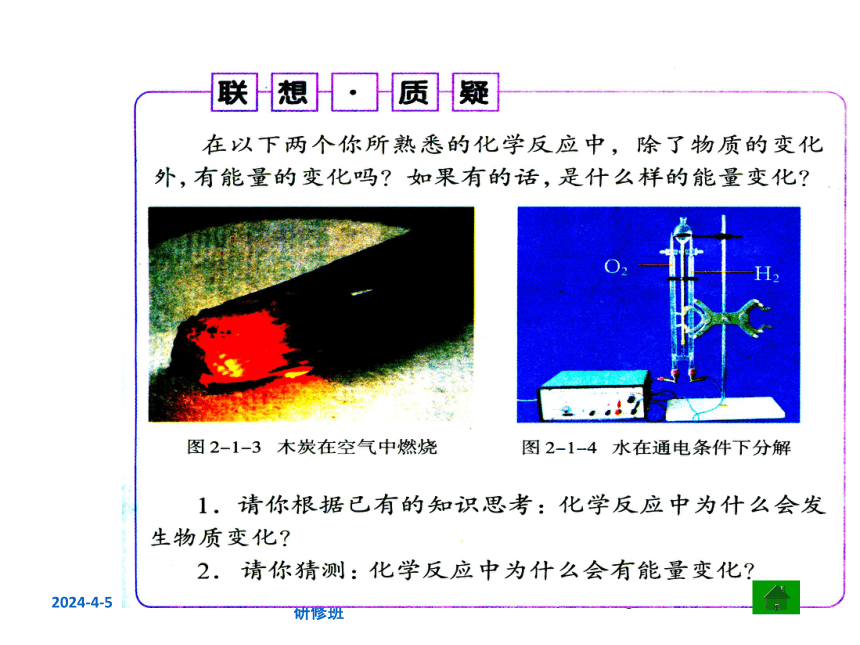
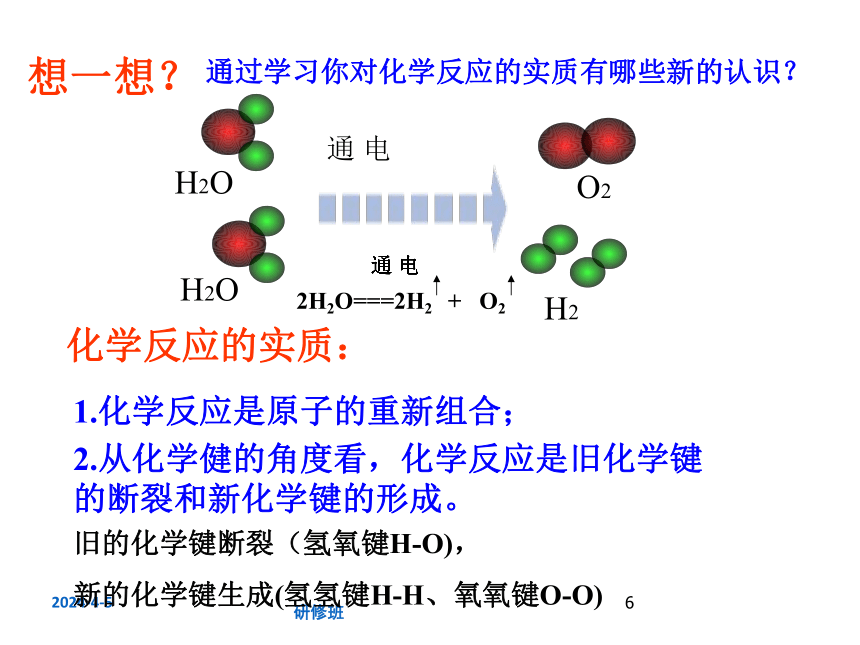
想一想?
1.化学反应中为什么会发生物质变化?化学反应中的最小微粒是什么?
2. 以电解水为例,说说水电解时为什么要消耗能量?水分子是如何分解生成氢气与氧气的?
3.为什么碳与氧气反应需要先加热?
4. 初中化学中曾经讨论过的化学反应的实质是什么?
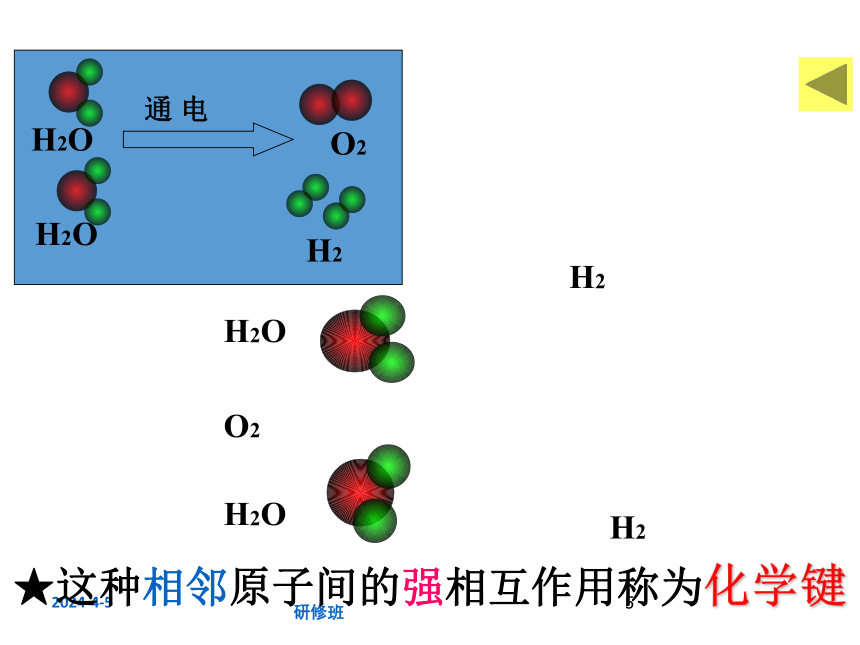
2H2O===2H2 + O2
通电
*
研修班
*
H2O
H2O
H2
H2
O2
H2O
H2O
H2
O2
通 电
★这种相邻原子间的强相互作用称为化学键
*
研修班
*
H2O
H2O
H2
O2
通 电
旧的化学键断裂(氢氧键H-O),
新的化学键生成(氢氢键H-H、氧氧键O-O)
化学反应的实质:
1.化学反应是原子的重新组合;
2.从化学健的角度看,化学反应是旧化学键的断裂和新化学键的形成。
2H2O===2H2 + O2
通 电
通 电
通 电
通 电
通 电
通 电
通 电
通 电
通 电
通过学习你对化学反应的实质有哪些新的认识?
想一想?
*
研修班
*
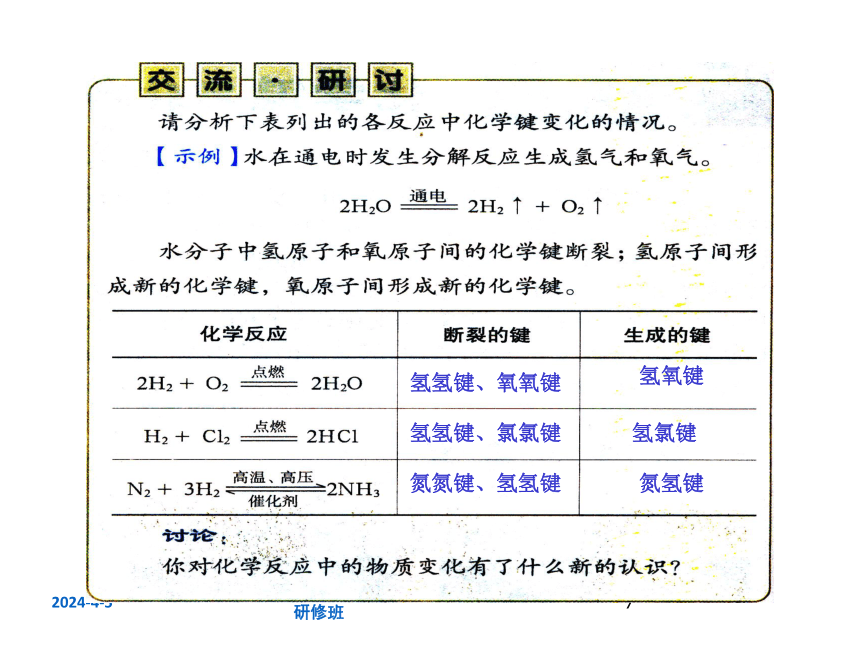
氢氢键、氧氧键
氢氧键
氢氢键、氯氯键
氢氯键
氮氮键、氢氢键
氮氢键
*
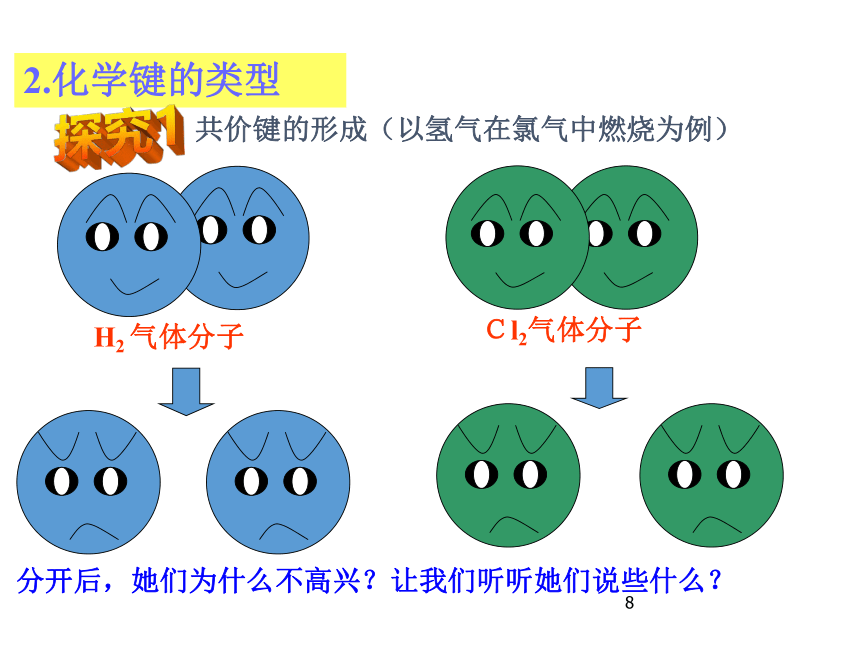
2.化学键的类型
Cl2气体分子
H2 气体分子
共价键的形成(以氢气在氯气中燃烧为例)
分开后,她们为什么不高兴?让我们听听她们说些什么?
*
研修班
*
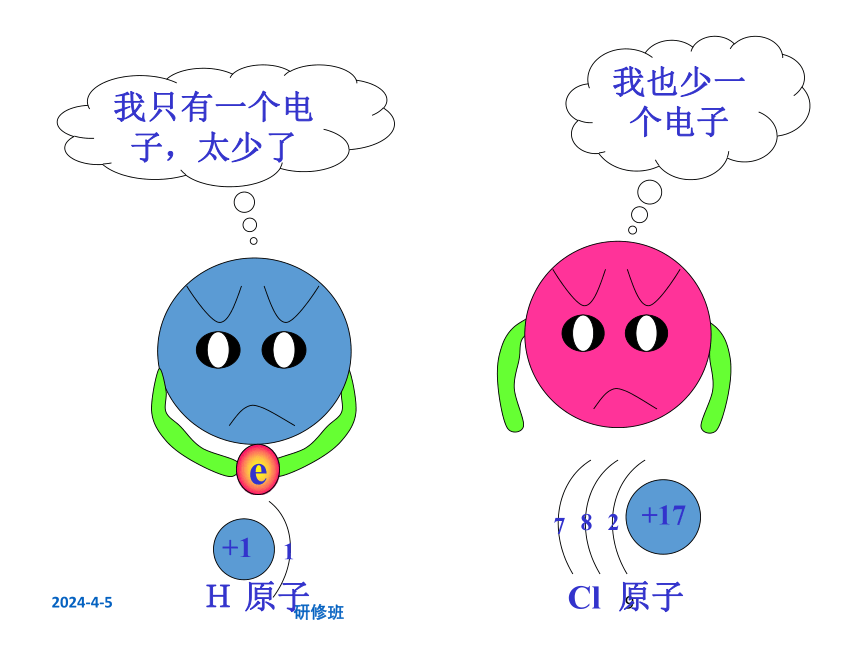
我只有一个电子,太少了
我也少一个电子
e
H 原子
Cl 原子
+1
1
+17
7
8
2
*
研修班
*
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有.行吗?
e
好
呵
谢
谢
好
呵
谢
谢
+1
1
+17
8
2
7
*
研修班
*
愿意
电子
电子
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.
愿意
H
Cl
*
研修班
*
我们的接合使人类的生活多了一点味道
我们的结合使人类的工厂有了活力
H2+Cl2===2HCl
点燃
*
研修班
*
分析氯化氢的形成过程
★原子之间通过共用电子对的相互作用所形成的化学键,叫做共价键。
通过共用电子对
H2+Cl2===2HCl
点燃
2
2
2
★共价键形成条件:
一般是非金属元素原子间的相互作用。
非金属元素可以是同种,也可以是不同种;如:H2、Cl2、HCl、CO2 等分子中均含有共价键。
*
研修班
*
★氢分子的形成:
H ·
★氯化氢分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
原子间通过共用电子对所形成的化学键,叫做共价键。(形成过程可用电子式表示如下)
共用电子对不偏移,成键原子不显电性
共用电子对偏向氯原子,
非极性共价键:
极性共价键:
H﹣H(结构式)
H﹣Cl(结构式)
氯原子带部份负电荷,氢原子带份正电荷部。
知识拓展
*
研修班
*
键的极性特点
非极性键:电子对不偏向任何原子,成键两原子不出现正负两极。
电子对不偏移
极性键:电子对偏向得电子能力强的原子,使成键的两原子电荷分布不均匀,一个带部分正电荷,为正极,另一个带部分负电荷,为负极
电子对偏向Cl
Cl
··
··
H
··
··
H H
··
*
研修班
*
原子结构示意图 通过什么途径达到稳定结构 用离子结构示意图表示
Na
Cl
+11
8
1
2
+17
8
7
2
得到一个电子
氯化钠的形成
失去一个电子
(2Na+ Cl2== 2NaCl )
点燃
*
研修班
*
氯化钠的形成过程
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
失 e-
得 e-
静电作用
Na+
Cl-
★阴、阳离子通过静电作用而形成的化学键叫做离子键。
成键原因:
微粒由不稳定结构通过得失电子后变成稳定结构。
*
研修班
*
4.哪些元素的原子之间可能形成离子键(成键条件) ?
1.离子键的形成原因是什么?
3.离子键的成键本质是什么
2.形成离子键的微粒是什么?
答: 是因为参与化学反应的成键原子的结构不稳定,易得、失电子形成阴、阳离子。
答:是阴、阳离子。
答:阴、阳离子的静电作用(静电引力和斥力)。
答:活泼金属元素与活泼非金属元素之间容易形成。
第ⅠA族、
第ⅡA族的金属
卤素(VⅡA)及O、S等
如Na2 S、MgCl2 、 KI、 CaO等
*
研修班
*
共 价 键
离 子 键
成键微粒
原 子
阴、阳离子
微 粒
间的作用
成键元素范围
成键原因
原子间通过共用电子对相互作用
阴、阳离子间静电作用
同种或不同种的非金属元素
活泼金属(ⅠA、ⅡA)元素与 活泼非金属(ⅥA、ⅦA)元素
微粒由不稳定结构通过得失电子后变成稳定结构。
微粒由不稳定结构通过共用电子对相互作用后变成稳定结构。
作业布置:P38.1、2、5
*
研修班
*
第2课时:化学键与物质构成
复习提问?
1.通过上节课的学习你是怎么理解“化学键”的?水气化变成水蒸气及金刚石变成石墨是否破坏化学键?
2.化学键的有哪些主要类型?
●化学键定义:相邻原子间强烈的相互作用
离子键
共价键
金属键(以后再学)
●化学键分类
O
H
H
表示共价键
没有化学键
●化学反应的实质——
旧化学键断裂和新化学键形成的过程
*
研修班
*
●下面给出的都是你熟悉的物质请你利用所学知识分析它们的构成情况。
物质 形成化学键的微粒 化学键的类型
水
氨气
二氧化碳
氧化钙
氯化钾
氢气
H、O
共价键(极性)
N、H
共价键(极性)
C、O
共价键(极性)
Ca2+ 、O2-
K+ 、 Cl-
离子键
离子键
H
共价键(非极性)
*
研修班
*
★阴、阳离子通过静电作用而形成的化学键叫做离子键。
由阴、阳离子通过离子键形成的化合物叫做离子化合物。如Na Cl 、KOH、 Na2 S、MgCl2 、 NH4Cl、 CaO等
3.化学键与物质构成
Na Cl 晶体结构模型
*
研修班
*
共 价 键
定义:原子间通过共用电子所形成的化学键叫做共价键。
成键微粒:
成键本质:
成键元素:
形成条件:
成键结果:
共价化合物:
键的种类:
共用电子对
同种或不同种非金属元素
注意:含有共价键的化合物不一定是共价
化合物,如NaOH、Na2SO4 、 NH4Cl等
非极性键及极性键
非金属元素原子间相互作用
形成共价化合物或单质
原子
只含有共价键的化合物
*
研修班
*
小 结
化学键
离子键
阴阳离子通过静电作用
共价键
通过共用电子对
化学变化的实质
旧键断裂,新键生成
共价化合物
只含有共价键
离子化合物
含有离子键
*
研修班
*
【说明】
1.离子化合物含有离子键,也可能同时含共价键;
2.共价化合物只含有共价键;
3.酸类物质均属于共价化合物,强碱均属于离子 化合物,大多数盐类物质属于离子化合物(但AlCl3、FeCl3等例外,它们属于共价化合物)。
离子化合物——含有离子键的化合物;
共价化合物——只含有共价键的化合物。
*
研修班
*
共 价 键
离 子 键
成键微粒
原 子
阴、阳离子
微 粒
间的作用
成键元素范围
化合物的类型
原子间通过共用电子对相互作用
阴、阳离子间静电作用
同种或不同种的非金属元素
活泼金属(ⅠA、ⅡA)元素与 活泼非金属(ⅥA、ⅦA)元素
离子化合物,如
NaCl 、Na2 S、MgCl2 、
NaOH、 Na2SO4
或离子化合物如 NaOH、 NH4Cl
共价化合物如HCl、CO2
*
研修班
*
1.下列物质中含有离子键的是
A.H2O B CaCl2 C. HCl D. Cl2
2、下列各组化合物中化学键类型不同的是
1. NaCl和KF 2. H2O和NH3 3. CaF2和CsCl 4. CCl4和Na2O
*
研修班
*
3. 下列叙述正确的是
A.两个非金属原子间不可能形成离子键
B.非金属原子间不可能形成离子化合物
C.离子化合物中可能有共价键
D.共价化合物中可能有离子键
(AC)
4. 下列说法正确的是
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的物质一定是共价化合物
D. 只有非金属原子间才能形成共价键
(B)
*
研修班
*
5.判断下列化合物是离子化合物 还是共价化合物
离子化合物
共价化合物
CaCl2
SO2
H2O
FeO
NaOH
NH3
CuSO4
HCl
*
研修班
*
7、与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是
A.Na2S B.CCl4
C.KCl D.KF
AD
6、下列化合物中,既含有离子键又含有极性键的是( )
A.NaOH B.NH4Cl
C.CH4 D.HNO3
A、B
*
研修班
*
第3课时:化学键与化学反应中的能量变化
【复习提问】
1.木炭在氧气中燃烧除了发生物质变化之外,还有什么变化?为什么?
2.水在通电条件下发生的分解反应生成氢气和氧气是释放能量还是吸收能量?
3.请你推测:氢气在氧气中燃烧是生成水蒸气时 是释放能量还是吸收能量?
【导课】本节课,我们将围绕这些问题,从 微观和宏观的角度来揭示这些秘密。
*
研修班
*
信息:
破坏1molH2共价键
H2 2H
吸收436kJ能量 形成1molH2O的共价
H20
0.5molO2共价键断裂 键要释放930KJ能量
0.5O2 O
需吸收249KJ能量
问题:根据上述信息判断H2燃烧生成水蒸气时是释放能量还是吸收能量?
*
研修班
*
【分析】
化学键是原子或离子之间的强烈的相互作用,形成时会放出一定的能量,破坏它时需要吸收一定的能量。由上面信息可知,1molH2的共价键断裂吸收能量436KJ,0.5molO2的共价键断裂吸收能量249KJ,两项共吸收能量685KJ。2molH与1molO形成1molH2O的共价键释放能量930KJ。
在1molH2与0.5molO2生1molH2O的过程中,放出的能量比吸收的能量多245KJ。
即H2燃烧生成水蒸气时是释放能量。
*
研修班
*
实验一、NaOH与盐酸反应
量取NaOH溶液与盐酸各5ml,分别盛在2支试管里,用温度计测量NaOH溶液与盐酸的温度,并做记录。将盐酸倒入NaOH溶液中,振荡试管,立即用温度计测量溶液的温度,并与原来NaOH溶液、盐酸的温度对比。
利用下列实验来感受化学反应中的 能量变化
*
研修班
*
实验二、锌粉与盐酸反应
取一小勺锌粉放入试管中,将温度计插入试管,再量取5ml盐酸倒入试管,观察温度计液柱的变化。
*
研修班
*
实验三、Ba(OH)2 · 8H2O晶体与NH4Cl晶体的反应
在玻璃片上加少量的水,将一个小烧杯放在玻璃片上。称取Ba(OH)2.8H2O晶体18g、NH4Cl晶体6g都倒入烧杯中。用玻璃棒将Ba(OH)2.8H2O晶体与NH4Cl晶体搅拌使之混合均匀。约3min~5min后,用手小心地提起烧杯,看烧杯与玻璃片是否黏在一起。
*
研修班
*
实验总结
实验内容 实验现象 实验结论
NaOH与盐酸反应
锌与HCl反应
Ba(OH)2晶体与NH4Cl固体反应
混合液的
温度升高
中和反应是放热的
混合液的温度升高
该反应是放热反应
烧杯温度降低使烧杯和玻璃片冻结
该反应是吸热反应
*
研修班
*
【实验结论】
每一个化学反应都伴随有能量的改变,有的对外释放能量,有的从外界吸收能量。
如果形成新的化学键所释放的能量大于破坏旧化学键所吸收的能量,该反应是放热的;
如果形成新化学键所释放的能量小于破坏旧化学键所吸收的能量,该反应是吸热的。
*
研修班
*
——化学反应的过程中伴随着能量变化,通常表现为热量的变化
概括·整合
常见放热反应:酸碱中和反应;燃烧反应;
活 泼金属跟水或酸的反应;
一般的化合反应
(C与CO2 反 应等除外)。
常见吸热反应:铵盐与碱 的反应;
一般的分解反应。
*
研修班
*
吸收能量E1
旧化学键断裂
反应物 生成物
新的化学键形成
释放能量E2
E1 > E2 反应吸收能量
E1 < E2 反应释放能量
*
研修班
*
1、下列反应中,属于吸热反应的是( )
A.实验室制H2的反应 B.实验室制CO2的反应
C.水的分解反应 D.石灰石分解的反应
2、下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
3.金刚石和石墨都是碳的单质,石墨在一定条件下可以转 化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
A.金刚石与石墨互为同位素
B.石墨不如金刚石稳定
C.金刚石不如石墨稳定
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多
练一练
C、D
C
C
课后作业P38.(3.4)
第1节 化学键与化学反应
【本节知识框架】
物质变化的实质
化学键
化学键的含义
化学键的类型
认识物质的构成
认识化学反应
化学键与物质构成
能量变化的实质
化学键
化学键的含义
化学键的类型
认识物质的构成
认识化学反应
化学键与物质构成
能量变化的实质
*
研修班
*
化学反应的应用
制备新物质
利用
物质
变化
提供能源
利用
能量
变化
*
研修班
*
*
研修班
*
第1课时:化学键与化学反应中的物质变化
1.化学键与物质变化
化学反应的实质是:
原子的重新组合。
想一想?
1.化学反应中为什么会发生物质变化?化学反应中的最小微粒是什么?
2. 以电解水为例,说说水电解时为什么要消耗能量?水分子是如何分解生成氢气与氧气的?
3.为什么碳与氧气反应需要先加热?
4. 初中化学中曾经讨论过的化学反应的实质是什么?
2H2O===2H2 + O2
通电
*
研修班
*
H2O
H2O
H2
H2
O2
H2O
H2O
H2
O2
通 电
★这种相邻原子间的强相互作用称为化学键
*
研修班
*
H2O
H2O
H2
O2
通 电
旧的化学键断裂(氢氧键H-O),
新的化学键生成(氢氢键H-H、氧氧键O-O)
化学反应的实质:
1.化学反应是原子的重新组合;
2.从化学健的角度看,化学反应是旧化学键的断裂和新化学键的形成。
2H2O===2H2 + O2
通 电
通 电
通 电
通 电
通 电
通 电
通 电
通 电
通 电
通过学习你对化学反应的实质有哪些新的认识?
想一想?
*
研修班
*
氢氢键、氧氧键
氢氧键
氢氢键、氯氯键
氢氯键
氮氮键、氢氢键
氮氢键
*
2.化学键的类型
Cl2气体分子
H2 气体分子
共价键的形成(以氢气在氯气中燃烧为例)
分开后,她们为什么不高兴?让我们听听她们说些什么?
*
研修班
*
我只有一个电子,太少了
我也少一个电子
e
H 原子
Cl 原子
+1
1
+17
7
8
2
*
研修班
*
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有.行吗?
e
好
呵
谢
谢
好
呵
谢
谢
+1
1
+17
8
2
7
*
研修班
*
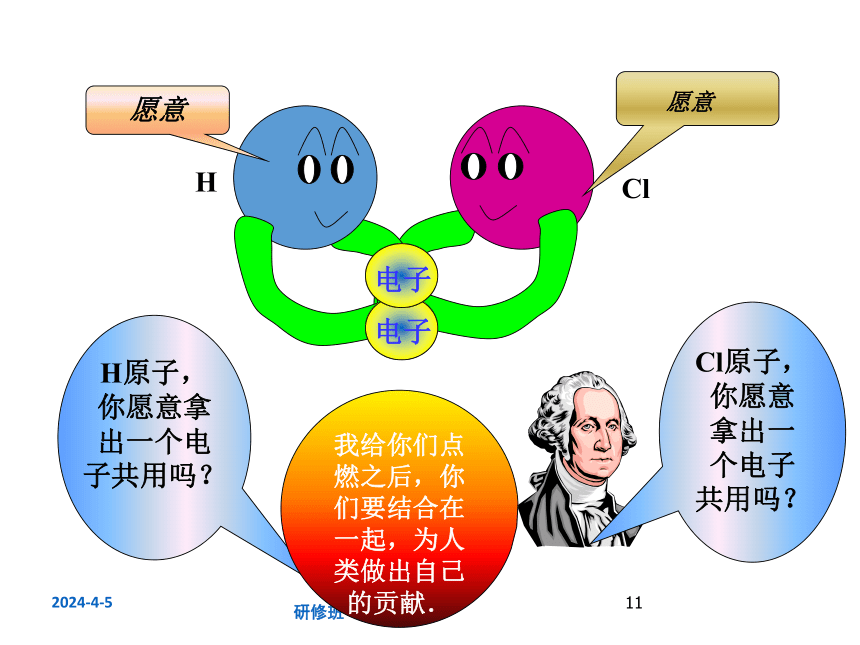
愿意
电子
电子
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.
愿意
H
Cl
*
研修班
*
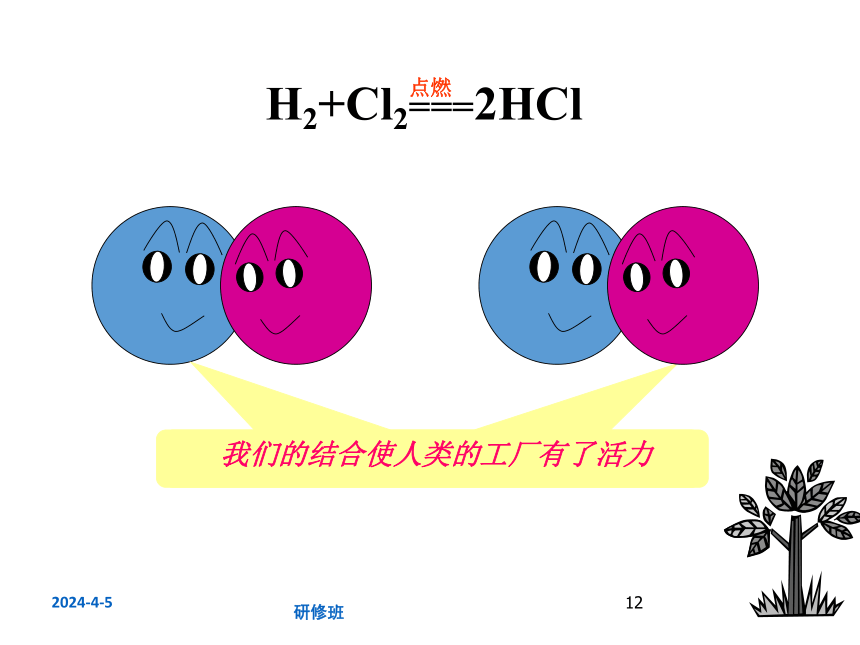
我们的接合使人类的生活多了一点味道
我们的结合使人类的工厂有了活力
H2+Cl2===2HCl
点燃
*
研修班
*
分析氯化氢的形成过程
★原子之间通过共用电子对的相互作用所形成的化学键,叫做共价键。
通过共用电子对
H2+Cl2===2HCl
点燃
2
2
2
★共价键形成条件:
一般是非金属元素原子间的相互作用。
非金属元素可以是同种,也可以是不同种;如:H2、Cl2、HCl、CO2 等分子中均含有共价键。
*
研修班
*
★氢分子的形成:
H ·
★氯化氢分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
原子间通过共用电子对所形成的化学键,叫做共价键。(形成过程可用电子式表示如下)
共用电子对不偏移,成键原子不显电性
共用电子对偏向氯原子,
非极性共价键:
极性共价键:
H﹣H(结构式)
H﹣Cl(结构式)
氯原子带部份负电荷,氢原子带份正电荷部。
知识拓展
*
研修班
*
键的极性特点
非极性键:电子对不偏向任何原子,成键两原子不出现正负两极。
电子对不偏移
极性键:电子对偏向得电子能力强的原子,使成键的两原子电荷分布不均匀,一个带部分正电荷,为正极,另一个带部分负电荷,为负极
电子对偏向Cl
Cl
··
··
H
··
··
H H
··
*
研修班
*
原子结构示意图 通过什么途径达到稳定结构 用离子结构示意图表示
Na
Cl
+11
8
1
2
+17
8
7
2
得到一个电子
氯化钠的形成
失去一个电子
(2Na+ Cl2== 2NaCl )
点燃
*
研修班
*
氯化钠的形成过程
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
失 e-
得 e-
静电作用
Na+
Cl-
★阴、阳离子通过静电作用而形成的化学键叫做离子键。
成键原因:
微粒由不稳定结构通过得失电子后变成稳定结构。
*
研修班
*
4.哪些元素的原子之间可能形成离子键(成键条件) ?
1.离子键的形成原因是什么?
3.离子键的成键本质是什么
2.形成离子键的微粒是什么?
答: 是因为参与化学反应的成键原子的结构不稳定,易得、失电子形成阴、阳离子。
答:是阴、阳离子。
答:阴、阳离子的静电作用(静电引力和斥力)。
答:活泼金属元素与活泼非金属元素之间容易形成。
第ⅠA族、
第ⅡA族的金属
卤素(VⅡA)及O、S等
如Na2 S、MgCl2 、 KI、 CaO等
*
研修班
*
共 价 键
离 子 键
成键微粒
原 子
阴、阳离子
微 粒
间的作用
成键元素范围
成键原因
原子间通过共用电子对相互作用
阴、阳离子间静电作用
同种或不同种的非金属元素
活泼金属(ⅠA、ⅡA)元素与 活泼非金属(ⅥA、ⅦA)元素
微粒由不稳定结构通过得失电子后变成稳定结构。
微粒由不稳定结构通过共用电子对相互作用后变成稳定结构。
作业布置:P38.1、2、5
*
研修班
*
第2课时:化学键与物质构成
复习提问?
1.通过上节课的学习你是怎么理解“化学键”的?水气化变成水蒸气及金刚石变成石墨是否破坏化学键?
2.化学键的有哪些主要类型?
●化学键定义:相邻原子间强烈的相互作用
离子键
共价键
金属键(以后再学)
●化学键分类
O
H
H
表示共价键
没有化学键
●化学反应的实质——
旧化学键断裂和新化学键形成的过程
*
研修班
*
●下面给出的都是你熟悉的物质请你利用所学知识分析它们的构成情况。
物质 形成化学键的微粒 化学键的类型
水
氨气
二氧化碳
氧化钙
氯化钾
氢气
H、O
共价键(极性)
N、H
共价键(极性)
C、O
共价键(极性)
Ca2+ 、O2-
K+ 、 Cl-
离子键
离子键
H
共价键(非极性)
*
研修班
*
★阴、阳离子通过静电作用而形成的化学键叫做离子键。
由阴、阳离子通过离子键形成的化合物叫做离子化合物。如Na Cl 、KOH、 Na2 S、MgCl2 、 NH4Cl、 CaO等
3.化学键与物质构成
Na Cl 晶体结构模型
*
研修班
*
共 价 键
定义:原子间通过共用电子所形成的化学键叫做共价键。
成键微粒:
成键本质:
成键元素:
形成条件:
成键结果:
共价化合物:
键的种类:
共用电子对
同种或不同种非金属元素
注意:含有共价键的化合物不一定是共价
化合物,如NaOH、Na2SO4 、 NH4Cl等
非极性键及极性键
非金属元素原子间相互作用
形成共价化合物或单质
原子
只含有共价键的化合物
*
研修班
*
小 结
化学键
离子键
阴阳离子通过静电作用
共价键
通过共用电子对
化学变化的实质
旧键断裂,新键生成
共价化合物
只含有共价键
离子化合物
含有离子键
*
研修班
*
【说明】
1.离子化合物含有离子键,也可能同时含共价键;
2.共价化合物只含有共价键;
3.酸类物质均属于共价化合物,强碱均属于离子 化合物,大多数盐类物质属于离子化合物(但AlCl3、FeCl3等例外,它们属于共价化合物)。
离子化合物——含有离子键的化合物;
共价化合物——只含有共价键的化合物。
*
研修班
*
共 价 键
离 子 键
成键微粒
原 子
阴、阳离子
微 粒
间的作用
成键元素范围
化合物的类型
原子间通过共用电子对相互作用
阴、阳离子间静电作用
同种或不同种的非金属元素
活泼金属(ⅠA、ⅡA)元素与 活泼非金属(ⅥA、ⅦA)元素
离子化合物,如
NaCl 、Na2 S、MgCl2 、
NaOH、 Na2SO4
或离子化合物如 NaOH、 NH4Cl
共价化合物如HCl、CO2
*
研修班
*
1.下列物质中含有离子键的是
A.H2O B CaCl2 C. HCl D. Cl2
2、下列各组化合物中化学键类型不同的是
1. NaCl和KF 2. H2O和NH3 3. CaF2和CsCl 4. CCl4和Na2O
*
研修班
*
3. 下列叙述正确的是
A.两个非金属原子间不可能形成离子键
B.非金属原子间不可能形成离子化合物
C.离子化合物中可能有共价键
D.共价化合物中可能有离子键
(AC)
4. 下列说法正确的是
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的物质一定是共价化合物
D. 只有非金属原子间才能形成共价键
(B)
*
研修班
*
5.判断下列化合物是离子化合物 还是共价化合物
离子化合物
共价化合物
CaCl2
SO2
H2O
FeO
NaOH
NH3
CuSO4
HCl
*
研修班
*
7、与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是
A.Na2S B.CCl4
C.KCl D.KF
AD
6、下列化合物中,既含有离子键又含有极性键的是( )
A.NaOH B.NH4Cl
C.CH4 D.HNO3
A、B
*
研修班
*
第3课时:化学键与化学反应中的能量变化
【复习提问】
1.木炭在氧气中燃烧除了发生物质变化之外,还有什么变化?为什么?
2.水在通电条件下发生的分解反应生成氢气和氧气是释放能量还是吸收能量?
3.请你推测:氢气在氧气中燃烧是生成水蒸气时 是释放能量还是吸收能量?
【导课】本节课,我们将围绕这些问题,从 微观和宏观的角度来揭示这些秘密。
*
研修班
*
信息:
破坏1molH2共价键
H2 2H
吸收436kJ能量 形成1molH2O的共价
H20
0.5molO2共价键断裂 键要释放930KJ能量
0.5O2 O
需吸收249KJ能量
问题:根据上述信息判断H2燃烧生成水蒸气时是释放能量还是吸收能量?
*
研修班
*
【分析】
化学键是原子或离子之间的强烈的相互作用,形成时会放出一定的能量,破坏它时需要吸收一定的能量。由上面信息可知,1molH2的共价键断裂吸收能量436KJ,0.5molO2的共价键断裂吸收能量249KJ,两项共吸收能量685KJ。2molH与1molO形成1molH2O的共价键释放能量930KJ。
在1molH2与0.5molO2生1molH2O的过程中,放出的能量比吸收的能量多245KJ。
即H2燃烧生成水蒸气时是释放能量。
*
研修班
*
实验一、NaOH与盐酸反应
量取NaOH溶液与盐酸各5ml,分别盛在2支试管里,用温度计测量NaOH溶液与盐酸的温度,并做记录。将盐酸倒入NaOH溶液中,振荡试管,立即用温度计测量溶液的温度,并与原来NaOH溶液、盐酸的温度对比。
利用下列实验来感受化学反应中的 能量变化
*
研修班
*
实验二、锌粉与盐酸反应
取一小勺锌粉放入试管中,将温度计插入试管,再量取5ml盐酸倒入试管,观察温度计液柱的变化。
*
研修班
*
实验三、Ba(OH)2 · 8H2O晶体与NH4Cl晶体的反应
在玻璃片上加少量的水,将一个小烧杯放在玻璃片上。称取Ba(OH)2.8H2O晶体18g、NH4Cl晶体6g都倒入烧杯中。用玻璃棒将Ba(OH)2.8H2O晶体与NH4Cl晶体搅拌使之混合均匀。约3min~5min后,用手小心地提起烧杯,看烧杯与玻璃片是否黏在一起。
*
研修班
*
实验总结
实验内容 实验现象 实验结论
NaOH与盐酸反应
锌与HCl反应
Ba(OH)2晶体与NH4Cl固体反应
混合液的
温度升高
中和反应是放热的
混合液的温度升高
该反应是放热反应
烧杯温度降低使烧杯和玻璃片冻结
该反应是吸热反应
*
研修班
*
【实验结论】
每一个化学反应都伴随有能量的改变,有的对外释放能量,有的从外界吸收能量。
如果形成新的化学键所释放的能量大于破坏旧化学键所吸收的能量,该反应是放热的;
如果形成新化学键所释放的能量小于破坏旧化学键所吸收的能量,该反应是吸热的。
*
研修班
*
——化学反应的过程中伴随着能量变化,通常表现为热量的变化
概括·整合
常见放热反应:酸碱中和反应;燃烧反应;
活 泼金属跟水或酸的反应;
一般的化合反应
(C与CO2 反 应等除外)。
常见吸热反应:铵盐与碱 的反应;
一般的分解反应。
*
研修班
*
吸收能量E1
旧化学键断裂
反应物 生成物
新的化学键形成
释放能量E2
E1 > E2 反应吸收能量
E1 < E2 反应释放能量
*
研修班
*
1、下列反应中,属于吸热反应的是( )
A.实验室制H2的反应 B.实验室制CO2的反应
C.水的分解反应 D.石灰石分解的反应
2、下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
3.金刚石和石墨都是碳的单质,石墨在一定条件下可以转 化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
A.金刚石与石墨互为同位素
B.石墨不如金刚石稳定
C.金刚石不如石墨稳定
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多
练一练
C、D
C
C
课后作业P38.(3.4)
