2.2.1 能量变化(教学课件)(共25张PPT)-2022-2023学年高一化学鲁科版(2019)必修二
文档属性
| 名称 | 2.2.1 能量变化(教学课件)(共25张PPT)-2022-2023学年高一化学鲁科版(2019)必修二 |  | |
| 格式 | ppt | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-24 09:49:34 | ||
图片预览







文档简介
(共25张PPT)
第2节 化学反应与能量变化
第1课时 化学反应中的能量变化
变化观念:通过生产、生活、实验中的实例,了解化学能与热能的相互转化,建立吸热反应、放热反应的概念, 从能量变化的视角发展对化学反应的认识。建立体系与环境的概念。
宏观辨识与微观探析:能从宏观和微观两个角度分析化学变化中的能量吸收和释放的原因,基于键能认识化学反应中能量变化的实质。
科学探究与创新意识:能设计实验方案探究物质和能量的转化
4. 科学态度与社会责任:关注与化学有关的社会热点问题,认识提高燃料的燃烧效率、开发高能清洁燃料的重要性,增强节约能源及环境保护等意识,逐步形成可持续发展的思想。
能从物质与能量的角度评价燃料的使用价值。
本节课目标素养:
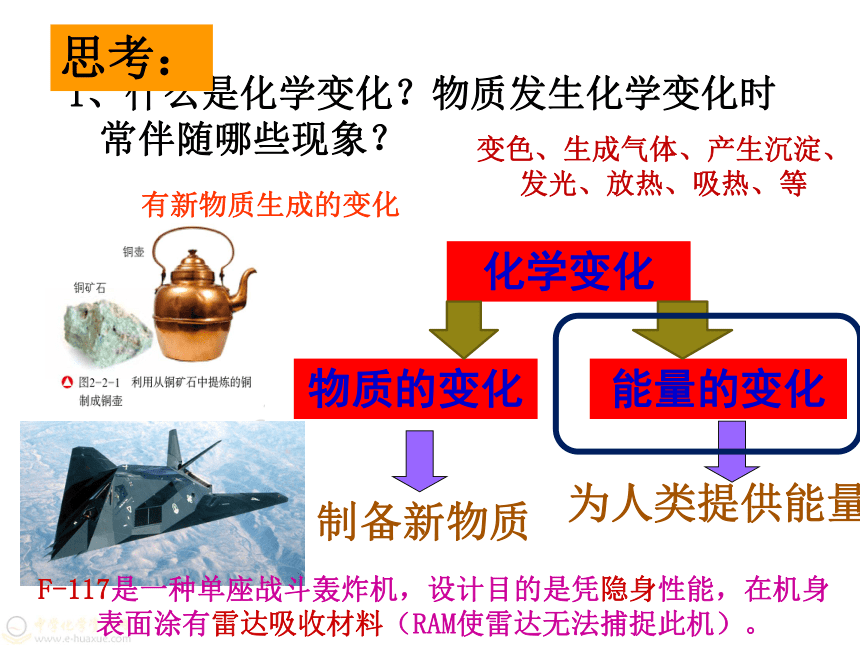
1、什么是化学变化?物质发生化学变化时常伴随哪些现象?
思考:
有新物质生成的变化
变色、生成气体、产生沉淀、发光、放热、吸热、等
为人类提供能量
能量的变化
制备新物质
物质的变化
化学变化
F-117是一种单座战斗轰炸机,设计目的是凭隐身性能,在机身表面涂有雷达吸收材料(RAM使雷达无法捕捉此机)。
一、认识化学反应的两个视角
物质变化、能量变化
化学反应中能量变化
联想·质疑
在以下两个你熟悉的化学反应中,除了物质的变化外是否还有能量的变化?如果有,是什么样的能量变化?
化学能转化为热能和光能
电能转化为化学能
化学能是指储存在物质当中的能量。不同的物质不仅组成不同、结构不同,所包含的化学能也不同。
如何理解化学能?
是否所有反应都有能量变化?能量变化的本质是什么?
二.能量变化的本质
活动探究:
感受化学反应中的 能量变化
1. 依据给出的实验用品,判断反应过程中能量变化的方法是什么?
2.依据给出的实验药品大家能设计几组实验?
实验内容 预计的实验现象 化学方程式及结论
用温度计测量反应混合物的温度
温度升---放热
温度降---吸热
选定反应进行实验,
实验用品
锌粉,铁粉,碳酸氢钠,稀盐酸,柠檬酸,蒸馏水;
试管,烧杯,温度计,胶头滴管,药匙。
化学能
热能
实验操作 实验现象 有关化学方程式及结论
感受化学反应中的 能量变化
Zn粉溶解
有气泡产生
溶液温度升高
Fe粉溶解
有气泡产生
溶液温度升高
有气泡产生
溶液温度降低
Zn+2HCl===ZnCl2+H2↑,
反应释放能量
Fe+2HCl===FeCl2+H2↑,
反应释放能量
反应吸收能量
H3A
+3NaHCO3===Na3A +3CO2 +3H2O
H3A>H2CO3
将实验内容填写课本47页表格
1. 概念
吸热反应:
放热反应:
2.常见的吸热反应、放热反应有哪些?
结论:化学反应伴随着能量变化,有的反应释放能量,有的反应吸收能量
吸收热量的化学反应
释放热量的化学反应
吸热反应:碳酸氢钠与柠檬酸的反应、
大部分分解反应如:碳酸钙受热分解、
C单质的反应如:CO2+C 2CO
放热反应:
金属与水或酸的反应、燃烧、酸碱中和反应、
大部分化合反应、
缓慢氧化反应等。
阅读课本47页最后一段并加以补充
思考?学过的实验从那些现象感受热量的变化?
Na与水
Fe与S
P的变化
是否所有反应都有能量变化?能量变化的本质是什么?
3.能量变化的本质
问题2:根据上述信息判断H2燃烧生成水蒸气时是释放能量还是吸收能量?
信息:
问题1:从化学键的角度看,化学反应的实质是什么?
反应物的化学键断裂 、 生成物的化学键形成
(吸热)
(放热)
685KJ
<
放热
1molH20.5molO2
1molH2O
能量
反应过程
断键吸热E1
结论:
E1放热反应
问题3:从化学键的角度分析化学反应中能量变化的实质
成键放热
E2
2molH、1molO
反应物总能量
生成物总能量
实质:如果破坏旧化学键吸收的能量小于形成新化学键释放的能量,就会有一定的能量以热能、电能或光能等形式释放出来;
3.能量变化的本质
从化学键的角度解释吸热反应的实质,仿照放热反应画出图示
反应物
生成物
小结:
反应实质
能量变化实质
放热反应
练习:1.从宏观能量角度画出吸热反应中的图示
2.总结宏观能量角度判断放热吸热反应的方法
反应物的总能量高于生成物总能量---放热反应
反应物的总能量低于生成物总能量---吸热反应
化学能(物质内部的能量)
其他能(热能、光能、电能)
小结
判断:
释放
储存
化学反应都有能量变化吗? 为什么?
实质(化学键):化学反应的实质是旧键断裂和新键形成,断键吸热,成键放热,两者不同则表现出反应放出或吸收能量。
物质能量角度:化学反应过程中有新物质生成,新物质与原物质具有不同的能量,
反应物的总能量>生成物的总能量 -------放出能量
反应物的总能量<生成物的总能量----------吸收能量
问题解决:
结论:化学反应都有能量变化
化学能
热能
光能
电能
机械能
三、化学反应中能量转化的形式
阅读课本49页最后一段内容总结能量转化的形式
人们常常利用化学反应将化学能转化为热能、电能等其他形式的能量,用于生产、生活和科研。 铝热反应----------焊接钢轨 铝--空气海洋电池-供电
化学能转化为热能、光能
化学反应的实质:
反应物的化学键断裂同时生成物化学键的形成
解释
小
结
为人类提供能量
能量的变化
制备新物质
物质的变化
化学变化
一、认识化学反应的两个视角
放热
反应
吸热
反应
常见的吸热反应、放热反应
吸热反应:碳酸氢钠与柠檬酸的反应、大部分分解反应如:碳酸钙受热分解、C单质的反应如:CO2+C 2CO
放热反应:金属与水或酸的反应、燃烧、酸碱中和反应、大部分化合反应、铝热反应、缓慢氧化反应等。
与条件无关
二、能量变化的本质
微观:
宏观
物质具有一定的能量
化学反应的实质:旧件断裂同时新键形成
体系
环境
环境
体系
三、能量转化形式
化学能
其他能
【典例1】 已知H2(g)+O2(g) = H2O(g)反应过程中能量变化如图所示,问:a、b、c分别代表什么意义?该反应是放热反应还是吸热反应?
a代表旧键断裂吸收的能量
b代表新键形成释放的能量
c代表反应放出的热量
1.判断正误(正确的打“√”,错误的打“×”)
(1)化学反应的旧键断裂的过程是放出能量的过程( )
(2)对于一个化学反应来说,当化学键断裂时的能量大于化学键形成时的能量时,反应放热。 ( )
(3)所有的燃烧均放出热量。 ( )
(4)化合反应均是放热反应,分解反应均是吸热反应( )
×
×
×
√
与条件无关
燃烧
二氧化硫与氧气
√
如碳和二氧化碳的反应是吸热反应,
√
【典例1】 已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.反应物X和Y的总能量一定小于生成物M和N的总能量
反应物总能量低于生成物的总能量
放热吸热与条件无关
第2节 化学反应与能量变化
第1课时 化学反应中的能量变化
变化观念:通过生产、生活、实验中的实例,了解化学能与热能的相互转化,建立吸热反应、放热反应的概念, 从能量变化的视角发展对化学反应的认识。建立体系与环境的概念。
宏观辨识与微观探析:能从宏观和微观两个角度分析化学变化中的能量吸收和释放的原因,基于键能认识化学反应中能量变化的实质。
科学探究与创新意识:能设计实验方案探究物质和能量的转化
4. 科学态度与社会责任:关注与化学有关的社会热点问题,认识提高燃料的燃烧效率、开发高能清洁燃料的重要性,增强节约能源及环境保护等意识,逐步形成可持续发展的思想。
能从物质与能量的角度评价燃料的使用价值。
本节课目标素养:
1、什么是化学变化?物质发生化学变化时常伴随哪些现象?
思考:
有新物质生成的变化
变色、生成气体、产生沉淀、发光、放热、吸热、等
为人类提供能量
能量的变化
制备新物质
物质的变化
化学变化
F-117是一种单座战斗轰炸机,设计目的是凭隐身性能,在机身表面涂有雷达吸收材料(RAM使雷达无法捕捉此机)。
一、认识化学反应的两个视角
物质变化、能量变化
化学反应中能量变化
联想·质疑
在以下两个你熟悉的化学反应中,除了物质的变化外是否还有能量的变化?如果有,是什么样的能量变化?
化学能转化为热能和光能
电能转化为化学能
化学能是指储存在物质当中的能量。不同的物质不仅组成不同、结构不同,所包含的化学能也不同。
如何理解化学能?
是否所有反应都有能量变化?能量变化的本质是什么?
二.能量变化的本质
活动探究:
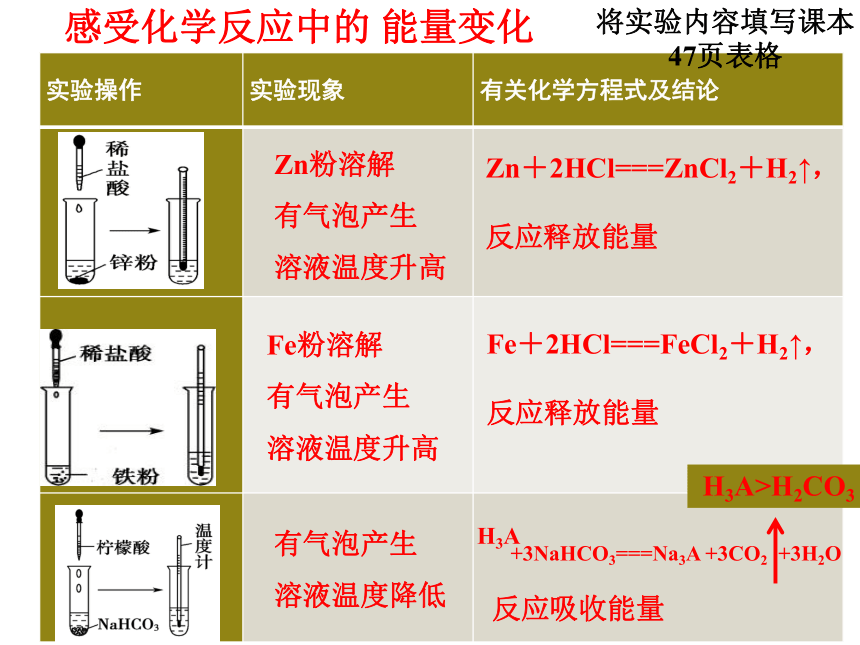
感受化学反应中的 能量变化
1. 依据给出的实验用品,判断反应过程中能量变化的方法是什么?
2.依据给出的实验药品大家能设计几组实验?
实验内容 预计的实验现象 化学方程式及结论
用温度计测量反应混合物的温度
温度升---放热
温度降---吸热
选定反应进行实验,
实验用品
锌粉,铁粉,碳酸氢钠,稀盐酸,柠檬酸,蒸馏水;
试管,烧杯,温度计,胶头滴管,药匙。
化学能
热能
实验操作 实验现象 有关化学方程式及结论
感受化学反应中的 能量变化
Zn粉溶解
有气泡产生
溶液温度升高
Fe粉溶解
有气泡产生
溶液温度升高
有气泡产生
溶液温度降低
Zn+2HCl===ZnCl2+H2↑,
反应释放能量
Fe+2HCl===FeCl2+H2↑,
反应释放能量
反应吸收能量
H3A
+3NaHCO3===Na3A +3CO2 +3H2O
H3A>H2CO3
将实验内容填写课本47页表格
1. 概念
吸热反应:
放热反应:
2.常见的吸热反应、放热反应有哪些?
结论:化学反应伴随着能量变化,有的反应释放能量,有的反应吸收能量
吸收热量的化学反应
释放热量的化学反应
吸热反应:碳酸氢钠与柠檬酸的反应、
大部分分解反应如:碳酸钙受热分解、
C单质的反应如:CO2+C 2CO
放热反应:
金属与水或酸的反应、燃烧、酸碱中和反应、
大部分化合反应、
缓慢氧化反应等。
阅读课本47页最后一段并加以补充
思考?学过的实验从那些现象感受热量的变化?
Na与水
Fe与S
P的变化
是否所有反应都有能量变化?能量变化的本质是什么?
3.能量变化的本质
问题2:根据上述信息判断H2燃烧生成水蒸气时是释放能量还是吸收能量?
信息:
问题1:从化学键的角度看,化学反应的实质是什么?
反应物的化学键断裂 、 生成物的化学键形成
(吸热)
(放热)
685KJ
<
放热
1molH20.5molO2
1molH2O
能量
反应过程
断键吸热E1
结论:
E1
问题3:从化学键的角度分析化学反应中能量变化的实质
成键放热
E2
2molH、1molO
反应物总能量
生成物总能量
实质:如果破坏旧化学键吸收的能量小于形成新化学键释放的能量,就会有一定的能量以热能、电能或光能等形式释放出来;
3.能量变化的本质
从化学键的角度解释吸热反应的实质,仿照放热反应画出图示
反应物
生成物
小结:
反应实质
能量变化实质
放热反应
练习:1.从宏观能量角度画出吸热反应中的图示
2.总结宏观能量角度判断放热吸热反应的方法
反应物的总能量高于生成物总能量---放热反应
反应物的总能量低于生成物总能量---吸热反应
化学能(物质内部的能量)
其他能(热能、光能、电能)
小结
判断:
释放
储存
化学反应都有能量变化吗? 为什么?
实质(化学键):化学反应的实质是旧键断裂和新键形成,断键吸热,成键放热,两者不同则表现出反应放出或吸收能量。
物质能量角度:化学反应过程中有新物质生成,新物质与原物质具有不同的能量,
反应物的总能量>生成物的总能量 -------放出能量
反应物的总能量<生成物的总能量----------吸收能量
问题解决:
结论:化学反应都有能量变化
化学能
热能
光能
电能
机械能
三、化学反应中能量转化的形式
阅读课本49页最后一段内容总结能量转化的形式
人们常常利用化学反应将化学能转化为热能、电能等其他形式的能量,用于生产、生活和科研。 铝热反应----------焊接钢轨 铝--空气海洋电池-供电
化学能转化为热能、光能
化学反应的实质:
反应物的化学键断裂同时生成物化学键的形成
解释
小
结
为人类提供能量
能量的变化
制备新物质
物质的变化
化学变化
一、认识化学反应的两个视角
放热
反应
吸热
反应
常见的吸热反应、放热反应
吸热反应:碳酸氢钠与柠檬酸的反应、大部分分解反应如:碳酸钙受热分解、C单质的反应如:CO2+C 2CO
放热反应:金属与水或酸的反应、燃烧、酸碱中和反应、大部分化合反应、铝热反应、缓慢氧化反应等。
与条件无关
二、能量变化的本质
微观:
宏观
物质具有一定的能量
化学反应的实质:旧件断裂同时新键形成
体系
环境
环境
体系
三、能量转化形式
化学能
其他能
【典例1】 已知H2(g)+O2(g) = H2O(g)反应过程中能量变化如图所示,问:a、b、c分别代表什么意义?该反应是放热反应还是吸热反应?
a代表旧键断裂吸收的能量
b代表新键形成释放的能量
c代表反应放出的热量
1.判断正误(正确的打“√”,错误的打“×”)
(1)化学反应的旧键断裂的过程是放出能量的过程( )
(2)对于一个化学反应来说,当化学键断裂时的能量大于化学键形成时的能量时,反应放热。 ( )
(3)所有的燃烧均放出热量。 ( )
(4)化合反应均是放热反应,分解反应均是吸热反应( )
×
×
×
√
与条件无关
燃烧
二氧化硫与氧气
√
如碳和二氧化碳的反应是吸热反应,
√
【典例1】 已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.反应物X和Y的总能量一定小于生成物M和N的总能量
反应物总能量低于生成物的总能量
放热吸热与条件无关
