铵盐 课件(共61张PPT) 高中化学人教版(2019)必修第二册
文档属性
| 名称 | 铵盐 课件(共61张PPT) 高中化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-24 20:38:36 | ||
图片预览











文档简介
(共61张PPT)
一个人知道自己为什么而活,就可以忍受任何一种生活。
尼采
化学与生活
铵盐与氨实验室制法
学
习
目
标
01
02
03
物理性质
化学性质
氨实验室制备
颜色
水溶性
状态
不稳定性
与碱反应
与盐反应
NH4+检验
原料
原理
装置
尾气处理
干法、湿法
铵盐长什么样子?
01
NH4Cl NH4NO3 (NH4)2SO4 (NH4)2CO3 NH4HCO3
概念与物理性质
1
概念
1
铵根离子(NH4+)
和酸根离子构成的化合物
“摇摇冰”是一种即用即冷的饮料.吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷!
A.硝酸铵 B.烧碱 C.食盐 D.生石灰
生活中的化学
概念与物理性质
1
概念
1
铵根离子(NH4+)
2
物理性质
无色或白色固体,都溶于水
和酸根离子构成的化合物
为何有时你所吃的油条有氨味?
02
氨的化学性质
氯化铵在金属焊接中起到除去金属表面氧化物的作用
你知道吗?
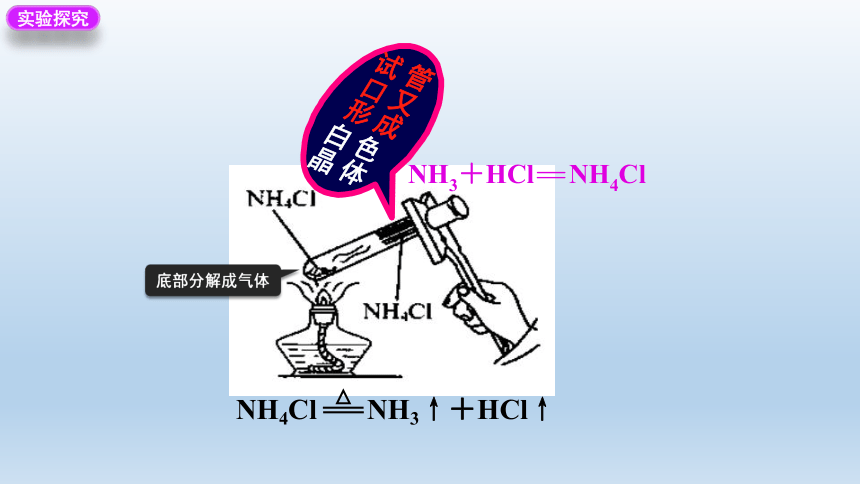
实验探究
底部分解成气体
NH4Cl NH3↑+HCl↑
HCl与金属氧化物发生复分解反应,将金属氧化物转变为金属氯化物。
问题探究
如焊接铁件时,在焊接温度下,发生反应:
Fe2O3+6HCl=2FeCl3+3H2O,生成的FeCl3可以挥发掉。
化学性质
2
受热分解
1
铵盐
NH3
+
相应的酸
酸性氧化物+H2O
铵盐
NH3
+
有一位农民在仓库里存放了一袋氮肥——碳酸氢铵(俗称碳铵),有一天他发现这袋化肥包装破损受潮了,就把它拿出去晒,结果发现没有人偷盗却少了很多。
化学与生活
NH4HCO3 NH3↑+CO2↑+H2O
顾客在永和大王北京的门店买到了一种特殊的油条—“氨味油条”。你有没有吃过呢?
本应是香喷喷的油条为何飘出氨气味?
化学与生活
化学趣史
化学趣史
N2O
铵盐分解都生成NH3吗?
有一种忠于职责的勇敢精神,凡是他制备的气体,都要亲自“嗅几下”,以了解它对人的生理作用。当戴维吸了几口这种气体后,他不由自主地大声发笑,还在实验室里大跳其舞,好久才安顿下来。这种气体于是被称为“笑气”,它就是N2O。
硝酸铵受撞击发生爆炸
化学趣史
NH4NO3 N2O↑+2H2O
NH4NO3=O2↑+N2↑+H2O
盐可和哪类物质反应?
除金属外,铵盐可与其他三类物质发生反应。
知识回顾
请写出下列反应的离子方程式。
1. 氯铵与硝酸银溶液
2. 硫铵与氯化钡溶液
看谁做得既准又快
化学性质
2
受热分解
1
2
与盐反应
生成沉淀
铵盐
NH3
+
相应的酸
请写出下列反应的离子方程式。
1. 碳铵与硝酸溶液
2. 亚硫酸铵与硫酸溶液
看谁做得既准又快
化学性质
2
受热分解
1
2
与盐反应
生成沉淀
铵盐
NH3
+
相应的酸
3
与酸反应
生成气体
化学家赫尔斯通过实验发现:
把氯化铵与熟石灰混合加热,会有氨臭味,请写出反应的化学方程式。
问题解决
化学性质
2
受热分解
1
2
与盐反应
生成沉淀
铵盐
NH3
+
相应的酸
3
4
与酸反应
生成气体
与碱反应
本质:
铵根与氢氧根之间的反应
请写出下列反应的离子方程式。
1. 氯铵与氢氧化钠稀溶液混合
3. 碳铵与过量氢氧化钠溶液加热
2. 硫铵与氢氧化钠溶液加热
考考你自己
NH4++OH-=NH3·H2O
NH4++OH- NH3↑+H2O
NH4++HCO3-+2OH- NH3↑+CO32- +2H2O
以下两种物质都可与哪种物质都能发生反应?
如何检验NH4Cl、(NH4)2SO4中的阳离子NH4+ ?
思考﹒ 运用
实验探究
化学性质
2
受热分解
1
2
与盐反应
生成沉淀
铵盐
NH3
+
相应的酸
3
4
与酸反应
生成气体
与碱反应
本质:
铵根与氢氧根之间的反应
应用:
检验NH4+
铵根离子的检验
原理
NH4++OH- NH3↑+H2O
答题模板
取少许溶液于试管,加入浓NaOH溶液,加热,试管口放湿润的红色石蕊试纸
操作
现象
若红色石蕊试纸变蓝色
结论
则溶液中含有NH4+
关键
必须加热
草木灰的主要成分是碳酸钾(K2CO3)
生活中的化学
草木灰呈碱性,与氮肥接触易造成氮素挥发损失
化学性质
2
受热分解
1
2
与盐反应
生成沉淀
铵盐
NH3
+
相应的酸
3
4
与酸反应
生成气体
与碱反应
本质:
铵根与氢氧根之间的反应
应用:
NH4+的检验
避免含NH4+的氮肥与碱性肥料混合使用
实验室制氨气
氨气的实验室制备
03
干法 湿法
3.1 制备
氨实验室制备
3
干法
1
2
3
原料
原理
发生装置
NH4Cl Ca(OH)2
实验室制备气
?
防止空气对流,快速收集满一试管氨气
3.1 制备
氨实验室制备
3
湿法
1
2
3
原料
原理
发生装置
浓氨水
3.1 制备
氨实验室制备
3
湿法
1
2
3
原料
原理
发生装置
浓氨水、NaOH固体
NaOH溶于水,放出大量热!
3.1 制备
氨实验室制备
3
湿法
1
2
3
原料
原理
发生装置
浓氨水、CaO固体
NH3·H2O+CaO=NH3↑+Ca(OH)2
3.2 干燥
氨干燥与收集
3
碱石灰或生石灰
化学家赫尔斯通过实验发现:把氯化铵与熟石灰混合在曲颈甑中加热,会有氨臭味,当把导管插入水中,则看到水会吸入曲颈甑中。
时间又过了约半个世纪英国化学家普里斯特利,在收集氨时,采用了他常用的高招——排汞集气法,终于被收在了瓶子里。
化学趣史
3.3 收集
氨实验室制备
3
向下排空气法
氨气也可以这样收集
3.4 检验
氨实验室制备
3
湿润的红色石蕊试纸靠近试管口
玻璃棒蘸取浓盐酸靠近试管口
以上装置,能否制备氨气?
用上述装置,氯化铵换成什么铵盐,可以制得氨气?
考考你的智慧
NH4HCO3 NH3↑+CO2↑+H2O
铵盐用途
4
大量的铵盐作氮肥
硝酸铵作炸药
氯化铵作制干电池原料,作焊药(除金属表面的氧化物薄膜)
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
NH4+检验
干法制NH3
铵盐的化学性质
课堂小结
无水CaCl2不能干燥NH3 !
氨气的实验室制备
实验室制取少量干燥的氨气涉及下列装置,其中正确的是
A.①是氨气发生装置
B.②是氨气吸收装置
C.③是氨气发生装置
D.④是氨气收集、检验装置
看谁做得既准又快
如何干燥?
尾气如何处理?
氨气的实验室制备
漏斗容积大,少量水倒吸后,与液面脱离接触,防倒吸。
×
防倒吸示意图
隔离式
导气管未瑞不插入液体中,导气管与液体呈隔离状态
防倒装置
肚容式
是在接近液面处放一个具有蓄液能力的仪器,如漏斗、球形干燥管,且让其接触液面。
防倒装置
分液式
是导气管品浸入下层与气体不反应的液体中
×
防倒装置
蓄液式
当发生倒吸时,倒吸而来的液体衩预先设置的蓄液装置贮存,从而使受热的仪器得到保护。
防倒装置
温差大的装置系统一般设置此装置
能用NH4++OH-=NH3↑+H2O表示的化学反应为(均为溶液中反应)
A.NH4HCO3与NaOH
B.NH4Br与NaOH
C.(NH4)2SO4与Ba(OH)2
D .NH4HSO4与KOH
成功体验
已知硫酸铵在一定条件下分解生成氨气、氮气、二氧化硫和水。求氧化产物与还原产物的物质的量之比为多少?
N
N2
-3
0
-6 e-
+6
+4
+2 e-
看谁做得既准又快
=
x∶y=1∶3
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中ClO-的物质的量随时间变化的曲线如图所示。下列判断正确的是
A.该反应的还原剂是Cl-
B.反应后溶液的酸性明显增强
C.消耗1 mol还原剂,转移6 mol电子
D.氧化剂与还原剂的物质的量之比为2∶3
挑战自我
感谢聆听
一个人知道自己为什么而活,就可以忍受任何一种生活。
尼采
化学与生活
铵盐与氨实验室制法
学
习
目
标
01
02
03
物理性质
化学性质
氨实验室制备
颜色
水溶性
状态
不稳定性
与碱反应
与盐反应
NH4+检验
原料
原理
装置
尾气处理
干法、湿法
铵盐长什么样子?
01
NH4Cl NH4NO3 (NH4)2SO4 (NH4)2CO3 NH4HCO3
概念与物理性质
1
概念
1
铵根离子(NH4+)
和酸根离子构成的化合物
“摇摇冰”是一种即用即冷的饮料.吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷!
A.硝酸铵 B.烧碱 C.食盐 D.生石灰
生活中的化学
概念与物理性质
1
概念
1
铵根离子(NH4+)
2
物理性质
无色或白色固体,都溶于水
和酸根离子构成的化合物
为何有时你所吃的油条有氨味?
02
氨的化学性质
氯化铵在金属焊接中起到除去金属表面氧化物的作用
你知道吗?
实验探究
底部分解成气体
NH4Cl NH3↑+HCl↑
HCl与金属氧化物发生复分解反应,将金属氧化物转变为金属氯化物。
问题探究
如焊接铁件时,在焊接温度下,发生反应:
Fe2O3+6HCl=2FeCl3+3H2O,生成的FeCl3可以挥发掉。
化学性质
2
受热分解
1
铵盐
NH3
+
相应的酸
酸性氧化物+H2O
铵盐
NH3
+
有一位农民在仓库里存放了一袋氮肥——碳酸氢铵(俗称碳铵),有一天他发现这袋化肥包装破损受潮了,就把它拿出去晒,结果发现没有人偷盗却少了很多。
化学与生活
NH4HCO3 NH3↑+CO2↑+H2O
顾客在永和大王北京的门店买到了一种特殊的油条—“氨味油条”。你有没有吃过呢?
本应是香喷喷的油条为何飘出氨气味?
化学与生活
化学趣史
化学趣史
N2O
铵盐分解都生成NH3吗?
有一种忠于职责的勇敢精神,凡是他制备的气体,都要亲自“嗅几下”,以了解它对人的生理作用。当戴维吸了几口这种气体后,他不由自主地大声发笑,还在实验室里大跳其舞,好久才安顿下来。这种气体于是被称为“笑气”,它就是N2O。
硝酸铵受撞击发生爆炸
化学趣史
NH4NO3 N2O↑+2H2O
NH4NO3=O2↑+N2↑+H2O
盐可和哪类物质反应?
除金属外,铵盐可与其他三类物质发生反应。
知识回顾
请写出下列反应的离子方程式。
1. 氯铵与硝酸银溶液
2. 硫铵与氯化钡溶液
看谁做得既准又快
化学性质
2
受热分解
1
2
与盐反应
生成沉淀
铵盐
NH3
+
相应的酸
请写出下列反应的离子方程式。
1. 碳铵与硝酸溶液
2. 亚硫酸铵与硫酸溶液
看谁做得既准又快
化学性质
2
受热分解
1
2
与盐反应
生成沉淀
铵盐
NH3
+
相应的酸
3
与酸反应
生成气体
化学家赫尔斯通过实验发现:
把氯化铵与熟石灰混合加热,会有氨臭味,请写出反应的化学方程式。
问题解决
化学性质
2
受热分解
1
2
与盐反应
生成沉淀
铵盐
NH3
+
相应的酸
3
4
与酸反应
生成气体
与碱反应
本质:
铵根与氢氧根之间的反应
请写出下列反应的离子方程式。
1. 氯铵与氢氧化钠稀溶液混合
3. 碳铵与过量氢氧化钠溶液加热
2. 硫铵与氢氧化钠溶液加热
考考你自己
NH4++OH-=NH3·H2O
NH4++OH- NH3↑+H2O
NH4++HCO3-+2OH- NH3↑+CO32- +2H2O
以下两种物质都可与哪种物质都能发生反应?
如何检验NH4Cl、(NH4)2SO4中的阳离子NH4+ ?
思考﹒ 运用
实验探究
化学性质
2
受热分解
1
2
与盐反应
生成沉淀
铵盐
NH3
+
相应的酸
3
4
与酸反应
生成气体
与碱反应
本质:
铵根与氢氧根之间的反应
应用:
检验NH4+
铵根离子的检验
原理
NH4++OH- NH3↑+H2O
答题模板
取少许溶液于试管,加入浓NaOH溶液,加热,试管口放湿润的红色石蕊试纸
操作
现象
若红色石蕊试纸变蓝色
结论
则溶液中含有NH4+
关键
必须加热
草木灰的主要成分是碳酸钾(K2CO3)
生活中的化学
草木灰呈碱性,与氮肥接触易造成氮素挥发损失
化学性质
2
受热分解
1
2
与盐反应
生成沉淀
铵盐
NH3
+
相应的酸
3
4
与酸反应
生成气体
与碱反应
本质:
铵根与氢氧根之间的反应
应用:
NH4+的检验
避免含NH4+的氮肥与碱性肥料混合使用
实验室制氨气
氨气的实验室制备
03
干法 湿法
3.1 制备
氨实验室制备
3
干法
1
2
3
原料
原理
发生装置
NH4Cl Ca(OH)2
实验室制备气
?
防止空气对流,快速收集满一试管氨气
3.1 制备
氨实验室制备
3
湿法
1
2
3
原料
原理
发生装置
浓氨水
3.1 制备
氨实验室制备
3
湿法
1
2
3
原料
原理
发生装置
浓氨水、NaOH固体
NaOH溶于水,放出大量热!
3.1 制备
氨实验室制备
3
湿法
1
2
3
原料
原理
发生装置
浓氨水、CaO固体
NH3·H2O+CaO=NH3↑+Ca(OH)2
3.2 干燥
氨干燥与收集
3
碱石灰或生石灰
化学家赫尔斯通过实验发现:把氯化铵与熟石灰混合在曲颈甑中加热,会有氨臭味,当把导管插入水中,则看到水会吸入曲颈甑中。
时间又过了约半个世纪英国化学家普里斯特利,在收集氨时,采用了他常用的高招——排汞集气法,终于被收在了瓶子里。
化学趣史
3.3 收集
氨实验室制备
3
向下排空气法
氨气也可以这样收集
3.4 检验
氨实验室制备
3
湿润的红色石蕊试纸靠近试管口
玻璃棒蘸取浓盐酸靠近试管口
以上装置,能否制备氨气?
用上述装置,氯化铵换成什么铵盐,可以制得氨气?
考考你的智慧
NH4HCO3 NH3↑+CO2↑+H2O
铵盐用途
4
大量的铵盐作氮肥
硝酸铵作炸药
氯化铵作制干电池原料,作焊药(除金属表面的氧化物薄膜)
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
NH4+检验
干法制NH3
铵盐的化学性质
课堂小结
无水CaCl2不能干燥NH3 !
氨气的实验室制备
实验室制取少量干燥的氨气涉及下列装置,其中正确的是
A.①是氨气发生装置
B.②是氨气吸收装置
C.③是氨气发生装置
D.④是氨气收集、检验装置
看谁做得既准又快
如何干燥?
尾气如何处理?
氨气的实验室制备
漏斗容积大,少量水倒吸后,与液面脱离接触,防倒吸。
×
防倒吸示意图
隔离式
导气管未瑞不插入液体中,导气管与液体呈隔离状态
防倒装置
肚容式
是在接近液面处放一个具有蓄液能力的仪器,如漏斗、球形干燥管,且让其接触液面。
防倒装置
分液式
是导气管品浸入下层与气体不反应的液体中
×
防倒装置
蓄液式
当发生倒吸时,倒吸而来的液体衩预先设置的蓄液装置贮存,从而使受热的仪器得到保护。
防倒装置
温差大的装置系统一般设置此装置
能用NH4++OH-=NH3↑+H2O表示的化学反应为(均为溶液中反应)
A.NH4HCO3与NaOH
B.NH4Br与NaOH
C.(NH4)2SO4与Ba(OH)2
D .NH4HSO4与KOH
成功体验
已知硫酸铵在一定条件下分解生成氨气、氮气、二氧化硫和水。求氧化产物与还原产物的物质的量之比为多少?
N
N2
-3
0
-6 e-
+6
+4
+2 e-
看谁做得既准又快
=
x∶y=1∶3
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中ClO-的物质的量随时间变化的曲线如图所示。下列判断正确的是
A.该反应的还原剂是Cl-
B.反应后溶液的酸性明显增强
C.消耗1 mol还原剂,转移6 mol电子
D.氧化剂与还原剂的物质的量之比为2∶3
挑战自我
感谢聆听
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
