人教版(2019)高中化学必修第二册《氨气的生产与性质》精品课件(共59张PPT)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册《氨气的生产与性质》精品课件(共59张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-25 11:34:10 | ||
图片预览









文档简介
(共59张PPT)
人们常觉得准备的阶段是在浪费时间,只有当真正机会来临,而自己没有能力把握的时候,才能觉悟自己平时没有准备才是浪费了时间。
罗曼·罗兰
是制备制造炸药的重要战争物资,早期,它由硝石与硫酸反应制取。而硝石的贮量有限(产于智利)。
早在 1913 年之前,人们发现德国有发动世界大战的可能,便开始限制德国进口硝石。以为世界会太平无事了。
1914 年
人们错误认为德国的硝酸不足,火药生产受到限制,战争顶多只会打半年。
战争打了四年多,造成了极大的灾难,夺去了人们无数的生命财。
德国为什么能坚持这么久的战争呢?
是什么力量在支持着它呢?
历史故事
氨气的生产和性质
学习目标
①由实验及有关事实记住氨的物理性质。
②能书写工业制备氨的化学方程式。
③通过实验及氧化还原原理,理解氨的化学性质。
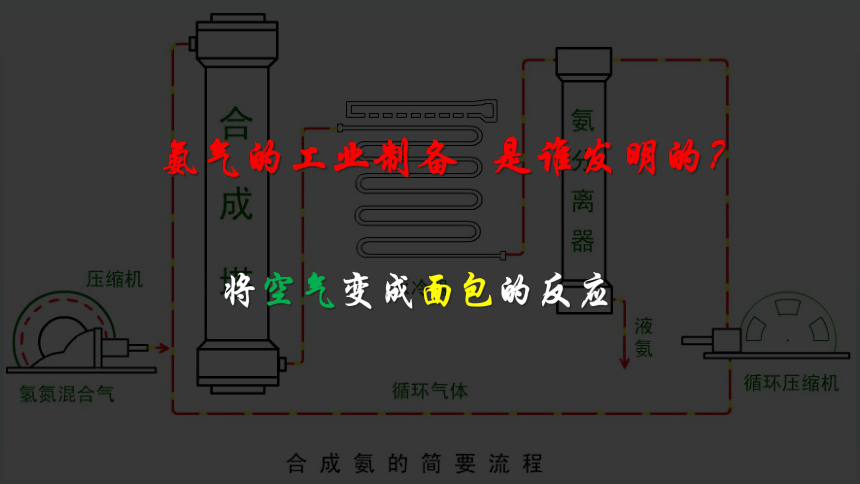
将空气变成面包的反应
氨气的工业制备 是谁发明的?
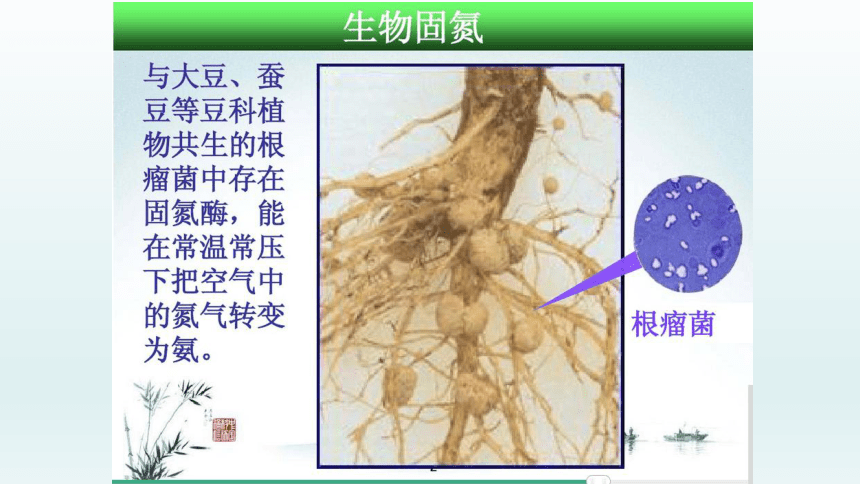
与大豆、蚕豆等豆科植物学共生的根瘤菌中存在固氮酶。
能在常温常压下,把空气中的氮气转变为氨。
生物固氮
根瘤菌
为了提高农作物的产量,科学家苦苦探索了几百年!
1908年7月首次合成氨。
1918年获得诺贝尔化学奖
1909年7月建成的实验装置
每小时生产90 g氨
氨工业制备
1
合成氨工厂
氨气长什么样子?
氨物理性质
2
NH3
颜色
状态
气味
水溶
无色
气体
刺激性
极易
700
如何设计实验可证明NH3极易溶于水?
是何原理?
苏州金鸡湖音乐喷泉
实验探究
氨物理性质
2
NH3
颜色
状态
气味
水溶
沸点
无色
气体
刺激性
极易
700
-33.35 ℃
易液化
液氨可作致冷剂,其原理是什么?
还有哪些物质易液化?
氯气(沸点-34. 6 ℃)
二氧化硫(沸点-10 ℃)
冷库
液氨泄漏有何现象?
泄漏处,白茫茫的一片
空气中弥漫着
一股浓烈的刺激性气味
进入厂区呼吸都感到困难,寒气逼人
消防队员是用何物质去吸收弥漫在大气中的NH3?
液氨泄漏的处理
实验探究
为何溶液显红色?
氨气的化学性质
●形成喷泉
NH3只是简单的溶解于水吗?
●形成红色喷泉
溶液显
感受﹒ 理解
氨的喷泉实验,喷泉是红色的,说明发生了化学反应。
氨水中含少量OH- ,呈弱碱性,故能使酚酞试液变红。
思考﹒ 讨论
NH3·H2O
NH3+H2O
大部分
NH3·H2O
少部分
3.1 与水反应
氨化学性质
3
NH3是唯一的碱性气体!
温馨提醒
难溶气体:N2(1∶0.02);H2(1∶0.02)
微溶气体:O2(1∶0.2)
可溶气体:Cl2(1∶2 )
易溶气体:SO2(1∶40)
极易溶气体:HCl(1∶500)
经常比较和归类,是学习化学的一种好方法。
NH3 1∶700
常见气体在常温常压下的溶解度
普利斯特利(英国)
根据收集到氨的性质,起名叫“碱性空气”。当时人们不刚刚研究空气,“空气”这个名词其实与我们今天说的“气体”更相近。
法国
后来,贝托雷又进一步确定了氨的组成,还为它取名为“挥发性碱”,使人们对氨的认识又有了一次飞跃。
化学趣史
实验探究
现象
结论
湿润的红色石蕊试纸变成蓝色
氨水易挥发,氨气的水溶液具有碱性
红色褪去
3.1 与水反应
氨化学性质
3
一水合氨不稳定
NH3是唯一的碱性气体!
浓溶液
NH3·H2O =NH3↑+ H2O
稀溶液
NH3·H2O NH3↑+ H2O
氨水与液氨比较
氨水 液氨
分类
微粒 分子
离子 ——
归纳与整理
NH3是碱性气体,可和什么物质反应?
问题探究
写出反应的化学方程式。
将浓盐酸铁为浓硫酸、浓硝酸是否也有此现象?
实验探究
3.2 与酸反应
氨化学性质
3
NH3+HCl=NH4Cl
白烟
(产生白烟,检验NH3)
NH3+HNO3=NH4NO3
白烟
与挥发性的酸反应有白烟
2NH3+H2SO4=(NH4)2SO4
无白烟
能否用浓硫酸干燥氨气?
将三个反应改写为离子方程式
1. 氨水作化肥有何缺点?
2. 用什么方法可解决这个问题?
问题解决
NH4Cl NH4NO3 (NH4)2SO4 (NH4)2CO3 NH4HCO3
常见铵盐
氮肥简介
铵态氮肥
其它氮肥
硝态氮肥 如:KNO3
有机态氮肥 如:CO(NH2)2
(俗称硫铵又称肥田粉)
(NH4)2SO4
NH4Cl
(俗称氯铵)
NH4HCO3
(俗称碳铵)
NH4NO3
(俗称硝铵)
NH3
N2
NO
-3
0
+2
NH3中N元素为-3价,只有还原性
可被氧化剂氧化
思考﹒ 讨论
从氧化还原反应看,NH3中的N元素具有什么性质?
NH3
-3
NH3在催化剂存在下,可被O2氧化生成NO气体,并将其工业化。
1909年奥斯特瓦尔德因对催化作用的研究获诺贝尔化学奖
回顾历史
一战中他的制取硝酸的专利被用于制造炸药
奥斯特瓦尔德
氨的催化氧化
3.2 与氧化剂反应
氨化学性质
3
1
O2
4NH3+5O2 4NO+6H2O
催化剂
4NH3+3O2 2N2+6H2O
点燃
瑞典ASES公司设计用于驱动潜艇的液氨—液氧燃料电池。
化学与生活
天津滨海发生爆炸 冷库液氨也危险
中国食品机械网
2015-08-14
思考﹒ 运用
德国为什么能坚持这么久的战争呢?是什么力量在支持着它呢?
NH3
NO
NO2
HNO3
NH4NO3
N2
H2
已知煤和水反应可生成H2和CO。
氯气有毒,一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3氧化成N2)。
若漏气则检验的现象是:___________。
并写出有关反应的化学方程式为___________________________________________。
由题给信息:Cl2可将NH3氧化成N2,可知Cl2被还原为HCl,HCl又与NH3反应生成NH4Cl小颗粒,而产生白烟。
看谁做得既准又快
3.2 与氧化剂反应
氨化学性质
3
1
O2
2
Cl2
4NH3+5O2 4NO+6H2O
催化剂
4NH3+3O2 2N2+6H2O
点燃
2NH3+3Cl2=N2+6HCl
(NH3不足)
(NH3过量)
2NH3+3Cl2=N2+6HCl
HCl+NH3=NH4Cl
6HCl+6NH3=6NH4Cl
8NH3+3Cl2=N2+6NH4Cl
还原性
碱性
3
NOx
已知NH3在加热条件下与氧化铜反应生成红色固体,同时生成一种无色气体,请写出此反应的方程式。
历史上科学家用此反应制N2
从氧化还原反应看,NH3具有还原性,是否具有氧化性?
-3
0
+2
NH3中H元素为+1价,可被还原剂还原
思考﹒ 讨论
NH3
N2
NO
+1
0
H2
工业上NaNH2用于制取靛青染料; LiNH2主要用于有机合成和药物制造,是具有良好前景的储氢材料。
请写出钠与液氨反应的方程式。
与钠和水反应相似
科学家在液氨中加入金属钠或金属锂制备NaNH2、LiNH2。
你学会了吗?
3.3 与还原剂反应
氨化学性质
3
氨的用途
致冷剂
铵盐
吸收硫酸生产中的二氧化硫
硝酸
消除
二氧化氮
的污染
纯碱
用稀氨水治疗
蚊虫叮咬
有机合成工业原料
NH3
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
氨气的性质和应用
NH3
易液化
液氨
致冷剂
碱性
酸
铵盐
化肥
CO2
NaCl
小苏打
还原性
O2
NO
N2
制硝酸
燃料电池
NOx
N2
尾气处理
Cl2
N2
检氯泄漏
F2
NF3
激光材料
Cl2
N2H4
火箭燃料
氧化性
NaNH2
药物
LiNH2
储氢材料
NH3和F2按物质的量之比4∶ 3完全反应,冒白烟,同时生成一种只含两种元素的气体M,则M的化学式是______。
挑战自我
N2H4可用作火箭燃料,它可由氨和次氯酸钠制备,同时生成一种钠盐和水,请写出制备的离子程式:
__________________________________________________________________
-3
-2
1
+1
-1
2
挑战自我
通过氨气的喷泉实验得到启发,我们该如何设计一个CO2的喷泉实验。
哪些气体和水、碱溶液能形成喷泉?
NaOH溶液与 SO2、CO2 、Cl2
水与HCl、NH3
问题探究
A干燥气体 B 液体
A NO2 水
B SO2 4 mol/L NaOH
C Cl2 饱和食盐水
D HCl 水
看我七十二变
下列组合能形成明显喷泉并充满烧瓶的是
喷泉的颜色能否改变?
你能设计出一个蓝色的喷泉实验来吗?
探究﹒ 拓展
在氨的喷泉实验中,烧瓶内溶液的物质的量浓度是多少?(假设实验是在标准状况下进行)
氨气体积设为V L
氨气物质的量为:V/22.4 mol
氨水溶液体积也是V L
氨水溶液物质的量浓度为
考考你的智慧
HCl、NO2作喷泉实验后溶液的物质的量浓度如何计算?(设为标准况)
看我七十二变
THANKS
for your time
人们常觉得准备的阶段是在浪费时间,只有当真正机会来临,而自己没有能力把握的时候,才能觉悟自己平时没有准备才是浪费了时间。
罗曼·罗兰
是制备制造炸药的重要战争物资,早期,它由硝石与硫酸反应制取。而硝石的贮量有限(产于智利)。
早在 1913 年之前,人们发现德国有发动世界大战的可能,便开始限制德国进口硝石。以为世界会太平无事了。
1914 年
人们错误认为德国的硝酸不足,火药生产受到限制,战争顶多只会打半年。
战争打了四年多,造成了极大的灾难,夺去了人们无数的生命财。
德国为什么能坚持这么久的战争呢?
是什么力量在支持着它呢?
历史故事
氨气的生产和性质
学习目标
①由实验及有关事实记住氨的物理性质。
②能书写工业制备氨的化学方程式。
③通过实验及氧化还原原理,理解氨的化学性质。
将空气变成面包的反应
氨气的工业制备 是谁发明的?
与大豆、蚕豆等豆科植物学共生的根瘤菌中存在固氮酶。
能在常温常压下,把空气中的氮气转变为氨。
生物固氮
根瘤菌
为了提高农作物的产量,科学家苦苦探索了几百年!
1908年7月首次合成氨。
1918年获得诺贝尔化学奖
1909年7月建成的实验装置
每小时生产90 g氨
氨工业制备
1
合成氨工厂
氨气长什么样子?
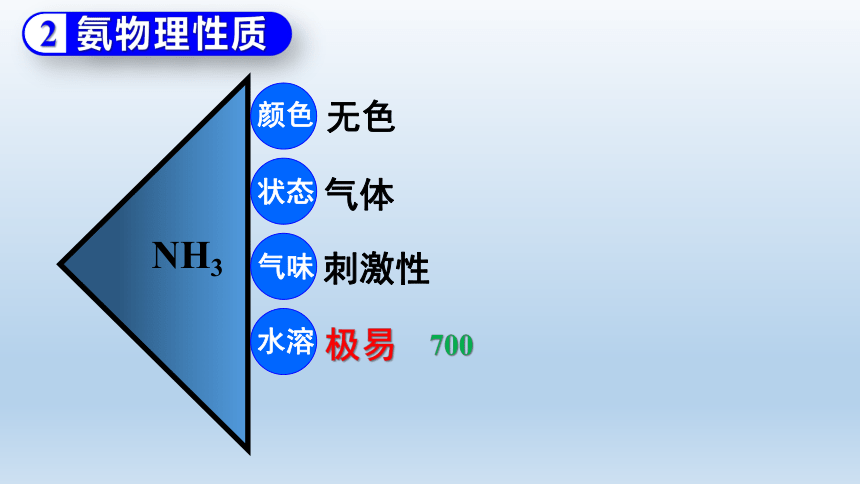
氨物理性质
2
NH3
颜色
状态
气味
水溶
无色
气体
刺激性
极易
700
如何设计实验可证明NH3极易溶于水?
是何原理?
苏州金鸡湖音乐喷泉
实验探究
氨物理性质
2
NH3
颜色
状态
气味
水溶
沸点
无色
气体
刺激性
极易
700
-33.35 ℃
易液化
液氨可作致冷剂,其原理是什么?
还有哪些物质易液化?
氯气(沸点-34. 6 ℃)
二氧化硫(沸点-10 ℃)
冷库
液氨泄漏有何现象?
泄漏处,白茫茫的一片
空气中弥漫着
一股浓烈的刺激性气味
进入厂区呼吸都感到困难,寒气逼人
消防队员是用何物质去吸收弥漫在大气中的NH3?
液氨泄漏的处理
实验探究
为何溶液显红色?
氨气的化学性质
●形成喷泉
NH3只是简单的溶解于水吗?
●形成红色喷泉
溶液显
感受﹒ 理解
氨的喷泉实验,喷泉是红色的,说明发生了化学反应。
氨水中含少量OH- ,呈弱碱性,故能使酚酞试液变红。
思考﹒ 讨论
NH3·H2O
NH3+H2O
大部分
NH3·H2O
少部分
3.1 与水反应
氨化学性质
3
NH3是唯一的碱性气体!
温馨提醒
难溶气体:N2(1∶0.02);H2(1∶0.02)
微溶气体:O2(1∶0.2)
可溶气体:Cl2(1∶2 )
易溶气体:SO2(1∶40)
极易溶气体:HCl(1∶500)
经常比较和归类,是学习化学的一种好方法。
NH3 1∶700
常见气体在常温常压下的溶解度
普利斯特利(英国)
根据收集到氨的性质,起名叫“碱性空气”。当时人们不刚刚研究空气,“空气”这个名词其实与我们今天说的“气体”更相近。
法国
后来,贝托雷又进一步确定了氨的组成,还为它取名为“挥发性碱”,使人们对氨的认识又有了一次飞跃。
化学趣史
实验探究
现象
结论
湿润的红色石蕊试纸变成蓝色
氨水易挥发,氨气的水溶液具有碱性
红色褪去
3.1 与水反应
氨化学性质
3
一水合氨不稳定
NH3是唯一的碱性气体!
浓溶液
NH3·H2O =NH3↑+ H2O
稀溶液
NH3·H2O NH3↑+ H2O
氨水与液氨比较
氨水 液氨
分类
微粒 分子
离子 ——
归纳与整理
NH3是碱性气体,可和什么物质反应?
问题探究
写出反应的化学方程式。
将浓盐酸铁为浓硫酸、浓硝酸是否也有此现象?
实验探究
3.2 与酸反应
氨化学性质
3
NH3+HCl=NH4Cl
白烟
(产生白烟,检验NH3)
NH3+HNO3=NH4NO3
白烟
与挥发性的酸反应有白烟
2NH3+H2SO4=(NH4)2SO4
无白烟
能否用浓硫酸干燥氨气?
将三个反应改写为离子方程式
1. 氨水作化肥有何缺点?
2. 用什么方法可解决这个问题?
问题解决
NH4Cl NH4NO3 (NH4)2SO4 (NH4)2CO3 NH4HCO3
常见铵盐
氮肥简介
铵态氮肥
其它氮肥
硝态氮肥 如:KNO3
有机态氮肥 如:CO(NH2)2
(俗称硫铵又称肥田粉)
(NH4)2SO4
NH4Cl
(俗称氯铵)
NH4HCO3
(俗称碳铵)
NH4NO3
(俗称硝铵)
NH3
N2
NO
-3
0
+2
NH3中N元素为-3价,只有还原性
可被氧化剂氧化
思考﹒ 讨论
从氧化还原反应看,NH3中的N元素具有什么性质?
NH3
-3
NH3在催化剂存在下,可被O2氧化生成NO气体,并将其工业化。
1909年奥斯特瓦尔德因对催化作用的研究获诺贝尔化学奖
回顾历史
一战中他的制取硝酸的专利被用于制造炸药
奥斯特瓦尔德
氨的催化氧化
3.2 与氧化剂反应
氨化学性质
3
1
O2
4NH3+5O2 4NO+6H2O
催化剂
4NH3+3O2 2N2+6H2O
点燃
瑞典ASES公司设计用于驱动潜艇的液氨—液氧燃料电池。
化学与生活
天津滨海发生爆炸 冷库液氨也危险
中国食品机械网
2015-08-14
思考﹒ 运用
德国为什么能坚持这么久的战争呢?是什么力量在支持着它呢?
NH3
NO
NO2
HNO3
NH4NO3
N2
H2
已知煤和水反应可生成H2和CO。
氯气有毒,一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3氧化成N2)。
若漏气则检验的现象是:___________。
并写出有关反应的化学方程式为___________________________________________。
由题给信息:Cl2可将NH3氧化成N2,可知Cl2被还原为HCl,HCl又与NH3反应生成NH4Cl小颗粒,而产生白烟。
看谁做得既准又快
3.2 与氧化剂反应
氨化学性质
3
1
O2
2
Cl2
4NH3+5O2 4NO+6H2O
催化剂
4NH3+3O2 2N2+6H2O
点燃
2NH3+3Cl2=N2+6HCl
(NH3不足)
(NH3过量)
2NH3+3Cl2=N2+6HCl
HCl+NH3=NH4Cl
6HCl+6NH3=6NH4Cl
8NH3+3Cl2=N2+6NH4Cl
还原性
碱性
3
NOx
已知NH3在加热条件下与氧化铜反应生成红色固体,同时生成一种无色气体,请写出此反应的方程式。
历史上科学家用此反应制N2
从氧化还原反应看,NH3具有还原性,是否具有氧化性?
-3
0
+2
NH3中H元素为+1价,可被还原剂还原
思考﹒ 讨论
NH3
N2
NO
+1
0
H2
工业上NaNH2用于制取靛青染料; LiNH2主要用于有机合成和药物制造,是具有良好前景的储氢材料。
请写出钠与液氨反应的方程式。
与钠和水反应相似
科学家在液氨中加入金属钠或金属锂制备NaNH2、LiNH2。
你学会了吗?
3.3 与还原剂反应
氨化学性质
3
氨的用途
致冷剂
铵盐
吸收硫酸生产中的二氧化硫
硝酸
消除
二氧化氮
的污染
纯碱
用稀氨水治疗
蚊虫叮咬
有机合成工业原料
NH3
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
氨气的性质和应用
NH3
易液化
液氨
致冷剂
碱性
酸
铵盐
化肥
CO2
NaCl
小苏打
还原性
O2
NO
N2
制硝酸
燃料电池
NOx
N2
尾气处理
Cl2
N2
检氯泄漏
F2
NF3
激光材料
Cl2
N2H4
火箭燃料
氧化性
NaNH2
药物
LiNH2
储氢材料
NH3和F2按物质的量之比4∶ 3完全反应,冒白烟,同时生成一种只含两种元素的气体M,则M的化学式是______。
挑战自我
N2H4可用作火箭燃料,它可由氨和次氯酸钠制备,同时生成一种钠盐和水,请写出制备的离子程式:
__________________________________________________________________
-3
-2
1
+1
-1
2
挑战自我
通过氨气的喷泉实验得到启发,我们该如何设计一个CO2的喷泉实验。
哪些气体和水、碱溶液能形成喷泉?
NaOH溶液与 SO2、CO2 、Cl2
水与HCl、NH3
问题探究
A干燥气体 B 液体
A NO2 水
B SO2 4 mol/L NaOH
C Cl2 饱和食盐水
D HCl 水
看我七十二变
下列组合能形成明显喷泉并充满烧瓶的是
喷泉的颜色能否改变?
你能设计出一个蓝色的喷泉实验来吗?
探究﹒ 拓展
在氨的喷泉实验中,烧瓶内溶液的物质的量浓度是多少?(假设实验是在标准状况下进行)
氨气体积设为V L
氨气物质的量为:V/22.4 mol
氨水溶液体积也是V L
氨水溶液物质的量浓度为
考考你的智慧
HCl、NO2作喷泉实验后溶液的物质的量浓度如何计算?(设为标准况)
看我七十二变
THANKS
for your time
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
