苏教版(2019)>选择性必修2 元素性质的递变规律(第2课时)(课件)(共27张PPT)
文档属性
| 名称 | 苏教版(2019)>选择性必修2 元素性质的递变规律(第2课时)(课件)(共27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-27 09:40:28 | ||
图片预览




文档简介
(共27张PPT)
2.2元素性质的递变规律
第二课时
金属性
原子失电子的能力
定性
电离能
定量
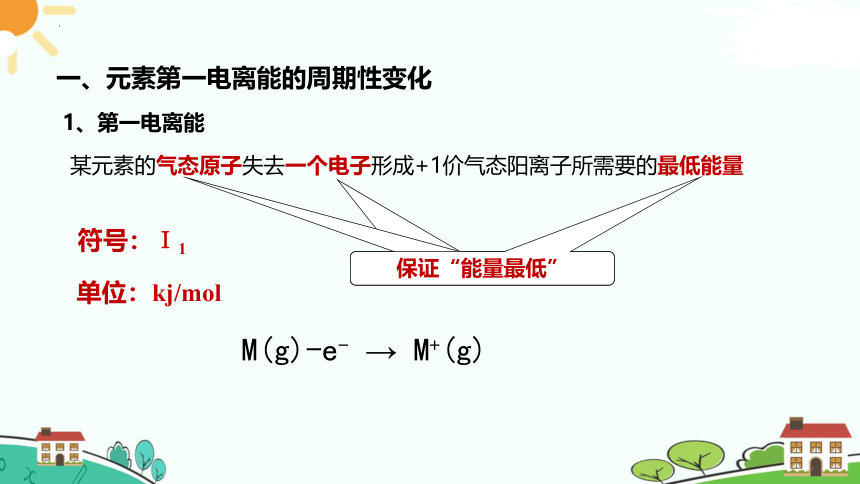
1、第一电离能
一、元素第一电离能的周期性变化
某元素的气态原子失去一个电子形成+1价气态阳离子所需要的最低能量
符号:I1
保证“能量最低”
单位:kj/mol
M(g)-e- → M+(g)
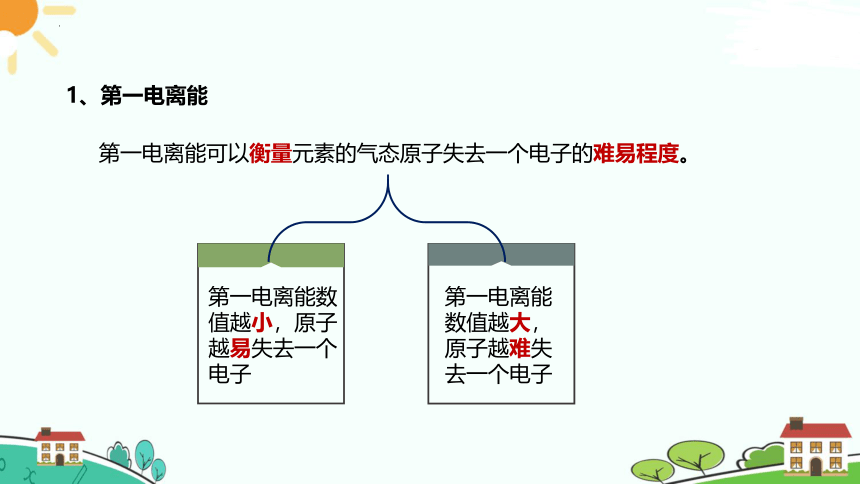
第一电离能可以衡量元素的气态原子失去一个电子的难易程度。
1、第一电离能
第一电离能数值越大,原子越难失去一个电子
第一电离能数值越小,原子越易失去一个电子
原子序数
第一电离能(kJ·mol-1)
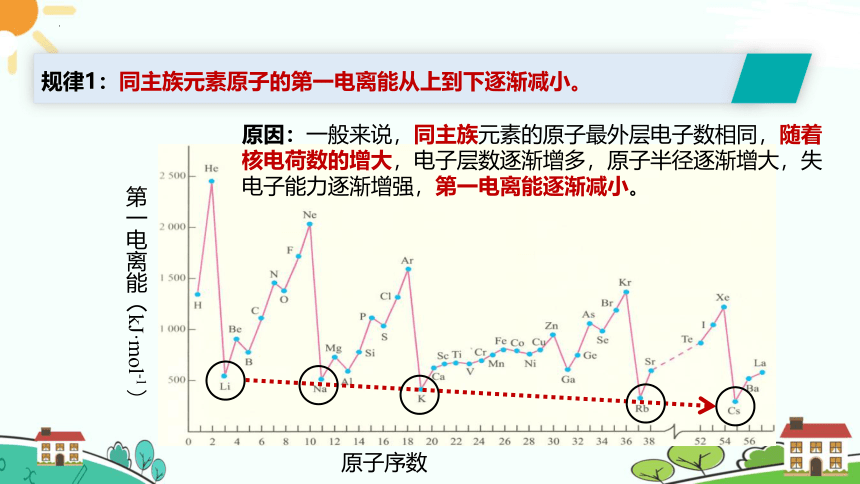
思考:随原子序数递增,同周期或者同族元素的第一电离能有什么规律?
原子序数
第一电离能(kJ·mol-1)
原因:一般来说,同主族元素的原子最外层电子数相同,随着核电荷数的增大,电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐增强,第一电离能逐渐减小。
规律1:同主族元素原子的第一电离能从上到下逐渐减小。
原子序数
第一电离能(kJ·mol-1)
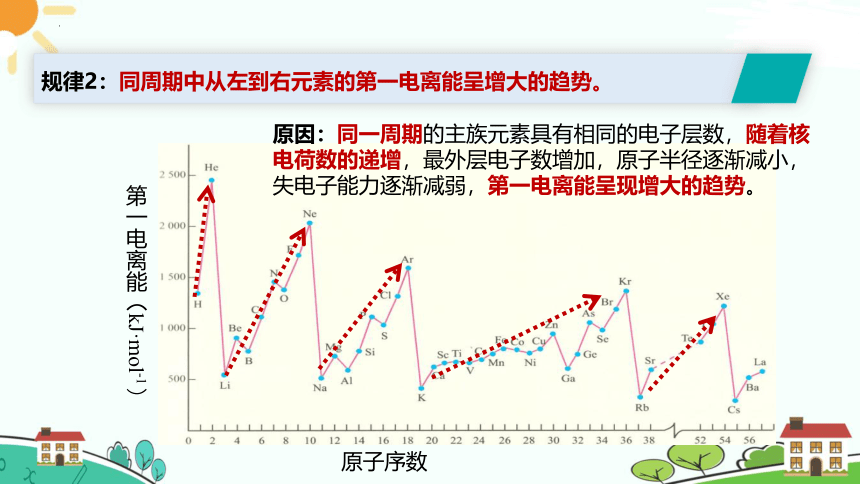
原因:同一周期的主族元素具有相同的电子层数,随着核电荷数的递增,最外层电子数增加,原子半径逐渐减小,失电子能力逐渐减弱,第一电离能呈现增大的趋势。
规律2:同周期中从左到右元素的第一电离能呈增大的趋势。
原子序数
第一电离能(kJ·mol-1)
规律3:同一周期中碱金属的第一电离能最小,稀有气体的第一电离能最大。
原子序数
第一电离能(kJ·mol-1)
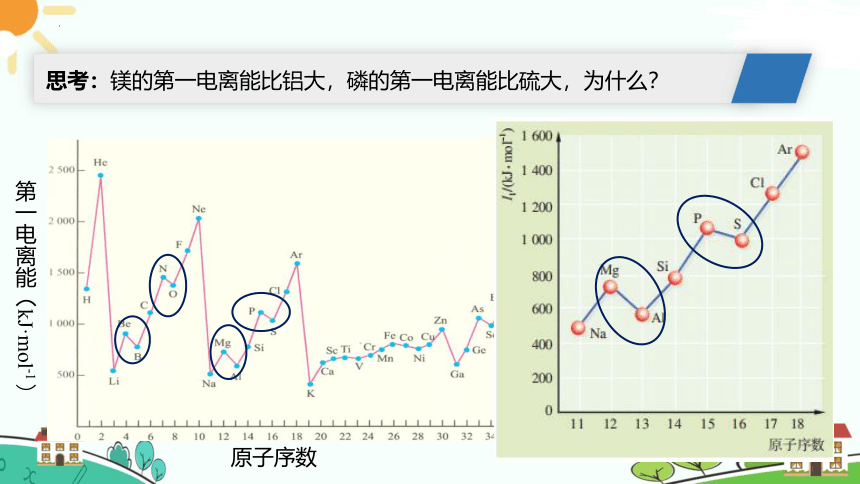
思考:镁的第一电离能比铝大,磷的第一电离能比硫大,为什么?
3s23p1
3s23p4
3s23p3
3s2
写出镁、铝、磷、硫的外围电子排布式
s轨道处于全充满状态
p轨道处于半充满状态
第一电离能的变化与元素原子的核外电子排布有关。
通常情况下,当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)和全满(p6、d10、f14)结构时,原子的能量较低,该元素具有较大的第一电离能。
第三周期元素第一电离能的大小关系为:I1(Ar)>I1(Cl)>I1(P)>I1(S)>I1(Si)>I1(Mg)>I1(Al)>I1(Na)。
规律4:第一电离能:第ⅡA族元素大于第ⅢA族元素,
第ⅤA族元素大于第ⅥA族元素
第ⅡA族元素的s轨道全满,最外层p轨道全空
第ⅤA族元素的最外层p轨道半满
M+(g)-e-→M2+(g)
第一电离能 I1
+1价气态离子失去1个电子,形成+2价气态离子所需要的最低能量
单位:kj/mol
M(g)-e- → M+(g)
第二电离能 I2
M2+(g)-e-→M3+(g)
第三电离能 I3
+2价气态离子失去1个电子,形成+3价气态离子所需要的最低能量
……
……
2、逐级电离能
变化规律:
①同一元素的逐级电离能是逐渐增大的,即I1< I2< I3<…
②当相邻逐级电离能突然变大时,说明失去的电子所在电子层发生了变化
钠、镁元素的第一、二、三电离能
3、电离能的应用
01
02
03
确定元素原子的核外电子排布
Li的逐级电离能I1 I2判断主族元素的最高正化合价或最外层电子数
如果电离能在In与In+1之间发生突变,则元素的原子易形成+n价离子而不易形成+(n+1)价离。如果是主族元素,则其最外层有n个电子,最高正化合价为+n(O、F除外)。
判断元素的金属性、非金属性强弱
I1越大,元素的非金属性越强(稀有气体元素除外);
I1越小,元素的金属性越强。
非金属性
原子得电子的能力
定性
电负性
定量
二、元素电负性的周期性变化
1、电负性
衡量元素在化合物中吸引电子的能力。
电负性越大的原子,对键合电子的吸引力越大。
H
F
H
.
.
.
.
F
.
.
+
.
.
.
.
F
.
.
H
.
.
键合电子
大小的标准:以氟的电负性为4.0作为相对标准
电负性是相对值,没单位。
主族元素的电负性
思考:随原子序数递增,元素的电负性同周期或者同族有什么规律?
规律1:
同一周期,主族元素的电负性从左到右逐渐增大,表明其吸引电子的能力逐渐增强。(稀有气体元素除外)
主族元素的电负性
规律2:同一主族,元素的电负性从上到下呈现减小趋势,表明其吸引电子的能力逐渐减弱。
电负性最大的是氟,最小的是铯。
2、电负性的应用
01
判断元素的金属性与非金属性的强弱
电负性 > 1.8 非金属元素
电负性 < 1.8 金属元素
电负性 ≈ 1.8 类金属元素
金属元素的电负性较小,非金属元素的电负性较大。
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱。
2、电负性的应用
02
判断化学键的类型
电负性的差值较大 离子键
Na
.
.
.
.
.
.
Cl
.
+
.
.
.
.
.
Cl
.
.
Na+
-
电负性差 2.1
电负性 0.9
3.0
电负性的差值较小 共价键
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
电负性差 0.4
电负性 2.1
2.5
+
H
H
电负性相差很大
离子键
(相差>1.7)
电负性相差不大
共价键
(相差<1.7)
电负性相差越大的共价键,共用电子对偏向电负性大的原子趋势越大,键的极性越大。
但也有特例(如HF)
但也有特例(如NaH)
2、电负性的应用
03
判断共价化合物中元素的化合价的正负
H
C
H
H
H
CH4
-4
+1
显负价
显正价
H
Si
H
H
H
SiH4
+4
-1
显正价
显负价
电负性大的显负价,电负性小的显正价。
3、对角线规则
“对角线”规则又称斜线关系,指元素周期表中某一元素及其化合物的性质与它左上方或右下方的另一元素的性质相类似。
在第2、3周期中,具有典型“对角线”规则的元素有三对:锂与镁,铍与铝,硼与硅。
有人从元素的电负性值相近解释“对角线”规则:
锂1.0、镁1.2;铍1.5、铝1.5;硼2.0、硅1.8。
锂和镁的相似性:
① 在氧气中燃烧生成氧化物,而其他碱金属则生成过氧化物、超氧化物;
② 能直接与氮作用,生成氮化物Li3N、Mg3N2,而其他碱金属不与氮直接反应;③ 氟化物、碳酸盐、磷酸盐都难溶于水,而其他碱金属的相应盐易溶于水等。
铍和铝的相似性:
① 单质在冷的浓硝酸中钝化;
② 氧化物、氢氧化物都有两性;
③ 氯化物都是共价化合物,易汽化,能升华,能溶于有机溶剂等。
硼和硅的相似性:
① 硼和硅的密度分别为2.35 g·cm-3 和2.336 g·cm-3,两者相近;
② 硼和硅的氢化物在常温下都是气体,都能直接被水氧化;
③ 最高价氧化物的水化物都是酸等。
“对角线”规则的表现,举例如下:
课堂小结
电负性
金属性
应用
金属性/非金属性
元素类型
第一电离能、电负性呈现周期性的递变
非金属性
化学键类型
化合价
第一电离能
应用
确定元素原子的核外电子排布
判断主族元素的最高正化合价或最外层电子数
判断元素的金属性、非金属性强弱
1.下列叙述正确的是( )
A.第三周期所含元素中,钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能最大
D.钾的第一电离能比镁的第一电离能大
A
2.具有下列价电子构型的原子中,第一电离能最小的是( )
A.2s22p4 B.3s23p4 C.4s24p4 D.5s25p4
D
课堂练习
课堂练习
3.下列是几种基态原子的电子排布式,电负性最大的原子是( )
A.1s22s22p4 B.1s22s22p63s23p3
C.1s22s22p63s23p2 D.1s22s22p63s23p64s2
A
4.下列不能根据元素电负性判断的性质是( )
A.判断化合物的溶解度
B.判断化合物中元素化合价的正负
C.判断化学键类型
D.判断一种元素是金属元素还是非金属元素
A
2.2元素性质的递变规律
第二课时
金属性
原子失电子的能力
定性
电离能
定量
1、第一电离能
一、元素第一电离能的周期性变化
某元素的气态原子失去一个电子形成+1价气态阳离子所需要的最低能量
符号:I1
保证“能量最低”
单位:kj/mol
M(g)-e- → M+(g)
第一电离能可以衡量元素的气态原子失去一个电子的难易程度。
1、第一电离能
第一电离能数值越大,原子越难失去一个电子
第一电离能数值越小,原子越易失去一个电子
原子序数
第一电离能(kJ·mol-1)
思考:随原子序数递增,同周期或者同族元素的第一电离能有什么规律?
原子序数
第一电离能(kJ·mol-1)
原因:一般来说,同主族元素的原子最外层电子数相同,随着核电荷数的增大,电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐增强,第一电离能逐渐减小。
规律1:同主族元素原子的第一电离能从上到下逐渐减小。
原子序数
第一电离能(kJ·mol-1)
原因:同一周期的主族元素具有相同的电子层数,随着核电荷数的递增,最外层电子数增加,原子半径逐渐减小,失电子能力逐渐减弱,第一电离能呈现增大的趋势。
规律2:同周期中从左到右元素的第一电离能呈增大的趋势。
原子序数
第一电离能(kJ·mol-1)
规律3:同一周期中碱金属的第一电离能最小,稀有气体的第一电离能最大。
原子序数
第一电离能(kJ·mol-1)
思考:镁的第一电离能比铝大,磷的第一电离能比硫大,为什么?
3s23p1
3s23p4
3s23p3
3s2
写出镁、铝、磷、硫的外围电子排布式
s轨道处于全充满状态
p轨道处于半充满状态
第一电离能的变化与元素原子的核外电子排布有关。
通常情况下,当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)和全满(p6、d10、f14)结构时,原子的能量较低,该元素具有较大的第一电离能。
第三周期元素第一电离能的大小关系为:I1(Ar)>I1(Cl)>I1(P)>I1(S)>I1(Si)>I1(Mg)>I1(Al)>I1(Na)。
规律4:第一电离能:第ⅡA族元素大于第ⅢA族元素,
第ⅤA族元素大于第ⅥA族元素
第ⅡA族元素的s轨道全满,最外层p轨道全空
第ⅤA族元素的最外层p轨道半满
M+(g)-e-→M2+(g)
第一电离能 I1
+1价气态离子失去1个电子,形成+2价气态离子所需要的最低能量
单位:kj/mol
M(g)-e- → M+(g)
第二电离能 I2
M2+(g)-e-→M3+(g)
第三电离能 I3
+2价气态离子失去1个电子,形成+3价气态离子所需要的最低能量
……
……
2、逐级电离能
变化规律:
①同一元素的逐级电离能是逐渐增大的,即I1< I2< I3<…
②当相邻逐级电离能突然变大时,说明失去的电子所在电子层发生了变化
钠、镁元素的第一、二、三电离能
3、电离能的应用
01
02
03
确定元素原子的核外电子排布
Li的逐级电离能I1 I2
如果电离能在In与In+1之间发生突变,则元素的原子易形成+n价离子而不易形成+(n+1)价离。如果是主族元素,则其最外层有n个电子,最高正化合价为+n(O、F除外)。
判断元素的金属性、非金属性强弱
I1越大,元素的非金属性越强(稀有气体元素除外);
I1越小,元素的金属性越强。
非金属性
原子得电子的能力
定性
电负性
定量
二、元素电负性的周期性变化
1、电负性
衡量元素在化合物中吸引电子的能力。
电负性越大的原子,对键合电子的吸引力越大。
H
F
H
.
.
.
.
F
.
.
+
.
.
.
.
F
.
.
H
.
.
键合电子
大小的标准:以氟的电负性为4.0作为相对标准
电负性是相对值,没单位。
主族元素的电负性
思考:随原子序数递增,元素的电负性同周期或者同族有什么规律?
规律1:
同一周期,主族元素的电负性从左到右逐渐增大,表明其吸引电子的能力逐渐增强。(稀有气体元素除外)
主族元素的电负性
规律2:同一主族,元素的电负性从上到下呈现减小趋势,表明其吸引电子的能力逐渐减弱。
电负性最大的是氟,最小的是铯。
2、电负性的应用
01
判断元素的金属性与非金属性的强弱
电负性 > 1.8 非金属元素
电负性 < 1.8 金属元素
电负性 ≈ 1.8 类金属元素
金属元素的电负性较小,非金属元素的电负性较大。
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱。
2、电负性的应用
02
判断化学键的类型
电负性的差值较大 离子键
Na
.
.
.
.
.
.
Cl
.
+
.
.
.
.
.
Cl
.
.
Na+
-
电负性差 2.1
电负性 0.9
3.0
电负性的差值较小 共价键
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
电负性差 0.4
电负性 2.1
2.5
+
H
H
电负性相差很大
离子键
(相差>1.7)
电负性相差不大
共价键
(相差<1.7)
电负性相差越大的共价键,共用电子对偏向电负性大的原子趋势越大,键的极性越大。
但也有特例(如HF)
但也有特例(如NaH)
2、电负性的应用
03
判断共价化合物中元素的化合价的正负
H
C
H
H
H
CH4
-4
+1
显负价
显正价
H
Si
H
H
H
SiH4
+4
-1
显正价
显负价
电负性大的显负价,电负性小的显正价。
3、对角线规则
“对角线”规则又称斜线关系,指元素周期表中某一元素及其化合物的性质与它左上方或右下方的另一元素的性质相类似。
在第2、3周期中,具有典型“对角线”规则的元素有三对:锂与镁,铍与铝,硼与硅。
有人从元素的电负性值相近解释“对角线”规则:
锂1.0、镁1.2;铍1.5、铝1.5;硼2.0、硅1.8。
锂和镁的相似性:
① 在氧气中燃烧生成氧化物,而其他碱金属则生成过氧化物、超氧化物;
② 能直接与氮作用,生成氮化物Li3N、Mg3N2,而其他碱金属不与氮直接反应;③ 氟化物、碳酸盐、磷酸盐都难溶于水,而其他碱金属的相应盐易溶于水等。
铍和铝的相似性:
① 单质在冷的浓硝酸中钝化;
② 氧化物、氢氧化物都有两性;
③ 氯化物都是共价化合物,易汽化,能升华,能溶于有机溶剂等。
硼和硅的相似性:
① 硼和硅的密度分别为2.35 g·cm-3 和2.336 g·cm-3,两者相近;
② 硼和硅的氢化物在常温下都是气体,都能直接被水氧化;
③ 最高价氧化物的水化物都是酸等。
“对角线”规则的表现,举例如下:
课堂小结
电负性
金属性
应用
金属性/非金属性
元素类型
第一电离能、电负性呈现周期性的递变
非金属性
化学键类型
化合价
第一电离能
应用
确定元素原子的核外电子排布
判断主族元素的最高正化合价或最外层电子数
判断元素的金属性、非金属性强弱
1.下列叙述正确的是( )
A.第三周期所含元素中,钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能最大
D.钾的第一电离能比镁的第一电离能大
A
2.具有下列价电子构型的原子中,第一电离能最小的是( )
A.2s22p4 B.3s23p4 C.4s24p4 D.5s25p4
D
课堂练习
课堂练习
3.下列是几种基态原子的电子排布式,电负性最大的原子是( )
A.1s22s22p4 B.1s22s22p63s23p3
C.1s22s22p63s23p2 D.1s22s22p63s23p64s2
A
4.下列不能根据元素电负性判断的性质是( )
A.判断化合物的溶解度
B.判断化合物中元素化合价的正负
C.判断化学键类型
D.判断一种元素是金属元素还是非金属元素
A
