2.2 元素性质的递变规律 第1课时 课件 (共26张PPT)
文档属性
| 名称 | 2.2 元素性质的递变规律 第1课时 课件 (共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-27 09:42:40 | ||
图片预览



文档简介
(共26张PPT)
2.2元素性质的递变规律
第一课时
一、原子核外电子排布的周期性
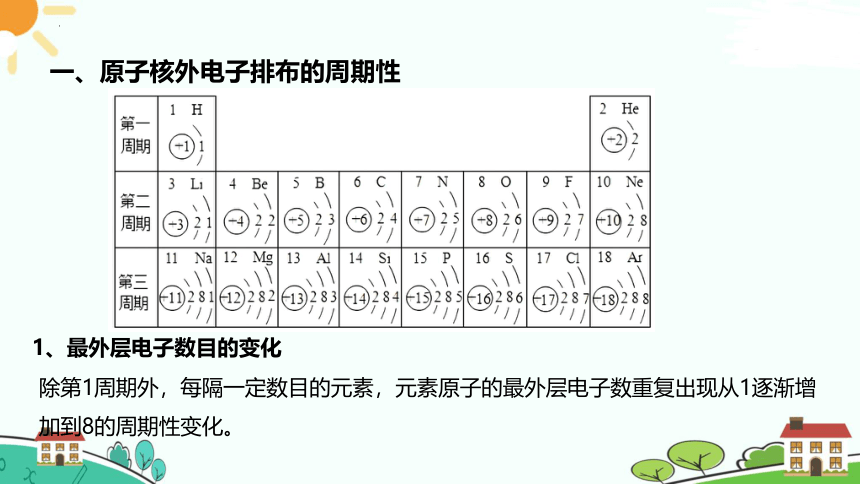
除第1周期外,每隔一定数目的元素,元素原子的最外层电子数重复出现从1逐渐增加到8的周期性变化。
1、最外层电子数目的变化
一、原子核外电子排布的周期性
ⅠA 0
H ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA He
Li Be B C N O F Ne
Na Mg ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB Al Si P S Cl Ar
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Sn As Se Br Kr
元素周期表1~36号元素
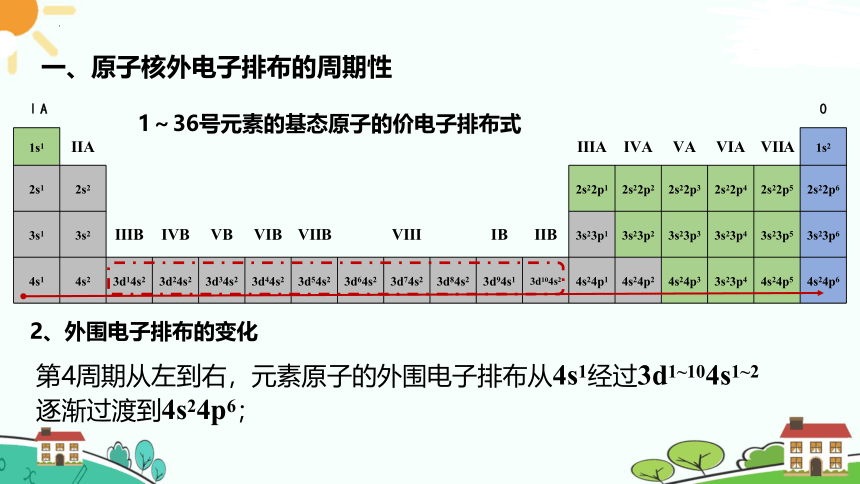
请写出1~36号元素的基态原子的价电子排布式
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5 3s23p6
4s1 4s2 3d14s2 3d24s2 3d34s2 3d44s2 3d54s2 3d64s2 3d74s2 3d84s2 3d94s1 3d104s2 4s24p1 4s24p2 4s24p3 3s23p4 4s24p5 4s24p6
1~36号元素的基态原子的价电子排布式
一、原子核外电子排布的周期性
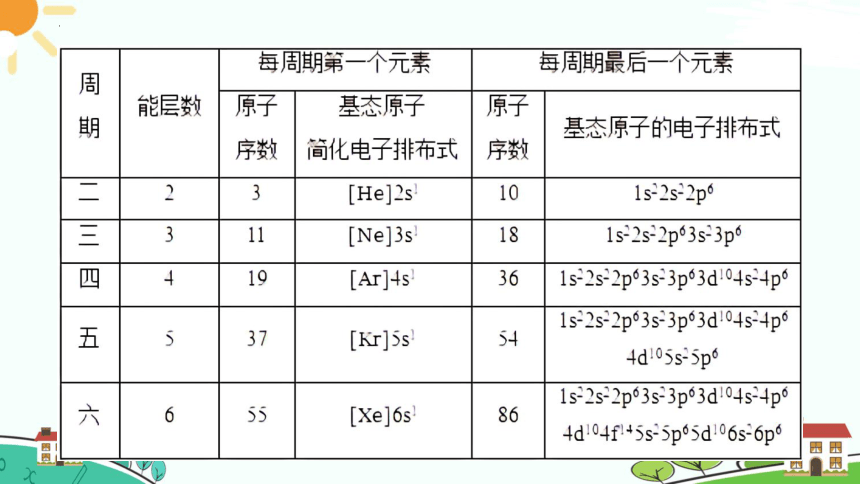
第2周期从左到右,元素原子的外围电子排布呈现从2s1到2s22p6的变化;
2、外围电子排布的变化
第3周期从左到右,元素原子的外围电子排布呈现从3s1到3s23p6的变化。
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5 3s23p6
4s1 4s2 3d14s2 3d24s2 3d34s2 3d44s2 3d54s2 3d64s2 3d74s2 3d84s2 3d94s1 3d104s2 4s24p1 4s24p2 4s24p3 3s23p4 4s24p5 4s24p6
1~36号元素的基态原子的价电子排布式
一、原子核外电子排布的周期性
2、外围电子排布的变化
第4周期从左到右,元素原子的外围电子排布从4s1经过3d1~104s1~2逐渐过渡到4s24p6;
2、外围电子排布的变化
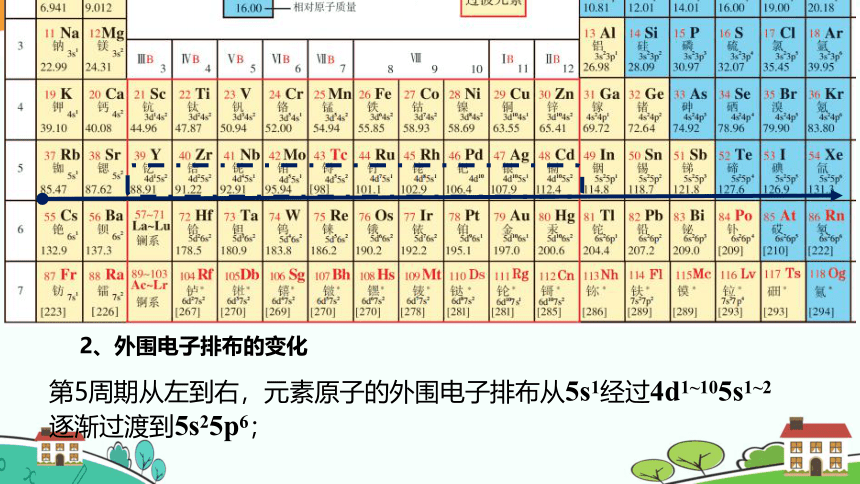
第5周期从左到右,元素原子的外围电子排布从5s1经过4d1~105s1~2逐渐过渡到5s25p6;
2、外围电子排布的变化
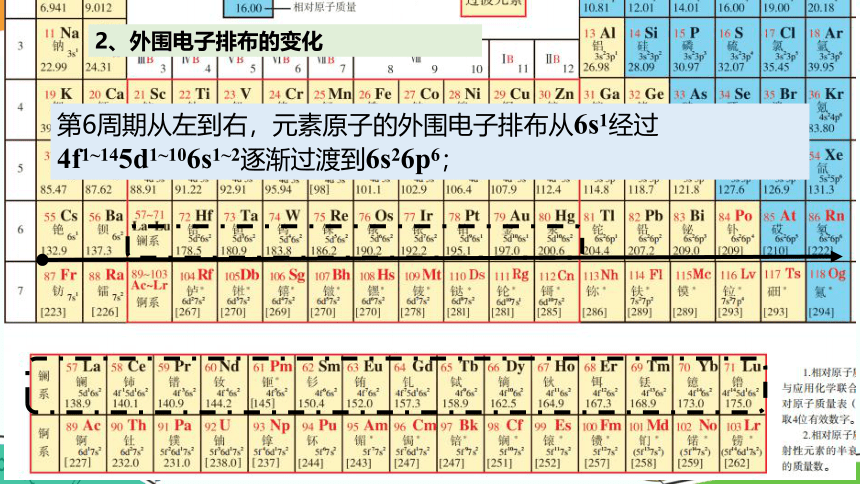
第6周期从左到右,元素原子的外围电子排布从6s1经过4f1~145d1~106s1~2逐渐过渡到6s26p6;
一、原子核外电子排布的周期性
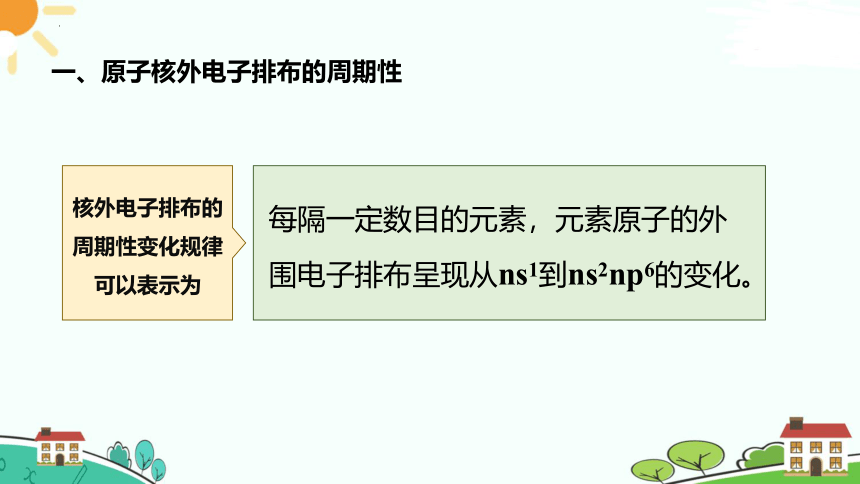
核外电子排布的周期性变化规律可以表示为
每隔一定数目的元素,元素原子的外围电子排布呈现从ns1到ns2np6的变化。
周期
元素数
1s
2s
2p
3s
3p
4s
3d
4p
5s
4d
5p
4f
5d
6p
6s
5f
6d
7p
7s
……
一
二
三
四
五
六
七
2
8
8
18
18
32
32
一、原子核外电子排布的周期性
原子的电子层数=能级中最高电子层序数=周期序数
外围电子排布与周期表的关系
主族元素原子的外围电子数=该元素在周期表中的主族序数
1s
2s
2p
3s
3p
4s
3d
4p
3ds
5s
4d
5p
4ds
6s
5d
6p
5ds
7s
6d
7p
6ds
4f
5f
4f
5f
二、元素周期表中区的划分
根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:
s区、p区、d区、ds区和f区
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
s区
p区
d区
ds区
f区
ns1~2
电子填充的最后一个能级是s能级
电子填充的最后一个能级是p能级
电子填充的最后一个能级是d能级
分区的来由
ns1~2np1~6
①s区:包括ⅠA、ⅡA族元素,价电子排布式为ns1~2, 最后一个电子填在ns能级上,除氢元素外均属于活泼金属元素。
二、元素周期表中区的划分
②p区:包括ⅢA~ⅦA族以及0族元素,价电子排布式为ns2np1~6(除He外),最后一个电子填在np能级上,为非金属元素和少数金属元素。
二、元素周期表中区的划分
③d区:包括ⅢB~Ⅷ族元素(除镧系、锕系外),价电子排布式为(n-1)d1~9ns1~2(钯除外),最后一个电子填在(n-1)d能级上,为过渡金属元素。
二、元素周期表中区的划分
因为副族元素是从典型的金属元素过渡到非金属元素的中间元素,故又被称为过渡元素
④ds区:包括ⅠB、ⅡB族元素,价电子排布式为(n-1)d10ns1~2。先填满了(n-1)d能级而后再填充ns能级,为过渡金属元素(d区和ds区金属元素均为过渡金属元素)。
二、元素周期表中区的划分
⑤f区:包括镧系和锕系元素,价电子排布式为
(n-2)f0~14(n-1)d0~2ns2。
二、元素周期表中区的划分
沿着周期表中硼、硅、砷、碲、砹、与铝、锗、锑、钋之间画一条线。
线的左边是金属元素(氢除外),线的右边是非金属元素。非金属元素要集中在元素周期表右上角的三角区内。
按金属元素与非金属元素分区
金属与非金属交界处元素的性质特点
在元素周期表中位于金属和非金属分界线上的元素兼有金属和非金属的性质,位于此处的元素(如硼、硅、锗、砷、锑等)常被称为半金属或类金属(一般可用作半导体材料) 。
课堂小结
1.下列关于原子核外电子排布与元素在周期表中位置关系的叙述中,正确的是( )
A.原子价电子排布为ns2np1~6的元素一定是主族元素
B.基态原子最外电子层的p能级上有5个电子的元素一定是第ⅦA族元素
C.原子的价电子排布为(n-1)d6~8ns2的元素一定位于第ⅢB~ⅦB族
D.基态原子N能层上只有1个电子的元素一定是主族元素
B
课堂练习
2.外围电子构型为3d104s1的元素在周期表中位于( )
A.第五周期第ⅠB族
B.第五周期第ⅡB族
C.第四周期第ⅦB族
D.第四周期第ⅠB族
D
3.下列各组元素都属于p区的是( )
A.原子序数为1、2、7的元素
B.O、S、P
C.Fe、Ar、Cl
D.Na、Li、Mg
B
4.指出下列元素是主族元素还是副族元素,及其在元素周期表中的位置。
(1)1s22s22p63s2是 族元素,位于周期表中第 周期第 族,
属于 区元素。
(2)[Kr]4d105s25p2是 族元素,位于周期表中第 周期第 族,属于 区元素。
(3)[Ar]3d14s2是 族元素,位于周期表中第 周期第 族,
属于 区元素。
(4)[Ar]3d104s1是 族元素,位于周期表中第 周期第 族,
属于 区元素。
主
三
ⅡA
s
主
五
ⅣA
p
副
四
ⅢB
d
副
四
ⅠB
ds
2.2元素性质的递变规律
第一课时
一、原子核外电子排布的周期性
除第1周期外,每隔一定数目的元素,元素原子的最外层电子数重复出现从1逐渐增加到8的周期性变化。
1、最外层电子数目的变化
一、原子核外电子排布的周期性
ⅠA 0
H ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA He
Li Be B C N O F Ne
Na Mg ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB Al Si P S Cl Ar
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Sn As Se Br Kr
元素周期表1~36号元素
请写出1~36号元素的基态原子的价电子排布式
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5 3s23p6
4s1 4s2 3d14s2 3d24s2 3d34s2 3d44s2 3d54s2 3d64s2 3d74s2 3d84s2 3d94s1 3d104s2 4s24p1 4s24p2 4s24p3 3s23p4 4s24p5 4s24p6
1~36号元素的基态原子的价电子排布式
一、原子核外电子排布的周期性
第2周期从左到右,元素原子的外围电子排布呈现从2s1到2s22p6的变化;
2、外围电子排布的变化
第3周期从左到右,元素原子的外围电子排布呈现从3s1到3s23p6的变化。
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5 3s23p6
4s1 4s2 3d14s2 3d24s2 3d34s2 3d44s2 3d54s2 3d64s2 3d74s2 3d84s2 3d94s1 3d104s2 4s24p1 4s24p2 4s24p3 3s23p4 4s24p5 4s24p6
1~36号元素的基态原子的价电子排布式
一、原子核外电子排布的周期性
2、外围电子排布的变化
第4周期从左到右,元素原子的外围电子排布从4s1经过3d1~104s1~2逐渐过渡到4s24p6;
2、外围电子排布的变化
第5周期从左到右,元素原子的外围电子排布从5s1经过4d1~105s1~2逐渐过渡到5s25p6;
2、外围电子排布的变化
第6周期从左到右,元素原子的外围电子排布从6s1经过4f1~145d1~106s1~2逐渐过渡到6s26p6;
一、原子核外电子排布的周期性
核外电子排布的周期性变化规律可以表示为
每隔一定数目的元素,元素原子的外围电子排布呈现从ns1到ns2np6的变化。
周期
元素数
1s
2s
2p
3s
3p
4s
3d
4p
5s
4d
5p
4f
5d
6p
6s
5f
6d
7p
7s
……
一
二
三
四
五
六
七
2
8
8
18
18
32
32
一、原子核外电子排布的周期性
原子的电子层数=能级中最高电子层序数=周期序数
外围电子排布与周期表的关系
主族元素原子的外围电子数=该元素在周期表中的主族序数
1s
2s
2p
3s
3p
4s
3d
4p
3ds
5s
4d
5p
4ds
6s
5d
6p
5ds
7s
6d
7p
6ds
4f
5f
4f
5f
二、元素周期表中区的划分
根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:
s区、p区、d区、ds区和f区
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
s区
p区
d区
ds区
f区
ns1~2
电子填充的最后一个能级是s能级
电子填充的最后一个能级是p能级
电子填充的最后一个能级是d能级
分区的来由
ns1~2np1~6
①s区:包括ⅠA、ⅡA族元素,价电子排布式为ns1~2, 最后一个电子填在ns能级上,除氢元素外均属于活泼金属元素。
二、元素周期表中区的划分
②p区:包括ⅢA~ⅦA族以及0族元素,价电子排布式为ns2np1~6(除He外),最后一个电子填在np能级上,为非金属元素和少数金属元素。
二、元素周期表中区的划分
③d区:包括ⅢB~Ⅷ族元素(除镧系、锕系外),价电子排布式为(n-1)d1~9ns1~2(钯除外),最后一个电子填在(n-1)d能级上,为过渡金属元素。
二、元素周期表中区的划分
因为副族元素是从典型的金属元素过渡到非金属元素的中间元素,故又被称为过渡元素
④ds区:包括ⅠB、ⅡB族元素,价电子排布式为(n-1)d10ns1~2。先填满了(n-1)d能级而后再填充ns能级,为过渡金属元素(d区和ds区金属元素均为过渡金属元素)。
二、元素周期表中区的划分
⑤f区:包括镧系和锕系元素,价电子排布式为
(n-2)f0~14(n-1)d0~2ns2。
二、元素周期表中区的划分
沿着周期表中硼、硅、砷、碲、砹、与铝、锗、锑、钋之间画一条线。
线的左边是金属元素(氢除外),线的右边是非金属元素。非金属元素要集中在元素周期表右上角的三角区内。
按金属元素与非金属元素分区
金属与非金属交界处元素的性质特点
在元素周期表中位于金属和非金属分界线上的元素兼有金属和非金属的性质,位于此处的元素(如硼、硅、锗、砷、锑等)常被称为半金属或类金属(一般可用作半导体材料) 。
课堂小结
1.下列关于原子核外电子排布与元素在周期表中位置关系的叙述中,正确的是( )
A.原子价电子排布为ns2np1~6的元素一定是主族元素
B.基态原子最外电子层的p能级上有5个电子的元素一定是第ⅦA族元素
C.原子的价电子排布为(n-1)d6~8ns2的元素一定位于第ⅢB~ⅦB族
D.基态原子N能层上只有1个电子的元素一定是主族元素
B
课堂练习
2.外围电子构型为3d104s1的元素在周期表中位于( )
A.第五周期第ⅠB族
B.第五周期第ⅡB族
C.第四周期第ⅦB族
D.第四周期第ⅠB族
D
3.下列各组元素都属于p区的是( )
A.原子序数为1、2、7的元素
B.O、S、P
C.Fe、Ar、Cl
D.Na、Li、Mg
B
4.指出下列元素是主族元素还是副族元素,及其在元素周期表中的位置。
(1)1s22s22p63s2是 族元素,位于周期表中第 周期第 族,
属于 区元素。
(2)[Kr]4d105s25p2是 族元素,位于周期表中第 周期第 族,属于 区元素。
(3)[Ar]3d14s2是 族元素,位于周期表中第 周期第 族,
属于 区元素。
(4)[Ar]3d104s1是 族元素,位于周期表中第 周期第 族,
属于 区元素。
主
三
ⅡA
s
主
五
ⅣA
p
副
四
ⅢB
d
副
四
ⅠB
ds
