5.2化学反应的表示(第1课时化学方程式及其意义)课件(共12张PPT)--2022-2023学年八年级化学鲁教版(五四学制)全一册
文档属性
| 名称 | 5.2化学反应的表示(第1课时化学方程式及其意义)课件(共12张PPT)--2022-2023学年八年级化学鲁教版(五四学制)全一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-23 23:23:43 | ||
图片预览


文档简介
(共12张PPT)
1.什么是质量守恒定律?
2.化学反应中什么一定变、一定不变的是什么?
3.写出氢气和氧气燃烧生成水的符号及文字表达式。
温故知新
化学反应的表示
Representation of chemical reaction
第五单元《定量研究化学反应》
第一课时 化学反应方程式及其意义
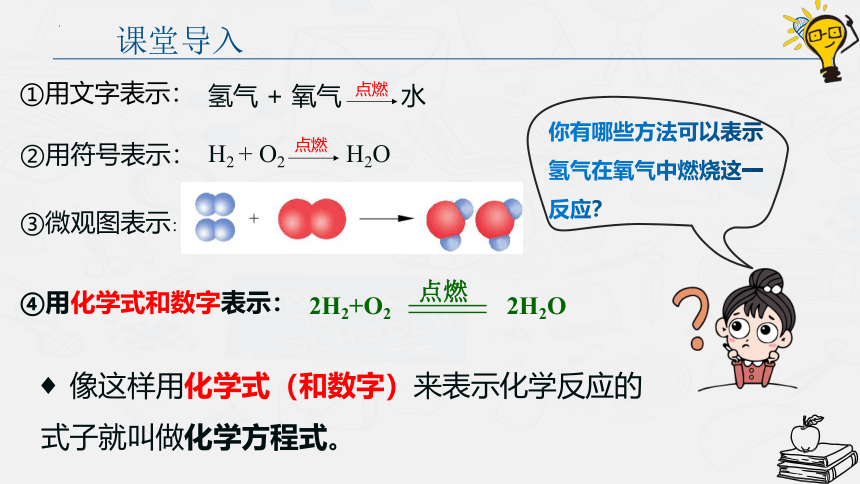
课堂导入
你有哪些方法可以表示氢气在氧气中燃烧这一反应?
①用文字表示:
点燃
氢气 + 氧气 水
②用符号表示:
H2 + O2 H2O
点燃
③微观图表示:
④用化学式和数字表示:
2H2+O2
点燃
2H2O
像这样用化学式(和数字)来表示化学反应的式子就叫做化学方程式。
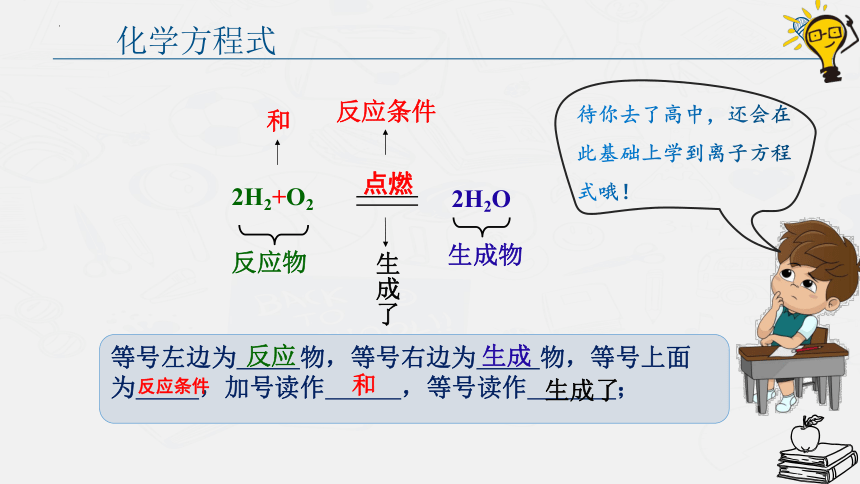
化学方程式
2H2+O2
点燃
2H2O
反应物
生成物
反应条件
和
生成了
等号左边为 物,等号右边为 物,等号上面为 ,加号读作 ,等号读作 ;
反应
生成
反应条件
和
生成了
待你去了高中,还会在此基础上学到离子方程式哦!
化学方程式
观察下面几个化学方程式,回答下列问题:
2Cu+O2
2CuO
1.
2H2O
通电
2H2↑+
O2 ↑
2.
CuSO4+2NaOH
Cu(OH)2↓+Na2SO4
3.
4.2Na2O2+2CO2 2Na2CO3+O2
5.3Fe+2O2 Fe3O4
点燃
在化学方程式中,通常用“△”表示反应需要_____,燃烧的条件用______用“↑”或“↓”注明生成物是______或是______。
加热
点燃
气体
沉淀
注意:
①如果反应物和生成物中都有气体,气体生成物就不需要标注“ ↑ ”。
②对于溶液中的反应,如果反应物和生成物中都有不溶性固体,不溶性固体生成物也不需标注“↓”。
点燃
2H2O
2H2 + O2
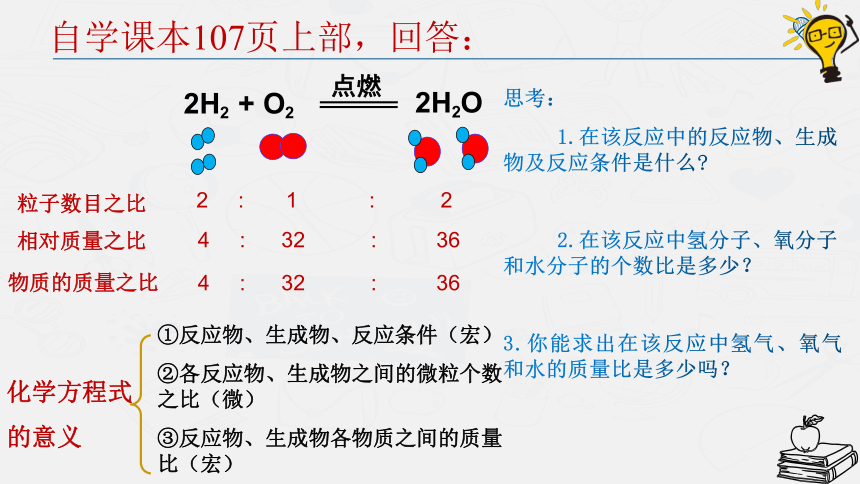
自学课本107页上部,回答:
粒子数目之比
2 : 1 : 2
相对质量之比
4 : 32 : 36
物质的质量之比
4 : 32 : 36
思考:
1.在该反应中的反应物、生成物及反应条件是什么
2.在该反应中氢分子、氧分子和水分子的个数比是多少?
3.你能求出在该反应中氢气、氧气和水的质量比是多少吗?
化学方程式
的意义
①反应物、生成物、反应条件(宏)
②各反应物、生成物之间的微粒个数之比(微)
③反应物、生成物各物质之间的质量比(宏)
典例分析
考点:如何描述化学方程式的意义(化学方程式的读法)
【典型例题】 C:12 O:16
说说看,你能从化学方程式:C+O2 CO2中获得那些信息(即意义)?
点燃
(1)表示反应物,生成物和反应条件(宏观意义)
表示碳和氧气在点燃条件下反应,生成二氧化碳
(2)表示反应物和生成物之间各物质的质量比(宏观意义)
表示每12份质量的碳与32份质量的氧气完全反应,生成44份质量的二氧化碳。
(3)表示反应物和生成物的各粒子个数比(微观意义)
(粒子个数比即化学式前面的化学计量数之比)
表示每1个碳原子与1个氧分子反应,生成1个二氧化碳分子
化学方程式的意义
4 P + 5 O2
点燃
2 P2O5
化学方程式的意义
宏观角度
和 在 条件下生成_________
微观角度
每 个 和 个 在点燃条件下生成 个 分子
质量角度
每 份质量的磷和 份质量的氧气在点燃的条件下生成 份质量的五氧化二磷
磷
点燃
氧气
五氧化二磷
4
磷原子
5
氧分子
2
五氧化二磷
124
160
284
小结
化学方程式及意义
1.定义:用化学式(和数字)表示化学反应的式子。
2.意义
①表示反应物,生成物和反应条件
②表示各物质之间的质量比,
③表示各物质之间的粒子个数比,
1.以下信息:①反应条件,②反应速率,③反应物、生成物各物质间的质量关系,④反应的微观过程,⑤反应过程中的能量变化,⑥反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是( )
A. ①③④ B. ②③⑤ C. ①③⑥ D. ②④⑥
跟踪练习
C
跟踪练习
4Al+3O2 ==== 2Al2O3
2.反应中铝,氧气,三氧化二铝的质量比是 ( )
A. 27:32:102
B. 27:16:43
C. 4:3:2
D. 9:8:17
D
H-1 O-16 Al-27
跟踪练习
3. 四位同学正在讨论一个化学方程式表示的意义,以下是他们四人的发言:
甲:反应在点燃的条件下进行。
乙:各物质的微观粒子个数之比为2:1:2。
丙:是化合反应。
丁:各物质的质量比为1:8:9
请推测他们描述的化学反应是( )
A.S+O2 SO2 B.2CO+O2 2CO2
C .2H2+O2 2H2O D.CH4+2O2 CO2+2H2O
C
1.什么是质量守恒定律?
2.化学反应中什么一定变、一定不变的是什么?
3.写出氢气和氧气燃烧生成水的符号及文字表达式。
温故知新
化学反应的表示
Representation of chemical reaction
第五单元《定量研究化学反应》
第一课时 化学反应方程式及其意义
课堂导入
你有哪些方法可以表示氢气在氧气中燃烧这一反应?
①用文字表示:
点燃
氢气 + 氧气 水
②用符号表示:
H2 + O2 H2O
点燃
③微观图表示:
④用化学式和数字表示:
2H2+O2
点燃
2H2O
像这样用化学式(和数字)来表示化学反应的式子就叫做化学方程式。
化学方程式
2H2+O2
点燃
2H2O
反应物
生成物
反应条件
和
生成了
等号左边为 物,等号右边为 物,等号上面为 ,加号读作 ,等号读作 ;
反应
生成
反应条件
和
生成了
待你去了高中,还会在此基础上学到离子方程式哦!
化学方程式
观察下面几个化学方程式,回答下列问题:
2Cu+O2
2CuO
1.
2H2O
通电
2H2↑+
O2 ↑
2.
CuSO4+2NaOH
Cu(OH)2↓+Na2SO4
3.
4.2Na2O2+2CO2 2Na2CO3+O2
5.3Fe+2O2 Fe3O4
点燃
在化学方程式中,通常用“△”表示反应需要_____,燃烧的条件用______用“↑”或“↓”注明生成物是______或是______。
加热
点燃
气体
沉淀
注意:
①如果反应物和生成物中都有气体,气体生成物就不需要标注“ ↑ ”。
②对于溶液中的反应,如果反应物和生成物中都有不溶性固体,不溶性固体生成物也不需标注“↓”。
点燃
2H2O
2H2 + O2
自学课本107页上部,回答:
粒子数目之比
2 : 1 : 2
相对质量之比
4 : 32 : 36
物质的质量之比
4 : 32 : 36
思考:
1.在该反应中的反应物、生成物及反应条件是什么
2.在该反应中氢分子、氧分子和水分子的个数比是多少?
3.你能求出在该反应中氢气、氧气和水的质量比是多少吗?
化学方程式
的意义
①反应物、生成物、反应条件(宏)
②各反应物、生成物之间的微粒个数之比(微)
③反应物、生成物各物质之间的质量比(宏)
典例分析
考点:如何描述化学方程式的意义(化学方程式的读法)
【典型例题】 C:12 O:16
说说看,你能从化学方程式:C+O2 CO2中获得那些信息(即意义)?
点燃
(1)表示反应物,生成物和反应条件(宏观意义)
表示碳和氧气在点燃条件下反应,生成二氧化碳
(2)表示反应物和生成物之间各物质的质量比(宏观意义)
表示每12份质量的碳与32份质量的氧气完全反应,生成44份质量的二氧化碳。
(3)表示反应物和生成物的各粒子个数比(微观意义)
(粒子个数比即化学式前面的化学计量数之比)
表示每1个碳原子与1个氧分子反应,生成1个二氧化碳分子
化学方程式的意义
4 P + 5 O2
点燃
2 P2O5
化学方程式的意义
宏观角度
和 在 条件下生成_________
微观角度
每 个 和 个 在点燃条件下生成 个 分子
质量角度
每 份质量的磷和 份质量的氧气在点燃的条件下生成 份质量的五氧化二磷
磷
点燃
氧气
五氧化二磷
4
磷原子
5
氧分子
2
五氧化二磷
124
160
284
小结
化学方程式及意义
1.定义:用化学式(和数字)表示化学反应的式子。
2.意义
①表示反应物,生成物和反应条件
②表示各物质之间的质量比,
③表示各物质之间的粒子个数比,
1.以下信息:①反应条件,②反应速率,③反应物、生成物各物质间的质量关系,④反应的微观过程,⑤反应过程中的能量变化,⑥反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是( )
A. ①③④ B. ②③⑤ C. ①③⑥ D. ②④⑥
跟踪练习
C
跟踪练习
4Al+3O2 ==== 2Al2O3
2.反应中铝,氧气,三氧化二铝的质量比是 ( )
A. 27:32:102
B. 27:16:43
C. 4:3:2
D. 9:8:17
D
H-1 O-16 Al-27
跟踪练习
3. 四位同学正在讨论一个化学方程式表示的意义,以下是他们四人的发言:
甲:反应在点燃的条件下进行。
乙:各物质的微观粒子个数之比为2:1:2。
丙:是化合反应。
丁:各物质的质量比为1:8:9
请推测他们描述的化学反应是( )
A.S+O2 SO2 B.2CO+O2 2CO2
C .2H2+O2 2H2O D.CH4+2O2 CO2+2H2O
C
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
