四川省成都市简阳市阳安中学2022-2023学年高二下学期3月月考化学试题(含答案)
文档属性
| 名称 | 四川省成都市简阳市阳安中学2022-2023学年高二下学期3月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 540.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-27 10:00:58 | ||
图片预览


文档简介
简阳市阳安中学2022-2023学年度高二下学期3月月考化学试题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。总分100分。考试时间90分钟。
【注意事项】
1.答题前,考生务必将自己的姓名、班级、考号用0.5毫米的黑色墨水签字笔填写在答题卡上。并检查条形码粘贴是否正确。
2.选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,非选择题用0.5毫米黑色墨水签字笔书写在答题卡对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
3.考试结束后,将答题卡收回。
可能用到的相对原子质量:H 1 N 14 O 16 Na 23 S 32 K 39 Cu 64 Zn 65 I 127
第Ⅰ卷 (选择题,共40分)
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.化学与生活、生产、科技密切相关。下列说法错误的是( )
A.小苏打和氢氧化铝胶囊可以作内服药治疗胃酸过多
B.将“地沟油”制成肥皂,可以提高资源的利用率
C.中国天眼传输信息用的光纤材料是硅,计算机芯片的材料是二氧化硅
D.Al2O3和MgO的熔点均很高,可用于制作耐高温材料
2.常温下,稀释0.1 mol·L-1 CH3COONa溶液,图中的横坐标表示加水的量,则纵坐标可以表示的是( )
A.CH3COO-水解的平衡常数 B.溶液的pH
C.溶液中CH3COOH数目 D.溶液中c(CH3COO-)
3.过氧乙酸能杀菌消毒,可通过反应CH3COOH+H2O2―――→CH3COOOH+H2O制备。下列表示反应中相关微粒的化学用语正确的是( )
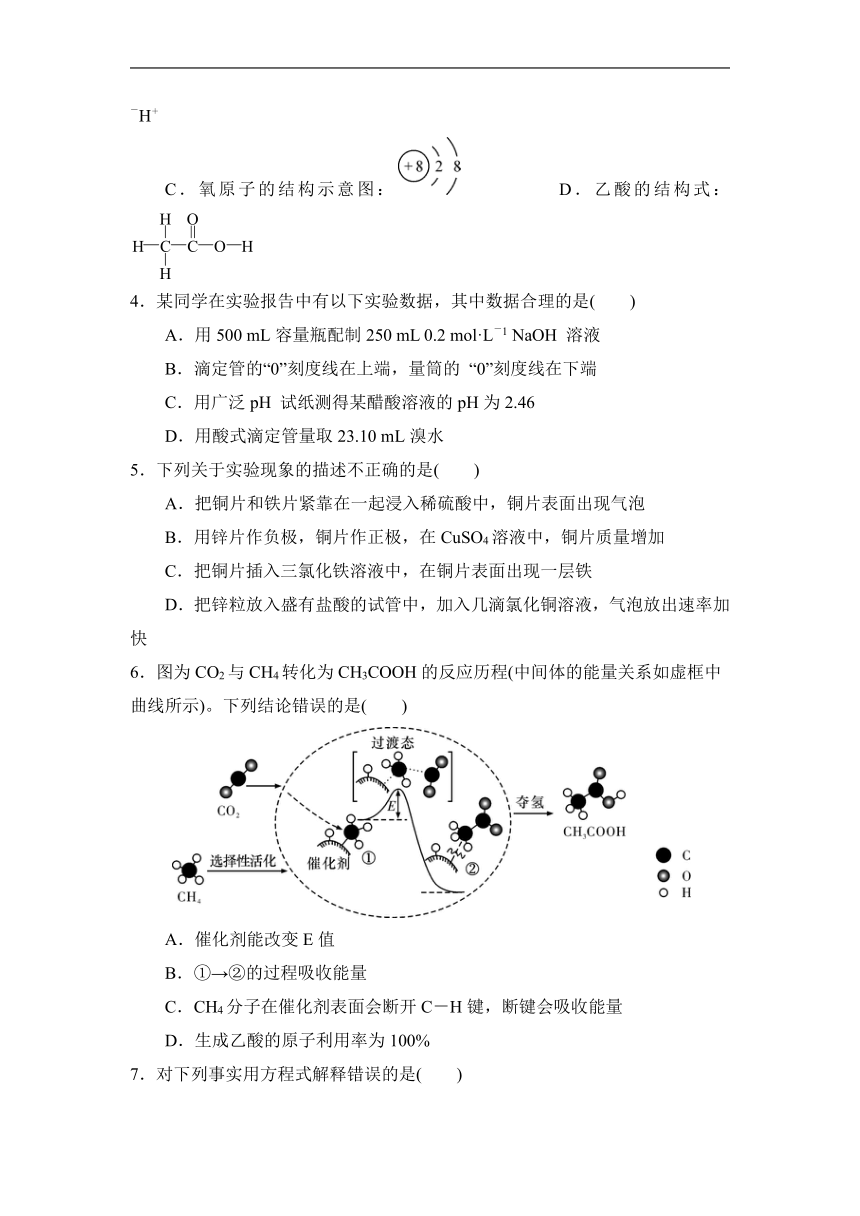
A.中子数为8的碳原子:68C B.H2O2的电子式:H+[]2-H+
C.氧原子的结构示意图: D.乙酸的结构式:
4.某同学在实验报告中有以下实验数据,其中数据合理的是( )
A.用500 mL容量瓶配制250 mL 0.2 mol·L-1 NaOH 溶液
B.滴定管的“0”刻度线在上端,量筒的 “0”刻度线在下端
C.用广泛pH 试纸测得某醋酸溶液的pH为2.46
D.用酸式滴定管量取23.10 mL溴水
5.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在CuSO4溶液中,铜片质量增加
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
6.图为CO2与CH4转化为CH3COOH的反应历程(中间体的能量关系如虚框中曲线所示)。下列结论错误的是( )
A.催化剂能改变E值
B.①→②的过程吸收能量
C.CH4分子在催化剂表面会断开C-H键,断键会吸收能量
D.生成乙酸的原子利用率为100%
7.对下列事实用方程式解释错误的是( )
A.向Mg(OH)2悬浊液中加入几滴FeCl3溶液,沉淀变为红褐色:
3Mg(OH)2+2Fe3+===2Fe(OH)3+3Mg2+
B.过氧化钠用作潜水艇中的供氧剂:2Na2O2+2CO2===4Na++2CO32-+O2
C.收集的酸雨过一段时间后pH值会减小:2H2SO3+O2===4H++2SO42-
D.工业上用情性电极电解饱和氯化钠溶液生产氢氧化钠:
2Cl-+2H2OCl2↑+H2↑+2OH-
8.NA是阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24L四氯化碳含共价键总数为0.4NA
B.由H218O与D216O组成的4.0g混合物含中子数为2NA
C.由NO2与N2O4组成的4.6g混合气体含氮原子数为0.5NA
D.标准状况下,溶有6.72L SO2的水中HSO3-与SO32-的微粒数目之和为0.3NA
9.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) → 2I(g)(快反应)
第二步I(g)+N2O(g) → N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g) → N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O的分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是( )
A.I2浓度与N2O分解速率无关 B.第三步对总反应速率起决定作用
C.IO为反应的中间产物 D.第二步活化能比第三步小
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加入盐酸后能形成不溶于硝酸的白色沉淀的溶液中:K+、Ca2+、I-、OH-
B.c(S2-)=0.1mol·L-1的溶液中:Fe3+、Na+、Br-、ClO-
C.能使甲基橙变红的透明溶液中:SO42-、Mg2+、Cu2+、Cl-
D. = 0.1mol/L的溶液中:Fe2+、K+、NO3-、Br-
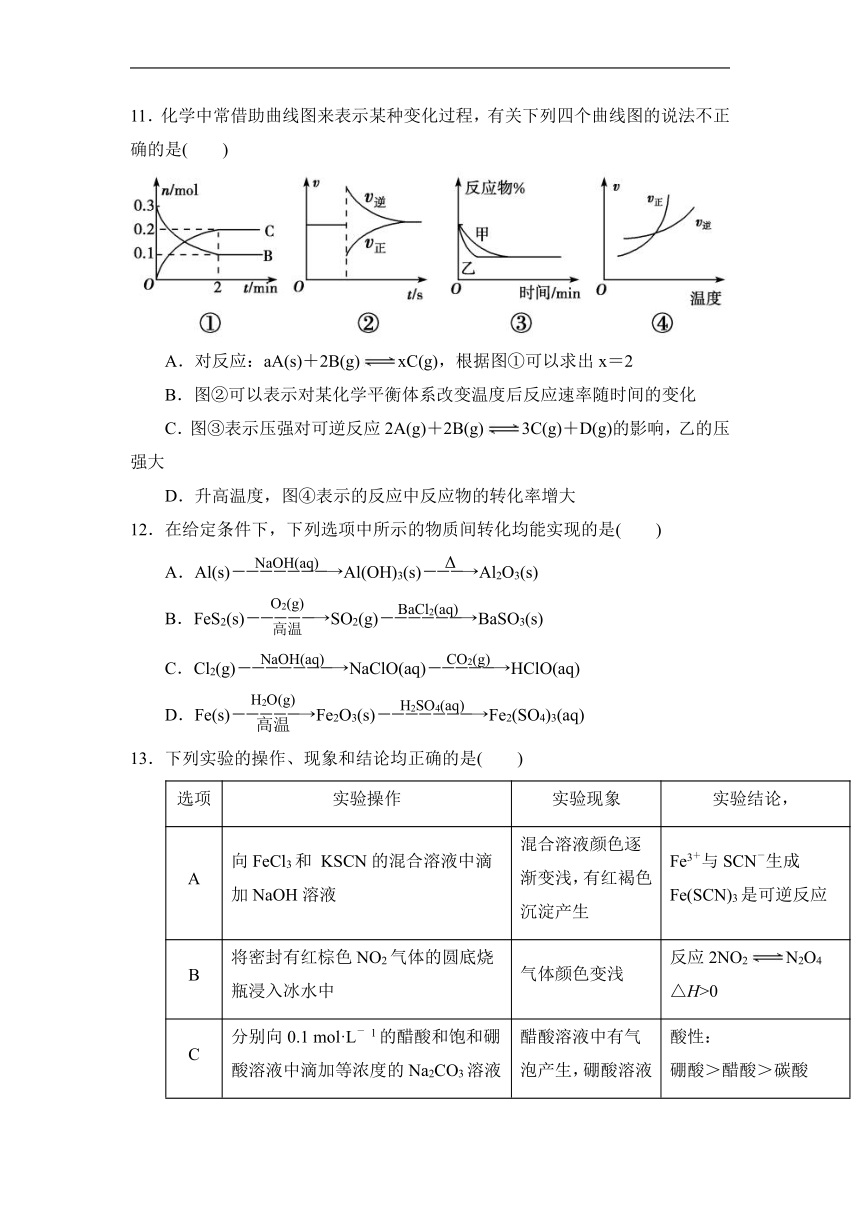
11.化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是( )
A.对反应:aA(s)+2B(g)xC(g),根据图①可以求出x=2
B.图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C.图③表示压强对可逆反应2A(g)+2B(g)3C(g)+D(g)的影响,乙的压强大
D.升高温度,图④表示的反应中反应物的转化率增大
12.在给定条件下,下列选项中所示的物质间转化均能实现的是( )
A.Al(s)Al(OH)3(s)Al2O3(s)
B.FeS2(s)SO2(g)BaSO3(s)
C.Cl2(g)NaClO(aq)HClO(aq)
D.Fe(s)Fe2O3(s)Fe2(SO4)3(aq)
13.下列实验的操作、现象和结论均正确的是( )
选项 实验操作 实验现象 实验结论,
A 向FeCl3和 KSCN的混合溶液中滴加NaOH溶液 混合溶液颜色逐渐变浅,有红褐色沉淀产生 Fe3+与SCN-生成Fe(SCN)3是可逆反应
B 将密封有红棕色NO2气体的圆底烧瓶浸入冰水中 气体颜色变浅 反应2NO2N2O4 △H>0
C 分别向0.1 mol·L- 1的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液 醋酸溶液中有气泡产生,硼酸溶液中无气泡 酸性: 硼酸>醋酸>碳酸
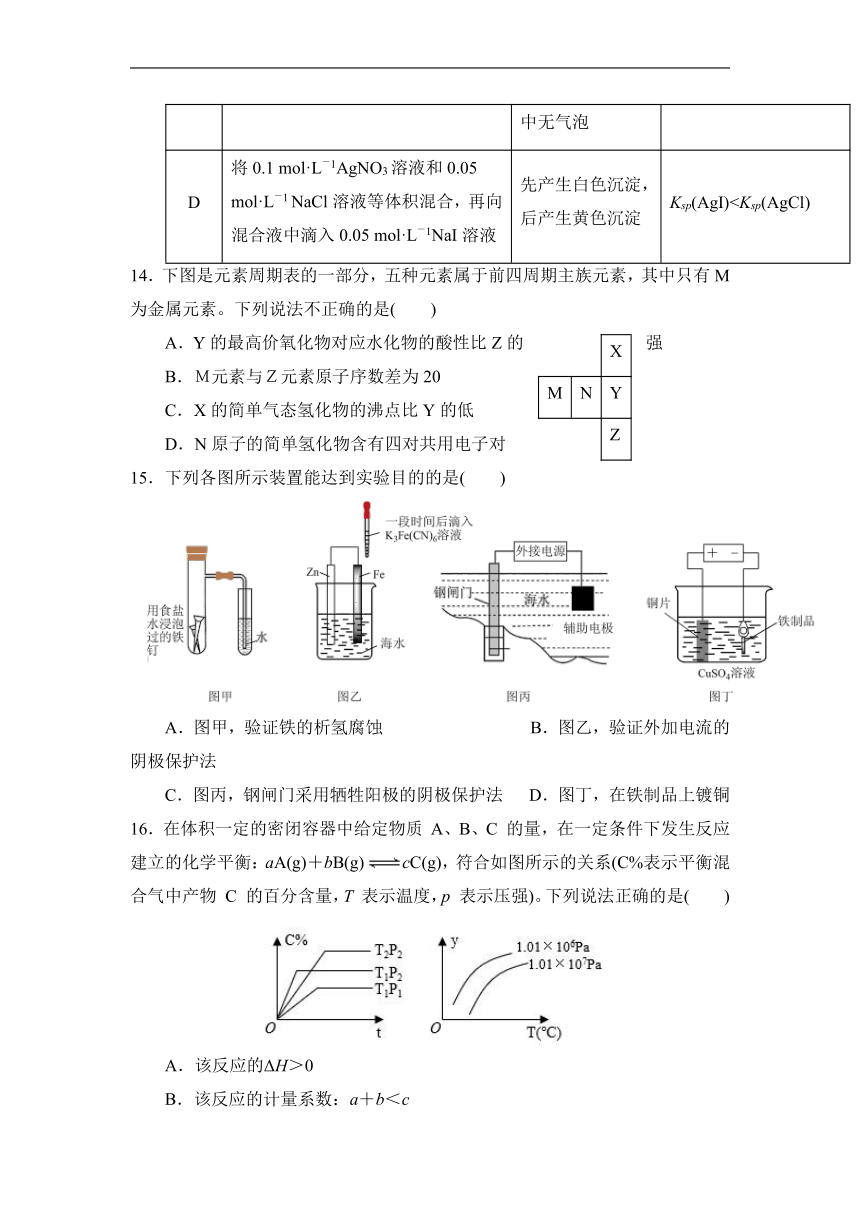
D 将0.1 mol·L-1AgNO3溶液和0.05 mol·L-1 NaCl溶液等体积混合,再向混合液中滴入0.05 mol·L-1NaI溶液 先产生白色沉淀,后产生黄色沉淀 Ksp(AgI)14.下图是元素周期表的一部分,五种元素属于前四周期主族元素,其中只有M为金属元素。下列说法不正确的是( )
X
M N Y
Z
A.Y的最高价氧化物对应水化物的酸性比Z的强
B.M元素与Z元素原子序数差为20
C.X的简单气态氢化物的沸点比Y的低
D.N原子的简单氢化物含有四对共用电子对
15.下列各图所示装置能达到实验目的的是( )
A.图甲,验证铁的析氢腐蚀 B.图乙,验证外加电流的阴极保护法
C.图丙,钢闸门采用牺牲阳极的阴极保护法 D.图丁,在铁制品上镀铜
16.在体积一定的密闭容器中给定物质 A、B、C 的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)cC(g),符合如图所示的关系(C%表示平衡混合气中产物 C 的百分含量,T 表示温度,p 表示压强)。下列说法正确的是( )
A.该反应的ΔH>0
B.该反应的计量系数:a+b<c
C.Y 轴是平衡混合气体中物质B 的百分含量
D.Y 轴是平衡混合气体的平均摩尔质量
17.用惰性电极实现电解,下列说法正确的是( )
A.电解氢氧化钠溶液,要消耗OH-,故溶液pH减小
B.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
C.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
D.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
18.要使0.1 mol·L-1 K2SO3溶液中的从c(SO32-)更接近0.1 mol·L-1,可以采取的措施是( )
A.通入SO2 B.加入SO3 C.加热 D.加入适量KOH固体
19.用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如下图。下列说法正确的是( )
A.电极N为负极,Fe(Ⅱ)为阳极
B.电解一段时间后,在Fe(Ⅰ)极附近有沉淀析出
C.M电极的电极反应式为CH3OH+8OH--6e-===CO32-+6H2O
D.电路中每转移6mol电子,最多有1molCr2O72-被还原
20.25℃时,用0.1mol·L-1 NaOH溶液滴定20mL 0.1mol·L-1 CH3COOH(Ka=1.75×10-5)溶液的过程中,消耗NaOH溶液的体积与溶液pH的关系如图所示。下列各项中粒子浓度关系正确的是( )
A.点①所示溶液中:2c(CH3COO-)-2c(CH3COOH) = c(H+)-c(OH-)
B.点②所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.点③所示溶液中:c(CH3COO-)-c(CH3COOH) = c(Na+)+2c(H+)-2c(OH-)
D.pH=12的溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
第Ⅱ卷(非选择题,共60分)
二、非选择题:本题共4大题,共60分。
21.(12分)
随着原子序数的递增,A~G七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。
(1)在A、B、F、G四种元素中,非金属性最弱的元素在周期表中的位置为 。
(2)A、B、F三种元素的原子半径由大到小的顺序是 (填元素符号)。
(3)E元素的最高价氧化物与氢氧化钠溶液反应的离子方程式是 。
(4)元素A与C形成的电子总数为22的分子的结构式为 。
(5)元素C与D按原子个数比1∶1形成的化合物的电子式为 ,其所含的化学键有 (填化学键类型)。
(6)用铂丝蘸取D的氯化物在火焰上灼烧,根据火焰呈现的特征颜色,可以判断D元素的存在,化学上把这种定性分析操作称为 。
22.(18分)
(1)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:
。
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量683.4kJ,则乙醇燃烧热的热化学方程式为 。
(3)甲烷完全燃烧反应的能量关系如图乙所示。
①CH4(g)+2O2(g) ===CO2(g)+2H2O(l) △H= (用含E1和E2的关系式表示)
②为提高燃料利用率,加入甲烷燃烧的催化剂,则E1 (填“变大”、“变小”或“不变”,下同),该反应的△H 。
(4)一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)CH3OH(g)达到平衡状态。
①该反应的平衡常数表达式K= ;根据右下图,升高温度,K值将 (填“增大”、“减小”或“不变”)。
②500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是 (用nB、tB表示)。
③判断该可逆反应达到化学平衡状态的标志是
(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
23.(16分)
Ⅰ.单质碘I2在医药、分析等方面应用广泛,回答下列问题。
(1)实验室配制碘水时,通常将I2溶于KI溶液:I2(aq)+I-(aq)I3-(aq)。关于该溶液,下列说法正确的是 。
A.滴入淀粉溶液,不变蓝 B.KI增大了I2的溶解度
C.加少量AgNO3固体平衡逆向移动 D.加水稀释,平衡正向移动
(2)I2加热易升华,升华时下列物理量增大的是 (选填编号)。
A.分子间作用力 B.分子间的平均距离
C.分子的数目 D.分子的质量
(3)碘量法测定氧化铜样品中CuO含量步骤如下:取2.00g氧化铜样品溶于足量稀硫酸(假设杂质不参与反应),充分反应后过滤。再向滤液中加入过量KI溶液反应,最后当加入90 mL
0.20 mol/LNa2S2O3溶液恰好完全反应。主要反应原理为:
2CuSO4+4KI=== 2CuI↓+I2+2K2SO4 2Na2S2O3+I2===2NaI+Na2S4O6
配制上述Na2S2O3溶液所需的定量仪器有 。
(4)上述氧化铜样品中CuO的质量分数为 。若配制Na2S2O3溶液时俯视读数,则测量结果 (选填“偏小”“偏大”“不变”)。
Ⅱ.高铁酸钾(K2FeO4)是优质水处理剂。实验室制取K2FeO4的装置如下图。
已知:高铁酸钾纯品为暗紫色、有光泽的粉末,极易溶于水形成浅紫红色溶液。
(5)A装置的作用是制取氯气,盛浓盐酸的仪器名称为 。
(6)装置C的作用是 。
(7) K2FeO4处理水的原理之一是在水中生成Fe3+,在这个过程中利用了K2FeO4的
性,Fe3+与水反应生成 后,能吸附水中的悬浮物,达到净水的目的。
(8) K2FeO4的制备原理为:3Cl2+2Fe(OH)3+10KOH===2K2FeO4+6KCl+8H2O。
B装置内出现 现象时,说明反应已停止。
24.(14分)
二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料,且电解原理在化学工业中有广泛应用。
Ⅰ.某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在该条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子 Fe3+ Fe2+ Al3+ Mn2+
开始沉淀 1.8 6.8 4.0 7.5
完全沉淀 3.2 8.0 5.0 8.4
(1)写出浸出时与铝元素有关的离子反应方程式 。
(2)上述“调pH除铁铝’’时,应控制的pH范围为 ;
“氟化除杂”中除去的离子为 。
(3)如何检验浸出液中是否含有Fe3+: 。
Ⅱ.下图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与碱性锌锰干电池相连,干电池总反应Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2。请回答下列问题:
(4)此装置工作时,干电池负极的电极反应式为 ;若X、Y都是惰性电极,a是100mL饱和NaCl溶液,当收集到1.12L H2(已折算为标准状况下)时,溶液的pH为 。(假设溶液温度为室温,溶液体积变化忽略不计)
(5)若Y极为铜锌合金,X极为纯铜,且电解质溶液中含有足量的Cu2+,通电一段时间后,若阳极恰好完全溶解,此时阴极质量增加7.68g,溶液质量增加0.03g,则合金中Cu、Zn的物质的量之比为 。
参考答案
1-5 CCDDC 6-10 BBBCC 11-15 BCACD 16-20 CCDBC
21.
第三周期第IVA族 r(Si)>r(C)>r(N)
Al2O3+2OH-===2AlO2-+H2O O=C=O
离子键和共价键(或非极性键) 焰色试验
22.
(1)H2-2e-+2OH-===2H2O
(2)C2H5OH(l)+3O2(g) ===2CO2(g)+3H2O(l) △H=-1366.8kJ/mol
(3) E1-E2 变小 不变
(4) 减小 mol·L-1·min-1 cd
23.
(1)BC
(2)B
(3)100mL容量瓶和托盘天平
(4)72.0% 偏小
(5)分液漏斗
(6)除尾气中的氯气,防止污染环境
(7)氧化性 Fe(OH)3胶体
(8)该装置出现黄绿色气体
24.
(1)Al2O3+6H+===3H2O+2Al3+
(2)5.0≤pH<7.5 Mg2+、Ca2+
(3)取少量浸出液,滴加KSCN试剂,若溶液变红色,则证明存在铁离子;若溶液不变红色,则证明不存在铁离子
(4)Zn-2e-+2OH-===Zn(OH)2 14
(5)3:1
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。总分100分。考试时间90分钟。
【注意事项】
1.答题前,考生务必将自己的姓名、班级、考号用0.5毫米的黑色墨水签字笔填写在答题卡上。并检查条形码粘贴是否正确。
2.选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,非选择题用0.5毫米黑色墨水签字笔书写在答题卡对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
3.考试结束后,将答题卡收回。
可能用到的相对原子质量:H 1 N 14 O 16 Na 23 S 32 K 39 Cu 64 Zn 65 I 127
第Ⅰ卷 (选择题,共40分)
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.化学与生活、生产、科技密切相关。下列说法错误的是( )
A.小苏打和氢氧化铝胶囊可以作内服药治疗胃酸过多
B.将“地沟油”制成肥皂,可以提高资源的利用率
C.中国天眼传输信息用的光纤材料是硅,计算机芯片的材料是二氧化硅
D.Al2O3和MgO的熔点均很高,可用于制作耐高温材料
2.常温下,稀释0.1 mol·L-1 CH3COONa溶液,图中的横坐标表示加水的量,则纵坐标可以表示的是( )
A.CH3COO-水解的平衡常数 B.溶液的pH
C.溶液中CH3COOH数目 D.溶液中c(CH3COO-)
3.过氧乙酸能杀菌消毒,可通过反应CH3COOH+H2O2―――→CH3COOOH+H2O制备。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为8的碳原子:68C B.H2O2的电子式:H+[]2-H+
C.氧原子的结构示意图: D.乙酸的结构式:
4.某同学在实验报告中有以下实验数据,其中数据合理的是( )
A.用500 mL容量瓶配制250 mL 0.2 mol·L-1 NaOH 溶液
B.滴定管的“0”刻度线在上端,量筒的 “0”刻度线在下端
C.用广泛pH 试纸测得某醋酸溶液的pH为2.46
D.用酸式滴定管量取23.10 mL溴水
5.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在CuSO4溶液中,铜片质量增加
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
6.图为CO2与CH4转化为CH3COOH的反应历程(中间体的能量关系如虚框中曲线所示)。下列结论错误的是( )
A.催化剂能改变E值
B.①→②的过程吸收能量
C.CH4分子在催化剂表面会断开C-H键,断键会吸收能量
D.生成乙酸的原子利用率为100%
7.对下列事实用方程式解释错误的是( )
A.向Mg(OH)2悬浊液中加入几滴FeCl3溶液,沉淀变为红褐色:
3Mg(OH)2+2Fe3+===2Fe(OH)3+3Mg2+
B.过氧化钠用作潜水艇中的供氧剂:2Na2O2+2CO2===4Na++2CO32-+O2
C.收集的酸雨过一段时间后pH值会减小:2H2SO3+O2===4H++2SO42-
D.工业上用情性电极电解饱和氯化钠溶液生产氢氧化钠:
2Cl-+2H2OCl2↑+H2↑+2OH-
8.NA是阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24L四氯化碳含共价键总数为0.4NA
B.由H218O与D216O组成的4.0g混合物含中子数为2NA
C.由NO2与N2O4组成的4.6g混合气体含氮原子数为0.5NA
D.标准状况下,溶有6.72L SO2的水中HSO3-与SO32-的微粒数目之和为0.3NA
9.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) → 2I(g)(快反应)
第二步I(g)+N2O(g) → N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g) → N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O的分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是( )
A.I2浓度与N2O分解速率无关 B.第三步对总反应速率起决定作用
C.IO为反应的中间产物 D.第二步活化能比第三步小
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加入盐酸后能形成不溶于硝酸的白色沉淀的溶液中:K+、Ca2+、I-、OH-
B.c(S2-)=0.1mol·L-1的溶液中:Fe3+、Na+、Br-、ClO-
C.能使甲基橙变红的透明溶液中:SO42-、Mg2+、Cu2+、Cl-
D. = 0.1mol/L的溶液中:Fe2+、K+、NO3-、Br-
11.化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是( )
A.对反应:aA(s)+2B(g)xC(g),根据图①可以求出x=2
B.图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C.图③表示压强对可逆反应2A(g)+2B(g)3C(g)+D(g)的影响,乙的压强大
D.升高温度,图④表示的反应中反应物的转化率增大
12.在给定条件下,下列选项中所示的物质间转化均能实现的是( )
A.Al(s)Al(OH)3(s)Al2O3(s)
B.FeS2(s)SO2(g)BaSO3(s)
C.Cl2(g)NaClO(aq)HClO(aq)
D.Fe(s)Fe2O3(s)Fe2(SO4)3(aq)
13.下列实验的操作、现象和结论均正确的是( )
选项 实验操作 实验现象 实验结论,
A 向FeCl3和 KSCN的混合溶液中滴加NaOH溶液 混合溶液颜色逐渐变浅,有红褐色沉淀产生 Fe3+与SCN-生成Fe(SCN)3是可逆反应
B 将密封有红棕色NO2气体的圆底烧瓶浸入冰水中 气体颜色变浅 反应2NO2N2O4 △H>0
C 分别向0.1 mol·L- 1的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液 醋酸溶液中有气泡产生,硼酸溶液中无气泡 酸性: 硼酸>醋酸>碳酸
D 将0.1 mol·L-1AgNO3溶液和0.05 mol·L-1 NaCl溶液等体积混合,再向混合液中滴入0.05 mol·L-1NaI溶液 先产生白色沉淀,后产生黄色沉淀 Ksp(AgI)
X
M N Y
Z
A.Y的最高价氧化物对应水化物的酸性比Z的强
B.M元素与Z元素原子序数差为20
C.X的简单气态氢化物的沸点比Y的低
D.N原子的简单氢化物含有四对共用电子对
15.下列各图所示装置能达到实验目的的是( )
A.图甲,验证铁的析氢腐蚀 B.图乙,验证外加电流的阴极保护法
C.图丙,钢闸门采用牺牲阳极的阴极保护法 D.图丁,在铁制品上镀铜
16.在体积一定的密闭容器中给定物质 A、B、C 的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)cC(g),符合如图所示的关系(C%表示平衡混合气中产物 C 的百分含量,T 表示温度,p 表示压强)。下列说法正确的是( )
A.该反应的ΔH>0
B.该反应的计量系数:a+b<c
C.Y 轴是平衡混合气体中物质B 的百分含量
D.Y 轴是平衡混合气体的平均摩尔质量
17.用惰性电极实现电解,下列说法正确的是( )
A.电解氢氧化钠溶液,要消耗OH-,故溶液pH减小
B.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
C.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
D.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
18.要使0.1 mol·L-1 K2SO3溶液中的从c(SO32-)更接近0.1 mol·L-1,可以采取的措施是( )
A.通入SO2 B.加入SO3 C.加热 D.加入适量KOH固体
19.用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如下图。下列说法正确的是( )
A.电极N为负极,Fe(Ⅱ)为阳极
B.电解一段时间后,在Fe(Ⅰ)极附近有沉淀析出
C.M电极的电极反应式为CH3OH+8OH--6e-===CO32-+6H2O
D.电路中每转移6mol电子,最多有1molCr2O72-被还原
20.25℃时,用0.1mol·L-1 NaOH溶液滴定20mL 0.1mol·L-1 CH3COOH(Ka=1.75×10-5)溶液的过程中,消耗NaOH溶液的体积与溶液pH的关系如图所示。下列各项中粒子浓度关系正确的是( )
A.点①所示溶液中:2c(CH3COO-)-2c(CH3COOH) = c(H+)-c(OH-)
B.点②所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.点③所示溶液中:c(CH3COO-)-c(CH3COOH) = c(Na+)+2c(H+)-2c(OH-)
D.pH=12的溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
第Ⅱ卷(非选择题,共60分)
二、非选择题:本题共4大题,共60分。
21.(12分)
随着原子序数的递增,A~G七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。
(1)在A、B、F、G四种元素中,非金属性最弱的元素在周期表中的位置为 。
(2)A、B、F三种元素的原子半径由大到小的顺序是 (填元素符号)。
(3)E元素的最高价氧化物与氢氧化钠溶液反应的离子方程式是 。
(4)元素A与C形成的电子总数为22的分子的结构式为 。
(5)元素C与D按原子个数比1∶1形成的化合物的电子式为 ,其所含的化学键有 (填化学键类型)。
(6)用铂丝蘸取D的氯化物在火焰上灼烧,根据火焰呈现的特征颜色,可以判断D元素的存在,化学上把这种定性分析操作称为 。
22.(18分)
(1)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:
。
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量683.4kJ,则乙醇燃烧热的热化学方程式为 。
(3)甲烷完全燃烧反应的能量关系如图乙所示。
①CH4(g)+2O2(g) ===CO2(g)+2H2O(l) △H= (用含E1和E2的关系式表示)
②为提高燃料利用率,加入甲烷燃烧的催化剂,则E1 (填“变大”、“变小”或“不变”,下同),该反应的△H 。
(4)一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)CH3OH(g)达到平衡状态。
①该反应的平衡常数表达式K= ;根据右下图,升高温度,K值将 (填“增大”、“减小”或“不变”)。
②500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是 (用nB、tB表示)。
③判断该可逆反应达到化学平衡状态的标志是
(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
23.(16分)
Ⅰ.单质碘I2在医药、分析等方面应用广泛,回答下列问题。
(1)实验室配制碘水时,通常将I2溶于KI溶液:I2(aq)+I-(aq)I3-(aq)。关于该溶液,下列说法正确的是 。
A.滴入淀粉溶液,不变蓝 B.KI增大了I2的溶解度
C.加少量AgNO3固体平衡逆向移动 D.加水稀释,平衡正向移动
(2)I2加热易升华,升华时下列物理量增大的是 (选填编号)。
A.分子间作用力 B.分子间的平均距离
C.分子的数目 D.分子的质量
(3)碘量法测定氧化铜样品中CuO含量步骤如下:取2.00g氧化铜样品溶于足量稀硫酸(假设杂质不参与反应),充分反应后过滤。再向滤液中加入过量KI溶液反应,最后当加入90 mL
0.20 mol/LNa2S2O3溶液恰好完全反应。主要反应原理为:
2CuSO4+4KI=== 2CuI↓+I2+2K2SO4 2Na2S2O3+I2===2NaI+Na2S4O6
配制上述Na2S2O3溶液所需的定量仪器有 。
(4)上述氧化铜样品中CuO的质量分数为 。若配制Na2S2O3溶液时俯视读数,则测量结果 (选填“偏小”“偏大”“不变”)。
Ⅱ.高铁酸钾(K2FeO4)是优质水处理剂。实验室制取K2FeO4的装置如下图。
已知:高铁酸钾纯品为暗紫色、有光泽的粉末,极易溶于水形成浅紫红色溶液。
(5)A装置的作用是制取氯气,盛浓盐酸的仪器名称为 。
(6)装置C的作用是 。
(7) K2FeO4处理水的原理之一是在水中生成Fe3+,在这个过程中利用了K2FeO4的
性,Fe3+与水反应生成 后,能吸附水中的悬浮物,达到净水的目的。
(8) K2FeO4的制备原理为:3Cl2+2Fe(OH)3+10KOH===2K2FeO4+6KCl+8H2O。
B装置内出现 现象时,说明反应已停止。
24.(14分)
二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料,且电解原理在化学工业中有广泛应用。
Ⅰ.某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在该条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子 Fe3+ Fe2+ Al3+ Mn2+
开始沉淀 1.8 6.8 4.0 7.5
完全沉淀 3.2 8.0 5.0 8.4
(1)写出浸出时与铝元素有关的离子反应方程式 。
(2)上述“调pH除铁铝’’时,应控制的pH范围为 ;
“氟化除杂”中除去的离子为 。
(3)如何检验浸出液中是否含有Fe3+: 。
Ⅱ.下图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与碱性锌锰干电池相连,干电池总反应Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2。请回答下列问题:
(4)此装置工作时,干电池负极的电极反应式为 ;若X、Y都是惰性电极,a是100mL饱和NaCl溶液,当收集到1.12L H2(已折算为标准状况下)时,溶液的pH为 。(假设溶液温度为室温,溶液体积变化忽略不计)
(5)若Y极为铜锌合金,X极为纯铜,且电解质溶液中含有足量的Cu2+,通电一段时间后,若阳极恰好完全溶解,此时阴极质量增加7.68g,溶液质量增加0.03g,则合金中Cu、Zn的物质的量之比为 。
参考答案
1-5 CCDDC 6-10 BBBCC 11-15 BCACD 16-20 CCDBC
21.
第三周期第IVA族 r(Si)>r(C)>r(N)
Al2O3+2OH-===2AlO2-+H2O O=C=O
离子键和共价键(或非极性键) 焰色试验
22.
(1)H2-2e-+2OH-===2H2O
(2)C2H5OH(l)+3O2(g) ===2CO2(g)+3H2O(l) △H=-1366.8kJ/mol
(3) E1-E2 变小 不变
(4) 减小 mol·L-1·min-1 cd
23.
(1)BC
(2)B
(3)100mL容量瓶和托盘天平
(4)72.0% 偏小
(5)分液漏斗
(6)除尾气中的氯气,防止污染环境
(7)氧化性 Fe(OH)3胶体
(8)该装置出现黄绿色气体
24.
(1)Al2O3+6H+===3H2O+2Al3+
(2)5.0≤pH<7.5 Mg2+、Ca2+
(3)取少量浸出液,滴加KSCN试剂,若溶液变红色,则证明存在铁离子;若溶液不变红色,则证明不存在铁离子
(4)Zn-2e-+2OH-===Zn(OH)2 14
(5)3:1
同课章节目录
