河南省洛阳市洛宁县中2022-2023学年高二下学期第一次月考化学试卷(含答案)
文档属性
| 名称 | 河南省洛阳市洛宁县中2022-2023学年高二下学期第一次月考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 237.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-27 10:13:37 | ||
图片预览


文档简介
洛宁县中2022-2023学年高二下学期第一次月考
化学试题
考生注意:
1.本试卷共100分,考试时间100分钟。
2.请将各题答案填写在答题卡上。.
一、单选题(共18题,每题3分,共54分)
1. 下列叙述中不正确的是
A.在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
B. p轨道电子云轮廓图是哑铃形
C.电子的运动状态可从能层、能级、轨道、自旋方向4个方面进行描述
D.3p能级上只有一个空轨道的原子和3p能级上有两个未成对电子的原子对应为同一元素
2. 下列有关化学用语表达正确的是
A. N的原子结构示意图:
B. NH Cl电子式为
C. CS 的空间充填模型:
D.基态铜原子的价层电子排布图
3. 下列基态原子的电子排布式中其未成对电子数最多的是
A.1s 2s 2p 3s 3p 3d 4s B.1s 2s 2p 3s 3p 4s
C.1s 2s 2p 3s 3p 34 D.1s 2s 2p 3s 3p 34
4. 下列关于能层与能级的说法中正确的是
A.气体单质分子中,一定没有π键
B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数
C.同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D.1个原子轨道里最多只能容纳2个电子,但自旋方向相同
5. 下列有关化学用语表示正确的是
A.中子数为10的氟原子:10F
B.钠基态原子的核外电子排布式:1s 2s 2p 3s
C. Mg 的结构示意图:
D.2p3p4p能级轨道数目依次增多
6. 下列关于σ键和π键的说法中,不正确的是
A.σ键和π键能同时存在于同一个分子中
B.σ键是原子轨道“头碰头”重叠形成的,π键是原子轨道“肩并肩”重叠形成的
C.乙烯分子中含有5个σ键和1个π键
D. H 分子中只存在σ键,N 分子中只存在π键
7.下列说法错误的是
A.σ键的电子云重叠程度比π键大,稳定性强
B. N与3个H结合形成NH 分子,体现了共价键的饱和性
C.第三周期主族元素中第一电离能介于Mg和P之间的有3种
D.短周期主族元素中位于s区的有5种
8. 硼氢化钠(NaBH )具有很强的还原性,被称为“万能还原剂”,它在催化剂钉( Ru)表面与水反应的历程如图所示,下列说法错误的是
A.元素钉(44Ru)在元素周期表中位于d区
B. BH 分子中B原子为sp 杂化且不含孤电子对
C.过程④中产生1molH ,转移电子的物质的量为2mol
D.若将H O中的H用D代替,反应后生成的气体中含有H 、HD和D
9. X、Y、Z、W为原子序数依次增大的四种短周期主族元素。X的基态原子中s轨道电子总数是p轨道电子总数的两倍,Y的基态原子中未成对电子数是同周期最多的,Z是地壳中含量最多的金属元素,W和X位于同一主族。下列说法正确的是
A.原子半径:r(X)< r(Y)B.最高价氧化物对应水化物的酸性:XC. Y的简单气态氢化物的水溶液呈酸性
D. X、Y的简单气态氧化物的沸点高低:X>Y
10. 短期主族元素X、Y、Z、W、Q形成的化合物结构如图所示。其中Z、W相邻且与Q同周期,Y、Q同主族,X、Z同主族且Z原子半径小。下列说法错误的是
A. X、Y、Z、W四种元素可形成离子化合物
B.原子半径:X>Z>W
C.电负性:Z>W>Y
D. X与Z形成的两种常见化合物中,X原子杂化方式相同
11. 关于碳、氮、硅和硫及其化合物的叙述错误的是
A. Na S 中阴离子S32-中心原子的杂化方式为sp
B.在CCl 、SiCl 、NCl 中;键能:N-Cl>C-Cl>Si-Cl
C. N -离子和SCN 互为等电子体,空间构型均为直线形
D. 噻吩( )相对分子质量大于吡咯( ) 故噻吩的沸点高于吡咯
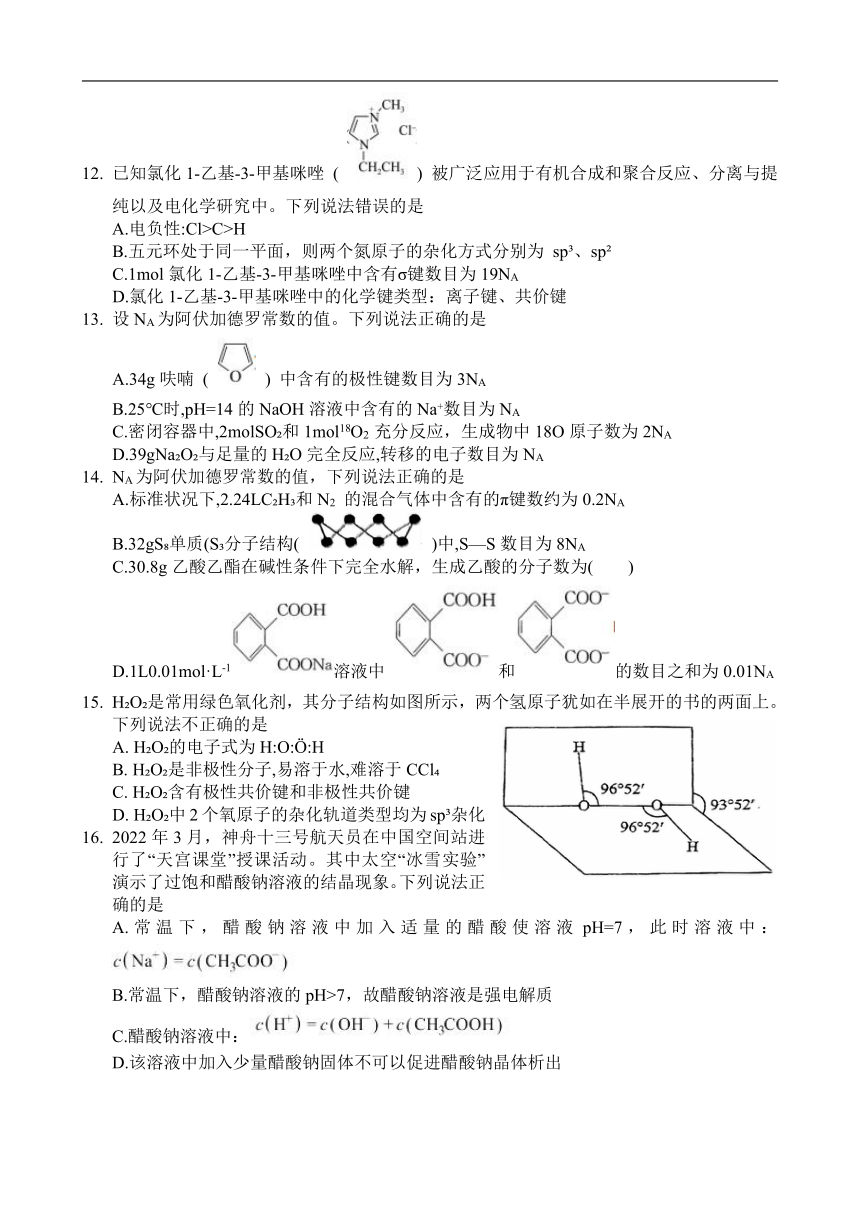
12. 已知氯化1-乙基-3-甲基咪唑 ( ) 被广泛应用于有机合成和聚合反应、分离与提纯以及电化学研究中。下列说法错误的是
A.电负性:Cl>C>H
B.五元环处于同一平面,则两个氮原子的杂化方式分别为 sp 、sp
C.1mol氯化1-乙基-3-甲基咪唑中含有σ键数目为19NA
D.氯化1-乙基-3-甲基咪唑中的化学键类型:离子键、共价键
13. 设NA为阿伏加德罗常数的值。下列说法正确的是
A.34g呋喃 ( ) 中含有的极性键数目为3NA
B.25℃时,pH=14的NaOH溶液中含有的Na 数目为NA
C.密闭容器中,2molSO 和1mol18O2 充分反应,生成物中18O原子数为2NA
D.39gNa O 与足量的H O完全反应,转移的电子数目为NA
14. NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24LC H 和N2 的混合气体中含有的π键数约为0.2NA
B.32gS 单质(S 分子结构( )中,S—S数目为8NA
C.30.8g乙酸乙酯在碱性条件下完全水解,生成乙酸的分子数为( )
D.1L0.01mol·L-1溶液中和的数目之和为0.01NA
15. H O 是常用绿色氧化剂,其分子结构如图所示,两个氢原子犹如在半展开的书的两面上。下列说法不正确的是
A. H O 的电子式为H:O: :H
B. H O 是非极性分子,易溶于水,难溶于CCl
C. H O 含有极性共价键和非极性共价键
D. H O 中2个氧原子的杂化轨道类型均为sp 杂化
16. 2022年3月,神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法正确的是
A.常温下,醋酸钠溶液中加入适量的醋酸使溶液pH=7,此时溶液中:
B.常温下,醋酸钠溶液的pH>7,故醋酸钠溶液是强电解质
C.醋酸钠溶液中:
D.该溶液中加入少量醋酸钠固体不可以促进醋酸钠晶体析出
17. 氯元素有多种化合价,可形成
等微粒。下列说法错误的是
A. 中Cl原子的杂化方式均为sp 杂化
B. 基态Cl原子核外电子的空间运动状态有9种
C. 键角:
D. Cl O的空间构型为V形,分子中的化学键的键长和键角可以通过X射线衍射实验获得
18.根据VSEPR模型判断下列各组分子或离子空间结构相同的是
A. SO 和CO B. BF 和NH C. PH 和H S D. CCl 和NH4+
二、非选择题(每空2分,共46分)
19.下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)③原子的核外电子轨道表示式是 。
(2)写出元素⑩的一价离子的核外电子排布式: ,该元素属于 区元素。
(3)在标号的主族元素中,电负性最大的是 (填元素符号)。
(4)元素④⑥⑦的气态氢化物热稳定性由强到弱的顺序为: (填化学式)。
(5)已知周期表中存在对角相似规则,如②与⑤在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑨的氢氧化物反应的化学方程式 。
20. A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素。已知:A原子核外电子只有一种自旋取向;B元素原子核外有三个未成对电子;C原子的第一至第四电离能数据分别为: ;D原子核外最外层所有p轨道均为半充满;E元素的族序数与周期序数的差为4;F元素原子的最外层只有一个电子,其次外层的所有电子均成对。
回答下列问题:
(1)写出A的元素符号 ,写出C元素在周期表中位置 ;
(2)电子占据最高能级的电子云轮廓图为 形
(3)比较D、E的电负性: > (用元素符号表示);
(4)写出元素F的基态原子简化电子排布式 。
(5)B、C、D三种元素的原子半径由大到小的顺序 (用元素符号表示)。
21.现有部分短周期主族元素的性质或原子结构如表所示:
元素编号 元素性质或原子结构
X 其电子层上M层与K层上的电子数相等
Y 其最简单氢化物丙的水溶液呈碱性
Z 其原子半径在所有原子中最小
A、B、D三种单质(单质分别由X、Y、Z元素组成)和甲、乙、丙、丁四种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种高能燃料,常用于火箭推进剂,1个丁分子中含有18个电子,其组成元素与丙相同。
请回答:
(1)元素X在周期表中的位置是 ,元素Y的原子结构示意图为 。
(2)单质B电子式为 ,YZ4+中心原子杂化类型为 ,空间结构为 。
(3)分子中的大π键可以用符号:表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。YO3- 中中心原子价层电子对数为 , YO3-的大π键可表示为 。
(4)丙中所包含的化学键类型有 (填字母序号)。
A.离子键 B.极性共价键 C.非极性共价键
(5)反应①的化学方程式为 。
(6)反应②中,0.5molNaClO参加反应时,转移1mol电子,反应②的离子方程式为: 。
参考答案
选择题
1-5DCCBC 6-10DCCBB 11-15DBAAB 16-18ACD
非选择题
19. (1)
(2)1s22s22p63s23p63d10 ds
(3) O
(4)H2O>H2S>PH3
(5)Be(OH)2+2NaOH=Na2BeO2+2H2O
20. (1)H 第三周期IIA族
(2)
(3)Cl P
(4)[Ar] 3d104s1
(5)Mg >P>N
21. (1)第三周期第IIA族
(2) sp3 正四面体
(3) 3
(4) B
(5)Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(6)2NH3+ClO-=N2H4+Cl-+H2O
化学试题
考生注意:
1.本试卷共100分,考试时间100分钟。
2.请将各题答案填写在答题卡上。.
一、单选题(共18题,每题3分,共54分)
1. 下列叙述中不正确的是
A.在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
B. p轨道电子云轮廓图是哑铃形
C.电子的运动状态可从能层、能级、轨道、自旋方向4个方面进行描述
D.3p能级上只有一个空轨道的原子和3p能级上有两个未成对电子的原子对应为同一元素
2. 下列有关化学用语表达正确的是
A. N的原子结构示意图:
B. NH Cl电子式为
C. CS 的空间充填模型:
D.基态铜原子的价层电子排布图
3. 下列基态原子的电子排布式中其未成对电子数最多的是
A.1s 2s 2p 3s 3p 3d 4s B.1s 2s 2p 3s 3p 4s
C.1s 2s 2p 3s 3p 34 D.1s 2s 2p 3s 3p 34
4. 下列关于能层与能级的说法中正确的是
A.气体单质分子中,一定没有π键
B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数
C.同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D.1个原子轨道里最多只能容纳2个电子,但自旋方向相同
5. 下列有关化学用语表示正确的是
A.中子数为10的氟原子:10F
B.钠基态原子的核外电子排布式:1s 2s 2p 3s
C. Mg 的结构示意图:
D.2p3p4p能级轨道数目依次增多
6. 下列关于σ键和π键的说法中,不正确的是
A.σ键和π键能同时存在于同一个分子中
B.σ键是原子轨道“头碰头”重叠形成的,π键是原子轨道“肩并肩”重叠形成的
C.乙烯分子中含有5个σ键和1个π键
D. H 分子中只存在σ键,N 分子中只存在π键
7.下列说法错误的是
A.σ键的电子云重叠程度比π键大,稳定性强
B. N与3个H结合形成NH 分子,体现了共价键的饱和性
C.第三周期主族元素中第一电离能介于Mg和P之间的有3种
D.短周期主族元素中位于s区的有5种
8. 硼氢化钠(NaBH )具有很强的还原性,被称为“万能还原剂”,它在催化剂钉( Ru)表面与水反应的历程如图所示,下列说法错误的是
A.元素钉(44Ru)在元素周期表中位于d区
B. BH 分子中B原子为sp 杂化且不含孤电子对
C.过程④中产生1molH ,转移电子的物质的量为2mol
D.若将H O中的H用D代替,反应后生成的气体中含有H 、HD和D
9. X、Y、Z、W为原子序数依次增大的四种短周期主族元素。X的基态原子中s轨道电子总数是p轨道电子总数的两倍,Y的基态原子中未成对电子数是同周期最多的,Z是地壳中含量最多的金属元素,W和X位于同一主族。下列说法正确的是
A.原子半径:r(X)< r(Y)
D. X、Y的简单气态氧化物的沸点高低:X>Y
10. 短期主族元素X、Y、Z、W、Q形成的化合物结构如图所示。其中Z、W相邻且与Q同周期,Y、Q同主族,X、Z同主族且Z原子半径小。下列说法错误的是
A. X、Y、Z、W四种元素可形成离子化合物
B.原子半径:X>Z>W
C.电负性:Z>W>Y
D. X与Z形成的两种常见化合物中,X原子杂化方式相同
11. 关于碳、氮、硅和硫及其化合物的叙述错误的是
A. Na S 中阴离子S32-中心原子的杂化方式为sp
B.在CCl 、SiCl 、NCl 中;键能:N-Cl>C-Cl>Si-Cl
C. N -离子和SCN 互为等电子体,空间构型均为直线形
D. 噻吩( )相对分子质量大于吡咯( ) 故噻吩的沸点高于吡咯
12. 已知氯化1-乙基-3-甲基咪唑 ( ) 被广泛应用于有机合成和聚合反应、分离与提纯以及电化学研究中。下列说法错误的是
A.电负性:Cl>C>H
B.五元环处于同一平面,则两个氮原子的杂化方式分别为 sp 、sp
C.1mol氯化1-乙基-3-甲基咪唑中含有σ键数目为19NA
D.氯化1-乙基-3-甲基咪唑中的化学键类型:离子键、共价键
13. 设NA为阿伏加德罗常数的值。下列说法正确的是
A.34g呋喃 ( ) 中含有的极性键数目为3NA
B.25℃时,pH=14的NaOH溶液中含有的Na 数目为NA
C.密闭容器中,2molSO 和1mol18O2 充分反应,生成物中18O原子数为2NA
D.39gNa O 与足量的H O完全反应,转移的电子数目为NA
14. NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24LC H 和N2 的混合气体中含有的π键数约为0.2NA
B.32gS 单质(S 分子结构( )中,S—S数目为8NA
C.30.8g乙酸乙酯在碱性条件下完全水解,生成乙酸的分子数为( )
D.1L0.01mol·L-1溶液中和的数目之和为0.01NA
15. H O 是常用绿色氧化剂,其分子结构如图所示,两个氢原子犹如在半展开的书的两面上。下列说法不正确的是
A. H O 的电子式为H:O: :H
B. H O 是非极性分子,易溶于水,难溶于CCl
C. H O 含有极性共价键和非极性共价键
D. H O 中2个氧原子的杂化轨道类型均为sp 杂化
16. 2022年3月,神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法正确的是
A.常温下,醋酸钠溶液中加入适量的醋酸使溶液pH=7,此时溶液中:
B.常温下,醋酸钠溶液的pH>7,故醋酸钠溶液是强电解质
C.醋酸钠溶液中:
D.该溶液中加入少量醋酸钠固体不可以促进醋酸钠晶体析出
17. 氯元素有多种化合价,可形成
等微粒。下列说法错误的是
A. 中Cl原子的杂化方式均为sp 杂化
B. 基态Cl原子核外电子的空间运动状态有9种
C. 键角:
D. Cl O的空间构型为V形,分子中的化学键的键长和键角可以通过X射线衍射实验获得
18.根据VSEPR模型判断下列各组分子或离子空间结构相同的是
A. SO 和CO B. BF 和NH C. PH 和H S D. CCl 和NH4+
二、非选择题(每空2分,共46分)
19.下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)③原子的核外电子轨道表示式是 。
(2)写出元素⑩的一价离子的核外电子排布式: ,该元素属于 区元素。
(3)在标号的主族元素中,电负性最大的是 (填元素符号)。
(4)元素④⑥⑦的气态氢化物热稳定性由强到弱的顺序为: (填化学式)。
(5)已知周期表中存在对角相似规则,如②与⑤在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑨的氢氧化物反应的化学方程式 。
20. A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素。已知:A原子核外电子只有一种自旋取向;B元素原子核外有三个未成对电子;C原子的第一至第四电离能数据分别为: ;D原子核外最外层所有p轨道均为半充满;E元素的族序数与周期序数的差为4;F元素原子的最外层只有一个电子,其次外层的所有电子均成对。
回答下列问题:
(1)写出A的元素符号 ,写出C元素在周期表中位置 ;
(2)电子占据最高能级的电子云轮廓图为 形
(3)比较D、E的电负性: > (用元素符号表示);
(4)写出元素F的基态原子简化电子排布式 。
(5)B、C、D三种元素的原子半径由大到小的顺序 (用元素符号表示)。
21.现有部分短周期主族元素的性质或原子结构如表所示:
元素编号 元素性质或原子结构
X 其电子层上M层与K层上的电子数相等
Y 其最简单氢化物丙的水溶液呈碱性
Z 其原子半径在所有原子中最小
A、B、D三种单质(单质分别由X、Y、Z元素组成)和甲、乙、丙、丁四种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种高能燃料,常用于火箭推进剂,1个丁分子中含有18个电子,其组成元素与丙相同。
请回答:
(1)元素X在周期表中的位置是 ,元素Y的原子结构示意图为 。
(2)单质B电子式为 ,YZ4+中心原子杂化类型为 ,空间结构为 。
(3)分子中的大π键可以用符号:表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。YO3- 中中心原子价层电子对数为 , YO3-的大π键可表示为 。
(4)丙中所包含的化学键类型有 (填字母序号)。
A.离子键 B.极性共价键 C.非极性共价键
(5)反应①的化学方程式为 。
(6)反应②中,0.5molNaClO参加反应时,转移1mol电子,反应②的离子方程式为: 。
参考答案
选择题
1-5DCCBC 6-10DCCBB 11-15DBAAB 16-18ACD
非选择题
19. (1)
(2)1s22s22p63s23p63d10 ds
(3) O
(4)H2O>H2S>PH3
(5)Be(OH)2+2NaOH=Na2BeO2+2H2O
20. (1)H 第三周期IIA族
(2)
(3)Cl P
(4)[Ar] 3d104s1
(5)Mg >P>N
21. (1)第三周期第IIA族
(2) sp3 正四面体
(3) 3
(4) B
(5)Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(6)2NH3+ClO-=N2H4+Cl-+H2O
同课章节目录
