1.2.1 原子结构与元素周期表 课件(共18张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.2.1 原子结构与元素周期表 课件(共18张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-27 00:00:00 | ||
图片预览



文档简介
(共18张PPT)
主要内容:原子结构与元素周期表
第二节 课时1
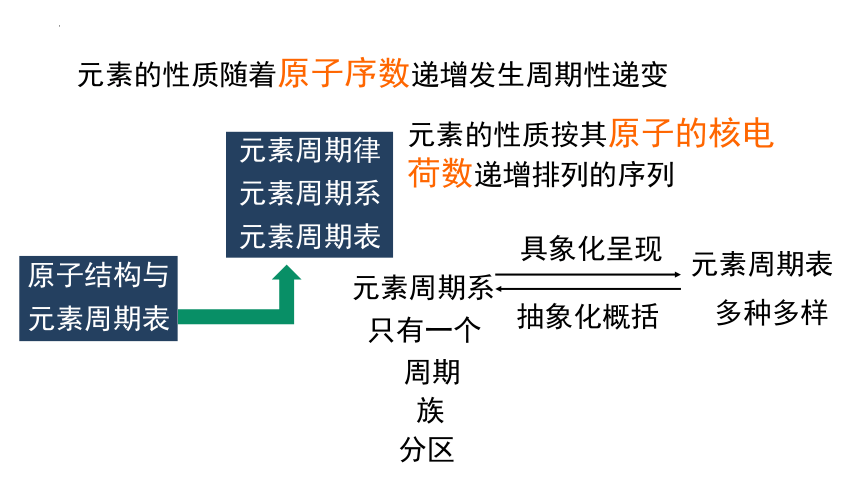
一、元素周期律、元素周期系和元素周期表
1.原子序数
2.元素周期律
3.元素周期系
原子结构与
元素周期表
元素周期律
元素周期系
元素周期表
元素的性质随着原子序数递增发生周期性递变
元素的性质按其原子的核电荷数递增排列的序列
元素周期系
元素周期表
只有一个
多种多样
具象化呈现
抽象化概括
周期
族
分区
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5 3s23p6
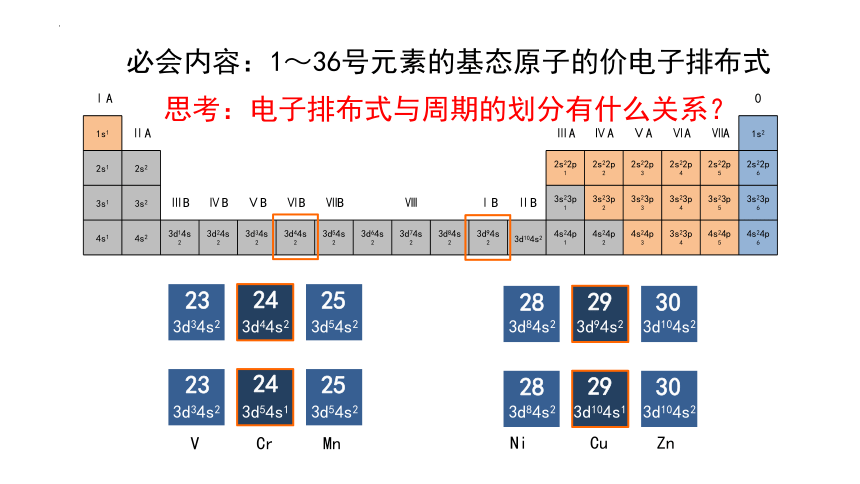
4s1 4s2 3d14s2 3d24s2 3d34s2 3d44s2 3d54s2 3d64s2 3d74s2 3d84s2 3d94s2 4s24p1 4s24p2 4s24p3 3s23p4 4s24p5 4s24p6
3d104s2
Cr
Mn
V
Cu
Zn
Ni
3d34s2
3d44s2
3d54s2
3d84s2
3d94s2
3d104s2
3d34s2
3d54s1
3d54s2
3d84s2
3d104s1
3d104s2
23
24
25
23
24
25
28
29
30
28
29
30
必会内容:1~36号元素的基态原子的价电子排布式
思考:电子排布式与周期的划分有什么关系?
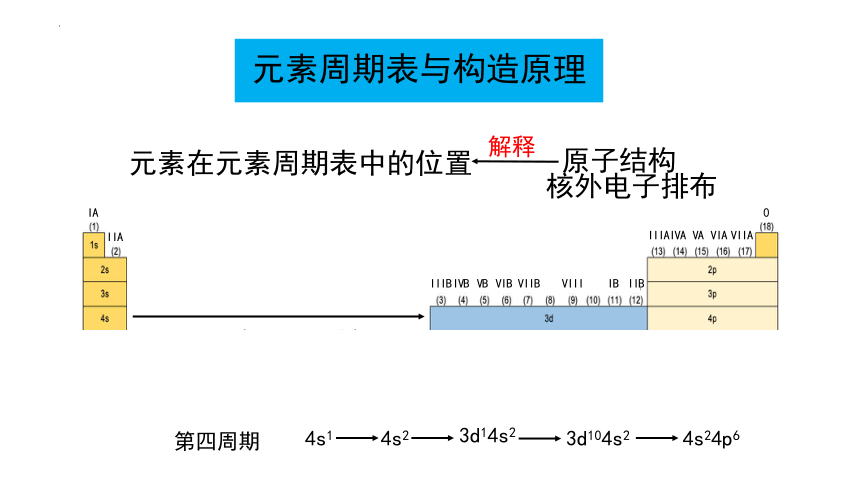
第四周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
4s1
4s2
3d14s2
IIIB
IVB
VB
VIB
VIIB
VIII
IB
IIB
3d104s2
4s24p6
元素周期表与构造原理
元素在元素周期表中的位置
原子结构
解释
核外电子排布
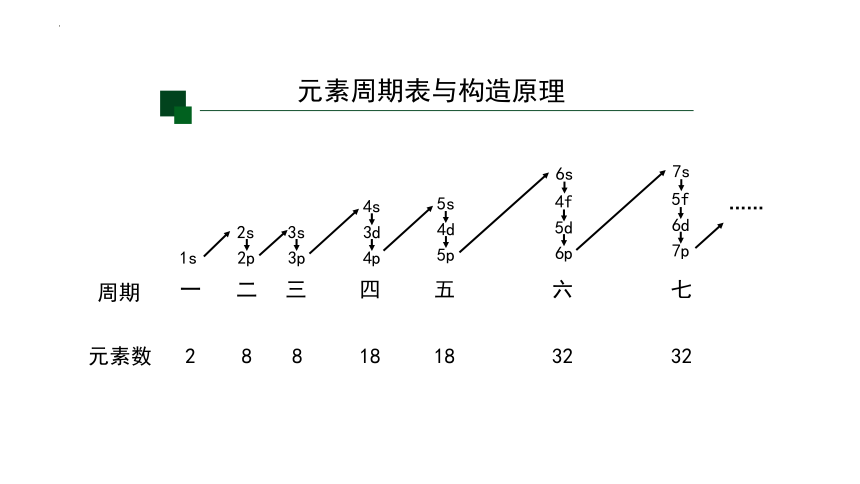
元素周期表与构造原理
周期
元素数
1s
2s
2p
3s
3p
4s
3d
4p
5s
4d
5p
4f
5d
6p
6s
5f
6d
7p
7s
……
一
二
三
四
五
六
七
2
8
8
18
18
32
32
元素周期表与构造原理
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
ns2np5
ns1
ns2
ns2np1
思考:核外电子排布与族的划分有什么关系?
二、构造原理与元素周期表
元素周期表中,同族元素 相同,这是同族元素性质相似的结构基础。
价层电子数
例如,元素周期表最左侧第ⅠA族元素的基态原子最外层都只有一个电子,即ns1;元素周期表最右侧稀有气体元素的基态原子,除氦(1s2)外,最外层都是8电子,即ns2np6
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
过渡元素
3d能级
思考:为什么过渡元素都是金属元素?
二、构造原理与元素周期表
从第四周期开始的长周期,比短周期多出的元素全部是金属元素,这是因为它们的最外层电子数始终不超过2, 即为ns1~2(Pd例外)。而第六、七周期比第四、五周期多出14个元素的基态原子最外层也只有2个s电子,所以也是金属元素。
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
s区
p区
d区
ds区
f区
ns1~2
思考:为什么要这样分区?
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
s区
p区
d区
ds区
f区
ns1~2
电子填充的最后一个能级是s能级
电子填充的最后一个能级是p能级
电子填充的最后一个能级是d能级
ns2np1~6
电子排布式d10s1(IB族也叫铜副族)或者d10s2 (IIB族也叫锌副族),都是过渡金属元素,由于d层是满的,故与其他过渡金属不同。
镧系元素和锕系元素
分区
电子填入的最后能级
周期
族
电子层数
最外层电子数(主族)
构
性
位
元素周期律
元素的性质随元素原子的核电荷数
递增发生周期性递变
原子序数=质子数=核外电子数
总结
1.下列有关元素周期系的叙述正确的是 ( )
A.元素周期系中ⅠA族元素又称为碱金属元素
B.元素周期系中每一周期元素的种类均相等
C.元素周期系的形成原因是核外电子排布的周期性变化
D.每一周期的元素最外层电子数均是1→8,周而复始
课堂练习
【答案】C
【解析】
A、元素周期系中ⅠA族元素除氢外又称为碱金属元素,故A错误;
B、元素周期系中每一周期元素的种类有2种、8种、18种、54种等,所以每一周期元素的种类不一定相等,故B错误;
C、元素周期系的形成原因是核外电子排布的周期性变化,故C正确;
D、第一周期的元素最外层电子数是1→2,故D错误。
2、某元素原子的电子排布式为
根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第______周期,该周期的元素种数是______;
(2)该元素处于元素周期表的第______族,该族的非金属元素种数是______。
(3)试推测该元素处于元素周期表的______区,该区包含族的种类是______。
课堂练习
【答案】四 18 ⅢA 1 p ⅢA~ⅦA族、0族
【详解】
(1)根据元素原子有4个电子层容纳电子,则该元素处于第四周期,该周期元素原子的电子排布式为[Ar]3d1-104s1-24p1-6,故共有18种元素;
(2)由外围电子排布为4s24p1,可知该元素处于p区,为主族元素,最外层电子数为3,处于ⅢA族,本族元素只有一种非金属元素--硼;
(3)由外围电子排布为4s24p1,可知该元素处于p区,由该区元素的价层电子的电子排布为ns24p1-6,可以确定所包含元素族的种数为ⅢA~ⅦA族、零族。
主要内容:原子结构与元素周期表
第二节 课时1
一、元素周期律、元素周期系和元素周期表
1.原子序数
2.元素周期律
3.元素周期系
原子结构与
元素周期表
元素周期律
元素周期系
元素周期表
元素的性质随着原子序数递增发生周期性递变
元素的性质按其原子的核电荷数递增排列的序列
元素周期系
元素周期表
只有一个
多种多样
具象化呈现
抽象化概括
周期
族
分区
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5 3s23p6
4s1 4s2 3d14s2 3d24s2 3d34s2 3d44s2 3d54s2 3d64s2 3d74s2 3d84s2 3d94s2 4s24p1 4s24p2 4s24p3 3s23p4 4s24p5 4s24p6
3d104s2
Cr
Mn
V
Cu
Zn
Ni
3d34s2
3d44s2
3d54s2
3d84s2
3d94s2
3d104s2
3d34s2
3d54s1
3d54s2
3d84s2
3d104s1
3d104s2
23
24
25
23
24
25
28
29
30
28
29
30
必会内容:1~36号元素的基态原子的价电子排布式
思考:电子排布式与周期的划分有什么关系?
第四周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
4s1
4s2
3d14s2
IIIB
IVB
VB
VIB
VIIB
VIII
IB
IIB
3d104s2
4s24p6
元素周期表与构造原理
元素在元素周期表中的位置
原子结构
解释
核外电子排布
元素周期表与构造原理
周期
元素数
1s
2s
2p
3s
3p
4s
3d
4p
5s
4d
5p
4f
5d
6p
6s
5f
6d
7p
7s
……
一
二
三
四
五
六
七
2
8
8
18
18
32
32
元素周期表与构造原理
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
ns2np5
ns1
ns2
ns2np1
思考:核外电子排布与族的划分有什么关系?
二、构造原理与元素周期表
元素周期表中,同族元素 相同,这是同族元素性质相似的结构基础。
价层电子数
例如,元素周期表最左侧第ⅠA族元素的基态原子最外层都只有一个电子,即ns1;元素周期表最右侧稀有气体元素的基态原子,除氦(1s2)外,最外层都是8电子,即ns2np6
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
过渡元素
3d能级
思考:为什么过渡元素都是金属元素?
二、构造原理与元素周期表
从第四周期开始的长周期,比短周期多出的元素全部是金属元素,这是因为它们的最外层电子数始终不超过2, 即为ns1~2(Pd例外)。而第六、七周期比第四、五周期多出14个元素的基态原子最外层也只有2个s电子,所以也是金属元素。
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
s区
p区
d区
ds区
f区
ns1~2
思考:为什么要这样分区?
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
s区
p区
d区
ds区
f区
ns1~2
电子填充的最后一个能级是s能级
电子填充的最后一个能级是p能级
电子填充的最后一个能级是d能级
ns2np1~6
电子排布式d10s1(IB族也叫铜副族)或者d10s2 (IIB族也叫锌副族),都是过渡金属元素,由于d层是满的,故与其他过渡金属不同。
镧系元素和锕系元素
分区
电子填入的最后能级
周期
族
电子层数
最外层电子数(主族)
构
性
位
元素周期律
元素的性质随元素原子的核电荷数
递增发生周期性递变
原子序数=质子数=核外电子数
总结
1.下列有关元素周期系的叙述正确的是 ( )
A.元素周期系中ⅠA族元素又称为碱金属元素
B.元素周期系中每一周期元素的种类均相等
C.元素周期系的形成原因是核外电子排布的周期性变化
D.每一周期的元素最外层电子数均是1→8,周而复始
课堂练习
【答案】C
【解析】
A、元素周期系中ⅠA族元素除氢外又称为碱金属元素,故A错误;
B、元素周期系中每一周期元素的种类有2种、8种、18种、54种等,所以每一周期元素的种类不一定相等,故B错误;
C、元素周期系的形成原因是核外电子排布的周期性变化,故C正确;
D、第一周期的元素最外层电子数是1→2,故D错误。
2、某元素原子的电子排布式为
根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第______周期,该周期的元素种数是______;
(2)该元素处于元素周期表的第______族,该族的非金属元素种数是______。
(3)试推测该元素处于元素周期表的______区,该区包含族的种类是______。
课堂练习
【答案】四 18 ⅢA 1 p ⅢA~ⅦA族、0族
【详解】
(1)根据元素原子有4个电子层容纳电子,则该元素处于第四周期,该周期元素原子的电子排布式为[Ar]3d1-104s1-24p1-6,故共有18种元素;
(2)由外围电子排布为4s24p1,可知该元素处于p区,为主族元素,最外层电子数为3,处于ⅢA族,本族元素只有一种非金属元素--硼;
(3)由外围电子排布为4s24p1,可知该元素处于p区,由该区元素的价层电子的电子排布为ns24p1-6,可以确定所包含元素族的种数为ⅢA~ⅦA族、零族。
