山东省泰安市新泰市重点中学校2022-2023学年高二下学期3月第一次质量检测化学试题(含答案)
文档属性
| 名称 | 山东省泰安市新泰市重点中学校2022-2023学年高二下学期3月第一次质量检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 991.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-27 15:54:10 | ||
图片预览




文档简介
新泰市重点中学校2022-2023学年高二下学期3月第一次质量检测
化学试题
满分:100分 时间:90分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填涂在答题卡上相应的位置
可能用到的相当原子质量:C-12 N-14 O-16 F-19 Na-23 S-32 Cl-35.5 Mn-55 Cu-64 Zn-65 Se-79
第Ⅰ卷(共40分)
一、单选题(各小题只有一个正确答案,每小题2分,共20分)
1. 下列说法正确的是
A. H2O比H2S稳定是因为H-O键的键能大于H-S键的键能
B. 电子排布式1s22s22p63s23p10违反了能量最低原则
C. 表示的原子能量处于最低状态
D 卢瑟福发现“葡萄干布丁”模型
2. 下列叙述不正确的是
A. 含有金属阳离子的晶体不一定是离子晶体
B. 化合物硫氰化铁和氢氧化二氨合银中都存在配位键
C. HF、CH3CH2OH、SO2都易溶于水,且原因相同
D. MgO熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能
3. 某晶体中含有极性键,关于该晶体的说法错误的是
A. 不可能有很高的熔沸点 B. 不可能是单质
C. 可能是有机物 D. 可能是离子晶体
4. 下列说法中正确的是
①晶体中分子间作用力越大,分子越稳定 ②共价晶体中共价键越强,熔点越高 ③干冰是分子通过氢键和分子间作用力有规则排列成的分子晶体 ④在和晶体中,阴、阳离子数之比相等 ⑤正四面体构型的分子,键角都是109°28′,其晶体类型可能是原子晶体或分子晶体 ⑥分子晶体中都含有化学键 ⑦含4.8g碳元素的金刚石晶体中的共价键的物质的量为0.8mol
A. ①②④⑤ B. ②④⑦ C. ⑤⑥⑦ D. ②④⑤⑦
5. 下列关于分子或晶体中中心原子的杂化类型的说法中正确的是
A. CH3CH3中的两个碳原子与BF3中的硼原子均为sp2杂化
B. 晶体硅和石英(SiO2)晶体中硅原子均为sp3杂化
C. BeCl2中的铍原子和H2O中的氧原子均为sp1杂化
D. CO2中的碳原子与CH2=CH2中的两个碳原子均为sp1杂化
6. 食盐晶体的结构示意图如图所示.已知食盐的密度为,摩尔质量为,阿伏伽德罗常数的值为,则在食盐晶体中和的最小距离大约是
A. B. C. D.
7. 在半导体生产或灭火剂的使用中,会向空气逸散气体,如NF3、CHClFCF3、C3F8,它们虽是微量的,有些却是强温室气体,下列推测不正确的是
A. 熔点:NF3>C3F8
B. CHClFCF3存在手性异构
C. C3F8在CCl4中的溶解度比在水中大
D. 由价层电子对互斥理论可确定NF3中N原子是sp3杂化,分子呈三角锥形
8. 有关晶体的结构如图所示,下列说法中不正确的是
A. 在NaCl晶体(图甲)中,距最近的形成正八面体
B. 该气态团簇分子(图乙)的分子式为或
C. 在晶体(图丙)中,一个分子周围有12个分子紧邻
D. 在碘晶体(图丁)中,只存在一种作用力
9. 某研究小组发现首例带结晶水的晶体在5K下呈现超导性。据报道,该晶体中含有最简式为CoO2的层状结构,结构如图所示(小球表示Co原子,大球表示O原子)。下列用粗线画出的CoO2层状结构的晶胞示意图不符合化学式的是
A. B. C. D.
10. 下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
A 、空间构型均为角形 和是等电子体
B 白磷为正四面体分子 白磷分子中P—Р键间的夹角是109.5°
C 硼酸固体难溶于水,加热溶解度增大 加热后,硼酸分子之间的氢键部分断裂,与水分子产生氢键作用
D HF的沸点高于HCl H—F的键能比H—Cl的键能大
A. A B. B C. C D. D
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
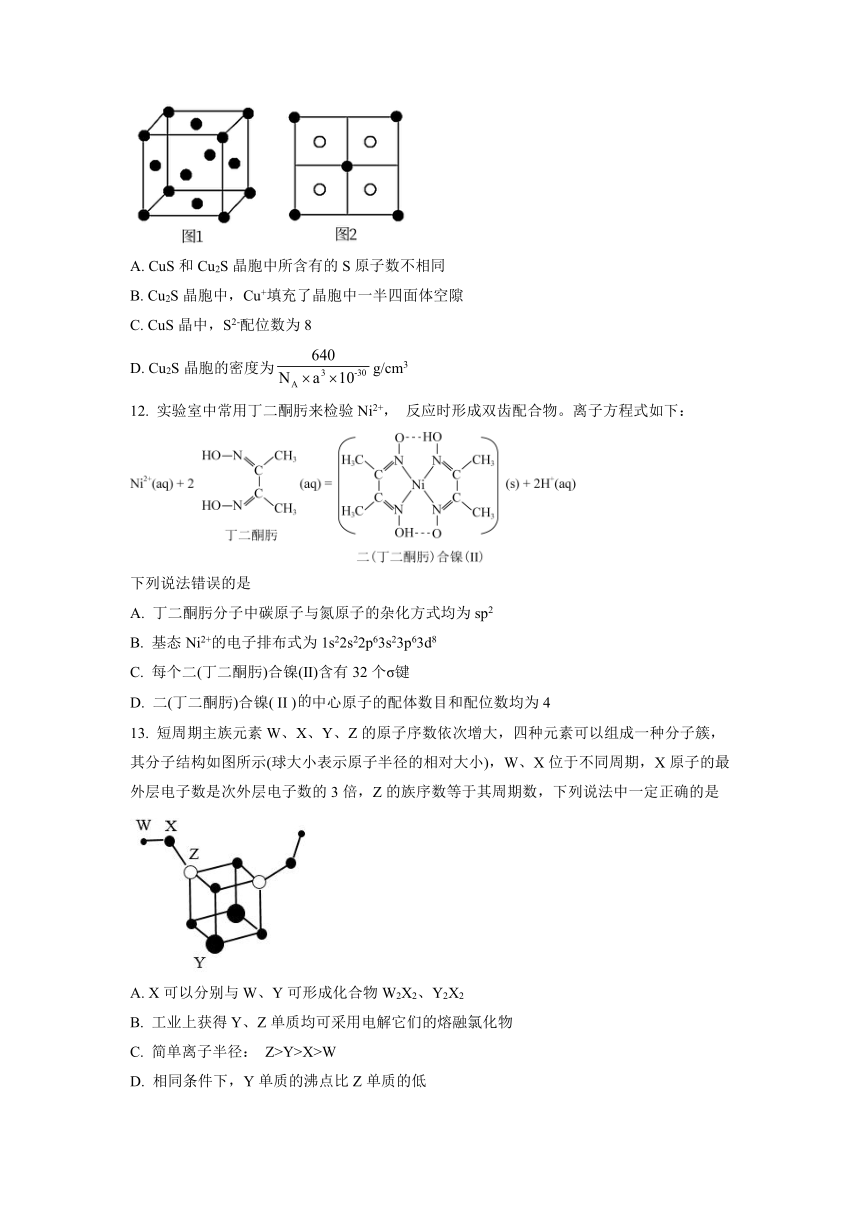
11. 常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们的晶胞上有相同的侧视图如图2所示。Cu2S的晶胞参数apm阿伏伽德罗常数的值为NA,下列说法正确的是
A. CuS和Cu2S晶胞中所含有的S原子数不相同
B. Cu2S晶胞中,Cu+填充了晶胞中一半四面体空隙
C. CuS晶中,S2-配位数为8
D. Cu2S晶胞的密度为g/cm3
12. 实验室中常用丁二酮肟来检验Ni2+, 反应时形成双齿配合物。离子方程式如下:
下列说法错误的是
A. 丁二酮肟分子中碳原子与氮原子的杂化方式均为sp2
B. 基态Ni2+的电子排布式为1s22s22p63s23p63d8
C. 每个二(丁二酮肟)合镍(II)含有32个σ键
D. 二(丁二酮肟)合镍( II )中心原子的配体数目和配位数均为4
13. 短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可以组成一种分子簇,其分子结构如图所示(球大小表示原子半径的相对大小),W、X位于不同周期,X原子的最外层电子数是次外层电子数的3倍,Z的族序数等于其周期数,下列说法中一定正确的是
A. X可以分别与W、Y可形成化合物W2X2、Y2X2
B. 工业上获得Y、Z单质均可采用电解它们的熔融氯化物
C. 简单离子半径: Z>Y>X>W
D. 相同条件下,Y单质的沸点比Z单质的低
14. 三氯化氮()常温是一种淡黄色液体,其分子结构呈三角锥形,以下关于的说法中正确的是
A. 它是一种非极性分子
B. 已知中N元素为 3价,所以水解产物为和HClO
C. 其挥发性比小
D 它能以配位键与结合,生成
15. 钙钛矿是以俄罗斯矿物学家Perovski的名字命名的,最初单指钛酸钙这种矿物[如图(a)],此后,把结构与之类似的晶体(化学式与钛酸钙相同)统称为钙钛矿物质。某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中为,另两种离子为和。
下列说法错误的是
A. 钛酸钙的化学式为
B. 图(b)中,为
C. 中含有配位键
D. 晶胞中与每个紧邻的有6个
第Ⅱ卷(非选择题 共60分)
16. 周期表前四周期的元素a、b、c、d、e原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,其次外层所有轨道均是全满状态。回答下列问题:
(1)b、c、d的简单离子半径最大的是___________(填离子符号),e的晶胞结构中e配位数为___________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的电子式为___________;分子中既含有极性共价键、又含有非极性共价键的化合物是___________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是___________(任写一种);酸根呈三角锥结构的酸是___________(填化学式)。
(4)e和c形成的一种离子化合物的晶体结构如图所示,则e离子的电荷为___________。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构。该化合物中,阴离子为___________,阳离子中存在的化学键类型有___________。
17. 吡啶()是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
请回答下列问题:
(1)MPy分子中碳原子的杂化方式为___________,EPy中组成元素的第一电离能由大到小的顺序为___________。
(2)EPy晶体中微粒间的作用力类型有___________(填标号)。
a.离子键b.金属键c.极性键d.非极性键e.配位键f.氢键
(3)反应①中每生成1molEPy,断裂___________个π键,形成___________个σ键。
(4)分子中的大π键可用表示,其中m表示形成大π键的原子个数,n表示参与形成大π键的电子个数,则吡啶中大π键表示为___________。
(5)吡啶、与形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体科学研究表明,顺式分子具有抗癌活性。
的配位数为___________。顺式二氯二吡啶合铂分子能否溶于水___________(填“能”或“否”),简述理由___________。
18. 三明清流“天芳悦潭”温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。回答下列问题:
(1)基态Ge原子价电子排布图为___________。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:;二锗酸钠:等),也能形成类似于烷烃的锗烷()。
①中阴离子的空间结构是___________。
②推测1mol中含有的σ键的数目是___________(用表示阿伏加德罗常数值)。
(3)利用离子液体[EMIM][]可电沉积还原金属Ge,其熔点只有7℃,其中结构如图所示。
①该物质的晶体类型是___________。
②离子中组成元素的电负性由小到大的顺序是___________。
(4)独立的分子中H—N—H的键角为107.3°,离子中H—N—H的键角___________107.3°(填“大于”、“小于”或“等于”)。
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,该晶胞中两个Zn原子之间的间距是___________;乙图为甲图的俯视图,A点坐标为(0,0,0),B点坐标为,则D点坐标为___________;若该晶胞密度为,则阿伏加德罗常数为___________(只列出计算式)。
19. 铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
(1)铁、铬、锰属于周期表中的___区元素。
(2)基态铬原子和基态锰原子中第一电离能较大的是___(填元素符号),原因为:___。
(3)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgCl沉淀的物质的量之比为3:2:1。
①呈暗绿色的配合物内界的化学式为___。
②H2O分子的VSEPR模型为___。
(4)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为___。
(5)一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。
①该晶胞中由O2-形成的正八面体空隙数目为___。
②设NA为阿伏伽德罗常数的值,晶胞中距离最近的两个O2-之间的距离为apm,则MnO晶体的密度ρ=___g·cm-3。(用含a、NA的代数式表示)。
20. Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)写出基态Р原子的电子排布式___________,有___________种空间运动状态,占据最高能级的电子云轮廓图为___________形。
(2)浓磷酸在常温下呈粘稠状,原因___________,浓磷酸在200~300℃时脱水生成焦磷酸(化学式:),焦磷酸的结构式为___________。
(3)的晶胞结构示意图如(a)所示。其中О围绕Fe和Р分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有的单元数有___________个。
电池充电时,脱出部分,形成,结构示意图如(b)所示,则x=___________,___________。
新泰市重点中学校2022-2023学年高二下学期3月第一次质量检测
化学试题 答案
第Ⅰ卷(共40分)
一、单选题(各小题只有一个正确答案,每小题2分,共20分)
【1题答案】
【答案】A
【2题答案】
【答案】C
【3题答案】
【答案】A
【4题答案】
【答案】B
【5题答案】
【答案】B
【6题答案】
【答案】B
【7题答案】
【答案】A
【8题答案】
【答案】D
【9题答案】
【答案】D
【10题答案】
【答案】C
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
【11题答案】
【答案】D
【12题答案】
【答案】AD
【13题答案】
【答案】D
【14题答案】
【答案】B
【15题答案】
【答案】BD
第Ⅱ卷(非选择题 共60分)
【16题答案】
【答案】(1) ①. S2- ②. 12
(2) ①. ②. H2O2、N2H4
(3) ①. HNO2或HNO3 ②. H2SO3
(4)+1 (5) ①. ②. 共价键、配位键
【17题答案】
【答案】(1) ①. sp2、sp3 ②. N>O>C>H
(2)cdf (3) ①. NA ②. 2NA
(4)
(5) ①. 4 ②. 能 ③. 顺式二氯二吡啶合铂分子是极性分子,依据相似相溶原理,能溶于水
【18题答案】
【答案】(1) (2) ①. 平面三角形 ②. (3n+1)NA
(3) ①. 离子晶体 ②. H(4)大于 (5) ①. ②. ③.
【19题答案】
【答案】 ①. d ②. Mn ③. 基态Mn原子的核外电子排布式为[Ar]3d54s2,4s能级是全满结构,更稳定,失去一个电子所需能量更高 ④. [Cr(H2O)5C1]2+ ⑤. 正四面体形 ⑥. F-半径更小,MnF2的晶格能更大,熔点更高 ⑦. 4 ⑧. ×1030
【20题答案】
【答案】(1) ①. 1s22s22p63s23p3 ②. 9 ③. 哑铃形(纺锤形)
(2) ①. 磷酸分子间存在氢键 ②.
(3) ①. 4 ②. ③. 3∶1
化学试题
满分:100分 时间:90分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填涂在答题卡上相应的位置
可能用到的相当原子质量:C-12 N-14 O-16 F-19 Na-23 S-32 Cl-35.5 Mn-55 Cu-64 Zn-65 Se-79
第Ⅰ卷(共40分)
一、单选题(各小题只有一个正确答案,每小题2分,共20分)
1. 下列说法正确的是
A. H2O比H2S稳定是因为H-O键的键能大于H-S键的键能
B. 电子排布式1s22s22p63s23p10违反了能量最低原则
C. 表示的原子能量处于最低状态
D 卢瑟福发现“葡萄干布丁”模型
2. 下列叙述不正确的是
A. 含有金属阳离子的晶体不一定是离子晶体
B. 化合物硫氰化铁和氢氧化二氨合银中都存在配位键
C. HF、CH3CH2OH、SO2都易溶于水,且原因相同
D. MgO熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能
3. 某晶体中含有极性键,关于该晶体的说法错误的是
A. 不可能有很高的熔沸点 B. 不可能是单质
C. 可能是有机物 D. 可能是离子晶体
4. 下列说法中正确的是
①晶体中分子间作用力越大,分子越稳定 ②共价晶体中共价键越强,熔点越高 ③干冰是分子通过氢键和分子间作用力有规则排列成的分子晶体 ④在和晶体中,阴、阳离子数之比相等 ⑤正四面体构型的分子,键角都是109°28′,其晶体类型可能是原子晶体或分子晶体 ⑥分子晶体中都含有化学键 ⑦含4.8g碳元素的金刚石晶体中的共价键的物质的量为0.8mol
A. ①②④⑤ B. ②④⑦ C. ⑤⑥⑦ D. ②④⑤⑦
5. 下列关于分子或晶体中中心原子的杂化类型的说法中正确的是
A. CH3CH3中的两个碳原子与BF3中的硼原子均为sp2杂化
B. 晶体硅和石英(SiO2)晶体中硅原子均为sp3杂化
C. BeCl2中的铍原子和H2O中的氧原子均为sp1杂化
D. CO2中的碳原子与CH2=CH2中的两个碳原子均为sp1杂化
6. 食盐晶体的结构示意图如图所示.已知食盐的密度为,摩尔质量为,阿伏伽德罗常数的值为,则在食盐晶体中和的最小距离大约是
A. B. C. D.
7. 在半导体生产或灭火剂的使用中,会向空气逸散气体,如NF3、CHClFCF3、C3F8,它们虽是微量的,有些却是强温室气体,下列推测不正确的是
A. 熔点:NF3>C3F8
B. CHClFCF3存在手性异构
C. C3F8在CCl4中的溶解度比在水中大
D. 由价层电子对互斥理论可确定NF3中N原子是sp3杂化,分子呈三角锥形
8. 有关晶体的结构如图所示,下列说法中不正确的是
A. 在NaCl晶体(图甲)中,距最近的形成正八面体
B. 该气态团簇分子(图乙)的分子式为或
C. 在晶体(图丙)中,一个分子周围有12个分子紧邻
D. 在碘晶体(图丁)中,只存在一种作用力
9. 某研究小组发现首例带结晶水的晶体在5K下呈现超导性。据报道,该晶体中含有最简式为CoO2的层状结构,结构如图所示(小球表示Co原子,大球表示O原子)。下列用粗线画出的CoO2层状结构的晶胞示意图不符合化学式的是
A. B. C. D.
10. 下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
A 、空间构型均为角形 和是等电子体
B 白磷为正四面体分子 白磷分子中P—Р键间的夹角是109.5°
C 硼酸固体难溶于水,加热溶解度增大 加热后,硼酸分子之间的氢键部分断裂,与水分子产生氢键作用
D HF的沸点高于HCl H—F的键能比H—Cl的键能大
A. A B. B C. C D. D
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11. 常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们的晶胞上有相同的侧视图如图2所示。Cu2S的晶胞参数apm阿伏伽德罗常数的值为NA,下列说法正确的是
A. CuS和Cu2S晶胞中所含有的S原子数不相同
B. Cu2S晶胞中,Cu+填充了晶胞中一半四面体空隙
C. CuS晶中,S2-配位数为8
D. Cu2S晶胞的密度为g/cm3
12. 实验室中常用丁二酮肟来检验Ni2+, 反应时形成双齿配合物。离子方程式如下:
下列说法错误的是
A. 丁二酮肟分子中碳原子与氮原子的杂化方式均为sp2
B. 基态Ni2+的电子排布式为1s22s22p63s23p63d8
C. 每个二(丁二酮肟)合镍(II)含有32个σ键
D. 二(丁二酮肟)合镍( II )中心原子的配体数目和配位数均为4
13. 短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可以组成一种分子簇,其分子结构如图所示(球大小表示原子半径的相对大小),W、X位于不同周期,X原子的最外层电子数是次外层电子数的3倍,Z的族序数等于其周期数,下列说法中一定正确的是
A. X可以分别与W、Y可形成化合物W2X2、Y2X2
B. 工业上获得Y、Z单质均可采用电解它们的熔融氯化物
C. 简单离子半径: Z>Y>X>W
D. 相同条件下,Y单质的沸点比Z单质的低
14. 三氯化氮()常温是一种淡黄色液体,其分子结构呈三角锥形,以下关于的说法中正确的是
A. 它是一种非极性分子
B. 已知中N元素为 3价,所以水解产物为和HClO
C. 其挥发性比小
D 它能以配位键与结合,生成
15. 钙钛矿是以俄罗斯矿物学家Perovski的名字命名的,最初单指钛酸钙这种矿物[如图(a)],此后,把结构与之类似的晶体(化学式与钛酸钙相同)统称为钙钛矿物质。某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中为,另两种离子为和。
下列说法错误的是
A. 钛酸钙的化学式为
B. 图(b)中,为
C. 中含有配位键
D. 晶胞中与每个紧邻的有6个
第Ⅱ卷(非选择题 共60分)
16. 周期表前四周期的元素a、b、c、d、e原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,其次外层所有轨道均是全满状态。回答下列问题:
(1)b、c、d的简单离子半径最大的是___________(填离子符号),e的晶胞结构中e配位数为___________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的电子式为___________;分子中既含有极性共价键、又含有非极性共价键的化合物是___________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是___________(任写一种);酸根呈三角锥结构的酸是___________(填化学式)。
(4)e和c形成的一种离子化合物的晶体结构如图所示,则e离子的电荷为___________。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构。该化合物中,阴离子为___________,阳离子中存在的化学键类型有___________。
17. 吡啶()是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
请回答下列问题:
(1)MPy分子中碳原子的杂化方式为___________,EPy中组成元素的第一电离能由大到小的顺序为___________。
(2)EPy晶体中微粒间的作用力类型有___________(填标号)。
a.离子键b.金属键c.极性键d.非极性键e.配位键f.氢键
(3)反应①中每生成1molEPy,断裂___________个π键,形成___________个σ键。
(4)分子中的大π键可用表示,其中m表示形成大π键的原子个数,n表示参与形成大π键的电子个数,则吡啶中大π键表示为___________。
(5)吡啶、与形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体科学研究表明,顺式分子具有抗癌活性。
的配位数为___________。顺式二氯二吡啶合铂分子能否溶于水___________(填“能”或“否”),简述理由___________。
18. 三明清流“天芳悦潭”温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。回答下列问题:
(1)基态Ge原子价电子排布图为___________。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:;二锗酸钠:等),也能形成类似于烷烃的锗烷()。
①中阴离子的空间结构是___________。
②推测1mol中含有的σ键的数目是___________(用表示阿伏加德罗常数值)。
(3)利用离子液体[EMIM][]可电沉积还原金属Ge,其熔点只有7℃,其中结构如图所示。
①该物质的晶体类型是___________。
②离子中组成元素的电负性由小到大的顺序是___________。
(4)独立的分子中H—N—H的键角为107.3°,离子中H—N—H的键角___________107.3°(填“大于”、“小于”或“等于”)。
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,该晶胞中两个Zn原子之间的间距是___________;乙图为甲图的俯视图,A点坐标为(0,0,0),B点坐标为,则D点坐标为___________;若该晶胞密度为,则阿伏加德罗常数为___________(只列出计算式)。
19. 铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
(1)铁、铬、锰属于周期表中的___区元素。
(2)基态铬原子和基态锰原子中第一电离能较大的是___(填元素符号),原因为:___。
(3)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgCl沉淀的物质的量之比为3:2:1。
①呈暗绿色的配合物内界的化学式为___。
②H2O分子的VSEPR模型为___。
(4)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为___。
(5)一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。
①该晶胞中由O2-形成的正八面体空隙数目为___。
②设NA为阿伏伽德罗常数的值,晶胞中距离最近的两个O2-之间的距离为apm,则MnO晶体的密度ρ=___g·cm-3。(用含a、NA的代数式表示)。
20. Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)写出基态Р原子的电子排布式___________,有___________种空间运动状态,占据最高能级的电子云轮廓图为___________形。
(2)浓磷酸在常温下呈粘稠状,原因___________,浓磷酸在200~300℃时脱水生成焦磷酸(化学式:),焦磷酸的结构式为___________。
(3)的晶胞结构示意图如(a)所示。其中О围绕Fe和Р分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有的单元数有___________个。
电池充电时,脱出部分,形成,结构示意图如(b)所示,则x=___________,___________。
新泰市重点中学校2022-2023学年高二下学期3月第一次质量检测
化学试题 答案
第Ⅰ卷(共40分)
一、单选题(各小题只有一个正确答案,每小题2分,共20分)
【1题答案】
【答案】A
【2题答案】
【答案】C
【3题答案】
【答案】A
【4题答案】
【答案】B
【5题答案】
【答案】B
【6题答案】
【答案】B
【7题答案】
【答案】A
【8题答案】
【答案】D
【9题答案】
【答案】D
【10题答案】
【答案】C
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
【11题答案】
【答案】D
【12题答案】
【答案】AD
【13题答案】
【答案】D
【14题答案】
【答案】B
【15题答案】
【答案】BD
第Ⅱ卷(非选择题 共60分)
【16题答案】
【答案】(1) ①. S2- ②. 12
(2) ①. ②. H2O2、N2H4
(3) ①. HNO2或HNO3 ②. H2SO3
(4)+1 (5) ①. ②. 共价键、配位键
【17题答案】
【答案】(1) ①. sp2、sp3 ②. N>O>C>H
(2)cdf (3) ①. NA ②. 2NA
(4)
(5) ①. 4 ②. 能 ③. 顺式二氯二吡啶合铂分子是极性分子,依据相似相溶原理,能溶于水
【18题答案】
【答案】(1) (2) ①. 平面三角形 ②. (3n+1)NA
(3) ①. 离子晶体 ②. H
【19题答案】
【答案】 ①. d ②. Mn ③. 基态Mn原子的核外电子排布式为[Ar]3d54s2,4s能级是全满结构,更稳定,失去一个电子所需能量更高 ④. [Cr(H2O)5C1]2+ ⑤. 正四面体形 ⑥. F-半径更小,MnF2的晶格能更大,熔点更高 ⑦. 4 ⑧. ×1030
【20题答案】
【答案】(1) ①. 1s22s22p63s23p3 ②. 9 ③. 哑铃形(纺锤形)
(2) ①. 磷酸分子间存在氢键 ②.
(3) ①. 4 ②. ③. 3∶1
同课章节目录
