江苏省南通市重点中学2022-2023学年高二下学期3月教学质量调研(一)化学试题(选修)(含答案)
文档属性
| 名称 | 江苏省南通市重点中学2022-2023学年高二下学期3月教学质量调研(一)化学试题(选修)(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 968.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-26 21:22:19 | ||
图片预览

文档简介
南通市重点中学2022-2023学年高二下学期教学质量调研(一)
化学试题
总分:100分 考试时间:75分钟。
可能用到的相对原子质量:H 1 O 16 Na 23 S 32 Cl 35.5 Cu 64
选择题(共36分)
单项选择题:本题包括8 小题,每小题2 分,共计16分。每小题只有一个选项符合题意。
1.自然界中绝大多数物质以固体形式存在,固体有晶体和非晶体之分。晶体和非晶体的本质差别是
A.是否澄清透明
B.是否具有规则的外观
C.是否具有固定的熔点
D.内部构成粒子在三维空间是否呈周期性有序排列
2.以白磷(P4,结构如下图所示)为原料利用反应P4+3KOH(浓)+3H2O=3KH2PO2+PH3↑可制备PH3。下列说法正确的是
A.P4是非极性分子
B.PH3的电子式:
C.中子数为10的O原子可以表示为O
D.K的结构示意图为
3.下列有关化学用语表示正确的是
A.潮湿空气中铁钉发生吸氧腐蚀时的负极反应为:Fe-3e-=Fe3+
B.HClO的电离方程式:HClO=H++ClO-
C.由反应2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1可知,H2的燃烧热为
285.8 kJ·mol-1
D.Na2C2O4水解的离子方程式:C2O+2H2OH2C2O4+2OH-
4.下列有关反应2SO2(g)+O2(g)2SO3(g) ΔH<0的说法正确的是
A.该反应在任意条件下均能自发进行
B.其他条件一定,升高温度能提高反应的平衡转化率
C.使用催化剂能改变反应的焓变,加快反应的速率
D.其他条件一定,增大反应的压强,可以增大正、逆反应的速率
5.在给定条件下,下列选项所示的物质间转化均能实现的是
A.NaNaOH(aq)Na2CO3(aq)
B.Cl2FeCl3(aq)Fe2O3(s)
C.AlAl(OH)3Al2O3
D.浓H2SO4SO2BaSO3
6.C、N、O、P、Cl是生命体中的一些常见元素。下列说法正确的是
A.原子半径:r(N)<r(O)<r(P)
B.非金属性:O>P>Cl
C.最高价氧化物对应水化物酸性:HClO4>H3PO4>HNO3
D.氢化物的沸点:H2O>NH3>CH4
7.键的极性会影响物质的化学性质。羧基上连有不同的基团时,会影响羧基电离出H+的能力。CH3COOH、HCOOH、CF3COOH、CHCl2COOH中酸性最强的是
A.CH3COOH B.HCOOH C.CF3COOH D.CHCl2COOH
8.电化学原理广泛应用于物质制取、金属防护、电镀等领域。下列说法正确的是
A.氯碱工业中,Cl2在阴极产生
B.铁表面镀锌时,铁应与直流电源负极相连
C.电解精炼铜时,电解质溶液的成分不发生变化
D.在铁闸门上焊接铜块,可以防止铁闸被腐蚀
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
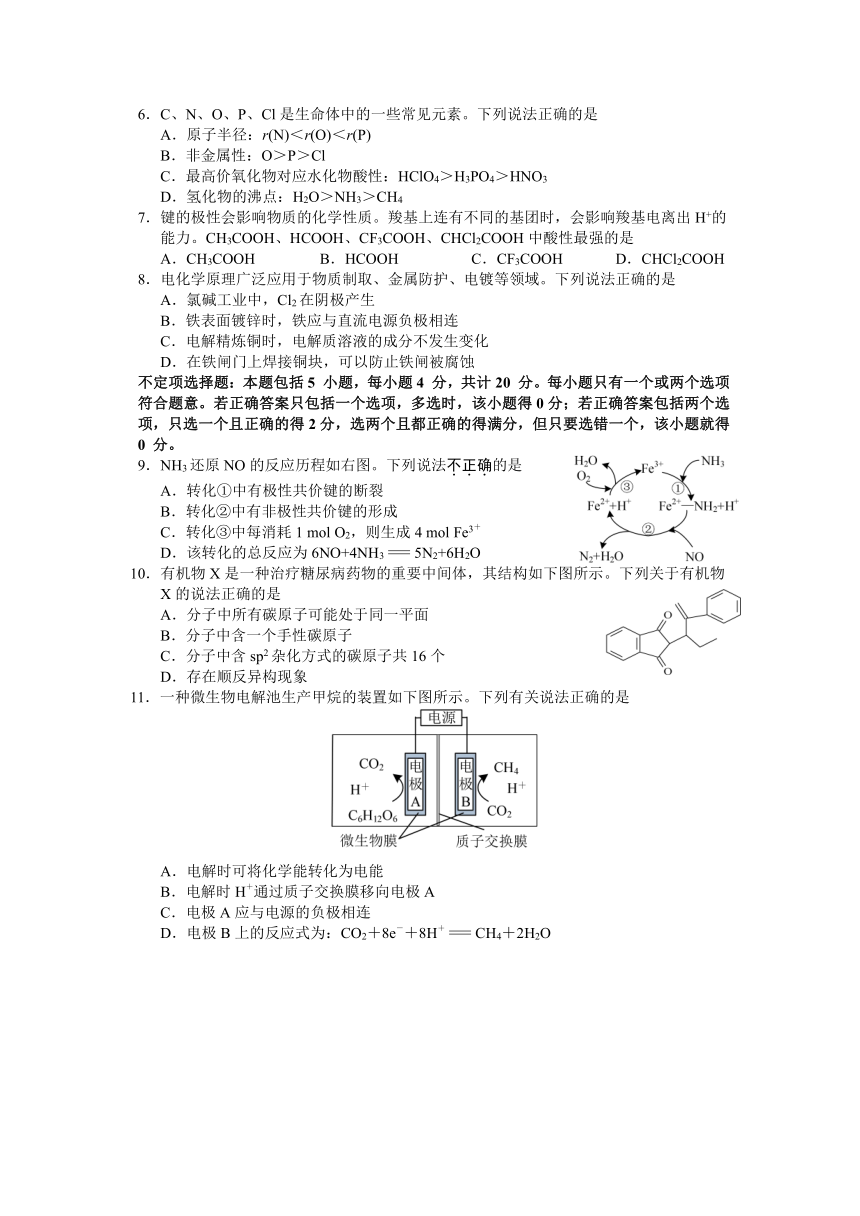
9.NH3还原NO的反应历程如右图。下列说法不正确的是
A.转化①中有极性共价键的断裂
B.转化②中有非极性共价键的形成
C.转化③中每消耗1 mol O2,则生成4 mol Fe3+
D.该转化的总反应为6NO+4NH3=5N2+6H2O
10.有机物X是一种治疗糖尿病药物的重要中间体,其结构如下图所示。下列关于有机物X的说法正确的是
A.分子中所有碳原子可能处于同一平面
B.分子中含一个手性碳原子
C.分子中含sp2杂化方式的碳原子共16个
D.存在顺反异构现象
11.一种微生物电解池生产甲烷的装置如下图所示。下列有关说法正确的是
A.电解时可将化学能转化为电能
B.电解时H+通过质子交换膜移向电极A
C.电极A应与电源的负极相连
D.电极B上的反应式为:CO2+8e-+8H+=CH4+2H2O
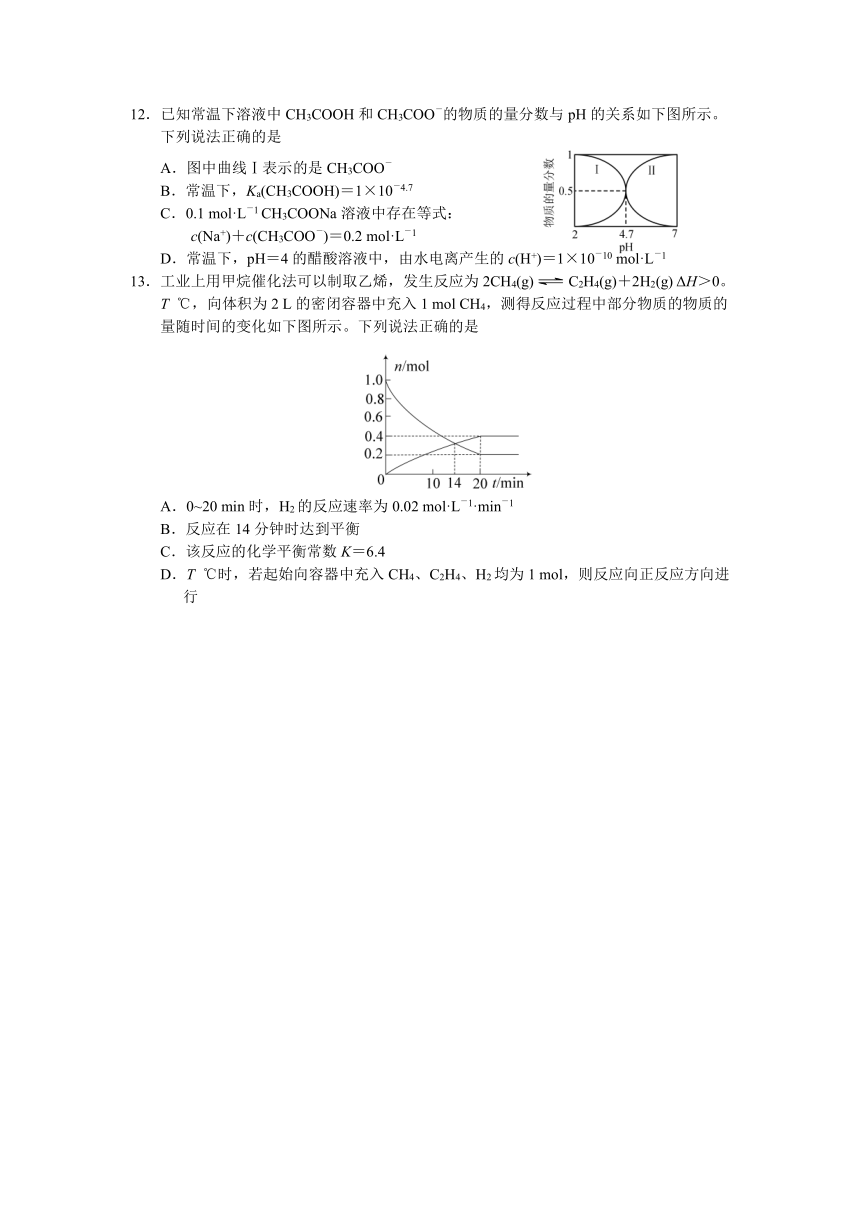
12.已知常温下溶液中CH3COOH和CH3COO-的物质的量分数与pH的关系如下图所示。下列说法正确的是
A.图中曲线Ⅰ表示的是CH3COO-
B.常温下,Ka(CH3COOH)=1×10-4.7
C.0.1 mol·L-1 CH3COONa溶液中存在等式:
c(Na+)+c(CH3COO-)=0.2 mol·L-1
D.常温下,pH=4的醋酸溶液中,由水电离产生的c(H+)=1×10-10 mol·L-1
13.工业上用甲烷催化法可以制取乙烯,发生反应为2CH4(g)C2H4(g)+2H2(g) ΔH>0。T ℃,向体积为2 L的密闭容器中充入1 mol CH4,测得反应过程中部分物质的物质的量随时间的变化如下图所示。下列说法正确的是
A.0~20 min时,H2的反应速率为0.02 mol·L-1·min-1
B.反应在14分钟时达到平衡
C.该反应的化学平衡常数K=6.4
D.T ℃时,若起始向容器中充入CH4、C2H4、H2均为1 mol,则反应向正反应方向进行
非选择题(共64分)
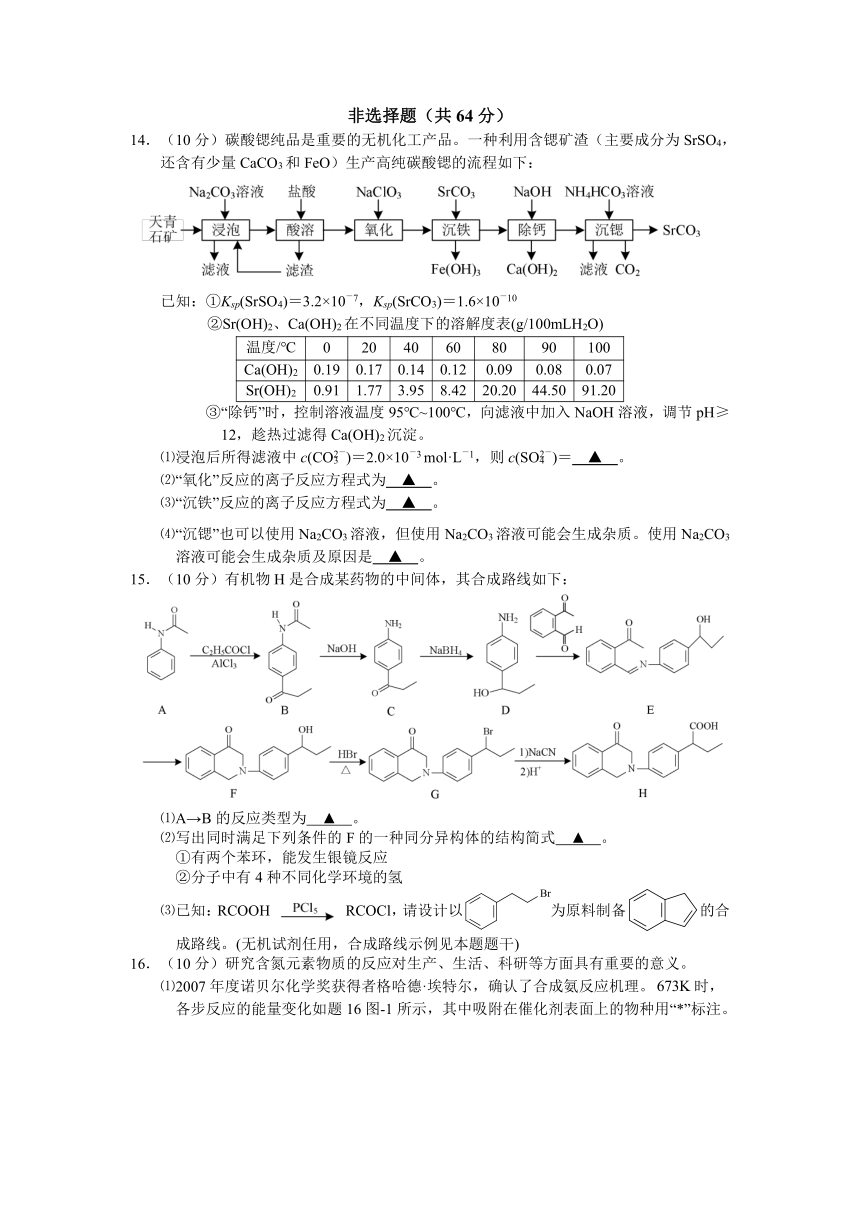
14.(10分)碳酸锶纯品是重要的无机化工产品。一种利用含锶矿渣(主要成分为SrSO4,还含有少量CaCO3和FeO)生产高纯碳酸锶的流程如下:
已知:①Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.6×10-10
②Sr(OH)2、Ca(OH)2在不同温度下的溶解度表(g/100mLH2O)
温度/℃ 0 20 40 60 80 90 100
Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08 0.07
Sr(OH)2 0.91 1.77 3.95 8.42 20.20 44.50 91.20
③“除钙”时,控制溶液温度95℃~100℃,向滤液中加入NaOH溶液,调节pH≥12,趁热过滤得Ca(OH)2沉淀。
⑴浸泡后所得滤液中c(CO)=2.0×10-3 mol·L-1,则c(SO)= ▲ 。
⑵“氧化”反应的离子反应方程式为 ▲ 。
⑶“沉铁”反应的离子反应方程式为 ▲ 。
⑷“沉锶”也可以使用Na2CO3溶液,但使用Na2CO3溶液可能会生成杂质。使用Na2CO3溶液可能会生成杂质及原因是 ▲ 。
15.(10分)有机物H是合成某药物的中间体,其合成路线如下:
⑴A→B的反应类型为 ▲ 。
⑵写出同时满足下列条件的F的一种同分异构体的结构简式 ▲ 。
①有两个苯环,能发生银镜反应
②分子中有4种不同化学环境的氢
⑶已知:RCOOHRCOCl,请设计以为原料制备的合成路线。(无机试剂任用,合成路线示例见本题题干)
16.(10分)研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
⑴2007年度诺贝尔化学奖获得者格哈德·埃特尔,确认了合成氨反应机理。时,各步反应的能量变化如题16图-1所示,其中吸附在催化剂表面上的物种用“*”标注。
题16图-1 题16图-2
①写出合成氨反应的热化学方程式: ▲ 。
②图中所示转化中决定反应快慢的决速步骤是 ▲ 。(选填反应序号)
③在一体积不变的密闭容器中,起始充入1 mol N2和3 mol H2,充分反应一段时间。下列情形能说明反应已经达到平衡的是 ▲ 。(填序号)
A.容器内气体的密度不再发生变化
B.容器内气体的压强不再发生变化
C.容器内N2和H2的物质的量之比为1∶3
D.容器内各物质的体积分数不再发生变化
⑵一种电解法间接除N2O的工作原理如题16图-2所示,已知:H2S2O4是一种弱酸。
①电解时的阴极电极反应式为 ▲ 。
②每除去1 mol N2O,理论上阳极将产生标准状况下气体的体积为 ▲ 。
17.(11分)X、Y、Z、W、Q是前四周期元素且原子序数依次增大。X的基态原子核外有8种运动状态不同的电子,Y的基态原子的逐级电离能如题17图-1所示,Z的电负性在同周期元素中最大,W是第26号元素,Q是同周期主族元素中未成对电子最多的元素。
题17图-1 题17图-2
⑴W在周期表中的位置是 ▲ ,W2+的基态电子排布式为 ▲ 。
⑵Q的基态电子排布式为 ▲ 。QZ3的价层电子对互斥(VSEPR)模型名称为 ▲ 。
⑶与X同周期且第一电离能大于X的元素有 ▲ (填对应元素的符号,下同)。
⑷题17图-2是某晶体的晶胞结构(W和Q均位于晶胞内部),该晶体的化学式为 ▲ 。
18.(13分)有机化合物Y是一种治疗糖尿病药物的重要中间体,可以由下列反应制得
⑴1 mol有机物X含有 ▲ mol σ键。
⑵SO中S原子的轨道杂化方式为 ▲ ,键角:SO ▲ SO(填“>”“<”或“=”)。
⑶CO的空间构型为 ▲ 。
⑷有机化合物X的熔点 ▲ Y(填“>” 或“<”),原因是 ▲ 。
⑸多原子分子中相邻原子若处于同一平面,且有相互平行的p轨道,则p轨道电子可在多个p轨道间运动,形成“离域π键(大π键)”,下列分子中存在“离域π键”的是 ▲ 。
A.CO B.有机物X C.SO D.C2H5Br
19.(10分)N2H4是一种常见的还原剂,可以制取纳米级Cu2O。由尿素[CO(NH2)2]制取N2H4并进一步制取纳米级Cu2O的反应如下:
CO(NH2)2+NaClO+2NaOH=NaCl+Na2CO3+N2H4+H2O
N2H4+4Cu(OH)2=2Cu2O+N2+6H2O
⑴Cu的基态价层电子排布式为 ▲ 。
⑵CO(NH2)2分子中电负性最大的元素是 ▲ 。
⑶CO(NH2)2易溶于水的原因是 ▲ 。
⑷Cu2O晶体的晶胞如下图a所示,白球B代表 ▲ 。如下图b中“”是晶胞中微粒B在平面投影,请在图b中用“”表示微粒A在平面投影的位置。
南通市重点中学2022-2023学年高二下学期教学质量调研(一)
化学试题(选修)
参考答案及评分标准
选择题(共36分)
单项选择题:本题包括8小题。每小题2分,共计16分。每小题只有一个选项符合题意
1.D 2.A 3.C 4.D 5.B 6.D 7.C 8.B
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
D 10.BC 11.D 12.BD 13.AD
非选择题(共64分)
14.⑴ 4.0 mol·L-1 (2分)
⑵ 6Fe2++ClO+6H+=6Fe3++Cl-+3H2O (3分)
⑶2Fe3++ 3SrCO3+3H2O=2Fe(OH)3+ 3Sr2++3CO2↑ (2分)
⑷可能会生成Sr(OH)2 杂质,原因是常温下Sr(OH)2溶解度较小,碳酸钠溶液呈碱性,可能会产生Sr(OH)2沉淀。 (3分)
(共10分)
⑴ 取代反应 (2分)
⑵或
或(3分)
⑶
(5分)
(共10分)
⑴ ① N2(g) + 3H2(g) === 2NH3(g) ΔH=-92 kJ·mol-1 (2分)
②反应(Ⅰ) (2分)
③ BD (2分)
⑵ ①2H+ + 2H2SO3 + 2e-= H2S2O4+ 2H2O (2分)
②11.2 L (2分)
(共10分)
⑴第4周期 Ⅷ族(1分) [Ar]3d6 (2分)
⑵[Ar]3d104s24p3(2分) 四面体形 (2分)
⑶ N、F、Ne(2分)
⑷NaFeAs(2分) ( 共11分)
⑴19(2分)
⑵ sp3(2分) > (2分)
⑶平面三角形(2分)
⑷ > (1分) X分子间存在氢键,而Y分子间不存在氢键 (2分)
⑸AB (2分) ( 共13分)
⑴ 3d104s1(2分)
⑵O(2分)
⑶CO(NH2)2为极性分子,易溶于极性溶剂水中;CO(NH2)2与水分子间存在氢键(2分)
⑷O2-(2分) (2分)
( 共10分)
化学试题
总分:100分 考试时间:75分钟。
可能用到的相对原子质量:H 1 O 16 Na 23 S 32 Cl 35.5 Cu 64
选择题(共36分)
单项选择题:本题包括8 小题,每小题2 分,共计16分。每小题只有一个选项符合题意。
1.自然界中绝大多数物质以固体形式存在,固体有晶体和非晶体之分。晶体和非晶体的本质差别是
A.是否澄清透明
B.是否具有规则的外观
C.是否具有固定的熔点
D.内部构成粒子在三维空间是否呈周期性有序排列
2.以白磷(P4,结构如下图所示)为原料利用反应P4+3KOH(浓)+3H2O=3KH2PO2+PH3↑可制备PH3。下列说法正确的是
A.P4是非极性分子
B.PH3的电子式:
C.中子数为10的O原子可以表示为O
D.K的结构示意图为
3.下列有关化学用语表示正确的是
A.潮湿空气中铁钉发生吸氧腐蚀时的负极反应为:Fe-3e-=Fe3+
B.HClO的电离方程式:HClO=H++ClO-
C.由反应2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1可知,H2的燃烧热为
285.8 kJ·mol-1
D.Na2C2O4水解的离子方程式:C2O+2H2OH2C2O4+2OH-
4.下列有关反应2SO2(g)+O2(g)2SO3(g) ΔH<0的说法正确的是
A.该反应在任意条件下均能自发进行
B.其他条件一定,升高温度能提高反应的平衡转化率
C.使用催化剂能改变反应的焓变,加快反应的速率
D.其他条件一定,增大反应的压强,可以增大正、逆反应的速率
5.在给定条件下,下列选项所示的物质间转化均能实现的是
A.NaNaOH(aq)Na2CO3(aq)
B.Cl2FeCl3(aq)Fe2O3(s)
C.AlAl(OH)3Al2O3
D.浓H2SO4SO2BaSO3
6.C、N、O、P、Cl是生命体中的一些常见元素。下列说法正确的是
A.原子半径:r(N)<r(O)<r(P)
B.非金属性:O>P>Cl
C.最高价氧化物对应水化物酸性:HClO4>H3PO4>HNO3
D.氢化物的沸点:H2O>NH3>CH4
7.键的极性会影响物质的化学性质。羧基上连有不同的基团时,会影响羧基电离出H+的能力。CH3COOH、HCOOH、CF3COOH、CHCl2COOH中酸性最强的是
A.CH3COOH B.HCOOH C.CF3COOH D.CHCl2COOH
8.电化学原理广泛应用于物质制取、金属防护、电镀等领域。下列说法正确的是
A.氯碱工业中,Cl2在阴极产生
B.铁表面镀锌时,铁应与直流电源负极相连
C.电解精炼铜时,电解质溶液的成分不发生变化
D.在铁闸门上焊接铜块,可以防止铁闸被腐蚀
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
9.NH3还原NO的反应历程如右图。下列说法不正确的是
A.转化①中有极性共价键的断裂
B.转化②中有非极性共价键的形成
C.转化③中每消耗1 mol O2,则生成4 mol Fe3+
D.该转化的总反应为6NO+4NH3=5N2+6H2O
10.有机物X是一种治疗糖尿病药物的重要中间体,其结构如下图所示。下列关于有机物X的说法正确的是
A.分子中所有碳原子可能处于同一平面
B.分子中含一个手性碳原子
C.分子中含sp2杂化方式的碳原子共16个
D.存在顺反异构现象
11.一种微生物电解池生产甲烷的装置如下图所示。下列有关说法正确的是
A.电解时可将化学能转化为电能
B.电解时H+通过质子交换膜移向电极A
C.电极A应与电源的负极相连
D.电极B上的反应式为:CO2+8e-+8H+=CH4+2H2O
12.已知常温下溶液中CH3COOH和CH3COO-的物质的量分数与pH的关系如下图所示。下列说法正确的是
A.图中曲线Ⅰ表示的是CH3COO-
B.常温下,Ka(CH3COOH)=1×10-4.7
C.0.1 mol·L-1 CH3COONa溶液中存在等式:
c(Na+)+c(CH3COO-)=0.2 mol·L-1
D.常温下,pH=4的醋酸溶液中,由水电离产生的c(H+)=1×10-10 mol·L-1
13.工业上用甲烷催化法可以制取乙烯,发生反应为2CH4(g)C2H4(g)+2H2(g) ΔH>0。T ℃,向体积为2 L的密闭容器中充入1 mol CH4,测得反应过程中部分物质的物质的量随时间的变化如下图所示。下列说法正确的是
A.0~20 min时,H2的反应速率为0.02 mol·L-1·min-1
B.反应在14分钟时达到平衡
C.该反应的化学平衡常数K=6.4
D.T ℃时,若起始向容器中充入CH4、C2H4、H2均为1 mol,则反应向正反应方向进行
非选择题(共64分)
14.(10分)碳酸锶纯品是重要的无机化工产品。一种利用含锶矿渣(主要成分为SrSO4,还含有少量CaCO3和FeO)生产高纯碳酸锶的流程如下:
已知:①Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.6×10-10
②Sr(OH)2、Ca(OH)2在不同温度下的溶解度表(g/100mLH2O)
温度/℃ 0 20 40 60 80 90 100
Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08 0.07
Sr(OH)2 0.91 1.77 3.95 8.42 20.20 44.50 91.20
③“除钙”时,控制溶液温度95℃~100℃,向滤液中加入NaOH溶液,调节pH≥12,趁热过滤得Ca(OH)2沉淀。
⑴浸泡后所得滤液中c(CO)=2.0×10-3 mol·L-1,则c(SO)= ▲ 。
⑵“氧化”反应的离子反应方程式为 ▲ 。
⑶“沉铁”反应的离子反应方程式为 ▲ 。
⑷“沉锶”也可以使用Na2CO3溶液,但使用Na2CO3溶液可能会生成杂质。使用Na2CO3溶液可能会生成杂质及原因是 ▲ 。
15.(10分)有机物H是合成某药物的中间体,其合成路线如下:
⑴A→B的反应类型为 ▲ 。
⑵写出同时满足下列条件的F的一种同分异构体的结构简式 ▲ 。
①有两个苯环,能发生银镜反应
②分子中有4种不同化学环境的氢
⑶已知:RCOOHRCOCl,请设计以为原料制备的合成路线。(无机试剂任用,合成路线示例见本题题干)
16.(10分)研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
⑴2007年度诺贝尔化学奖获得者格哈德·埃特尔,确认了合成氨反应机理。时,各步反应的能量变化如题16图-1所示,其中吸附在催化剂表面上的物种用“*”标注。
题16图-1 题16图-2
①写出合成氨反应的热化学方程式: ▲ 。
②图中所示转化中决定反应快慢的决速步骤是 ▲ 。(选填反应序号)
③在一体积不变的密闭容器中,起始充入1 mol N2和3 mol H2,充分反应一段时间。下列情形能说明反应已经达到平衡的是 ▲ 。(填序号)
A.容器内气体的密度不再发生变化
B.容器内气体的压强不再发生变化
C.容器内N2和H2的物质的量之比为1∶3
D.容器内各物质的体积分数不再发生变化
⑵一种电解法间接除N2O的工作原理如题16图-2所示,已知:H2S2O4是一种弱酸。
①电解时的阴极电极反应式为 ▲ 。
②每除去1 mol N2O,理论上阳极将产生标准状况下气体的体积为 ▲ 。
17.(11分)X、Y、Z、W、Q是前四周期元素且原子序数依次增大。X的基态原子核外有8种运动状态不同的电子,Y的基态原子的逐级电离能如题17图-1所示,Z的电负性在同周期元素中最大,W是第26号元素,Q是同周期主族元素中未成对电子最多的元素。
题17图-1 题17图-2
⑴W在周期表中的位置是 ▲ ,W2+的基态电子排布式为 ▲ 。
⑵Q的基态电子排布式为 ▲ 。QZ3的价层电子对互斥(VSEPR)模型名称为 ▲ 。
⑶与X同周期且第一电离能大于X的元素有 ▲ (填对应元素的符号,下同)。
⑷题17图-2是某晶体的晶胞结构(W和Q均位于晶胞内部),该晶体的化学式为 ▲ 。
18.(13分)有机化合物Y是一种治疗糖尿病药物的重要中间体,可以由下列反应制得
⑴1 mol有机物X含有 ▲ mol σ键。
⑵SO中S原子的轨道杂化方式为 ▲ ,键角:SO ▲ SO(填“>”“<”或“=”)。
⑶CO的空间构型为 ▲ 。
⑷有机化合物X的熔点 ▲ Y(填“>” 或“<”),原因是 ▲ 。
⑸多原子分子中相邻原子若处于同一平面,且有相互平行的p轨道,则p轨道电子可在多个p轨道间运动,形成“离域π键(大π键)”,下列分子中存在“离域π键”的是 ▲ 。
A.CO B.有机物X C.SO D.C2H5Br
19.(10分)N2H4是一种常见的还原剂,可以制取纳米级Cu2O。由尿素[CO(NH2)2]制取N2H4并进一步制取纳米级Cu2O的反应如下:
CO(NH2)2+NaClO+2NaOH=NaCl+Na2CO3+N2H4+H2O
N2H4+4Cu(OH)2=2Cu2O+N2+6H2O
⑴Cu的基态价层电子排布式为 ▲ 。
⑵CO(NH2)2分子中电负性最大的元素是 ▲ 。
⑶CO(NH2)2易溶于水的原因是 ▲ 。
⑷Cu2O晶体的晶胞如下图a所示,白球B代表 ▲ 。如下图b中“”是晶胞中微粒B在平面投影,请在图b中用“”表示微粒A在平面投影的位置。
南通市重点中学2022-2023学年高二下学期教学质量调研(一)
化学试题(选修)
参考答案及评分标准
选择题(共36分)
单项选择题:本题包括8小题。每小题2分,共计16分。每小题只有一个选项符合题意
1.D 2.A 3.C 4.D 5.B 6.D 7.C 8.B
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
D 10.BC 11.D 12.BD 13.AD
非选择题(共64分)
14.⑴ 4.0 mol·L-1 (2分)
⑵ 6Fe2++ClO+6H+=6Fe3++Cl-+3H2O (3分)
⑶2Fe3++ 3SrCO3+3H2O=2Fe(OH)3+ 3Sr2++3CO2↑ (2分)
⑷可能会生成Sr(OH)2 杂质,原因是常温下Sr(OH)2溶解度较小,碳酸钠溶液呈碱性,可能会产生Sr(OH)2沉淀。 (3分)
(共10分)
⑴ 取代反应 (2分)
⑵或
或(3分)
⑶
(5分)
(共10分)
⑴ ① N2(g) + 3H2(g) === 2NH3(g) ΔH=-92 kJ·mol-1 (2分)
②反应(Ⅰ) (2分)
③ BD (2分)
⑵ ①2H+ + 2H2SO3 + 2e-= H2S2O4+ 2H2O (2分)
②11.2 L (2分)
(共10分)
⑴第4周期 Ⅷ族(1分) [Ar]3d6 (2分)
⑵[Ar]3d104s24p3(2分) 四面体形 (2分)
⑶ N、F、Ne(2分)
⑷NaFeAs(2分) ( 共11分)
⑴19(2分)
⑵ sp3(2分) > (2分)
⑶平面三角形(2分)
⑷ > (1分) X分子间存在氢键,而Y分子间不存在氢键 (2分)
⑸AB (2分) ( 共13分)
⑴ 3d104s1(2分)
⑵O(2分)
⑶CO(NH2)2为极性分子,易溶于极性溶剂水中;CO(NH2)2与水分子间存在氢键(2分)
⑷O2-(2分) (2分)
( 共10分)
同课章节目录
