【备考2023】浙教版科学中考核心考点训练(十五):水和溶液【word,含解析】
文档属性
| 名称 | 【备考2023】浙教版科学中考核心考点训练(十五):水和溶液【word,含解析】 |
|
|
| 格式 | docx | ||
| 文件大小 | 432.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-28 00:00:00 | ||
图片预览

文档简介
水和溶液
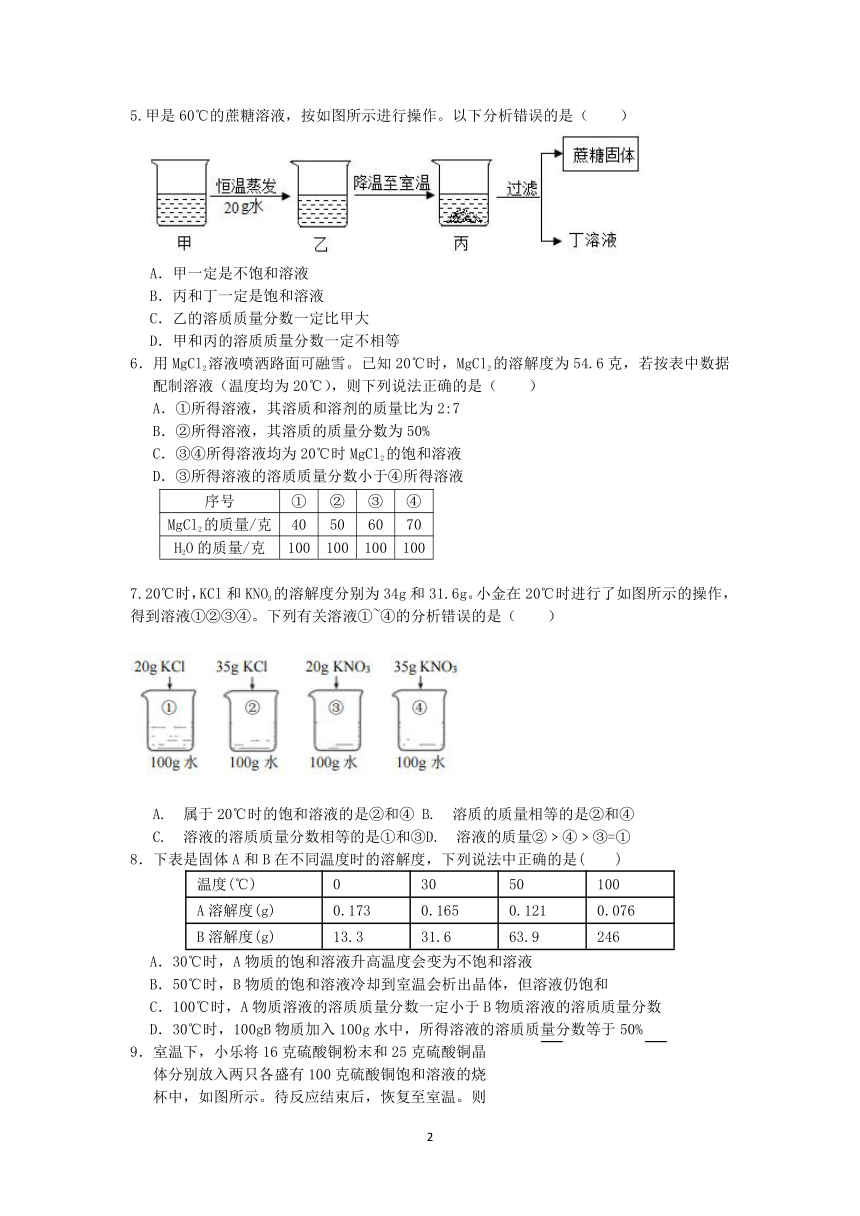
1.20℃时,称取18g氯化钠固体倒于烧杯中,将一定量的水依次加入烧杯中,并不断搅拌,使之充分溶解,实验过程如图所示。(己知20℃,氯化钠的溶解度为36g)下列分析错误的是( )
A.乙烧杯中溶液的质量为34gB.乙和丙两烧杯中溶液的溶质质量分数相等
C. 丁烧杯中的溶液为不饱和浴液D,丁烧杯中溶液的溶质质量分数为25%
2.如图为水循环的示意图,关于水循环和水资源,以下说法不正确的是( )
A.通过人工“地下暗河”从千岛湖引水入杭,作为杭州第二水源,此举属于改变水循环的环节5
B.水循环的环节③使陆地淡水不断得到补充,因此夏季风能到达的地区降水比较丰富
C.我国水资源在地区分布上不均匀,南多北少;在时间分布上不均匀,夏季丰富,冬季欠缺
D.通过水循环过程,地球上的水、大气、岩石和生物发生了密切的联系,共同构成了人类生存的自然环境。
3.下列有关溶液的说法正确的是
A.同一种溶质的水溶液,饱和溶液中溶质的质量分数一定大于不饱和溶液中溶质的质量分数
B.③中的溶液一定是不饱和溶液
C.溶液②的溶质质量分数大于溶液③的溶质质量分数
D.若②中的溶液恒温蒸发,溶质的质量分数不变
4.如图是一杯充分搅拌并久置后的糖水,图中甲、乙、丙三处溶液的溶质质量分数分别为a、b、c,其大小关系是( )
A.a>b>c B.a5.甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( )
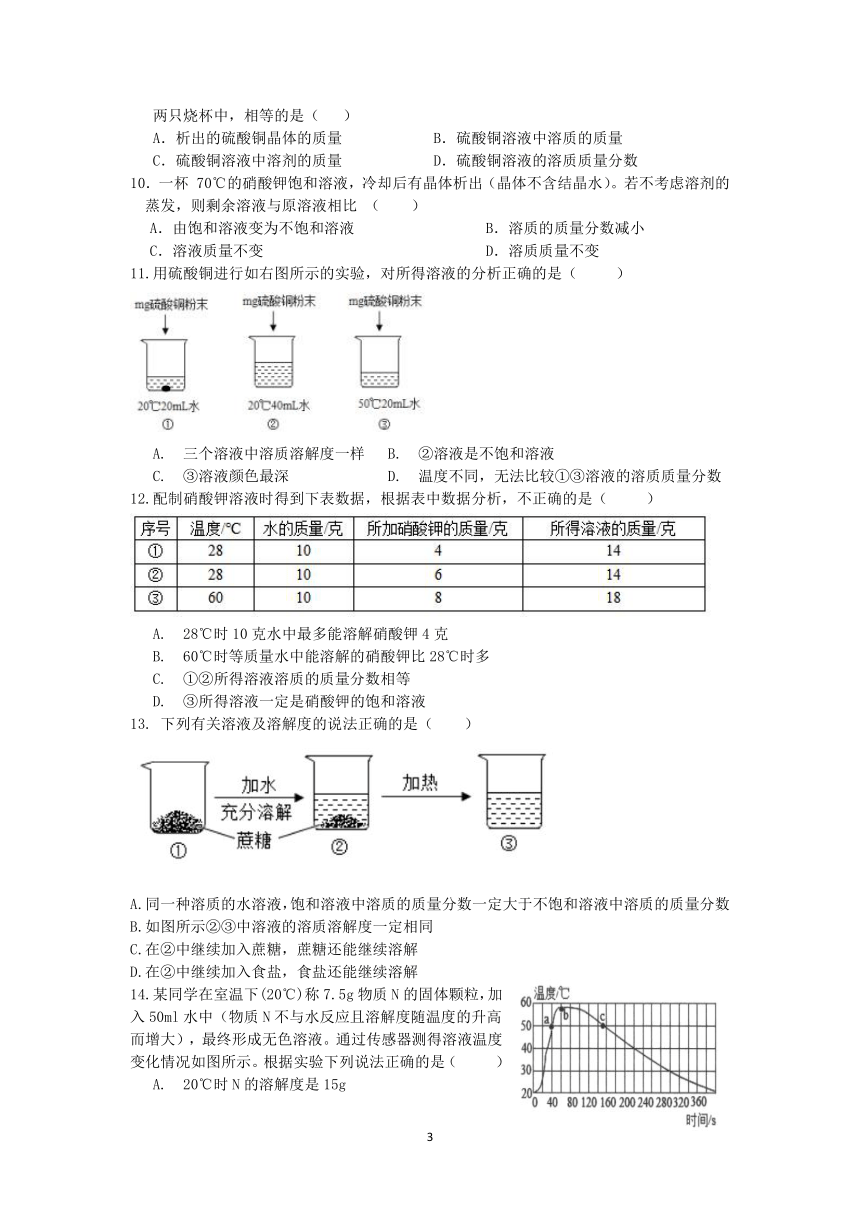
A.甲一定是不饱和溶液
B.丙和丁一定是饱和溶液
C.乙的溶质质量分数一定比甲大
D.甲和丙的溶质质量分数一定不相等
6.用MgCl2溶液喷洒路面可融雪。已知20℃时,MgCl2的溶解度为54.6克,若按表中数据配制溶液(温度均为20℃),则下列说法正确的是( )
A.①所得溶液,其溶质和溶剂的质量比为2:7
B.②所得溶液,其溶质的质量分数为50%
C.③④所得溶液均为20℃时MgCl2的饱和溶液
D.③所得溶液的溶质质量分数小于④所得溶液
序号 ① ② ③ ④
MgCl2的质量/克 40 50 60 70
H2O的质量/克 100 100 100 100
7.20℃时,KCl和KNO3的溶解度分别为34g和31.6g。小金在20℃时进行了如图所示的操作,得到溶液①②③④。下列有关溶液①~④的分析错误的是( )
A. 属于20℃时的饱和溶液的是②和④ B. 溶质的质量相等的是②和④
C. 溶液的溶质质量分数相等的是①和③D. 溶液的质量②﹥④﹥③=①
8.下表是固体A和B在不同温度时的溶解度,下列说法中正确的是( )
温度(℃) 0 30 50 100
A溶解度(g) 0.173 0.165 0.121 0.076
B溶解度(g) 13.3 31.6 63.9 246
A.30℃时,A物质的饱和溶液升高温度会变为不饱和溶液
B.50℃时,B物质的饱和溶液冷却到室温会析出晶体,但溶液仍饱和
C.100℃时,A物质溶液的溶质质量分数一定小于B物质溶液的溶质质量分数
D.30℃时,100gB物质加入100g水中,所得溶液的溶质质量分数等于50%
(
16
克硫酸铜粉末
25
克硫酸铜晶体
100
克硫酸铜
饱和溶液
)9.室温下,小乐将16克硫酸铜粉末和25克硫酸铜晶体分别放入两只各盛有100克硫酸铜饱和溶液的烧杯中,如图所示。待反应结束后,恢复至室温。则两只烧杯中,相等的是( )
A.析出的硫酸铜晶体的质量 B.硫酸铜溶液中溶质的质量
C.硫酸铜溶液中溶剂的质量 D.硫酸铜溶液的溶质质量分数
10.一杯 70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水)。若不考虑溶剂的蒸发,则剩余溶液与原溶液相比 ( )
A.由饱和溶液变为不饱和溶液 B.溶质的质量分数减小
C.溶液质量不变 D.溶质质量不变
11.用硫酸铜进行如右图所示的实验,对所得溶液的分析正确的是( )
A. 三个溶液中溶质溶解度一样 B. ②溶液是不饱和溶液
C. ③溶液颜色最深 D. 温度不同,无法比较①③溶液的溶质质量分数
12.配制硝酸钾溶液时得到下表数据,根据表中数据分析,不正确的是( )
A. 28℃时10克水中最多能溶解硝酸钾4克
B. 60℃时等质量水中能溶解的硝酸钾比28℃时多
C. ①②所得溶液溶质的质量分数相等
D. ③所得溶液一定是硝酸钾的饱和溶液
13. 下列有关溶液及溶解度的说法正确的是( )
A.同一种溶质的水溶液,饱和溶液中溶质的质量分数一定大于不饱和溶液中溶质的质量分数
B.如图所示②③中溶液的溶质溶解度一定相同
C.在②中继续加入蔗糖,蔗糖还能继续溶解
D.在②中继续加入食盐,食盐还能继续溶解
14.某同学在室温下(20℃)称7.5g物质N的固体颗粒,加入50ml水中(物质N不与水反应且溶解度随温度的升高而增大),最终形成无色溶液。通过传感器测得溶液温度变化情况如图所示。根据实验下列说法正确的是( )
A. 20℃时N的溶解度是15g
B. 最终所得溶液的溶质质量分数为15%
C. a、c两点时N的溶解度一定相同
D. b、c两点时所得溶液的溶质质量分数一定不相同
15.甲是60℃的蔗糖溶液,按如图所示进行操作,回答以下问题:
(1)溶液乙 (填“是”“不是”或“可能是”)蔗糖的饱和溶液。
(2)丁溶液静置一段时间不分层,说明溶液具有 的特点。
(3)溶液甲、乙、丙、丁中质量分数最大的是 。
16.“天气瓶”和“彩球温度计”是两款不同的现代居家饰品,都可以获知天气冷暖变化。
(1)图甲为“天气瓶”,当外界温度降低时,瓶中晶体增多。由此推测瓶中晶体的溶解度随温度降低而 。
(2)图乙为“彩球温度计”,当温度降低到小球所标注的温度值时该小球会浮起。某时,只有“20°C”、“18°C"的小球沉底,则此时的气温范围为 。
(3)图乙中漂浮的“24°C"小球质量为5 克,则其所受浮力为 牛。
17.某小组提纯含有泥沙的粗盐,并用提纯后的氯化钠来配制100g质量分数为7.5%的NaCl溶液。
(1)粗盐提纯:
①将粗盐加入到盛有水的烧杯里,使用玻璃棒搅拌,作用是____。
②在蒸发结晶的过程中,当蒸发皿中____,停止加热。
(2)配制溶液:
③配制上述溶液需要称取提纯后的精盐____g。
④量取所需的水应选用____mL的量筒。
18.如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答:
(1)应称量__________g NaCl,需加水______________mL。
(2)若称量NaCl固体时指针向右偏转,则应____________________直到天平平衡。
(3)取上述溶液10g加水稀释到__________g,可得到5%的NaCl溶液。
19.实验室有一瓶未开封的浓盐酸,部分标签如图所示。求:
(1)这瓶浓盐酸中溶液的质量为多少克?
(2)若用这瓶浓盐酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸的体积是多少毫升?水的体积是多少毫升?
20.2020年的新春出现了新冠肺炎疫情,全国人民众志成城、抗击疫情。我国多地采用一天两次高空雾炮进行杀菌消毒(如图),所用的主要消毒液是84消毒液。它是由氯气通入氢氧化钠溶液中制得,有效成分是次氯酸钠(NaClO)。
(1)次氯酸钠中钠、氯、氧元素的原子个数比为________。
(2)制备次氯酸钠的化学方程式为:Cl2+2NaOH=NaCl+NaClO+X,则X的化学式是________。
(3)市售的84消毒液必须经过稀释才能使用,其标签如图所示。现需配制0.2%浓度的消毒液2000kg,需要该消毒液多少千克?加水多少千克?
参考答案
1.D 2.A3.D 4.D5.D 6.C 7.B 8.B 9.D 10.B 11.C 12.D 13. D 14.C
15.(1)可能是(2)稳定性(3)乙
【解析】(1)溶液乙是甲蒸发20克水后无晶体析出的溶液,所以可能是饱和溶液,可能是不饱和溶液; (2)丁溶液静置一段时间不分层,说明溶液具有稳定性;
(3)溶液甲蒸发20克水后形成乙,乙的溶质质量分数大于甲,丙是乙降温后析出晶体所得溶液,因析出晶体溶质质量减小,丙的溶质质量分数小于乙,丁与丙溶质质量分数相同,所以质量分数最大的是乙。
16.(1)减小(2)20°C-22°C(3)0.05
【解析】(1)图甲为“天气瓶”,当外界温度降低时,瓶中晶体增多。由此推测瓶中晶体的溶解度随温度降低而减小。
(2)20℃”、18℃的小球都沉底,说明此时的温度高于20℃,22℃ 的小球已经漂浮,说明温度低于或等于22℃,因此此时的气温范围为:20℃~22℃。
(3)当小球漂浮时,它受到的浮力等于重力,即F浮=G=mg=0.005kg×10N/kg=0.05N。
17.加速溶解出现较多固体时7.5100
【解析】(1)①溶解过程中玻璃棒的作用是搅拌,加速溶解;②在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多固体时,停止加热,用余热蒸干剩余的液体。(2)③配制100g质量分数为7.5%的NaCl溶液需要氯化钠的质量为100g×7.5%=7.5g;④溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-7.5g=92.5g(合92.5mL),应选用100mL的量筒。
18.7.542.5继续向左盘添加氯化钠30
【解析】(1)溶质质量=溶液质量×溶质的质量分数,配制50g 15%的氯化钠溶液,需氯化钠的质量=50g×15%=7.5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-7.5g=42.5g(合42.5mL)。(2)在称量氯化钠固体的过程中,步骤应该是:先调好砝码和游码,然后向左边托盘添加氯化钠固体;若发现指针向右偏转,说明氯化钠的质量小于砝码和游码显示的质量和,故应继续向左盘添加氯化钠,直至天平平衡。(3)溶液具有均一性,取出的溶液溶质质量分数为15%,设稀释后溶液的质量为x,根据溶液稀释前后溶质质量不变,则10g×15%=x×5%,x=30g。
19.590g45.8mL146mL
【解析】(1)这瓶浓盐酸中溶液的质量:m=ρV=1.18g/mL×500mL=590g。
(2)稀释溶液时,溶质质量不变。则m浓×37%=200g×10%,
m浓≈54g,m水=200g-54g=146g,
需取浓盐酸的体积:V浓==≈45.8mL,需加水的体积:V水=146mL。
20.(1)1:1:1
(2)H2O
(3)设需要该消毒液的质量为m
2000千克×0.2%=m×25%
m=16千克
加水质量=2000千克-16千克=1984千克
【解析】(1)由次氯酸钠的化学式可知, 次氯酸钠中钠、氯、氧元素的原子个数比为 1:1:1;
(2)化学反应前后原子种类和个数都不变,由方程式可知,反应前原子种类和个数为:氯2、钠2、氢2、氧2,反应后为:氯2、钠2、氧1,则X中含2个氢原子和1个氧原子,化学式为 H2O ;
(
1
)
1.20℃时,称取18g氯化钠固体倒于烧杯中,将一定量的水依次加入烧杯中,并不断搅拌,使之充分溶解,实验过程如图所示。(己知20℃,氯化钠的溶解度为36g)下列分析错误的是( )
A.乙烧杯中溶液的质量为34gB.乙和丙两烧杯中溶液的溶质质量分数相等
C. 丁烧杯中的溶液为不饱和浴液D,丁烧杯中溶液的溶质质量分数为25%
2.如图为水循环的示意图,关于水循环和水资源,以下说法不正确的是( )
A.通过人工“地下暗河”从千岛湖引水入杭,作为杭州第二水源,此举属于改变水循环的环节5
B.水循环的环节③使陆地淡水不断得到补充,因此夏季风能到达的地区降水比较丰富
C.我国水资源在地区分布上不均匀,南多北少;在时间分布上不均匀,夏季丰富,冬季欠缺
D.通过水循环过程,地球上的水、大气、岩石和生物发生了密切的联系,共同构成了人类生存的自然环境。
3.下列有关溶液的说法正确的是
A.同一种溶质的水溶液,饱和溶液中溶质的质量分数一定大于不饱和溶液中溶质的质量分数
B.③中的溶液一定是不饱和溶液
C.溶液②的溶质质量分数大于溶液③的溶质质量分数
D.若②中的溶液恒温蒸发,溶质的质量分数不变
4.如图是一杯充分搅拌并久置后的糖水,图中甲、乙、丙三处溶液的溶质质量分数分别为a、b、c,其大小关系是( )
A.a>b>c B.a
A.甲一定是不饱和溶液
B.丙和丁一定是饱和溶液
C.乙的溶质质量分数一定比甲大
D.甲和丙的溶质质量分数一定不相等
6.用MgCl2溶液喷洒路面可融雪。已知20℃时,MgCl2的溶解度为54.6克,若按表中数据配制溶液(温度均为20℃),则下列说法正确的是( )
A.①所得溶液,其溶质和溶剂的质量比为2:7
B.②所得溶液,其溶质的质量分数为50%
C.③④所得溶液均为20℃时MgCl2的饱和溶液
D.③所得溶液的溶质质量分数小于④所得溶液
序号 ① ② ③ ④
MgCl2的质量/克 40 50 60 70
H2O的质量/克 100 100 100 100
7.20℃时,KCl和KNO3的溶解度分别为34g和31.6g。小金在20℃时进行了如图所示的操作,得到溶液①②③④。下列有关溶液①~④的分析错误的是( )
A. 属于20℃时的饱和溶液的是②和④ B. 溶质的质量相等的是②和④
C. 溶液的溶质质量分数相等的是①和③D. 溶液的质量②﹥④﹥③=①
8.下表是固体A和B在不同温度时的溶解度,下列说法中正确的是( )
温度(℃) 0 30 50 100
A溶解度(g) 0.173 0.165 0.121 0.076
B溶解度(g) 13.3 31.6 63.9 246
A.30℃时,A物质的饱和溶液升高温度会变为不饱和溶液
B.50℃时,B物质的饱和溶液冷却到室温会析出晶体,但溶液仍饱和
C.100℃时,A物质溶液的溶质质量分数一定小于B物质溶液的溶质质量分数
D.30℃时,100gB物质加入100g水中,所得溶液的溶质质量分数等于50%
(
16
克硫酸铜粉末
25
克硫酸铜晶体
100
克硫酸铜
饱和溶液
)9.室温下,小乐将16克硫酸铜粉末和25克硫酸铜晶体分别放入两只各盛有100克硫酸铜饱和溶液的烧杯中,如图所示。待反应结束后,恢复至室温。则两只烧杯中,相等的是( )
A.析出的硫酸铜晶体的质量 B.硫酸铜溶液中溶质的质量
C.硫酸铜溶液中溶剂的质量 D.硫酸铜溶液的溶质质量分数
10.一杯 70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水)。若不考虑溶剂的蒸发,则剩余溶液与原溶液相比 ( )
A.由饱和溶液变为不饱和溶液 B.溶质的质量分数减小
C.溶液质量不变 D.溶质质量不变
11.用硫酸铜进行如右图所示的实验,对所得溶液的分析正确的是( )
A. 三个溶液中溶质溶解度一样 B. ②溶液是不饱和溶液
C. ③溶液颜色最深 D. 温度不同,无法比较①③溶液的溶质质量分数
12.配制硝酸钾溶液时得到下表数据,根据表中数据分析,不正确的是( )
A. 28℃时10克水中最多能溶解硝酸钾4克
B. 60℃时等质量水中能溶解的硝酸钾比28℃时多
C. ①②所得溶液溶质的质量分数相等
D. ③所得溶液一定是硝酸钾的饱和溶液
13. 下列有关溶液及溶解度的说法正确的是( )
A.同一种溶质的水溶液,饱和溶液中溶质的质量分数一定大于不饱和溶液中溶质的质量分数
B.如图所示②③中溶液的溶质溶解度一定相同
C.在②中继续加入蔗糖,蔗糖还能继续溶解
D.在②中继续加入食盐,食盐还能继续溶解
14.某同学在室温下(20℃)称7.5g物质N的固体颗粒,加入50ml水中(物质N不与水反应且溶解度随温度的升高而增大),最终形成无色溶液。通过传感器测得溶液温度变化情况如图所示。根据实验下列说法正确的是( )
A. 20℃时N的溶解度是15g
B. 最终所得溶液的溶质质量分数为15%
C. a、c两点时N的溶解度一定相同
D. b、c两点时所得溶液的溶质质量分数一定不相同
15.甲是60℃的蔗糖溶液,按如图所示进行操作,回答以下问题:
(1)溶液乙 (填“是”“不是”或“可能是”)蔗糖的饱和溶液。
(2)丁溶液静置一段时间不分层,说明溶液具有 的特点。
(3)溶液甲、乙、丙、丁中质量分数最大的是 。
16.“天气瓶”和“彩球温度计”是两款不同的现代居家饰品,都可以获知天气冷暖变化。
(1)图甲为“天气瓶”,当外界温度降低时,瓶中晶体增多。由此推测瓶中晶体的溶解度随温度降低而 。
(2)图乙为“彩球温度计”,当温度降低到小球所标注的温度值时该小球会浮起。某时,只有“20°C”、“18°C"的小球沉底,则此时的气温范围为 。
(3)图乙中漂浮的“24°C"小球质量为5 克,则其所受浮力为 牛。
17.某小组提纯含有泥沙的粗盐,并用提纯后的氯化钠来配制100g质量分数为7.5%的NaCl溶液。
(1)粗盐提纯:
①将粗盐加入到盛有水的烧杯里,使用玻璃棒搅拌,作用是____。
②在蒸发结晶的过程中,当蒸发皿中____,停止加热。
(2)配制溶液:
③配制上述溶液需要称取提纯后的精盐____g。
④量取所需的水应选用____mL的量筒。
18.如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答:
(1)应称量__________g NaCl,需加水______________mL。
(2)若称量NaCl固体时指针向右偏转,则应____________________直到天平平衡。
(3)取上述溶液10g加水稀释到__________g,可得到5%的NaCl溶液。
19.实验室有一瓶未开封的浓盐酸,部分标签如图所示。求:
(1)这瓶浓盐酸中溶液的质量为多少克?
(2)若用这瓶浓盐酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸的体积是多少毫升?水的体积是多少毫升?
20.2020年的新春出现了新冠肺炎疫情,全国人民众志成城、抗击疫情。我国多地采用一天两次高空雾炮进行杀菌消毒(如图),所用的主要消毒液是84消毒液。它是由氯气通入氢氧化钠溶液中制得,有效成分是次氯酸钠(NaClO)。
(1)次氯酸钠中钠、氯、氧元素的原子个数比为________。
(2)制备次氯酸钠的化学方程式为:Cl2+2NaOH=NaCl+NaClO+X,则X的化学式是________。
(3)市售的84消毒液必须经过稀释才能使用,其标签如图所示。现需配制0.2%浓度的消毒液2000kg,需要该消毒液多少千克?加水多少千克?
参考答案
1.D 2.A3.D 4.D5.D 6.C 7.B 8.B 9.D 10.B 11.C 12.D 13. D 14.C
15.(1)可能是(2)稳定性(3)乙
【解析】(1)溶液乙是甲蒸发20克水后无晶体析出的溶液,所以可能是饱和溶液,可能是不饱和溶液; (2)丁溶液静置一段时间不分层,说明溶液具有稳定性;
(3)溶液甲蒸发20克水后形成乙,乙的溶质质量分数大于甲,丙是乙降温后析出晶体所得溶液,因析出晶体溶质质量减小,丙的溶质质量分数小于乙,丁与丙溶质质量分数相同,所以质量分数最大的是乙。
16.(1)减小(2)20°C-22°C(3)0.05
【解析】(1)图甲为“天气瓶”,当外界温度降低时,瓶中晶体增多。由此推测瓶中晶体的溶解度随温度降低而减小。
(2)20℃”、18℃的小球都沉底,说明此时的温度高于20℃,22℃ 的小球已经漂浮,说明温度低于或等于22℃,因此此时的气温范围为:20℃~22℃。
(3)当小球漂浮时,它受到的浮力等于重力,即F浮=G=mg=0.005kg×10N/kg=0.05N。
17.加速溶解出现较多固体时7.5100
【解析】(1)①溶解过程中玻璃棒的作用是搅拌,加速溶解;②在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多固体时,停止加热,用余热蒸干剩余的液体。(2)③配制100g质量分数为7.5%的NaCl溶液需要氯化钠的质量为100g×7.5%=7.5g;④溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-7.5g=92.5g(合92.5mL),应选用100mL的量筒。
18.7.542.5继续向左盘添加氯化钠30
【解析】(1)溶质质量=溶液质量×溶质的质量分数,配制50g 15%的氯化钠溶液,需氯化钠的质量=50g×15%=7.5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-7.5g=42.5g(合42.5mL)。(2)在称量氯化钠固体的过程中,步骤应该是:先调好砝码和游码,然后向左边托盘添加氯化钠固体;若发现指针向右偏转,说明氯化钠的质量小于砝码和游码显示的质量和,故应继续向左盘添加氯化钠,直至天平平衡。(3)溶液具有均一性,取出的溶液溶质质量分数为15%,设稀释后溶液的质量为x,根据溶液稀释前后溶质质量不变,则10g×15%=x×5%,x=30g。
19.590g45.8mL146mL
【解析】(1)这瓶浓盐酸中溶液的质量:m=ρV=1.18g/mL×500mL=590g。
(2)稀释溶液时,溶质质量不变。则m浓×37%=200g×10%,
m浓≈54g,m水=200g-54g=146g,
需取浓盐酸的体积:V浓==≈45.8mL,需加水的体积:V水=146mL。
20.(1)1:1:1
(2)H2O
(3)设需要该消毒液的质量为m
2000千克×0.2%=m×25%
m=16千克
加水质量=2000千克-16千克=1984千克
【解析】(1)由次氯酸钠的化学式可知, 次氯酸钠中钠、氯、氧元素的原子个数比为 1:1:1;
(2)化学反应前后原子种类和个数都不变,由方程式可知,反应前原子种类和个数为:氯2、钠2、氢2、氧2,反应后为:氯2、钠2、氧1,则X中含2个氢原子和1个氧原子,化学式为 H2O ;
(
1
)
同课章节目录
