化学人教版(2019)选择性必修3 2.2.2 炔烃(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2.2 炔烃(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-28 16:30:46 | ||
图片预览




文档简介
(共17张PPT)
人教版 选择性必修三
第二章 第二节 第二课时
《炔烃》
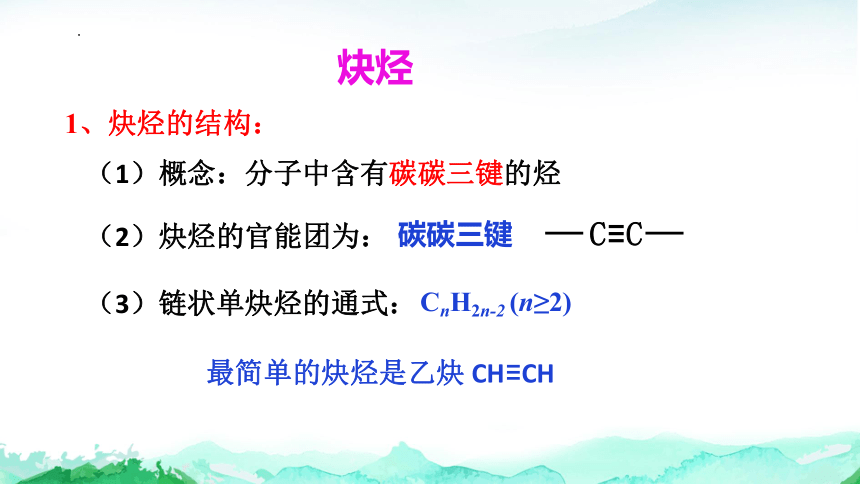
1、炔烃的结构:
(1)概念:分子中含有碳碳三键的烃
(2)炔烃的官能团为:
碳碳三键
最简单的炔烃是乙炔 CH≡CH
(3)链状单炔烃的通式:
CnH2n-2 (n≥2)
C≡C
炔烃
2、炔烃的物理性质:
(1)常温下C2~C4的炔烃为气体;
(2)炔烃的熔、沸点随碳原子数的增加而增大;
(3)密度小于水;
(4)炔烃不易溶于水,易溶于有机溶剂;
物理性质类似于烯烃
(乙炔微溶于水)
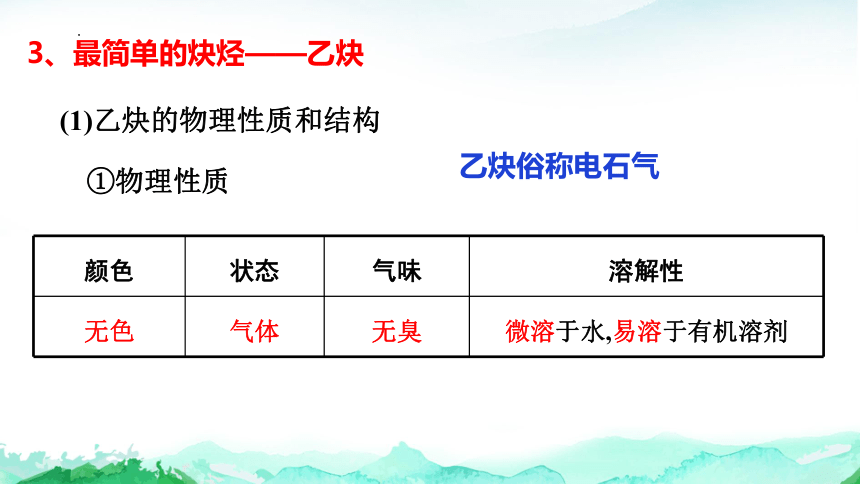
3、最简单的炔烃——乙炔
(1)乙炔的物理性质和结构
①物理性质
颜色 状态 气味 溶解性
无色 气体 无臭 微溶于水,易溶于有机溶剂
乙炔俗称电石气
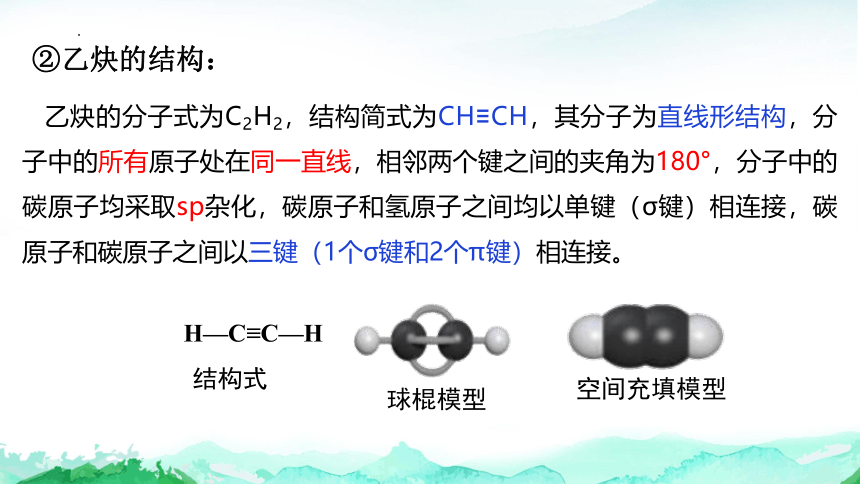
②乙炔的结构:
乙炔的分子式为C2H2,结构简式为CH≡CH,其分子为直线形结构,分子中的所有原子处在同一直线,相邻两个键之间的夹角为180°,分子中的碳原子均采取sp杂化,碳原子和氢原子之间均以单键(σ键)相连接,碳原子和碳原子之间以三键(1个σ键和2个π键)相连接。
H—C≡C—H
结构式
球棍模型
空间充填模型
4.乙炔的实验室制法
H OH
H OH
[ C≡C ]2-
Ca2+
+
H C C H ↑
+ Ca(OH)2
学习任务:乙炔的实验室制法及性质
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
4、乙炔的实验室制法
电石+饱和食盐水
①可燃性
O2
2CO2+2H2O
C2H4+ 3
甲烷
乙烯
乙炔
火焰明亮,并伴有浓烟
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
含碳量不同导致燃烧现象
有所不同,可用于三者鉴别
(1)乙炔的氧化反应
②使酸性KMnO4溶液褪色
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
5、乙炔的化学性质
(2)加成反应(与反应物的量有关,可分步表示)
①催化加氢
②使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 2 —二溴乙烯
1 , 1 , 2 , 2 —四溴乙烷
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
△
CH≡CH+H2O CH3CHO
③与HX等的反应
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
(3)加聚反应
nCH ≡ CH [ CH=CH ]n
催化剂
(制导电高分子材料)
乙炔与水加成后的产物乙烯醇
(CH2=CH—OH不稳定,很快转化为乙醛)
导电塑料——聚乙炔
⑴乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、聚氯乙烯和乙醛等。
⑵乙炔燃烧时产生的氧炔焰可用来切割或焊接金属。
6.乙炔的主要用途
1. 请写出戊炔所有属于炔烃的同分异构体的结构简式。
2. 请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
【思考与讨论】
CH≡CCH2CH2CH3 CH3CH≡CCH2CH3 CH≡CCH(CH3)CH3
CH≡CCH2CH3 + 2H2→CH3CH2CH2CH3 该反应为加成反应。反应中碳原子之间形成的π键断裂,形成4个C—H σ键。
3. 某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔经可能的结构简式。
4-甲基-2-戊炔 4-甲基-1-戊炔
4.以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,下图所示是有关合成路线图。
已知反应:
n CH2=CH-CH=CH2 → -CH2-CH = CH - CH2-n
[
]
人教版 选择性必修三
第二章 第二节 第二课时
《炔烃》
1、炔烃的结构:
(1)概念:分子中含有碳碳三键的烃
(2)炔烃的官能团为:
碳碳三键
最简单的炔烃是乙炔 CH≡CH
(3)链状单炔烃的通式:
CnH2n-2 (n≥2)
C≡C
炔烃
2、炔烃的物理性质:
(1)常温下C2~C4的炔烃为气体;
(2)炔烃的熔、沸点随碳原子数的增加而增大;
(3)密度小于水;
(4)炔烃不易溶于水,易溶于有机溶剂;
物理性质类似于烯烃
(乙炔微溶于水)
3、最简单的炔烃——乙炔
(1)乙炔的物理性质和结构
①物理性质
颜色 状态 气味 溶解性
无色 气体 无臭 微溶于水,易溶于有机溶剂
乙炔俗称电石气
②乙炔的结构:
乙炔的分子式为C2H2,结构简式为CH≡CH,其分子为直线形结构,分子中的所有原子处在同一直线,相邻两个键之间的夹角为180°,分子中的碳原子均采取sp杂化,碳原子和氢原子之间均以单键(σ键)相连接,碳原子和碳原子之间以三键(1个σ键和2个π键)相连接。
H—C≡C—H
结构式
球棍模型
空间充填模型
4.乙炔的实验室制法
H OH
H OH
[ C≡C ]2-
Ca2+
+
H C C H ↑
+ Ca(OH)2
学习任务:乙炔的实验室制法及性质
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
4、乙炔的实验室制法
电石+饱和食盐水
①可燃性
O2
2CO2+2H2O
C2H4+ 3
甲烷
乙烯
乙炔
火焰明亮,并伴有浓烟
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
含碳量不同导致燃烧现象
有所不同,可用于三者鉴别
(1)乙炔的氧化反应
②使酸性KMnO4溶液褪色
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
5、乙炔的化学性质
(2)加成反应(与反应物的量有关,可分步表示)
①催化加氢
②使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 2 —二溴乙烯
1 , 1 , 2 , 2 —四溴乙烷
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
△
CH≡CH+H2O CH3CHO
③与HX等的反应
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
(3)加聚反应
nCH ≡ CH [ CH=CH ]n
催化剂
(制导电高分子材料)
乙炔与水加成后的产物乙烯醇
(CH2=CH—OH不稳定,很快转化为乙醛)
导电塑料——聚乙炔
⑴乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、聚氯乙烯和乙醛等。
⑵乙炔燃烧时产生的氧炔焰可用来切割或焊接金属。
6.乙炔的主要用途
1. 请写出戊炔所有属于炔烃的同分异构体的结构简式。
2. 请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
【思考与讨论】
CH≡CCH2CH2CH3 CH3CH≡CCH2CH3 CH≡CCH(CH3)CH3
CH≡CCH2CH3 + 2H2→CH3CH2CH2CH3 该反应为加成反应。反应中碳原子之间形成的π键断裂,形成4个C—H σ键。
3. 某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔经可能的结构简式。
4-甲基-2-戊炔 4-甲基-1-戊炔
4.以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,下图所示是有关合成路线图。
已知反应:
n CH2=CH-CH=CH2 → -CH2-CH = CH - CH2-n
[
]
