第9章溶液检测题(含答案)--2022-2023学年九年级化学京改版(2013)下册
文档属性
| 名称 | 第9章溶液检测题(含答案)--2022-2023学年九年级化学京改版(2013)下册 |
|
|
| 格式 | docx | ||
| 文件大小 | 123.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-28 00:00:00 | ||
图片预览



文档简介
第9章《溶液》检测题
一、单选题
1.下列关于水的说法正确的是
A.活性炭能起到软化水的作用 B.电解水实验说明水是由氢气和氧气组成
C.将植物油与水混合振荡可以得到溶液 D.将硝酸铵溶于水时溶液的温度降低
2.将家庭中常用的四种调味品分别放入水中,能形成溶液的是( )
A.橄榄油 B.番茄酱 C.白醋 D.胡椒粉
3.下列有关水和溶液的说法中,错误的是
A.溶液具有均一性和稳定性
B.洗洁精去除油污的主要原理是乳化作用
C.溶解过程中,玻璃棒搅拌的作用是增大物质的溶解限量
D.自来水厂处理天然水时,通常进行沉降、过滤、灭菌等净化操作
4.分析和推理是化学学习中常用的思维方法。下列因果关系完全正确的一组是( )
A.洗洁精能够洗去餐具上的油污,是因为洗洁精能够溶解油污
B.饱和澄清石灰水受热后变浑浊,是因为氢氧化钙的溶解度随温度升高而增大
C.碳酸钠溶液能使无色酚酞试液变红,是因为碳酸钠属于碱类物质
D.氯化铵与草木灰不能混合施用,是因为铵态氮肥与碱性物质混合产生氨气,降低肥效
5.如图为硫酸钠的溶解度曲线。下列说法错误的是
A.硫酸钠属于可溶性物质
B.硫酸钠的溶解度随温度升高先增大后减小
C.40℃时,硫酸钠饱和溶液的溶质质量分数为50%
D.40℃时,硫酸钠饱和溶液升温或降温会析出晶体
6.如图是甲、乙两种固体物质的溶解度曲线图。下列说法中,不正确的是
A.甲物质的溶解度受温度影响变化比乙物质大
B.t1℃时,甲、乙两种物质的溶解度相等
C.可采用降温的方法使甲物质的不饱和溶液变为饱和溶液
D.将t2℃时乙物质的不饱和溶液降温到t1℃,乙物质溶液的溶质质量分数一定减小
7.溶液的知识广泛应用于生产生活。下列说法正确的是
A.植物油加入水中可得到溶液 B.氯化钠溶于水温度明显上升
C.洗涤剂去油污的原理是溶解 D.溶液是均一的、稳定的混合物
8.如图为甲、乙两种固体物质的溶解度曲线,下列说法不正确的是
A.20℃时,甲物质的溶解度比乙物质的溶解度小
B.40℃时,甲、乙两物质的饱和溶液中溶质质量分数相等
C.60℃时,将 60g 甲物质放入 100g 水中,所得溶液中溶质的质量分数为 60%
D.甲物质中混有少量乙物质,采用降温结晶的方法提纯甲物质
9.描述正确的是
A.用稀有气体制霓虹灯,是因为稀有气体化学性质稳定
B.夏天鱼池内需要增氧,是因为温度升高,氧气在水中的溶解度减小
C.木炭具有还原性,常温下可以将氧化铜中的铜还原出来
D.二氧化碳在空气中含量增多会引起温室效应,属于空气污染物
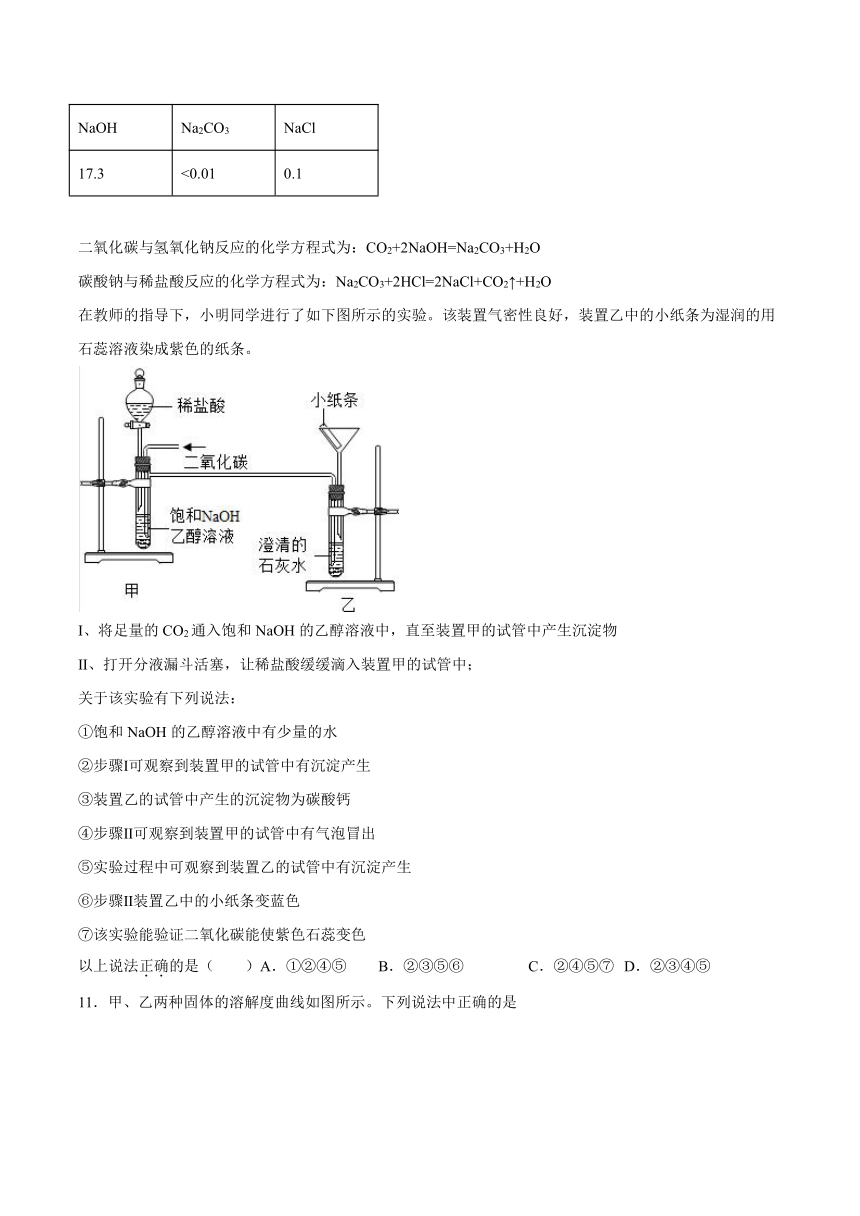
10.已知常温下NaOH、Na2CO3和NaCl分别在乙醇中溶解度(s/g)如下表所示:
NaOH Na2CO3 NaCl
17.3 <0.01 0.1
二氧化碳与氢氧化钠反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O
碳酸钠与稀盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O
在教师的指导下,小明同学进行了如下图所示的实验。该装置气密性良好,装置乙中的小纸条为湿润的用石蕊溶液染成紫色的纸条。
I、将足量的CO2通入饱和NaOH的乙醇溶液中,直至装置甲的试管中产生沉淀物
Ⅱ、打开分液漏斗活塞,让稀盐酸缓缓滴入装置甲的试管中;
关于该实验有下列说法:
①饱和NaOH的乙醇溶液中有少量的水
②步骤Ⅰ可观察到装置甲的试管中有沉淀产生
③装置乙的试管中产生的沉淀物为碳酸钙
④步骤Ⅱ可观察到装置甲的试管中有气泡冒出
⑤实验过程中可观察到装置乙的试管中有沉淀产生
⑥步骤Ⅱ装置乙中的小纸条变蓝色
⑦该实验能验证二氧化碳能使紫色石蕊变色
以上说法正确的是( )A.①②④⑤ B.②③⑤⑥ C.②④⑤⑦ D.②③④⑤
11.甲、乙两种固体的溶解度曲线如图所示。下列说法中正确的是
A.20℃甲、乙两种物质饱和溶液的质量分数都为30%
B.将40℃时75g甲物质的饱和溶液降温到20℃,可得到65g饱和溶液
C.40℃时,质量分数均为25%的甲、乙两物质的溶液降温到20℃,甲、乙析出晶体质量相等
D.40℃时,将等质量的甲、乙两物质的饱和溶液,分别降温至20℃,所得溶液中溶质的质量甲等于乙
12.2022年3月23日,神舟十三号乘组航天员王亚平在太空进行了一次“冰雪”实验。实验所用醋酸钠在20℃、60℃时溶解度分别为124g、140g。20℃时在烧杯中按下表配制溶液。下列有关说法错误的是
实验编号 ① ② ③ ④
醋酸钠的质量/g 100 120 140 160
水的质量/g 100 100 100 100
A.实验①中溶液的质量分数为50%
B.实验②中溶液为不饱和溶液
C.实验③溶质和溶剂的质量比为7:5
D.加热实验④烧杯内物质至60℃,溶液质量增大
二、填空题
13.实验室用溶质质量分数为10%氢氧化钠溶液进行水的电解实验.
实验一:配制100g溶质质量分数为10%氢氧化钠溶液.
(1)所需的氢氧化钠质量: __________ g;
(2)称量时,氢氧化钠固体应放于天平 __________ (填“左”或“右”)盘的烧杯内;量取的需的水(水的密度为1g/cm3),应选择的量筒的规格是 _________ mL(选填“10”、“100”或“250”).
实验二:水的电解实验
用如图装置进行水的电解实验.已知氢氧化钠在水的电解实验中,只起到增强水的导电性作用.
(3)开始反应前a,b两管内都充满溶液.关闭活塞,接通电源,一段时间后,两管产生的气体如图所示,则a管下方导线应接电源的 ______ 极(填“正”或“负”).用 __________ 验证b管中的气体,写出电解水的化学方程式: _______________________ .
(4)说明水是一种化合物的实验事实: ________________________________ .
(5)电解后溶液的溶质质量分数 _______________ 10%(填“<”、“=”或“>”).
14.在粗盐提纯的过程中,有以下几项实验操作:①过滤;②溶解;③蒸发。
⑴正确的先后操作顺序是__________________ ;
⑵在以上三项操作中都需用到的一种仪器是____ ,它在第③操作中的作用是____________
15.甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(1)25℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为_______g;
三种物质中可能是气态物质的是_______。
(2)要使35℃时接近饱和的甲溶液变成该温度下的饱和溶液,可采用的一种方法是__________。若甲是KNO3,则甲溶液中的微观粒子是(填符号)______________。
(3)现有操作步骤:a.溶解 b.过滤 c.降温结晶 d.加热浓缩;
若甲固体中含有少量乙,则提纯甲的操作步骤是________________(填字母序号)。
(4)小明同学欲在35℃时配制溶质质量分数为30%的甲溶液,你认为他能否成功 _____________。将35℃时甲、乙、丙的饱和溶液分别降温到25℃,所得溶液的溶质质量分数的大小关系是_____________。
(5)向100g35℃的水中加入45g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出。你认为“全部溶解”的原因可能是___________________。
三、简答题
16.甲、乙两种物质的溶解度曲线如图。
(1)20℃时,甲物质的溶解度为 _____ g;
(2)40℃时,把40g甲物质放入100g水中,所得的溶液是 _____ (填“饱和”或“不饱和”)的;
(3)欲将40℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是 _____ ;
(4)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,所得甲物质溶液的质量 _____ (填“>”“=”或“<”)乙物质溶液的质量。
17.溶液在日常生活、工农业生产和科学研究中具有广泛用途。氢氧化钙、硝酸钾、氯化钠的溶解度如下表所示。
温度/℃ 0 20 40 60 80
溶解度/g 氢氧化钙 0.18 0.16 0.14 0.11 0.09
硝酸钾 13.3 31.6 63.9 110 169
氯化钠 35.7 36.0 36.6 37.3 38.4
回答问题:
(1)氢氧化钙的溶解度随温度的升高而______(填“增大”或“减小”)。
(2)将接近饱和的硝酸钾溶液变为饱和溶液,可以采用的一种方法是______。
(3)农业上常用质量分数为16%的氯化钠溶液选种。20℃时,将136g饱和氯化钠溶液稀释成质量分数为16%的氯化钠溶液,需加水的质量为______。
(4)下列有关说法正确的是______(填标号)。A.40℃时,向氢氧化钙饱和溶液中加入少量硝酸钾,溶液质量变大
B.60℃时,将100g硝酸钾饱和溶液恒温蒸发10g水,析出11g硝酸钾
C.某物质的不饱和溶液,其溶质的质量分数可能比该物质的饱和溶液大
D.将80℃时上述三种物质的饱和溶液各mg分别降温至20℃,所得溶液中,氯化钠溶液的质量最大
四、实验题
18.下图是小明配制100g溶质质量分数为12%的氯化钠溶液的有关实验操作示意图。
(1)请你指出图中的一个错误 __________ 。
(2)如果氯化钠中含有少量不溶的杂质,溶质的质量分数会 ______ (填“偏大”或“偏小”);量取水最好选择 _____ 的量筒(填10mL、50mL、100mL)。
五、计算题
19.向100g硫酸铜溶液中,逐滴加入NaOH溶液,加入NaOH溶液的质量与生成沉淀的质量之间的关系如图所示,请回答下列问题。
(1)生成Cu(OH)2的质量为________g。
(2)将A点所对应的混合物过滤,滤液中所含溶质为________;
(3)计算硫酸铜溶液中溶质的质量分数。(请写出计算过程)
参考答案:
1.D 2.C 3.C 4.D 5.C 6.D 7.D 8.C 9.B 10.D 11.B 12.C
13. 10 左 100 负 带火星的木条 2H2O 2H2↑+O2↑ 水分解生成了氢气和氧气 >
14. ②①③ 玻璃棒 搅拌,防止局部温度过高使液滴飞溅
15. 65 丙 加甲溶质(恒温蒸发水) K+ NO3- H2O adcb 不能 甲>乙>丙 甲溶于水时放热
16. 40 不饱和 降温或加溶剂 <
17.(1)减小
(2)加硝酸钾/蒸发水/降低温度
(3)89g
(4)ABC
18. 砝码和氯化钠放反了 偏小 100mL
19.(1)9.8;(2)硫酸钠;(3)16%
一、单选题
1.下列关于水的说法正确的是
A.活性炭能起到软化水的作用 B.电解水实验说明水是由氢气和氧气组成
C.将植物油与水混合振荡可以得到溶液 D.将硝酸铵溶于水时溶液的温度降低
2.将家庭中常用的四种调味品分别放入水中,能形成溶液的是( )
A.橄榄油 B.番茄酱 C.白醋 D.胡椒粉
3.下列有关水和溶液的说法中,错误的是
A.溶液具有均一性和稳定性
B.洗洁精去除油污的主要原理是乳化作用
C.溶解过程中,玻璃棒搅拌的作用是增大物质的溶解限量
D.自来水厂处理天然水时,通常进行沉降、过滤、灭菌等净化操作
4.分析和推理是化学学习中常用的思维方法。下列因果关系完全正确的一组是( )
A.洗洁精能够洗去餐具上的油污,是因为洗洁精能够溶解油污
B.饱和澄清石灰水受热后变浑浊,是因为氢氧化钙的溶解度随温度升高而增大
C.碳酸钠溶液能使无色酚酞试液变红,是因为碳酸钠属于碱类物质
D.氯化铵与草木灰不能混合施用,是因为铵态氮肥与碱性物质混合产生氨气,降低肥效
5.如图为硫酸钠的溶解度曲线。下列说法错误的是
A.硫酸钠属于可溶性物质
B.硫酸钠的溶解度随温度升高先增大后减小
C.40℃时,硫酸钠饱和溶液的溶质质量分数为50%
D.40℃时,硫酸钠饱和溶液升温或降温会析出晶体
6.如图是甲、乙两种固体物质的溶解度曲线图。下列说法中,不正确的是
A.甲物质的溶解度受温度影响变化比乙物质大
B.t1℃时,甲、乙两种物质的溶解度相等
C.可采用降温的方法使甲物质的不饱和溶液变为饱和溶液
D.将t2℃时乙物质的不饱和溶液降温到t1℃,乙物质溶液的溶质质量分数一定减小
7.溶液的知识广泛应用于生产生活。下列说法正确的是
A.植物油加入水中可得到溶液 B.氯化钠溶于水温度明显上升
C.洗涤剂去油污的原理是溶解 D.溶液是均一的、稳定的混合物
8.如图为甲、乙两种固体物质的溶解度曲线,下列说法不正确的是
A.20℃时,甲物质的溶解度比乙物质的溶解度小
B.40℃时,甲、乙两物质的饱和溶液中溶质质量分数相等
C.60℃时,将 60g 甲物质放入 100g 水中,所得溶液中溶质的质量分数为 60%
D.甲物质中混有少量乙物质,采用降温结晶的方法提纯甲物质
9.描述正确的是
A.用稀有气体制霓虹灯,是因为稀有气体化学性质稳定
B.夏天鱼池内需要增氧,是因为温度升高,氧气在水中的溶解度减小
C.木炭具有还原性,常温下可以将氧化铜中的铜还原出来
D.二氧化碳在空气中含量增多会引起温室效应,属于空气污染物
10.已知常温下NaOH、Na2CO3和NaCl分别在乙醇中溶解度(s/g)如下表所示:
NaOH Na2CO3 NaCl
17.3 <0.01 0.1
二氧化碳与氢氧化钠反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O
碳酸钠与稀盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O
在教师的指导下,小明同学进行了如下图所示的实验。该装置气密性良好,装置乙中的小纸条为湿润的用石蕊溶液染成紫色的纸条。
I、将足量的CO2通入饱和NaOH的乙醇溶液中,直至装置甲的试管中产生沉淀物
Ⅱ、打开分液漏斗活塞,让稀盐酸缓缓滴入装置甲的试管中;
关于该实验有下列说法:
①饱和NaOH的乙醇溶液中有少量的水
②步骤Ⅰ可观察到装置甲的试管中有沉淀产生
③装置乙的试管中产生的沉淀物为碳酸钙
④步骤Ⅱ可观察到装置甲的试管中有气泡冒出
⑤实验过程中可观察到装置乙的试管中有沉淀产生
⑥步骤Ⅱ装置乙中的小纸条变蓝色
⑦该实验能验证二氧化碳能使紫色石蕊变色
以上说法正确的是( )A.①②④⑤ B.②③⑤⑥ C.②④⑤⑦ D.②③④⑤
11.甲、乙两种固体的溶解度曲线如图所示。下列说法中正确的是
A.20℃甲、乙两种物质饱和溶液的质量分数都为30%
B.将40℃时75g甲物质的饱和溶液降温到20℃,可得到65g饱和溶液
C.40℃时,质量分数均为25%的甲、乙两物质的溶液降温到20℃,甲、乙析出晶体质量相等
D.40℃时,将等质量的甲、乙两物质的饱和溶液,分别降温至20℃,所得溶液中溶质的质量甲等于乙
12.2022年3月23日,神舟十三号乘组航天员王亚平在太空进行了一次“冰雪”实验。实验所用醋酸钠在20℃、60℃时溶解度分别为124g、140g。20℃时在烧杯中按下表配制溶液。下列有关说法错误的是
实验编号 ① ② ③ ④
醋酸钠的质量/g 100 120 140 160
水的质量/g 100 100 100 100
A.实验①中溶液的质量分数为50%
B.实验②中溶液为不饱和溶液
C.实验③溶质和溶剂的质量比为7:5
D.加热实验④烧杯内物质至60℃,溶液质量增大
二、填空题
13.实验室用溶质质量分数为10%氢氧化钠溶液进行水的电解实验.
实验一:配制100g溶质质量分数为10%氢氧化钠溶液.
(1)所需的氢氧化钠质量: __________ g;
(2)称量时,氢氧化钠固体应放于天平 __________ (填“左”或“右”)盘的烧杯内;量取的需的水(水的密度为1g/cm3),应选择的量筒的规格是 _________ mL(选填“10”、“100”或“250”).
实验二:水的电解实验
用如图装置进行水的电解实验.已知氢氧化钠在水的电解实验中,只起到增强水的导电性作用.
(3)开始反应前a,b两管内都充满溶液.关闭活塞,接通电源,一段时间后,两管产生的气体如图所示,则a管下方导线应接电源的 ______ 极(填“正”或“负”).用 __________ 验证b管中的气体,写出电解水的化学方程式: _______________________ .
(4)说明水是一种化合物的实验事实: ________________________________ .
(5)电解后溶液的溶质质量分数 _______________ 10%(填“<”、“=”或“>”).
14.在粗盐提纯的过程中,有以下几项实验操作:①过滤;②溶解;③蒸发。
⑴正确的先后操作顺序是__________________ ;
⑵在以上三项操作中都需用到的一种仪器是____ ,它在第③操作中的作用是____________
15.甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(1)25℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为_______g;
三种物质中可能是气态物质的是_______。
(2)要使35℃时接近饱和的甲溶液变成该温度下的饱和溶液,可采用的一种方法是__________。若甲是KNO3,则甲溶液中的微观粒子是(填符号)______________。
(3)现有操作步骤:a.溶解 b.过滤 c.降温结晶 d.加热浓缩;
若甲固体中含有少量乙,则提纯甲的操作步骤是________________(填字母序号)。
(4)小明同学欲在35℃时配制溶质质量分数为30%的甲溶液,你认为他能否成功 _____________。将35℃时甲、乙、丙的饱和溶液分别降温到25℃,所得溶液的溶质质量分数的大小关系是_____________。
(5)向100g35℃的水中加入45g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出。你认为“全部溶解”的原因可能是___________________。
三、简答题
16.甲、乙两种物质的溶解度曲线如图。
(1)20℃时,甲物质的溶解度为 _____ g;
(2)40℃时,把40g甲物质放入100g水中,所得的溶液是 _____ (填“饱和”或“不饱和”)的;
(3)欲将40℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是 _____ ;
(4)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,所得甲物质溶液的质量 _____ (填“>”“=”或“<”)乙物质溶液的质量。
17.溶液在日常生活、工农业生产和科学研究中具有广泛用途。氢氧化钙、硝酸钾、氯化钠的溶解度如下表所示。
温度/℃ 0 20 40 60 80
溶解度/g 氢氧化钙 0.18 0.16 0.14 0.11 0.09
硝酸钾 13.3 31.6 63.9 110 169
氯化钠 35.7 36.0 36.6 37.3 38.4
回答问题:
(1)氢氧化钙的溶解度随温度的升高而______(填“增大”或“减小”)。
(2)将接近饱和的硝酸钾溶液变为饱和溶液,可以采用的一种方法是______。
(3)农业上常用质量分数为16%的氯化钠溶液选种。20℃时,将136g饱和氯化钠溶液稀释成质量分数为16%的氯化钠溶液,需加水的质量为______。
(4)下列有关说法正确的是______(填标号)。A.40℃时,向氢氧化钙饱和溶液中加入少量硝酸钾,溶液质量变大
B.60℃时,将100g硝酸钾饱和溶液恒温蒸发10g水,析出11g硝酸钾
C.某物质的不饱和溶液,其溶质的质量分数可能比该物质的饱和溶液大
D.将80℃时上述三种物质的饱和溶液各mg分别降温至20℃,所得溶液中,氯化钠溶液的质量最大
四、实验题
18.下图是小明配制100g溶质质量分数为12%的氯化钠溶液的有关实验操作示意图。
(1)请你指出图中的一个错误 __________ 。
(2)如果氯化钠中含有少量不溶的杂质,溶质的质量分数会 ______ (填“偏大”或“偏小”);量取水最好选择 _____ 的量筒(填10mL、50mL、100mL)。
五、计算题
19.向100g硫酸铜溶液中,逐滴加入NaOH溶液,加入NaOH溶液的质量与生成沉淀的质量之间的关系如图所示,请回答下列问题。
(1)生成Cu(OH)2的质量为________g。
(2)将A点所对应的混合物过滤,滤液中所含溶质为________;
(3)计算硫酸铜溶液中溶质的质量分数。(请写出计算过程)
参考答案:
1.D 2.C 3.C 4.D 5.C 6.D 7.D 8.C 9.B 10.D 11.B 12.C
13. 10 左 100 负 带火星的木条 2H2O 2H2↑+O2↑ 水分解生成了氢气和氧气 >
14. ②①③ 玻璃棒 搅拌,防止局部温度过高使液滴飞溅
15. 65 丙 加甲溶质(恒温蒸发水) K+ NO3- H2O adcb 不能 甲>乙>丙 甲溶于水时放热
16. 40 不饱和 降温或加溶剂 <
17.(1)减小
(2)加硝酸钾/蒸发水/降低温度
(3)89g
(4)ABC
18. 砝码和氯化钠放反了 偏小 100mL
19.(1)9.8;(2)硫酸钠;(3)16%
同课章节目录
