7.2物质溶解的量同步练习 (含答案)九年级化学科粤版(2012)下册
文档属性
| 名称 | 7.2物质溶解的量同步练习 (含答案)九年级化学科粤版(2012)下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 144.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-28 17:15:02 | ||
图片预览


文档简介
7.2 物质溶解的量
同步练习
一、单选题
1.下列关于溶液的说法错误的是
A.溶液具有均一、稳定性
B.固体物质溶于水时,一般扩散的过程吸热,水合的过程放热
C.用胆矾、生石灰和水混制的波尔多液属于溶液
D.一定温度下,固体物质的溶解度不随水的质量改变而改变
2.现有两杯20℃时的食盐饱和溶液,甲为500g,乙为1000g,在温度不变的情况下分别蒸发掉15g水,析出食盐晶体的质量分别为m克和n克,则m、n的关系是
A.n=2m B.n=m C.m=2n D.无法确定
3.下列对实验现象的观察或记录中正确的是
A.镁在空气中燃烧,发出白光,生成氧化镁固体
B.室温下,向饱和食盐水中加入少量硝酸钾固体,搅拌,固体不溶解
C.硝酸铵溶于水时温度上升
D.将黄铜与紫铜互相刻划,紫铜表面出现划痕
4.20℃时,氯化钠的溶解度为36g,则20℃时,将50g氯化钠放入100g水中充分溶解后所得溶液的质量为( )
A.136g B.150g C.186g D.86g
5.甲、乙的溶解度曲线如图所示(不考虑水的变化),下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.t2℃时,甲的饱和溶液中溶质的质量分数为40%
C.t1℃时,甲、乙两物质的溶解度相等
D.t2℃时,将甲、乙的饱和溶液分别降温到t1℃,析出晶体甲的质量大
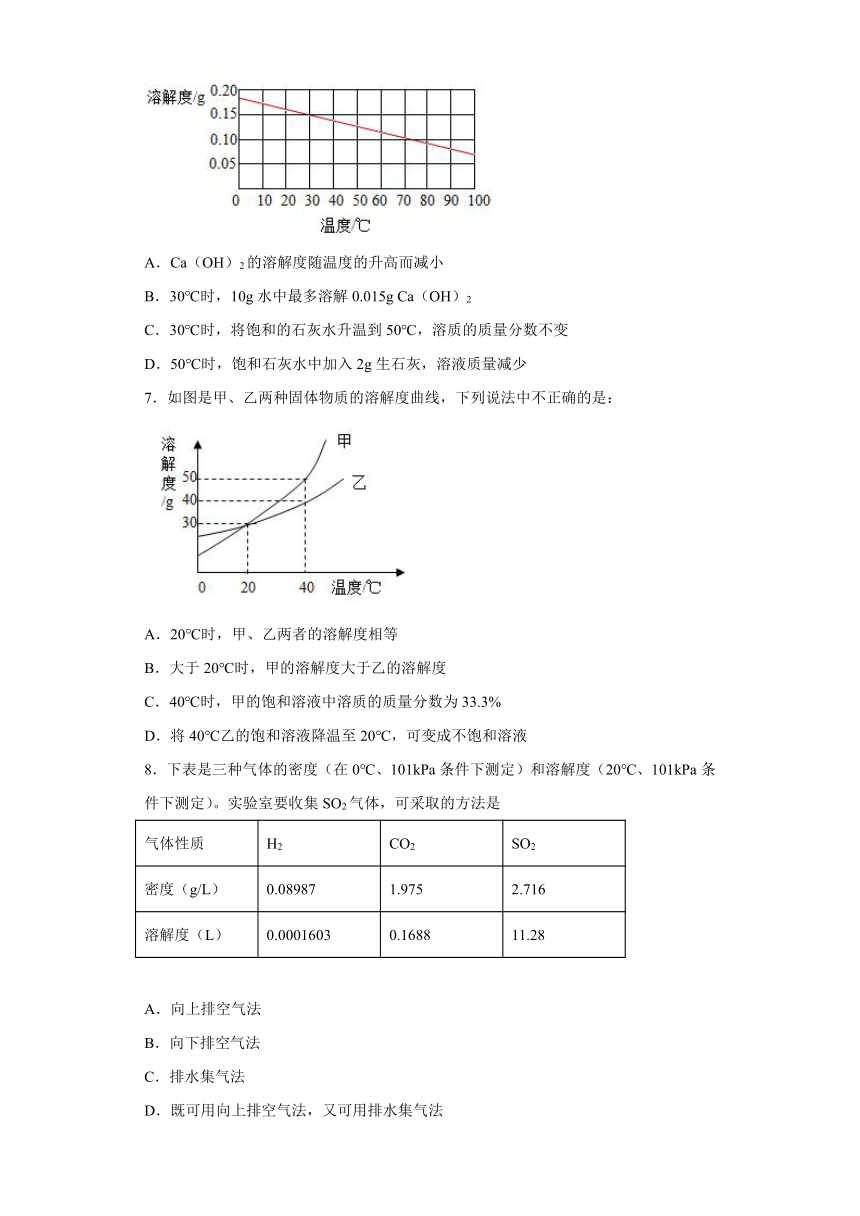
6.如图为Ca(OH)2的溶解度曲线,下列说法错误的是( )
A.Ca(OH)2的溶解度随温度的升高而减小
B.30℃时,10g水中最多溶解0.015g Ca(OH)2
C.30℃时,将饱和的石灰水升温到50℃,溶质的质量分数不变
D.50℃时,饱和石灰水中加入2g生石灰,溶液质量减少
7.如图是甲、乙两种固体物质的溶解度曲线,下列说法中不正确的是:
A.20℃时,甲、乙两者的溶解度相等
B.大于20℃时,甲的溶解度大于乙的溶解度
C.40℃时,甲的饱和溶液中溶质的质量分数为33.3%
D.将40℃乙的饱和溶液降温至20℃,可变成不饱和溶液
8.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(20℃、101kPa条件下测定)。实验室要收集SO2气体,可采取的方法是
气体性质 H2 CO2 SO2
密度(g/L) 0.08987 1.975 2.716
溶解度(L) 0.0001603 0.1688 11.28
A.向上排空气法
B.向下排空气法
C.排水集气法
D.既可用向上排空气法,又可用排水集气法
9.影响固体在水中溶解度大小的外界条件是
A.加入水的多少 B.加入溶质的多少
C.是否进行振荡和搅拌 D.温度的变化
10.下图是熟石灰的溶解度曲线,下列说法正确的是
A.熟石灰属于易溶物
B.任何固体的溶解度都是随温度的升高而变大
C.石灰水中溶质的质量分数随温度的升高而变大
D.把20℃时澄清的饱和石灰水升温到100℃溶液变浑浊
11.如表是NaCl、KNO3 在不同温度时的溶解度:
温度/°C 10 20 30 40 50 60
溶解度/g NaCl 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 20.9 31.6 45.8 63.9 85.5 110
据此数据,下列说法正确的是( )A.20℃时,将20gNaCl加入50g水中,得到70g 溶液
B.50℃时,KNO3溶液的溶质质量分数大于NaCl溶液的溶质质量分数
C.降温时,KNO3溶液析出的固体质量大于NaCl溶液析出的固体质量
D.NaCl和KNO3的溶解度曲线在20℃ ~30℃之间相交
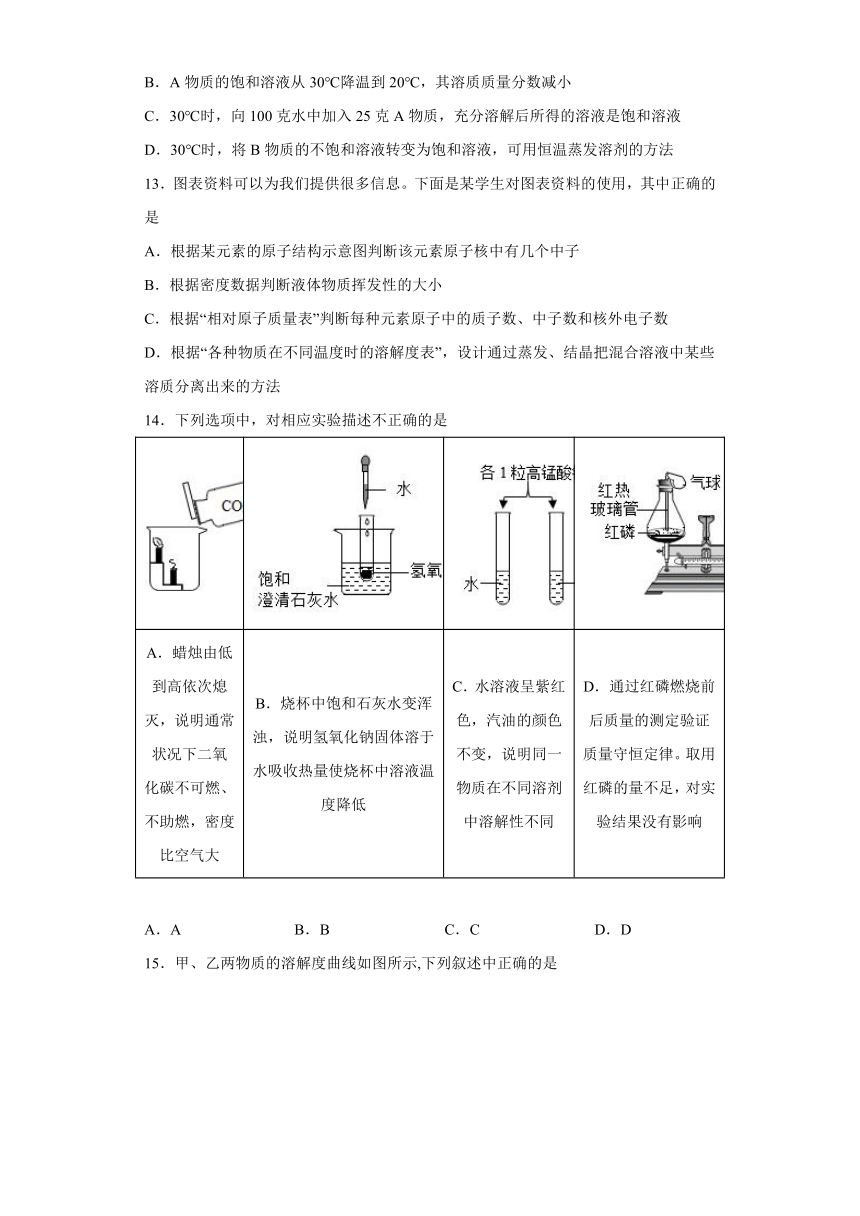
12.如图是A、B两种物质的溶解度曲线,下列叙述错误的是
A.A物质的溶解度大于B物质的溶解度
B.A物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小
C.30℃时,向100克水中加入25克A物质,充分溶解后所得的溶液是饱和溶液
D.30℃时,将B物质的不饱和溶液转变为饱和溶液,可用恒温蒸发溶剂的方法
13.图表资料可以为我们提供很多信息。下面是某学生对图表资料的使用,其中正确的是
A.根据某元素的原子结构示意图判断该元素原子核中有几个中子
B.根据密度数据判断液体物质挥发性的大小
C.根据“相对原子质量表”判断每种元素原子中的质子数、中子数和核外电子数
D.根据“各种物质在不同温度时的溶解度表”,设计通过蒸发、结晶把混合溶液中某些溶质分离出来的方法
14.下列选项中,对相应实验描述不正确的是
A.蜡烛由低到高依次熄灭,说明通常状况下二氧化碳不可燃、不助燃,密度比空气大 B.烧杯中饱和石灰水变浑浊,说明氢氧化钠固体溶于水吸收热量使烧杯中溶液温度降低 C.水溶液呈紫红色,汽油的颜色不变,说明同一物质在不同溶剂中溶解性不同 D.通过红磷燃烧前后质量的测定验证质量守恒定律。取用红磷的量不足,对实验结果没有影响
A.A B.B C.C D.D
15.甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是
A.t1℃时,甲和乙的溶解度均为30
B.t1℃时,甲和乙的饱和溶液中溶质质量一定相等
C.t2℃时,分别在100g水中各溶解20 g甲、乙,降温后,乙溶液的溶质质量分数可能会大于甲溶液的溶质质量分数
D.t2℃时,在100g水中放入60 g乙,其溶质的质量分数为37.5%
二、填空题
16.在老师的带领下,某学习小组的同学对“影响物质溶解性的因素”进行了实验探究,充分溶解后结果如下。
(1)A中溶液的溶质质量为______g。
(2)B中得到的溶液为______溶液(填“饱和”或“不饱和”)
(3)通过______对比,可得出的结论是温度影响物质的溶解性;通过AC对比,可得出的结论是______。
17.图表法是一种常用的数据处理方法。结合所给图表回答下列问题:
(1)下图为KNO3的溶解度曲线,a、b在溶解度曲线上。
①a点对应的溶液是______溶液。(填“饱和”或者“不饱和”)
②a点对应的溶液的质量分数是________。 (只列计算式)
③将a点对应的溶液升温到70℃,其质量分数________。(填写“变大”、“变小”或“不变”)
④欲使KNO3溶液的状态从b点转化为c点,可采取的措施是________________。
(2)来氢氧化钠、碳酸钠分别在水、酒精中的溶解度如下表所示: (说明:)
氢氧化钠 碳酸钠
20℃ 40℃ 20℃ 40℃
水 109g 129g 21.8g 49g
酒精 17.3g 40g 不溶 不溶
①上述图像表示__________(填“氢氧化钠”或“碳酸钠”)的溶解度曲线。
②20℃时,氢氧化钠的溶解度______(填“大于”或“小于”)碳酸钠。
③40℃时,若将50gNaOH分别投入到100g水和100g酒精中,能形成饱和溶液的是__________,后者形成溶液的溶质质量分数为__________。(结果保留一位小数)
④将CO2通入所得NaOH的酒精溶液中,观察到的现象为________________。
18.如图是X、Y、Z三种固体物质的溶解度曲线。
(1)t2℃时,将35gX加入50g水中,充分搅拌,得到的溶液是______(填“饱和”或“不饱和”)溶液。
(2)将 X、Y、Z 三种物质的饱和溶液,由t2℃降温到t1℃没有固体析出的是______。
19.甲、乙、丙三种物质的溶解度线如图所示,请回答问题。
(1)当温度为t2℃时,p点的意义________,甲、乙、丙三种物质形成饱和溶液的溶质质量分数的关系为________。
(2)t3℃时,甲的饱和溶液中溶质与溶液的质量比是________(填最简比)。
(3)若将丙的饱和溶液从t3℃降温到t1℃时,一定会发生改变的是________。
A 溶解度 B 溶剂质量 C 溶质质量 D 溶质质量分数
20.硝酸钾与氯化钾的溶解度曲线如下图所示,回答下列问题:
①t1℃时,两物质中溶解度较大的是_________。
②t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是________的溶液,将氯化钾从溶液中结晶出来的最佳方法是采用_______(填“降温结晶”或“蒸发结晶”)。
③t2℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的_______(填“饱和”或“不饱和”)溶液。保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数______(填“变大”、“不变”或“变小”)。
④欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围__________________。
三、实验题
21.下表是硝酸钾和氯化钠的部分溶解度数据,回答下列问题。
温度(℃) 0 20 40 60 80
溶解度(g/100g水) 氯化钠 35.7 36.0 36.6 37.3 38.4
硝酸钾 13.3 31.6 63.9 110.0 169.0
①60℃时,硝酸钾的溶解度是_______。
②20℃,50g水中加入30g硝酸钾,所得溶液的质量是_______g。
③若硝酸钾中混有少量的氯化钠,提纯硝酸钾可采取的方法是_______。
④在20℃时,将等质量的硝酸钾和氯化钠分别加入到各盛有100g水的甲、乙两个烧杯中,充分搅拌后如图,说法错误的是_______(填序号)。
A 烧杯甲中溶液一定是不饱和溶液
B 烧杯乙中溶液的溶质是硝酸钾
C 若使烧杯乙中固体全部溶解,其溶液浓度一定增大
D 将温度升高到50℃,烧杯乙中的固体一定全部溶解
⑤20℃时,在100g水中溶解NaCl和KNO3,进行以下实验:
Ⅰ.溶液c所含溶质为_______,固体a为_______g。
Ⅱ.对整个实验过程分析正确的是_______。
A 固体b是纯净物
B 溶液c、d中NaCl质量分数相等
C 溶液d中硝酸钾的质量小于氯化钠的质量
D 实验过程中硝酸钾溶液始终是不饱和溶液
参考答案:
1.C2.B3.D4.A5.C6.C7.D8.A9.D10.D11.D12.A13.D14.B15.C
16.(1)17.3
(2)饱和
(3) BD 溶质的种类影响物质溶解性
17. 饱和 ×100% 不变 加入水 氢氧化钠 大于 酒精 28.6% 出现浑浊
18.(1)饱和
(2)Z
19. t2°C时,甲乙物质溶解度相等 甲=乙>丙 4:9 A
20. 氯化钾 。 硝酸钾 蒸发结晶 饱和 不变 。 温度≥t1 。
21. 110.0g/100g水 65.8 降温结晶法 AC KNO3、NaCl 114 AD
同步练习
一、单选题
1.下列关于溶液的说法错误的是
A.溶液具有均一、稳定性
B.固体物质溶于水时,一般扩散的过程吸热,水合的过程放热
C.用胆矾、生石灰和水混制的波尔多液属于溶液
D.一定温度下,固体物质的溶解度不随水的质量改变而改变
2.现有两杯20℃时的食盐饱和溶液,甲为500g,乙为1000g,在温度不变的情况下分别蒸发掉15g水,析出食盐晶体的质量分别为m克和n克,则m、n的关系是
A.n=2m B.n=m C.m=2n D.无法确定
3.下列对实验现象的观察或记录中正确的是
A.镁在空气中燃烧,发出白光,生成氧化镁固体
B.室温下,向饱和食盐水中加入少量硝酸钾固体,搅拌,固体不溶解
C.硝酸铵溶于水时温度上升
D.将黄铜与紫铜互相刻划,紫铜表面出现划痕
4.20℃时,氯化钠的溶解度为36g,则20℃时,将50g氯化钠放入100g水中充分溶解后所得溶液的质量为( )
A.136g B.150g C.186g D.86g
5.甲、乙的溶解度曲线如图所示(不考虑水的变化),下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.t2℃时,甲的饱和溶液中溶质的质量分数为40%
C.t1℃时,甲、乙两物质的溶解度相等
D.t2℃时,将甲、乙的饱和溶液分别降温到t1℃,析出晶体甲的质量大
6.如图为Ca(OH)2的溶解度曲线,下列说法错误的是( )
A.Ca(OH)2的溶解度随温度的升高而减小
B.30℃时,10g水中最多溶解0.015g Ca(OH)2
C.30℃时,将饱和的石灰水升温到50℃,溶质的质量分数不变
D.50℃时,饱和石灰水中加入2g生石灰,溶液质量减少
7.如图是甲、乙两种固体物质的溶解度曲线,下列说法中不正确的是:
A.20℃时,甲、乙两者的溶解度相等
B.大于20℃时,甲的溶解度大于乙的溶解度
C.40℃时,甲的饱和溶液中溶质的质量分数为33.3%
D.将40℃乙的饱和溶液降温至20℃,可变成不饱和溶液
8.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(20℃、101kPa条件下测定)。实验室要收集SO2气体,可采取的方法是
气体性质 H2 CO2 SO2
密度(g/L) 0.08987 1.975 2.716
溶解度(L) 0.0001603 0.1688 11.28
A.向上排空气法
B.向下排空气法
C.排水集气法
D.既可用向上排空气法,又可用排水集气法
9.影响固体在水中溶解度大小的外界条件是
A.加入水的多少 B.加入溶质的多少
C.是否进行振荡和搅拌 D.温度的变化
10.下图是熟石灰的溶解度曲线,下列说法正确的是
A.熟石灰属于易溶物
B.任何固体的溶解度都是随温度的升高而变大
C.石灰水中溶质的质量分数随温度的升高而变大
D.把20℃时澄清的饱和石灰水升温到100℃溶液变浑浊
11.如表是NaCl、KNO3 在不同温度时的溶解度:
温度/°C 10 20 30 40 50 60
溶解度/g NaCl 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 20.9 31.6 45.8 63.9 85.5 110
据此数据,下列说法正确的是( )A.20℃时,将20gNaCl加入50g水中,得到70g 溶液
B.50℃时,KNO3溶液的溶质质量分数大于NaCl溶液的溶质质量分数
C.降温时,KNO3溶液析出的固体质量大于NaCl溶液析出的固体质量
D.NaCl和KNO3的溶解度曲线在20℃ ~30℃之间相交
12.如图是A、B两种物质的溶解度曲线,下列叙述错误的是
A.A物质的溶解度大于B物质的溶解度
B.A物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小
C.30℃时,向100克水中加入25克A物质,充分溶解后所得的溶液是饱和溶液
D.30℃时,将B物质的不饱和溶液转变为饱和溶液,可用恒温蒸发溶剂的方法
13.图表资料可以为我们提供很多信息。下面是某学生对图表资料的使用,其中正确的是
A.根据某元素的原子结构示意图判断该元素原子核中有几个中子
B.根据密度数据判断液体物质挥发性的大小
C.根据“相对原子质量表”判断每种元素原子中的质子数、中子数和核外电子数
D.根据“各种物质在不同温度时的溶解度表”,设计通过蒸发、结晶把混合溶液中某些溶质分离出来的方法
14.下列选项中,对相应实验描述不正确的是
A.蜡烛由低到高依次熄灭,说明通常状况下二氧化碳不可燃、不助燃,密度比空气大 B.烧杯中饱和石灰水变浑浊,说明氢氧化钠固体溶于水吸收热量使烧杯中溶液温度降低 C.水溶液呈紫红色,汽油的颜色不变,说明同一物质在不同溶剂中溶解性不同 D.通过红磷燃烧前后质量的测定验证质量守恒定律。取用红磷的量不足,对实验结果没有影响
A.A B.B C.C D.D
15.甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是
A.t1℃时,甲和乙的溶解度均为30
B.t1℃时,甲和乙的饱和溶液中溶质质量一定相等
C.t2℃时,分别在100g水中各溶解20 g甲、乙,降温后,乙溶液的溶质质量分数可能会大于甲溶液的溶质质量分数
D.t2℃时,在100g水中放入60 g乙,其溶质的质量分数为37.5%
二、填空题
16.在老师的带领下,某学习小组的同学对“影响物质溶解性的因素”进行了实验探究,充分溶解后结果如下。
(1)A中溶液的溶质质量为______g。
(2)B中得到的溶液为______溶液(填“饱和”或“不饱和”)
(3)通过______对比,可得出的结论是温度影响物质的溶解性;通过AC对比,可得出的结论是______。
17.图表法是一种常用的数据处理方法。结合所给图表回答下列问题:
(1)下图为KNO3的溶解度曲线,a、b在溶解度曲线上。
①a点对应的溶液是______溶液。(填“饱和”或者“不饱和”)
②a点对应的溶液的质量分数是________。 (只列计算式)
③将a点对应的溶液升温到70℃,其质量分数________。(填写“变大”、“变小”或“不变”)
④欲使KNO3溶液的状态从b点转化为c点,可采取的措施是________________。
(2)来氢氧化钠、碳酸钠分别在水、酒精中的溶解度如下表所示: (说明:)
氢氧化钠 碳酸钠
20℃ 40℃ 20℃ 40℃
水 109g 129g 21.8g 49g
酒精 17.3g 40g 不溶 不溶
①上述图像表示__________(填“氢氧化钠”或“碳酸钠”)的溶解度曲线。
②20℃时,氢氧化钠的溶解度______(填“大于”或“小于”)碳酸钠。
③40℃时,若将50gNaOH分别投入到100g水和100g酒精中,能形成饱和溶液的是__________,后者形成溶液的溶质质量分数为__________。(结果保留一位小数)
④将CO2通入所得NaOH的酒精溶液中,观察到的现象为________________。
18.如图是X、Y、Z三种固体物质的溶解度曲线。
(1)t2℃时,将35gX加入50g水中,充分搅拌,得到的溶液是______(填“饱和”或“不饱和”)溶液。
(2)将 X、Y、Z 三种物质的饱和溶液,由t2℃降温到t1℃没有固体析出的是______。
19.甲、乙、丙三种物质的溶解度线如图所示,请回答问题。
(1)当温度为t2℃时,p点的意义________,甲、乙、丙三种物质形成饱和溶液的溶质质量分数的关系为________。
(2)t3℃时,甲的饱和溶液中溶质与溶液的质量比是________(填最简比)。
(3)若将丙的饱和溶液从t3℃降温到t1℃时,一定会发生改变的是________。
A 溶解度 B 溶剂质量 C 溶质质量 D 溶质质量分数
20.硝酸钾与氯化钾的溶解度曲线如下图所示,回答下列问题:
①t1℃时,两物质中溶解度较大的是_________。
②t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是________的溶液,将氯化钾从溶液中结晶出来的最佳方法是采用_______(填“降温结晶”或“蒸发结晶”)。
③t2℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的_______(填“饱和”或“不饱和”)溶液。保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数______(填“变大”、“不变”或“变小”)。
④欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围__________________。
三、实验题
21.下表是硝酸钾和氯化钠的部分溶解度数据,回答下列问题。
温度(℃) 0 20 40 60 80
溶解度(g/100g水) 氯化钠 35.7 36.0 36.6 37.3 38.4
硝酸钾 13.3 31.6 63.9 110.0 169.0
①60℃时,硝酸钾的溶解度是_______。
②20℃,50g水中加入30g硝酸钾,所得溶液的质量是_______g。
③若硝酸钾中混有少量的氯化钠,提纯硝酸钾可采取的方法是_______。
④在20℃时,将等质量的硝酸钾和氯化钠分别加入到各盛有100g水的甲、乙两个烧杯中,充分搅拌后如图,说法错误的是_______(填序号)。
A 烧杯甲中溶液一定是不饱和溶液
B 烧杯乙中溶液的溶质是硝酸钾
C 若使烧杯乙中固体全部溶解,其溶液浓度一定增大
D 将温度升高到50℃,烧杯乙中的固体一定全部溶解
⑤20℃时,在100g水中溶解NaCl和KNO3,进行以下实验:
Ⅰ.溶液c所含溶质为_______,固体a为_______g。
Ⅱ.对整个实验过程分析正确的是_______。
A 固体b是纯净物
B 溶液c、d中NaCl质量分数相等
C 溶液d中硝酸钾的质量小于氯化钠的质量
D 实验过程中硝酸钾溶液始终是不饱和溶液
参考答案:
1.C2.B3.D4.A5.C6.C7.D8.A9.D10.D11.D12.A13.D14.B15.C
16.(1)17.3
(2)饱和
(3) BD 溶质的种类影响物质溶解性
17. 饱和 ×100% 不变 加入水 氢氧化钠 大于 酒精 28.6% 出现浑浊
18.(1)饱和
(2)Z
19. t2°C时,甲乙物质溶解度相等 甲=乙>丙 4:9 A
20. 氯化钾 。 硝酸钾 蒸发结晶 饱和 不变 。 温度≥t1 。
21. 110.0g/100g水 65.8 降温结晶法 AC KNO3、NaCl 114 AD
