第十一单元盐 化肥测试题 (含答案)九年级化学人教版下册
文档属性
| 名称 | 第十一单元盐 化肥测试题 (含答案)九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 89.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-28 18:28:26 | ||
图片预览


文档简介
第十一单元《盐 化肥》测试题
一、单选题
1.除去下列物质中的杂质,所用试剂和方法正确的是
选项 物质 杂质 除杂质所用试剂和方法
A CaO CaCO3 加水溶解、过滤、蒸发
B CO2 CO 点燃
C FeCl2溶液 CuCl2 加入过量铁粉,充分反应后过滤
D NaCl溶液 Na2CO3 加入适量的硝酸钙溶液,充分反应后过滤
A.A B.B C.C D.D
2.物质分类是一种重要的化学思想,下列物质属于碱的是
A.H2SO4 B.NH3·H2O C.Na2CO3 D.NaCl
3.“建设美丽中国”是新时代的目标,下列做法不符合这一理念的是
A.生活垃圾定时定点分类回收 B.实时监测工厂排放的废气
C.绿色出行,积极践行“低碳生活” D.施用大量农药以减少植物病虫害
4.下列有关实验现象描述正确的是
A.铁片加入稀盐酸中,产生气泡,溶液变成黄色
B.打开浓盐酸的试剂瓶,瓶口会产生白烟
C.向氢氧化钠溶液中滴加硫酸铜溶液,出现蓝色沉淀
D.硫在氧气中燃烧,发出蓝紫色火焰,生成二氧化硫气体
5.小金制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀生成。则残留液中有大量的
A.硫酸钠 B.碳酸钠 C.盐酸 D.氯化钠
6.胃液里含有少量盐酸,可以帮助消化,即胃酸.若胃酸过多,人会感到胃不舒服.有下列几种物质:①NaOH、②Ca(OH)2、③Al(OH)3、④NaHCO3,你认为可以用作治疗胃酸过多的药物的有
A.①②③④
B.①②③
C.①②
D.③④
7.物质的性质决定其用途。下列物质的性质与用途对应关系不正确的是
A.熟石灰呈碱性,可用于改良酸性土壤
B.洗洁精对油污有乳化作用,可用于除油污
C.碳酸氢钠受热能分解生成二氧化碳,可用于烘焙糕点
D.干冰与碱反应,可用于制造舞台烟雾效果
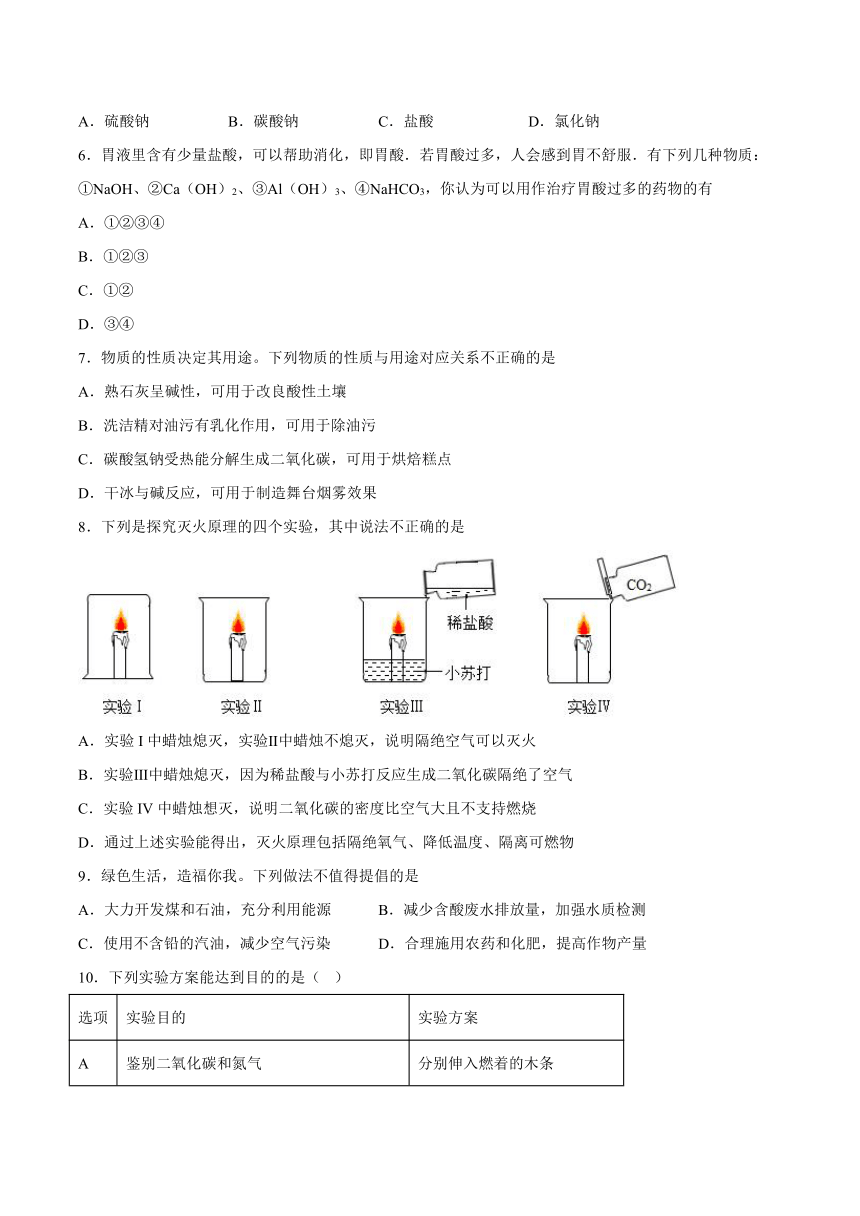
8.下列是探究灭火原理的四个实验,其中说法不正确的是
A.实验I中蜡烛熄灭,实验Ⅱ中蜡烛不熄灭,说明隔绝空气可以灭火
B.实验Ⅲ中蜡烛熄灭,因为稀盐酸与小苏打反应生成二氧化碳隔绝了空气
C.实验IV中蜡烛想灭,说明二氧化碳的密度比空气大且不支持燃烧
D.通过上述实验能得出,灭火原理包括隔绝氧气、降低温度、隔离可燃物
9.绿色生活,造福你我。下列做法不值得提倡的是
A.大力开发煤和石油,充分利用能源 B.减少含酸废水排放量,加强水质检测
C.使用不含铅的汽油,减少空气污染 D.合理施用农药和化肥,提高作物产量
10.下列实验方案能达到目的的是( )
选项 实验目的 实验方案
A 鉴别二氧化碳和氮气 分别伸入燃着的木条
B 除去氨气中少量的水蒸气 通过浓硫酸
C 除去氯化钙溶液中的少量盐酸 加入适量的铁粉
D 鉴别CuSO4、NaCl、CaCO3三种白色固体 取样,加适量水,搅拌,观察
A.A B.B C.C D.D
11.下列说法正确的是
A.某固体遇稀盐酸有气泡放出,则固体一定含碳酸根
B.合金一般比组成它们的纯金属更耐腐蚀
C.饱和溶液析出 晶体后,溶质质量分数一定减小
D.生成盐和水的反应一定属于中和反应
12.下表记录了物质X分别加入到另外三种物质中产生的现象,则物质X可能是
试剂 硝酸银溶液 氧化铜 氢氧化钠溶液
物质X 产生白色沉淀 固体溶解,溶液变蓝 无明显现象
A.氯化钠溶液 B.澄清石灰水 C.稀硝酸 D.稀盐酸
二、填空题
13.小明同学为探究“Na2CO3溶液与稀盐酸反应是放热反应还是吸热反应”,设计并进行了3次重复实验,结果如下表:
试剂1 试剂2 混合前温度/℃ 混合后温度/℃
35毫升稀盐酸 25毫升Na2CO3溶液 20.0 第1次 24.2
第2次 24.0
第3次 24.4
请你帮助填写相关内容:
(1)写出该实验涉及的化学反应方程式 _____;
(2)该实验中所用的仪器除烧杯、量筒、玻璃棒、保温瓶外,还必须用到的一种仪器是: _____;
(3)由上表数据可知:Na2CO3溶液与稀盐酸的反应是 _____(选填:“放热“或“吸热“)反应。
14.从①熟石灰、②硝酸钾、⑧金刚石、④小苏打中,选择适当的物质填空(填化学式):
(1)常用于发酵粉的是__________; (2)可用来裁玻璃的是__________;
(3)可用作复合肥的是__________; (4)可用于改良酸性土壤的是__________。
三、简答题
15.鉴别①CuSO4溶液②Ba(OH)2溶液③Na2CO3溶液④稀盐酸4瓶失去了标签的溶液。
(1)只需观察,就能将CuSO4溶液鉴别出来,原因是只有硫酸铜溶液呈_____色;
(2)向剩余的3种溶液的样品中分别滴加Na2CO3溶液就能把它们鉴别开来,Na2CO3溶液与稀盐酸的反应可用化学方程式表示为_____;
(3)将剩余的3种溶液随意编号为A、B、C后取样进行如下实验,也可以鉴别它们:
①A+B ②A+C ③B+C
鉴别出Ba(OH)2溶液所依据的现象是_____;
(4)将(3)两两混合后的所有物质倒入同一只烧杯中,产生大量气泡,最终只得到无色溶液,由此判断,所得无色溶液中一定含有的溶质是_____。
16.判断下列反应能否发生。如能反应,写出反应的化学方程式;如不能反应,
请注明“不反应”。
(1)铝和硝酸银溶液_____
(2)氯化钡溶液和硫酸钠溶液_____
(3)铜和稀硫酸_____
(4)硫酸铜溶液和氢氧化镁_____
四、实验题
17.同学们运用对比的学习方法探究碱的性质。
实验一 实验二 实验三
观察固体表面 向两块固体表面滴加稀盐酸 振荡三个塑料瓶
①由上图实验一、二可知,氢氧化钠会吸收空气的______________,因此要密封保存。
②实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C, A瓶内发生反应的化学方程式为_____________________,对比A瓶与____________(选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应。
③同学们设计如下两种方案鉴别氢氧化钠溶液与饱和氢氧化钙溶液(编号为A、B)。
方案一 方案二 分析
微热(不考虑水分蒸发) 两种方案中均观察到A试管内出现白色浑浊,A中试剂为____________; 方案二的设计原理是利用了_____________。
五、计算题
18.某学校化学实验室有一杯含盐酸和氯化铜的废液,该校化学兴趣小组的同学取109.8g废液于烧杯中,向其中逐滴加入一定溶质质量分数的氢氧化钠溶液,所加氢氧化钠溶液与生成沉淀的质量关系如图所示。
计算:
(1)产生沉淀的总质量是______g;
(2)计算氢氧化钠溶液中溶质的质量分数。
参考答案:
1.C 2.B 3.D 4.C 5.A 6.D 7.D 8.D 9.A 10.D 11.B 12.D
13. 温度计 放热
14. NaHCO3 C KNO3 Ca(OH)2
15. 蓝 Na2CO3+2HCl=2NaCl+CO2↑+H2O 和一种溶液混合生成白色沉淀,和一种溶液混合无现象。 BaCl2和NaCl
16. Al+3AgNO3═Al(NO3)3+3Ag Na2SO4+BaCl2=BaSO4↓+2NaCl 不反应 Mg(OH)2+ CuSO4= MgSO4+Cu(OH)2↓
17. H2O 和CO2 2NaOH + CO2 = Na2CO3 + H2O C 氢氧化钙溶液 氢氧化钙的溶解度随温度升高而减小
18.(1)9.8
(2)
解:从图像看出,与氯化铜反应的氢氧化钠溶液的质量为100g-50g=50g;
设50g氢氧化钠溶液中氢氧化钠的质量为x,
氢氧化钠溶液中溶质的质量分数为×100%=16%;
答:氢氧化钠溶液中溶质的质量分数为16%。
一、单选题
1.除去下列物质中的杂质,所用试剂和方法正确的是
选项 物质 杂质 除杂质所用试剂和方法
A CaO CaCO3 加水溶解、过滤、蒸发
B CO2 CO 点燃
C FeCl2溶液 CuCl2 加入过量铁粉,充分反应后过滤
D NaCl溶液 Na2CO3 加入适量的硝酸钙溶液,充分反应后过滤
A.A B.B C.C D.D
2.物质分类是一种重要的化学思想,下列物质属于碱的是
A.H2SO4 B.NH3·H2O C.Na2CO3 D.NaCl
3.“建设美丽中国”是新时代的目标,下列做法不符合这一理念的是
A.生活垃圾定时定点分类回收 B.实时监测工厂排放的废气
C.绿色出行,积极践行“低碳生活” D.施用大量农药以减少植物病虫害
4.下列有关实验现象描述正确的是
A.铁片加入稀盐酸中,产生气泡,溶液变成黄色
B.打开浓盐酸的试剂瓶,瓶口会产生白烟
C.向氢氧化钠溶液中滴加硫酸铜溶液,出现蓝色沉淀
D.硫在氧气中燃烧,发出蓝紫色火焰,生成二氧化硫气体
5.小金制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀生成。则残留液中有大量的
A.硫酸钠 B.碳酸钠 C.盐酸 D.氯化钠
6.胃液里含有少量盐酸,可以帮助消化,即胃酸.若胃酸过多,人会感到胃不舒服.有下列几种物质:①NaOH、②Ca(OH)2、③Al(OH)3、④NaHCO3,你认为可以用作治疗胃酸过多的药物的有
A.①②③④
B.①②③
C.①②
D.③④
7.物质的性质决定其用途。下列物质的性质与用途对应关系不正确的是
A.熟石灰呈碱性,可用于改良酸性土壤
B.洗洁精对油污有乳化作用,可用于除油污
C.碳酸氢钠受热能分解生成二氧化碳,可用于烘焙糕点
D.干冰与碱反应,可用于制造舞台烟雾效果
8.下列是探究灭火原理的四个实验,其中说法不正确的是
A.实验I中蜡烛熄灭,实验Ⅱ中蜡烛不熄灭,说明隔绝空气可以灭火
B.实验Ⅲ中蜡烛熄灭,因为稀盐酸与小苏打反应生成二氧化碳隔绝了空气
C.实验IV中蜡烛想灭,说明二氧化碳的密度比空气大且不支持燃烧
D.通过上述实验能得出,灭火原理包括隔绝氧气、降低温度、隔离可燃物
9.绿色生活,造福你我。下列做法不值得提倡的是
A.大力开发煤和石油,充分利用能源 B.减少含酸废水排放量,加强水质检测
C.使用不含铅的汽油,减少空气污染 D.合理施用农药和化肥,提高作物产量
10.下列实验方案能达到目的的是( )
选项 实验目的 实验方案
A 鉴别二氧化碳和氮气 分别伸入燃着的木条
B 除去氨气中少量的水蒸气 通过浓硫酸
C 除去氯化钙溶液中的少量盐酸 加入适量的铁粉
D 鉴别CuSO4、NaCl、CaCO3三种白色固体 取样,加适量水,搅拌,观察
A.A B.B C.C D.D
11.下列说法正确的是
A.某固体遇稀盐酸有气泡放出,则固体一定含碳酸根
B.合金一般比组成它们的纯金属更耐腐蚀
C.饱和溶液析出 晶体后,溶质质量分数一定减小
D.生成盐和水的反应一定属于中和反应
12.下表记录了物质X分别加入到另外三种物质中产生的现象,则物质X可能是
试剂 硝酸银溶液 氧化铜 氢氧化钠溶液
物质X 产生白色沉淀 固体溶解,溶液变蓝 无明显现象
A.氯化钠溶液 B.澄清石灰水 C.稀硝酸 D.稀盐酸
二、填空题
13.小明同学为探究“Na2CO3溶液与稀盐酸反应是放热反应还是吸热反应”,设计并进行了3次重复实验,结果如下表:
试剂1 试剂2 混合前温度/℃ 混合后温度/℃
35毫升稀盐酸 25毫升Na2CO3溶液 20.0 第1次 24.2
第2次 24.0
第3次 24.4
请你帮助填写相关内容:
(1)写出该实验涉及的化学反应方程式 _____;
(2)该实验中所用的仪器除烧杯、量筒、玻璃棒、保温瓶外,还必须用到的一种仪器是: _____;
(3)由上表数据可知:Na2CO3溶液与稀盐酸的反应是 _____(选填:“放热“或“吸热“)反应。
14.从①熟石灰、②硝酸钾、⑧金刚石、④小苏打中,选择适当的物质填空(填化学式):
(1)常用于发酵粉的是__________; (2)可用来裁玻璃的是__________;
(3)可用作复合肥的是__________; (4)可用于改良酸性土壤的是__________。
三、简答题
15.鉴别①CuSO4溶液②Ba(OH)2溶液③Na2CO3溶液④稀盐酸4瓶失去了标签的溶液。
(1)只需观察,就能将CuSO4溶液鉴别出来,原因是只有硫酸铜溶液呈_____色;
(2)向剩余的3种溶液的样品中分别滴加Na2CO3溶液就能把它们鉴别开来,Na2CO3溶液与稀盐酸的反应可用化学方程式表示为_____;
(3)将剩余的3种溶液随意编号为A、B、C后取样进行如下实验,也可以鉴别它们:
①A+B ②A+C ③B+C
鉴别出Ba(OH)2溶液所依据的现象是_____;
(4)将(3)两两混合后的所有物质倒入同一只烧杯中,产生大量气泡,最终只得到无色溶液,由此判断,所得无色溶液中一定含有的溶质是_____。
16.判断下列反应能否发生。如能反应,写出反应的化学方程式;如不能反应,
请注明“不反应”。
(1)铝和硝酸银溶液_____
(2)氯化钡溶液和硫酸钠溶液_____
(3)铜和稀硫酸_____
(4)硫酸铜溶液和氢氧化镁_____
四、实验题
17.同学们运用对比的学习方法探究碱的性质。
实验一 实验二 实验三
观察固体表面 向两块固体表面滴加稀盐酸 振荡三个塑料瓶
①由上图实验一、二可知,氢氧化钠会吸收空气的______________,因此要密封保存。
②实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C, A瓶内发生反应的化学方程式为_____________________,对比A瓶与____________(选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应。
③同学们设计如下两种方案鉴别氢氧化钠溶液与饱和氢氧化钙溶液(编号为A、B)。
方案一 方案二 分析
微热(不考虑水分蒸发) 两种方案中均观察到A试管内出现白色浑浊,A中试剂为____________; 方案二的设计原理是利用了_____________。
五、计算题
18.某学校化学实验室有一杯含盐酸和氯化铜的废液,该校化学兴趣小组的同学取109.8g废液于烧杯中,向其中逐滴加入一定溶质质量分数的氢氧化钠溶液,所加氢氧化钠溶液与生成沉淀的质量关系如图所示。
计算:
(1)产生沉淀的总质量是______g;
(2)计算氢氧化钠溶液中溶质的质量分数。
参考答案:
1.C 2.B 3.D 4.C 5.A 6.D 7.D 8.D 9.A 10.D 11.B 12.D
13. 温度计 放热
14. NaHCO3 C KNO3 Ca(OH)2
15. 蓝 Na2CO3+2HCl=2NaCl+CO2↑+H2O 和一种溶液混合生成白色沉淀,和一种溶液混合无现象。 BaCl2和NaCl
16. Al+3AgNO3═Al(NO3)3+3Ag Na2SO4+BaCl2=BaSO4↓+2NaCl 不反应 Mg(OH)2+ CuSO4= MgSO4+Cu(OH)2↓
17. H2O 和CO2 2NaOH + CO2 = Na2CO3 + H2O C 氢氧化钙溶液 氢氧化钙的溶解度随温度升高而减小
18.(1)9.8
(2)
解:从图像看出,与氯化铜反应的氢氧化钠溶液的质量为100g-50g=50g;
设50g氢氧化钠溶液中氢氧化钠的质量为x,
氢氧化钠溶液中溶质的质量分数为×100%=16%;
答:氢氧化钠溶液中溶质的质量分数为16%。
同课章节目录
