【备考2023】浙教版科学中考核心考点训练(二十):物质的转化【word,含解析】
文档属性
| 名称 | 【备考2023】浙教版科学中考核心考点训练(二十):物质的转化【word,含解析】 |  | |
| 格式 | docx | ||
| 文件大小 | 218.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-28 13:22:33 | ||
图片预览


文档简介
物质的转化
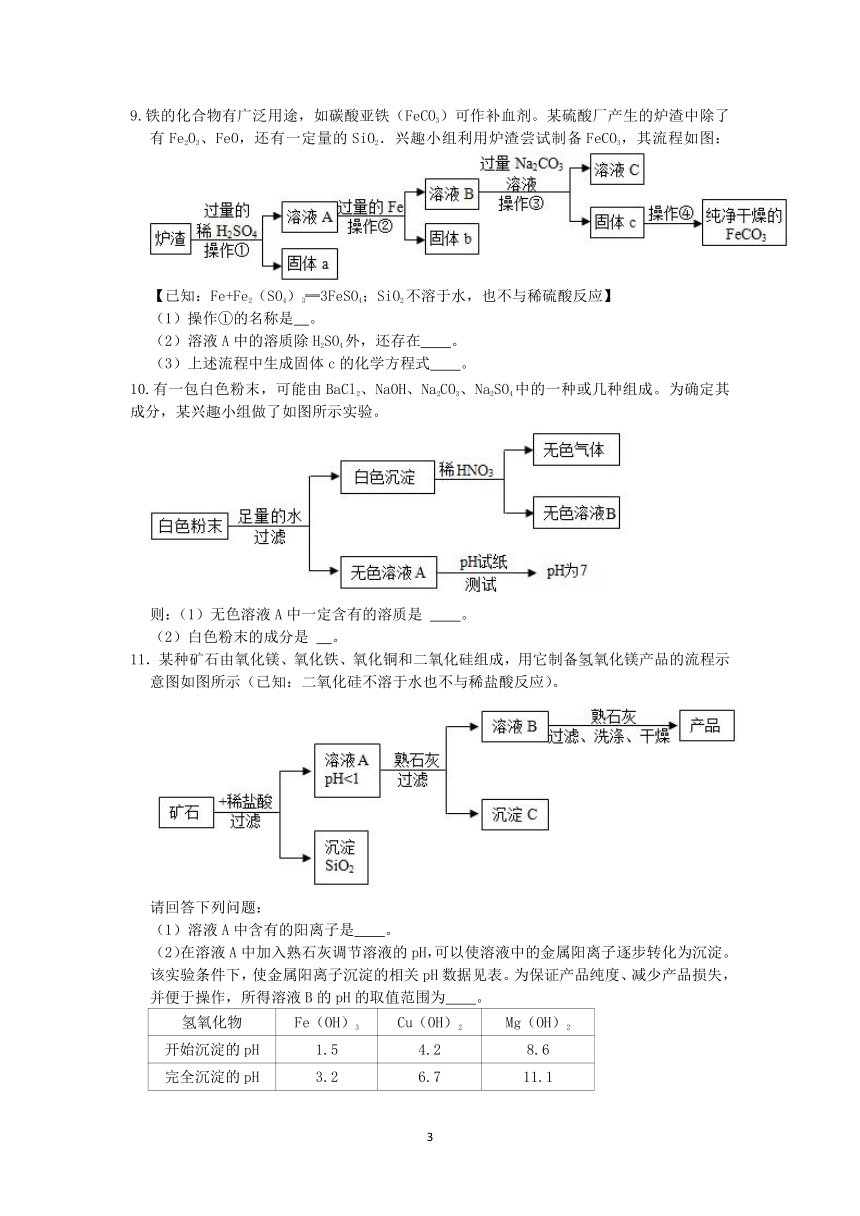
1.某兴趣小组为探究“猪肝中的铁元素”,进行了以下实验:选用新鲜猪肝,如图操作,将猪肝中的铁转化为铁离子,再用硫氰化钾溶液检验(硫氰化钾溶液遇铁离子变红色)。有关该实验的说法正确的是( )
A.实验研究的问题是新鲜猪肝中是否含有铁离子
B.新鲜猪肝中的铁是以游离态形式存在的
C.实验中获得的土黄色混合液属于溶液
D.新鲜猪肝中含铁元素的证据是滴加硫氰化钾溶液后溶液变红
2.如图所示为小嘉构建的甲、乙、丙、丁四种不同物质的关系图,“﹣”表示相邻的两种物质能发生反应。若甲为铁,乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种,则下列判断错误的是( )
A.乙可能是CuCl2溶液 B.丙一定是NaOH溶液
C.丁一定是稀H2SO4 D.丙不可能是稀H2SO4
3.“五水共治”大大美化了河道环境,某学校实验室排出的废水中含有Ag+、Ba2+和NO3﹣三种离子,该校实验小组设计实验从该废水中回收银,并得到副产品碳酸钡固体,操作步骤和实验结果如图:
已知滤液B中只含有一种溶质,则下列说法不正确的是( )
A.蓝色沉淀是Cu(OH)2
B.乙一定是氢氧化钡
C.若丙是K2CO3,滤液C结晶后可以作为化学肥料
D.若得到19.7g碳酸钡,则证明原废水中含有13.7g钡
4.如图所示是小金绘制的思维导图,通过□内物质与序号代表的物质一步反应制取Al2(SO4)3,其中序号所代表的物质错误的是( )
A.①﹣Al(OH)3 B.②﹣Fe2(SO4)3
C.③﹣H2SO4 D.④﹣Al
5.甲、乙、丙有如图所示的转化关系(“→”表示反应能一步实现,部分反应物和反应条件略去)下列各组物质按照甲、乙、丙的顺序符合要求的是( )
A.Fe(NO3)3、FeCl3、Fe(OH)3
B.C、CO2、CO
C.CaCO3、Ca(OH)2、CaO
D.CuO、Cu(OH)2、CuCl2
6.甲,乙,丙,丁四种物质有如图所示的转化关系(部分反应物和产物已略去),则甲,乙,丙,丁依次是( )
A.C,CO,CO2,H2CO3
B.CO,CO2,C,H2CO3
C.CaO,Ca(OH)2,CaCl2,CaCO3
D.CaCO3,Ca(OH)2,CaCl2,CaO
7.用同一种基本反应类型,经过两步反应,不能实现的转化是( )
A.S→H2SO3 B.Fe→Fe(OH)3
C.H2CO3→O2 D.K2CO3→Ba(NO3)2
8.二氧化碳的资源化利用是实现碳减排的重要途径。如图是一种实现二氧化碳转化为重要原料二甲醚(化学式为C2H6O)的途径:
(1)转化①是二氧化碳与一种常见单质反应生成甲醇和水,这种单质的化学式为 。
(2)转化②是甲醇发生分解反应生成二甲醚和水,反应中生成二甲醚和水的分子数之比为 。
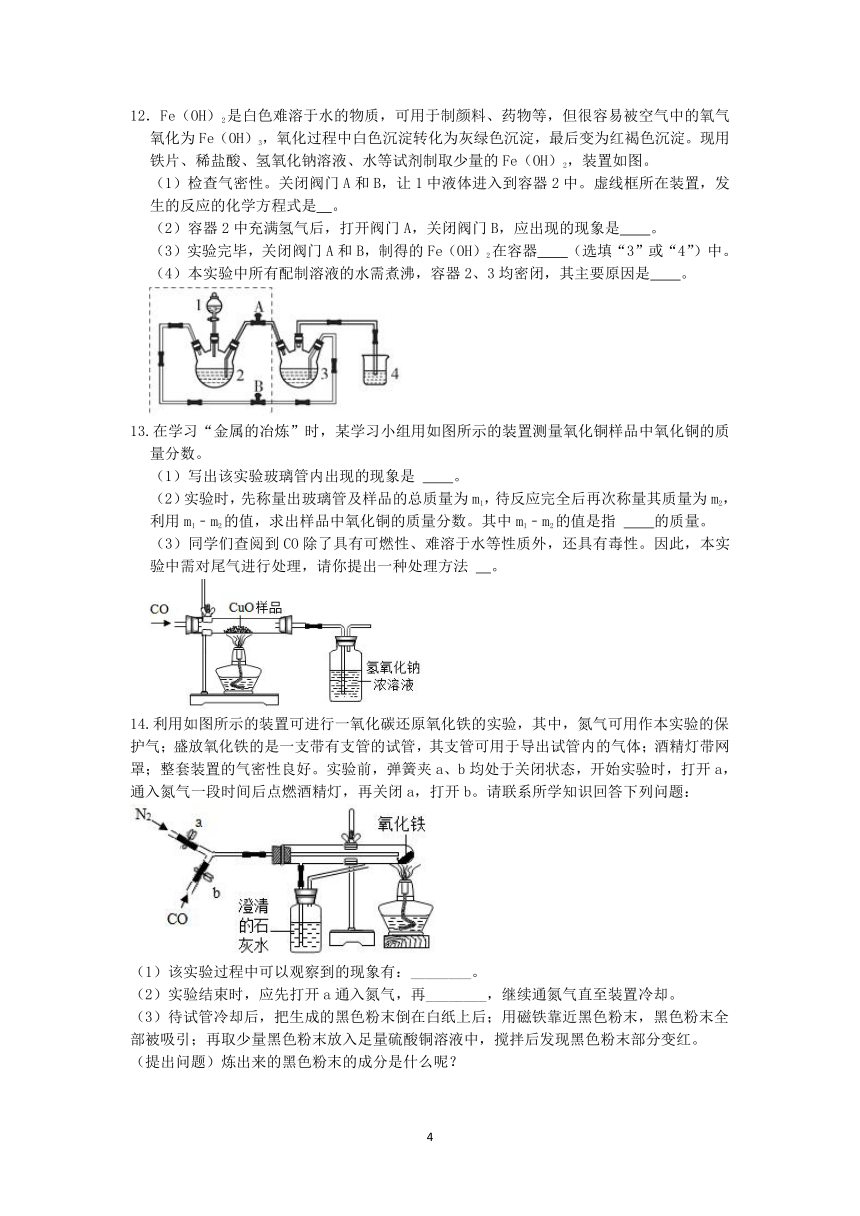
9.铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作补血剂。某硫酸厂产生的炉渣中除了有Fe2O3、FeO,还有一定量的SiO2.兴趣小组利用炉渣尝试制备FeCO3,其流程如图:
【已知:Fe+Fe2(SO4)3═3FeSO4;SiO2不溶于水,也不与稀硫酸反应】
(1)操作①的名称是 。
(2)溶液A中的溶质除H2SO4外,还存在 。
(3)上述流程中生成固体c的化学方程式 。
10.有一包白色粉末,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,某兴趣小组做了如图所示实验。
则:(1)无色溶液A中一定含有的溶质是 。
(2)白色粉末的成分是 。
11.某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁产品的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
请回答下列问题:
(1)溶液A中含有的阳离子是 。
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为 。
氢氧化物 Fe(OH)3 Cu(OH)2 Mg(OH)2
开始沉淀的pH 1.5 4.2 8.6
完全沉淀的pH 3.2 6.7 11.1
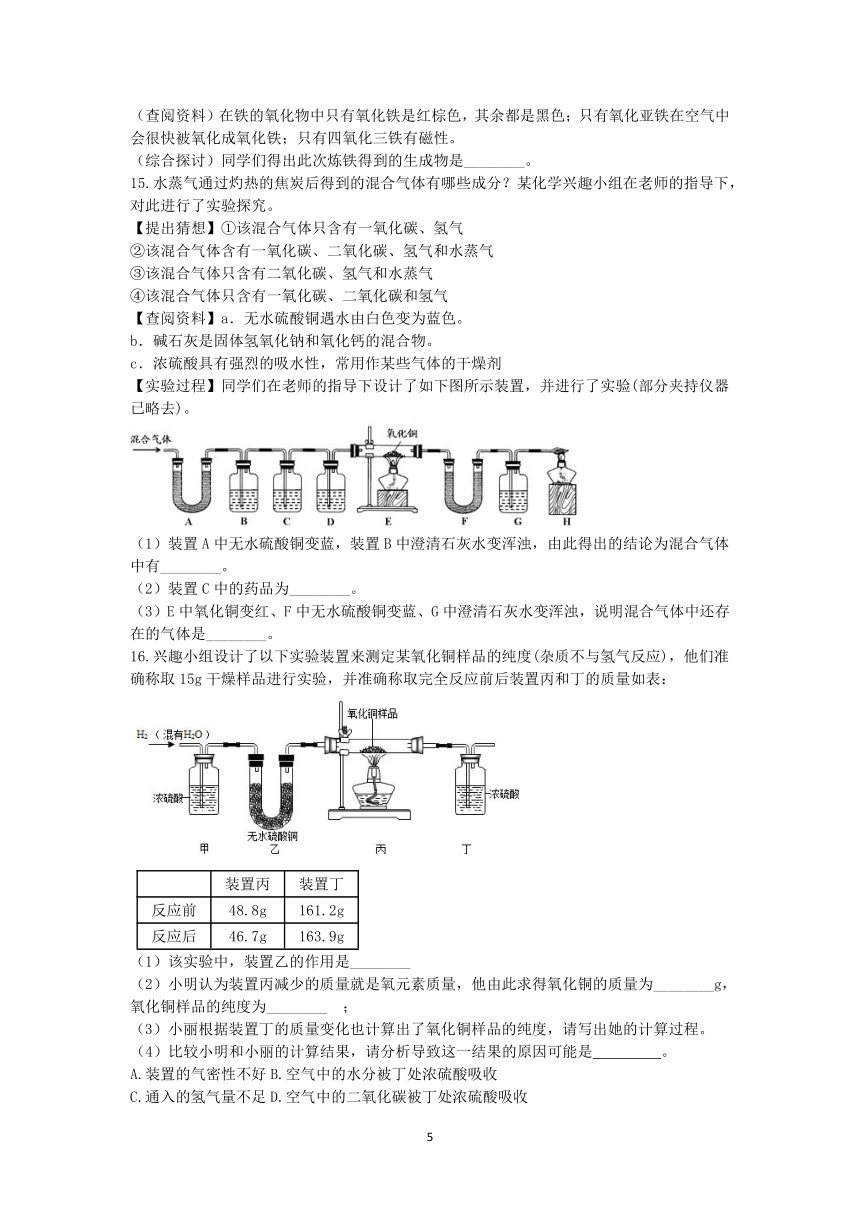
12.Fe(OH)2是白色难溶于水的物质,可用于制颜料、药物等,但很容易被空气中的氧气氧化为Fe(OH)3,氧化过程中白色沉淀转化为灰绿色沉淀,最后变为红褐色沉淀。现用铁片、稀盐酸、氢氧化钠溶液、水等试剂制取少量的Fe(OH)2,装置如图。
(1)检查气密性。关闭阀门A和B,让1中液体进入到容器2中。虚线框所在装置,发生的反应的化学方程式是 。
(2)容器2中充满氢气后,打开阀门A,关闭阀门B,应出现的现象是 。
(3)实验完毕,关闭阀门A和B,制得的Fe(OH)2在容器 (选填“3”或“4”)中。
(4)本实验中所有配制溶液的水需煮沸,容器2、3均密闭,其主要原因是 。
13.在学习“金属的冶炼”时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数。
(1)写出该实验玻璃管内出现的现象是 。
(2)实验时,先称量出玻璃管及样品的总质量为m1,待反应完全后再次称量其质量为m2,利用m1﹣m2的值,求出样品中氧化铜的质量分数。其中m1﹣m2的值是指 的质量。
(3)同学们查阅到CO除了具有可燃性、难溶于水等性质外,还具有毒性。因此,本实验中需对尾气进行处理,请你提出一种处理方法 。
14.利用如图所示的装置可进行一氧化碳还原氧化铁的实验,其中,氮气可用作本实验的保护气;盛放氧化铁的是一支带有支管的试管,其支管可用于导出试管内的气体;酒精灯带网罩;整套装置的气密性良好。实验前,弹簧夹a、b均处于关闭状态,开始实验时,打开a,通入氮气一段时间后点燃酒精灯,再关闭a,打开b。请联系所学知识回答下列问题:
(1)该实验过程中可以观察到的现象有:________。
(2)实验结束时,应先打开a通入氮气,再________,继续通氮气直至装置冷却。
(3)待试管冷却后,把生成的黑色粉末倒在白纸上后;用磁铁靠近黑色粉末,黑色粉末全部被吸引;再取少量黑色粉末放入足量硫酸铜溶液中,搅拌后发现黑色粉末部分变红。
(提出问题)炼出来的黑色粉末的成分是什么呢?
(查阅资料)在铁的氧化物中只有氧化铁是红棕色,其余都是黑色;只有氧化亚铁在空气中会很快被氧化成氧化铁;只有四氧化三铁有磁性。
(综合探讨)同学们得出此次炼铁得到的生成物是________。
15.水蒸气通过灼热的焦炭后得到的混合气体有哪些成分?某化学兴趣小组在老师的指导下,对此进行了实验探究。
【提出猜想】①该混合气体只含有一氧化碳、氢气
②该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气
③该混合气体只含有二氧化碳、氢气和水蒸气
④该混合气体只含有一氧化碳、二氧化碳和氢气
【查阅资料】a.无水硫酸铜遇水由白色变为蓝色。
b.碱石灰是固体氢氧化钠和氧化钙的混合物。
c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
【实验过程】同学们在老师的指导下设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有________。
(2)装置C中的药品为________。
(3)E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,说明混合气体中还存在的气体是________。
16.兴趣小组设计了以下实验装置来测定某氧化铜样品的纯度(杂质不与氢气反应),他们准确称取15g干燥样品进行实验,并准确称取完全反应前后装置丙和丁的质量如表:
装置丙 装置丁
反应前 48.8g 161.2g
反应后 46.7g 163.9g
(1)该实验中,装置乙的作用是________
(2)小明认为装置丙减少的质量就是氧元素质量,他由此求得氧化铜的质量为________g,氧化铜样品的纯度为________ ;
(3)小丽根据装置丁的质量变化也计算出了氧化铜样品的纯度,请写出她的计算过程。 (4)比较小明和小丽的计算结果,请分析导致这一结果的原因可能是 。 A.装置的气密性不好B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足D.空气中的二氧化碳被丁处浓硫酸吸收
答案及解析
1.解:A、由题干信息可知,实验研究的问题是新鲜猪肝中是否含有铁元素,故A错误;
B、新鲜猪肝中的铁是以化合态形式(亚铁离子)存在的,故B错误;
C、实验中获得的土黄色混合液中有难溶性物质,属于悬浊液,故C错误;
D、因为硫氰化钾溶液遇铁离子变红色,则新鲜猪肝中含铁元素的证据是滴加硫氰化钾溶液后溶液变红,故D正确。
故选:D。
2.解:A、铁能和氯化铜反应生成氯化亚铁和铜,氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,氢氧化钠和稀硫酸反应生成硫酸钠和水,稀硫酸和铁反应生成硫酸亚铁和氢气,因此乙可能是CuCl2溶液或稀硫酸,该选项说法正确;
B、铁不能和氢氧化钠反应,因此丙一定是NaOH溶液,该选项说法正确;
C、丁可以是氯化铜溶液,该选项说法不正确;
D、如果丙是稀硫酸,则乙、丁的其中一种是氢氧化钠,氢氧化钠不能和铁反应,因此丙不可能是稀H2SO4,该选项说法正确。
故选:C。
3.解:A、蓝色沉淀是氢氧化钡和硝酸铜反应生成的氢氧化铜,该选项说法正确;
B、滤液B中只含有一种溶质,乙中一定含有钡离子和氢氧根离子,因此乙是氢氧化钡,该选项说法正确;
C、若丙是K2CO3,碳酸钾和硝酸钡反应生成碳酸钡沉淀和硝酸钾,滤液C结晶后得到硝酸钾,可以作为化学肥料,该选项说法正确;
D、若得到19.7g碳酸钡,则钡离子质量:19.7g13.7g,由于加入的乙是氢氧化钡溶液,则原废水中的钡离子质量小于13.7g,该选项说法不正确。
故选:D。
4.解:A、硫酸与氢氧化铝反应生成硫酸铝和水,可以一步反应实现,A正确;
B、氢氧化铝与硫酸铁不能发生复分解反应,不能一步反应实现,B错误;
C、硫酸与氧化铝反应生成硫酸铝和水,可以一步反应实现,C正确;
D、铝与硫酸铜反应生成硫酸铝和铜,可以一步反应实现,D正确;
故选:B。
5.解:
A、硝酸铁不能直接转化为氯化铁,所以不能实现转化;
B、碳燃烧或者体现还原性都会生成二氧化碳,二氧化碳和碳在高温下生成一氧化碳。可以实现转化;
C、碳酸钙不能直接转化为氢氧化钙,所以不能实现转化;
D、氧化铜不能一步转化为氢氧化铜,所以不能实现转化;
故选:B。
6.解:
A、碳会转化成一氧化碳,一氧化碳会转化成二氧化碳,二氧化碳会转化成碳酸,但是碳酸不会转化成碳,故A错误;
B、一氧化碳会转化成二氧化碳,二氧化碳会转化成碳,碳不会转化成碳酸,故B错误;
C、氧化钙和水生成氢氧化钙,氢氧化钙和盐酸生成氯化钙,氯化钙和碳酸钠生成碳酸钙,碳酸钙高温生成氧化钙,故C正确;
D、碳酸钙不会生成氢氧化钙,故D错误。
故选:C。
7.解:A、硫在氧气中燃烧生成二氧化硫,二氧化硫与水反应生成亚硫酸,均属于化合反应,经过两步反应、能实现转化,故选项错误。
B、铁与盐酸发生置换反应生成氯化亚铁和氢气,氯化亚铁与氢氧化钠溶液反应生成氢氧化亚铁沉淀和氯化钠,分别属于置换反应、复分解反应,且经过两步反应,不能实现转化,故选项正确。
C、碳酸分解生成水和二氧化碳,水通电分解生成氢气和氧气,均属于分解反应,经过两步反应、能实现转化,故选项错误。
D、碳酸钾与氢氧化钡溶液反应生成碳酸钡沉淀和氢氧化钾,碳酸钡与硝酸反应生成硝酸钡、水和二氧化碳,均属于复分解反应,经过两步反应、能实现转化,故选项错误。
故选:B。
8.解:(1)根据质量守恒定律,化学反应前后元素的种类不变,转化①是二氧化碳与一种常见单质反应生成甲醇和水,则该单质是含有氢元素的单质,故是氢气,故填:H2;
(2)转化②是甲醇发生分解反应生成二甲醚和水,该反应的化学方程式为:
2CH4O=C2H6O+H2O
故二甲醚和水的分子个数比为1:1
故填:1:1.
9.解:(1)操作①的名称是过滤,通过过滤把液体和固体分离。
故填:过滤。
(2)溶液A中的溶质除H2SO4外,还存在硫酸铁和硫酸亚铁,是因为加入的是过量的稀硫酸,即完全反应后硫酸有剩余,稀硫酸和氧化铁反应生成硫酸铁和水,和氧化亚铁反应生成硫酸亚铁和水,因此溶液中还含有硫酸铁和硫酸亚铁。
故填:硫酸铁、硫酸亚铁。
(3)上述流程中生成固体c是碳酸亚铁,是因为硫酸亚铁和碳酸钠反应生成碳酸亚铁沉淀和硫酸钠,反应的化学方程式:FeSO4+Na2CO3=Na2SO4+FeCO3↓。
故填:FeSO4+Na2CO3=Na2SO4+FeCO3↓。
10.解:白色固体溶于水,得到白色沉淀和无色溶液A,白色沉淀与硝酸反应会生成无色气体和无色溶液B,说明白色沉淀为碳酸盐沉淀,一定不含硫酸钡沉淀,根据提供的物质、氯化钡与碳酸钠溶液反应生成碳酸钡白色沉淀,则白色固体中一定含有碳酸钠和氯化钡,一定不含硫酸钠;无色溶液A测得pH=7,说明显中性,一定不存在氢氧化钠。且碳酸钠在反应中不能过量。
(1)氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,所以无色溶液A中一定含有的溶质是氯化钠;
(2)通过前边的分析可知白色粉末的成分是氯化钡和碳酸钠(或BaCl2、Na2CO3)。
故答案为:(1)氯化钠(或NaCl);
(2)氯化钡和碳酸钠(或BaCl2、Na2CO3)。
11.解:(1)矿石中的金属氧化物与稀盐酸反应的化学方程式为:MgO+2HCl═MgCl2+H2O、CuO+2HCl═CuCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O,溶液A pH<1,呈酸性,说明含有H+,所以溶液A中含有的阳离子是H+、Mg2+、Fe3+和Cu2+。
(2)由表中数据可知,为保证产品纯度、减少产品损失,并便于操作,应控制氢氧化铁和氢氧化铜完全沉淀,而氢氧化镁未开始沉淀,所以所得溶液B的pH的取值范围为 6.7~8.6。
故答为:(1)H+、Mg2+、Fe3+、Cu2+;(2)6.7~8.6。
12.解:由所给药品的性质和装置的特点可知,该实验中利用铁片和盐酸反应制得氯化亚铁,再使氯化亚铁与氢氧化钠溶液反应制得氢氧化亚铁,因此分液漏斗中加入稀盐酸,容器2中加入铁片,容器3中加入氢氧化钠溶液,利用铁与稀盐酸反应生成的氢气可将容器2中的氯化亚铁溶液压入容器3中与氢氧化钠溶液反应,因此制得的氢氧化亚铁在容器3中,所以:
(1)检查气密性。关闭阀门A和B,让1中液体进入到容器2中。虚线框所在装置是铁与稀盐酸反应制取氯化亚铁的,发生的反应的化学方程式是:Fe+2HCl═FeCl2+H2↑。
(2)容器2中充满氢气后,打开阀门A,关闭阀门B,应出现的现象是容器2中液体被压入容器3,容器3中出现白色沉淀。
(3)由上述分析可知,实验完毕,关闭阀门A和B,制得的Fe(OH)2在容器3中。
(4)由于水中溶有少量的氧气,空气中含有氧气,所以本实验中所有配制溶液的水需煮沸,容器2、3均密闭,其主要原因是防止Fe(OH)2被氧化。
故答为:(1)Fe+2HCl═FeCl2+H2↑;(2)容器2中液体被压入容器3,容器3中出现白色沉淀;(3)3;(4)防止Fe(OH)2被氧化。
13.解:(1)一氧化碳可以还原氧化铜为铜,氧化铜为黑色粉末,铜为红色,所以可以看到固体粉末由黑色变为红色;
故答案为:黑色粉末变成红色。
(2)反应前后氧化铜变为铜,减少的为氧元素的质量,所以此时m1﹣m2表示氧化铜中氧元素质量;
故答案为:氧化铜中氧元素。
(3)一氧化碳具有可燃性,可以燃烧变为二氧化碳,因此可以进行点燃处理;
故答案为:将尾气点燃。
14.(1)红棕色粉末变黑,澄清石灰水变浑浊
(2)再关闭b停止通一氧化碳
(3)铁和四氧化三铁
【解析】(1)氧化铁为黑色固体,铜单质为红色固体;二氧化碳和石灰水中的氢氧化钙反应,生成碳酸钙白色沉淀,据此描述现象。
(2)加热的情况下铁易被氧化,所以应避免装置温度高时铁被氧化,所以应先打开a通入氮气,再关闭b停止通一氧化碳,最后熄灭酒精灯,这样可保证不反应的一氧化碳得到充分的燃烧,不会污染空气,最后继续通入氮气直到冷却;
(3)黑色粉末全部被吸引,说明粉末可能是铁单质,也可能是四氧化三铁。铁单质能够和硫酸铜反应生成红色的铜单质,而四氧化三铁则不与其反应,据此分析判断。
【解答】(1)在加热的条件下,一氧化碳将红棕色的氧化铁还原为黑色的铁粉,生成的二氧化碳能使澄清的石灰水变浑浊;
(2)实验结束时,应先打开a通入氮气,再关闭b停止通一氧化碳,继续通氮气直至装置冷却。
(3)[综合探讨] 把生成的黑色粉末倒在白纸上后;用磁铁靠近黑色粉末,黑色粉末全部被吸引;再取少量黑色粉末放入足量硫酸铜溶液中,搅拌后发现黑色粉末部分变红,说明该粉末中含有铁和四氧化三铁。
15.(1)水蒸气和二氧化碳
(2)NaOH 溶液
(3)氢气和一氧化碳
【解析】本题以实验探究的形式考查常见气体氢气、一氧化碳、二氧化碳和水蒸气的性质,同学们要具有综合的化学知识才能做好此题。(1)根据无水硫酸铜遇水变蓝和澄清石灰水遇二氧化碳变浑浊,判断混合气体中的气体;并根据记忆写出石灰水与二氧化碳的反应式;(2)CD装置应是除去(1)中所验证的气体;(3)根据E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,判断混合气体中其余气体;
【解答】(1)由无水硫酸铜遇水变蓝和澄清石灰水遇二氧化碳变浑浊的特点可知,混合气体中有水蒸气和二氧化碳;
(2)C装置中应是氢氧化钠溶液,目的是吸收混合气体中的二氧化碳;
(3)E中氧化铜变红,说明有一氧化碳气体或氢气或二者的混合气体;F中无水硫酸铜变蓝,说明有氢气,因为氢气还原氧化铜可生成水;G中澄清石灰水变浑浊,说明有一氧化碳气体,因为一氧化碳还原氧化铜可生成二氧化碳;
16.(1)检验氢气中混有的水是否被浓硫酸吸收完
(2)10.5;70%
(3)解:生成的水的量为: 163.9g-161.2g=2.7g
CuO+H2 Cu+ H2O
80 18
x 2.7g
x=12g,
则氧化铜的纯度为: ×100%=80%
(4)B
【解析】(1)无水硫酸铜遇到水会由白色变成蓝色,因此根据它的颜色是否改变,可以确定氢气中的水是否被完全除去;
(2)将装置丙中反应前后的总质量相减得到氧元素的质量,再根据计算出氧化铜的质量,最后根据计算出样品的纯度。
(3)将装置丁反应前后的总质量相减得到生成水的质量,然后写出氧化铜和氢气反应的方程式,计算出参加反应的氧化铜的质量,最后计算出氧化铜的纯度即可。
(4)将两个同学计算的结果进行比较,然后与各个选项中的成因进行对照即可。
【解答】(1)该实验中,装置乙的作用是:检验氢气中混有的水是否被浓硫酸吸收完;
(2)氧化铜中氧元素的质量:48.8g-46.7g=2.1g;
氧化铜的质量:;
氧化铜样品的纯度为:。
(3)生成的水的量为: 163.9g-161.2g=2.7g
80 18
x 2.7g
解得:x=12g,
则氧化铜的纯度为: ×100%=80%。
(4)将二者比较可知,小明计算出的结果偏大。
A.装置的气密性不好,那么生成的水蒸气会溢出,从而使丁装置的质量偏小,那么计算结果偏小,故A不合题意;
B.空气中的水分被丁处浓硫酸吸收,会使丁装置的质量偏大,那么计算结果偏大,故B符合题意;
C.通入的氢气量不足,那么参加的氧化铜偏少,生成水的质量偏少,计算结果偏小,故C不合题意;
D.空气中的二氧化碳不能被浓硫酸吸收,故D不合题意。
故选B。
(
1
)
1.某兴趣小组为探究“猪肝中的铁元素”,进行了以下实验:选用新鲜猪肝,如图操作,将猪肝中的铁转化为铁离子,再用硫氰化钾溶液检验(硫氰化钾溶液遇铁离子变红色)。有关该实验的说法正确的是( )
A.实验研究的问题是新鲜猪肝中是否含有铁离子
B.新鲜猪肝中的铁是以游离态形式存在的
C.实验中获得的土黄色混合液属于溶液
D.新鲜猪肝中含铁元素的证据是滴加硫氰化钾溶液后溶液变红
2.如图所示为小嘉构建的甲、乙、丙、丁四种不同物质的关系图,“﹣”表示相邻的两种物质能发生反应。若甲为铁,乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种,则下列判断错误的是( )
A.乙可能是CuCl2溶液 B.丙一定是NaOH溶液
C.丁一定是稀H2SO4 D.丙不可能是稀H2SO4
3.“五水共治”大大美化了河道环境,某学校实验室排出的废水中含有Ag+、Ba2+和NO3﹣三种离子,该校实验小组设计实验从该废水中回收银,并得到副产品碳酸钡固体,操作步骤和实验结果如图:
已知滤液B中只含有一种溶质,则下列说法不正确的是( )
A.蓝色沉淀是Cu(OH)2
B.乙一定是氢氧化钡
C.若丙是K2CO3,滤液C结晶后可以作为化学肥料
D.若得到19.7g碳酸钡,则证明原废水中含有13.7g钡
4.如图所示是小金绘制的思维导图,通过□内物质与序号代表的物质一步反应制取Al2(SO4)3,其中序号所代表的物质错误的是( )
A.①﹣Al(OH)3 B.②﹣Fe2(SO4)3
C.③﹣H2SO4 D.④﹣Al
5.甲、乙、丙有如图所示的转化关系(“→”表示反应能一步实现,部分反应物和反应条件略去)下列各组物质按照甲、乙、丙的顺序符合要求的是( )
A.Fe(NO3)3、FeCl3、Fe(OH)3
B.C、CO2、CO
C.CaCO3、Ca(OH)2、CaO
D.CuO、Cu(OH)2、CuCl2
6.甲,乙,丙,丁四种物质有如图所示的转化关系(部分反应物和产物已略去),则甲,乙,丙,丁依次是( )
A.C,CO,CO2,H2CO3
B.CO,CO2,C,H2CO3
C.CaO,Ca(OH)2,CaCl2,CaCO3
D.CaCO3,Ca(OH)2,CaCl2,CaO
7.用同一种基本反应类型,经过两步反应,不能实现的转化是( )
A.S→H2SO3 B.Fe→Fe(OH)3
C.H2CO3→O2 D.K2CO3→Ba(NO3)2
8.二氧化碳的资源化利用是实现碳减排的重要途径。如图是一种实现二氧化碳转化为重要原料二甲醚(化学式为C2H6O)的途径:
(1)转化①是二氧化碳与一种常见单质反应生成甲醇和水,这种单质的化学式为 。
(2)转化②是甲醇发生分解反应生成二甲醚和水,反应中生成二甲醚和水的分子数之比为 。
9.铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作补血剂。某硫酸厂产生的炉渣中除了有Fe2O3、FeO,还有一定量的SiO2.兴趣小组利用炉渣尝试制备FeCO3,其流程如图:
【已知:Fe+Fe2(SO4)3═3FeSO4;SiO2不溶于水,也不与稀硫酸反应】
(1)操作①的名称是 。
(2)溶液A中的溶质除H2SO4外,还存在 。
(3)上述流程中生成固体c的化学方程式 。
10.有一包白色粉末,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,某兴趣小组做了如图所示实验。
则:(1)无色溶液A中一定含有的溶质是 。
(2)白色粉末的成分是 。
11.某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁产品的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
请回答下列问题:
(1)溶液A中含有的阳离子是 。
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为 。
氢氧化物 Fe(OH)3 Cu(OH)2 Mg(OH)2
开始沉淀的pH 1.5 4.2 8.6
完全沉淀的pH 3.2 6.7 11.1
12.Fe(OH)2是白色难溶于水的物质,可用于制颜料、药物等,但很容易被空气中的氧气氧化为Fe(OH)3,氧化过程中白色沉淀转化为灰绿色沉淀,最后变为红褐色沉淀。现用铁片、稀盐酸、氢氧化钠溶液、水等试剂制取少量的Fe(OH)2,装置如图。
(1)检查气密性。关闭阀门A和B,让1中液体进入到容器2中。虚线框所在装置,发生的反应的化学方程式是 。
(2)容器2中充满氢气后,打开阀门A,关闭阀门B,应出现的现象是 。
(3)实验完毕,关闭阀门A和B,制得的Fe(OH)2在容器 (选填“3”或“4”)中。
(4)本实验中所有配制溶液的水需煮沸,容器2、3均密闭,其主要原因是 。
13.在学习“金属的冶炼”时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数。
(1)写出该实验玻璃管内出现的现象是 。
(2)实验时,先称量出玻璃管及样品的总质量为m1,待反应完全后再次称量其质量为m2,利用m1﹣m2的值,求出样品中氧化铜的质量分数。其中m1﹣m2的值是指 的质量。
(3)同学们查阅到CO除了具有可燃性、难溶于水等性质外,还具有毒性。因此,本实验中需对尾气进行处理,请你提出一种处理方法 。
14.利用如图所示的装置可进行一氧化碳还原氧化铁的实验,其中,氮气可用作本实验的保护气;盛放氧化铁的是一支带有支管的试管,其支管可用于导出试管内的气体;酒精灯带网罩;整套装置的气密性良好。实验前,弹簧夹a、b均处于关闭状态,开始实验时,打开a,通入氮气一段时间后点燃酒精灯,再关闭a,打开b。请联系所学知识回答下列问题:
(1)该实验过程中可以观察到的现象有:________。
(2)实验结束时,应先打开a通入氮气,再________,继续通氮气直至装置冷却。
(3)待试管冷却后,把生成的黑色粉末倒在白纸上后;用磁铁靠近黑色粉末,黑色粉末全部被吸引;再取少量黑色粉末放入足量硫酸铜溶液中,搅拌后发现黑色粉末部分变红。
(提出问题)炼出来的黑色粉末的成分是什么呢?
(查阅资料)在铁的氧化物中只有氧化铁是红棕色,其余都是黑色;只有氧化亚铁在空气中会很快被氧化成氧化铁;只有四氧化三铁有磁性。
(综合探讨)同学们得出此次炼铁得到的生成物是________。
15.水蒸气通过灼热的焦炭后得到的混合气体有哪些成分?某化学兴趣小组在老师的指导下,对此进行了实验探究。
【提出猜想】①该混合气体只含有一氧化碳、氢气
②该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气
③该混合气体只含有二氧化碳、氢气和水蒸气
④该混合气体只含有一氧化碳、二氧化碳和氢气
【查阅资料】a.无水硫酸铜遇水由白色变为蓝色。
b.碱石灰是固体氢氧化钠和氧化钙的混合物。
c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
【实验过程】同学们在老师的指导下设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有________。
(2)装置C中的药品为________。
(3)E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,说明混合气体中还存在的气体是________。
16.兴趣小组设计了以下实验装置来测定某氧化铜样品的纯度(杂质不与氢气反应),他们准确称取15g干燥样品进行实验,并准确称取完全反应前后装置丙和丁的质量如表:
装置丙 装置丁
反应前 48.8g 161.2g
反应后 46.7g 163.9g
(1)该实验中,装置乙的作用是________
(2)小明认为装置丙减少的质量就是氧元素质量,他由此求得氧化铜的质量为________g,氧化铜样品的纯度为________ ;
(3)小丽根据装置丁的质量变化也计算出了氧化铜样品的纯度,请写出她的计算过程。 (4)比较小明和小丽的计算结果,请分析导致这一结果的原因可能是 。 A.装置的气密性不好B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足D.空气中的二氧化碳被丁处浓硫酸吸收
答案及解析
1.解:A、由题干信息可知,实验研究的问题是新鲜猪肝中是否含有铁元素,故A错误;
B、新鲜猪肝中的铁是以化合态形式(亚铁离子)存在的,故B错误;
C、实验中获得的土黄色混合液中有难溶性物质,属于悬浊液,故C错误;
D、因为硫氰化钾溶液遇铁离子变红色,则新鲜猪肝中含铁元素的证据是滴加硫氰化钾溶液后溶液变红,故D正确。
故选:D。
2.解:A、铁能和氯化铜反应生成氯化亚铁和铜,氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,氢氧化钠和稀硫酸反应生成硫酸钠和水,稀硫酸和铁反应生成硫酸亚铁和氢气,因此乙可能是CuCl2溶液或稀硫酸,该选项说法正确;
B、铁不能和氢氧化钠反应,因此丙一定是NaOH溶液,该选项说法正确;
C、丁可以是氯化铜溶液,该选项说法不正确;
D、如果丙是稀硫酸,则乙、丁的其中一种是氢氧化钠,氢氧化钠不能和铁反应,因此丙不可能是稀H2SO4,该选项说法正确。
故选:C。
3.解:A、蓝色沉淀是氢氧化钡和硝酸铜反应生成的氢氧化铜,该选项说法正确;
B、滤液B中只含有一种溶质,乙中一定含有钡离子和氢氧根离子,因此乙是氢氧化钡,该选项说法正确;
C、若丙是K2CO3,碳酸钾和硝酸钡反应生成碳酸钡沉淀和硝酸钾,滤液C结晶后得到硝酸钾,可以作为化学肥料,该选项说法正确;
D、若得到19.7g碳酸钡,则钡离子质量:19.7g13.7g,由于加入的乙是氢氧化钡溶液,则原废水中的钡离子质量小于13.7g,该选项说法不正确。
故选:D。
4.解:A、硫酸与氢氧化铝反应生成硫酸铝和水,可以一步反应实现,A正确;
B、氢氧化铝与硫酸铁不能发生复分解反应,不能一步反应实现,B错误;
C、硫酸与氧化铝反应生成硫酸铝和水,可以一步反应实现,C正确;
D、铝与硫酸铜反应生成硫酸铝和铜,可以一步反应实现,D正确;
故选:B。
5.解:
A、硝酸铁不能直接转化为氯化铁,所以不能实现转化;
B、碳燃烧或者体现还原性都会生成二氧化碳,二氧化碳和碳在高温下生成一氧化碳。可以实现转化;
C、碳酸钙不能直接转化为氢氧化钙,所以不能实现转化;
D、氧化铜不能一步转化为氢氧化铜,所以不能实现转化;
故选:B。
6.解:
A、碳会转化成一氧化碳,一氧化碳会转化成二氧化碳,二氧化碳会转化成碳酸,但是碳酸不会转化成碳,故A错误;
B、一氧化碳会转化成二氧化碳,二氧化碳会转化成碳,碳不会转化成碳酸,故B错误;
C、氧化钙和水生成氢氧化钙,氢氧化钙和盐酸生成氯化钙,氯化钙和碳酸钠生成碳酸钙,碳酸钙高温生成氧化钙,故C正确;
D、碳酸钙不会生成氢氧化钙,故D错误。
故选:C。
7.解:A、硫在氧气中燃烧生成二氧化硫,二氧化硫与水反应生成亚硫酸,均属于化合反应,经过两步反应、能实现转化,故选项错误。
B、铁与盐酸发生置换反应生成氯化亚铁和氢气,氯化亚铁与氢氧化钠溶液反应生成氢氧化亚铁沉淀和氯化钠,分别属于置换反应、复分解反应,且经过两步反应,不能实现转化,故选项正确。
C、碳酸分解生成水和二氧化碳,水通电分解生成氢气和氧气,均属于分解反应,经过两步反应、能实现转化,故选项错误。
D、碳酸钾与氢氧化钡溶液反应生成碳酸钡沉淀和氢氧化钾,碳酸钡与硝酸反应生成硝酸钡、水和二氧化碳,均属于复分解反应,经过两步反应、能实现转化,故选项错误。
故选:B。
8.解:(1)根据质量守恒定律,化学反应前后元素的种类不变,转化①是二氧化碳与一种常见单质反应生成甲醇和水,则该单质是含有氢元素的单质,故是氢气,故填:H2;
(2)转化②是甲醇发生分解反应生成二甲醚和水,该反应的化学方程式为:
2CH4O=C2H6O+H2O
故二甲醚和水的分子个数比为1:1
故填:1:1.
9.解:(1)操作①的名称是过滤,通过过滤把液体和固体分离。
故填:过滤。
(2)溶液A中的溶质除H2SO4外,还存在硫酸铁和硫酸亚铁,是因为加入的是过量的稀硫酸,即完全反应后硫酸有剩余,稀硫酸和氧化铁反应生成硫酸铁和水,和氧化亚铁反应生成硫酸亚铁和水,因此溶液中还含有硫酸铁和硫酸亚铁。
故填:硫酸铁、硫酸亚铁。
(3)上述流程中生成固体c是碳酸亚铁,是因为硫酸亚铁和碳酸钠反应生成碳酸亚铁沉淀和硫酸钠,反应的化学方程式:FeSO4+Na2CO3=Na2SO4+FeCO3↓。
故填:FeSO4+Na2CO3=Na2SO4+FeCO3↓。
10.解:白色固体溶于水,得到白色沉淀和无色溶液A,白色沉淀与硝酸反应会生成无色气体和无色溶液B,说明白色沉淀为碳酸盐沉淀,一定不含硫酸钡沉淀,根据提供的物质、氯化钡与碳酸钠溶液反应生成碳酸钡白色沉淀,则白色固体中一定含有碳酸钠和氯化钡,一定不含硫酸钠;无色溶液A测得pH=7,说明显中性,一定不存在氢氧化钠。且碳酸钠在反应中不能过量。
(1)氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,所以无色溶液A中一定含有的溶质是氯化钠;
(2)通过前边的分析可知白色粉末的成分是氯化钡和碳酸钠(或BaCl2、Na2CO3)。
故答案为:(1)氯化钠(或NaCl);
(2)氯化钡和碳酸钠(或BaCl2、Na2CO3)。
11.解:(1)矿石中的金属氧化物与稀盐酸反应的化学方程式为:MgO+2HCl═MgCl2+H2O、CuO+2HCl═CuCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O,溶液A pH<1,呈酸性,说明含有H+,所以溶液A中含有的阳离子是H+、Mg2+、Fe3+和Cu2+。
(2)由表中数据可知,为保证产品纯度、减少产品损失,并便于操作,应控制氢氧化铁和氢氧化铜完全沉淀,而氢氧化镁未开始沉淀,所以所得溶液B的pH的取值范围为 6.7~8.6。
故答为:(1)H+、Mg2+、Fe3+、Cu2+;(2)6.7~8.6。
12.解:由所给药品的性质和装置的特点可知,该实验中利用铁片和盐酸反应制得氯化亚铁,再使氯化亚铁与氢氧化钠溶液反应制得氢氧化亚铁,因此分液漏斗中加入稀盐酸,容器2中加入铁片,容器3中加入氢氧化钠溶液,利用铁与稀盐酸反应生成的氢气可将容器2中的氯化亚铁溶液压入容器3中与氢氧化钠溶液反应,因此制得的氢氧化亚铁在容器3中,所以:
(1)检查气密性。关闭阀门A和B,让1中液体进入到容器2中。虚线框所在装置是铁与稀盐酸反应制取氯化亚铁的,发生的反应的化学方程式是:Fe+2HCl═FeCl2+H2↑。
(2)容器2中充满氢气后,打开阀门A,关闭阀门B,应出现的现象是容器2中液体被压入容器3,容器3中出现白色沉淀。
(3)由上述分析可知,实验完毕,关闭阀门A和B,制得的Fe(OH)2在容器3中。
(4)由于水中溶有少量的氧气,空气中含有氧气,所以本实验中所有配制溶液的水需煮沸,容器2、3均密闭,其主要原因是防止Fe(OH)2被氧化。
故答为:(1)Fe+2HCl═FeCl2+H2↑;(2)容器2中液体被压入容器3,容器3中出现白色沉淀;(3)3;(4)防止Fe(OH)2被氧化。
13.解:(1)一氧化碳可以还原氧化铜为铜,氧化铜为黑色粉末,铜为红色,所以可以看到固体粉末由黑色变为红色;
故答案为:黑色粉末变成红色。
(2)反应前后氧化铜变为铜,减少的为氧元素的质量,所以此时m1﹣m2表示氧化铜中氧元素质量;
故答案为:氧化铜中氧元素。
(3)一氧化碳具有可燃性,可以燃烧变为二氧化碳,因此可以进行点燃处理;
故答案为:将尾气点燃。
14.(1)红棕色粉末变黑,澄清石灰水变浑浊
(2)再关闭b停止通一氧化碳
(3)铁和四氧化三铁
【解析】(1)氧化铁为黑色固体,铜单质为红色固体;二氧化碳和石灰水中的氢氧化钙反应,生成碳酸钙白色沉淀,据此描述现象。
(2)加热的情况下铁易被氧化,所以应避免装置温度高时铁被氧化,所以应先打开a通入氮气,再关闭b停止通一氧化碳,最后熄灭酒精灯,这样可保证不反应的一氧化碳得到充分的燃烧,不会污染空气,最后继续通入氮气直到冷却;
(3)黑色粉末全部被吸引,说明粉末可能是铁单质,也可能是四氧化三铁。铁单质能够和硫酸铜反应生成红色的铜单质,而四氧化三铁则不与其反应,据此分析判断。
【解答】(1)在加热的条件下,一氧化碳将红棕色的氧化铁还原为黑色的铁粉,生成的二氧化碳能使澄清的石灰水变浑浊;
(2)实验结束时,应先打开a通入氮气,再关闭b停止通一氧化碳,继续通氮气直至装置冷却。
(3)[综合探讨] 把生成的黑色粉末倒在白纸上后;用磁铁靠近黑色粉末,黑色粉末全部被吸引;再取少量黑色粉末放入足量硫酸铜溶液中,搅拌后发现黑色粉末部分变红,说明该粉末中含有铁和四氧化三铁。
15.(1)水蒸气和二氧化碳
(2)NaOH 溶液
(3)氢气和一氧化碳
【解析】本题以实验探究的形式考查常见气体氢气、一氧化碳、二氧化碳和水蒸气的性质,同学们要具有综合的化学知识才能做好此题。(1)根据无水硫酸铜遇水变蓝和澄清石灰水遇二氧化碳变浑浊,判断混合气体中的气体;并根据记忆写出石灰水与二氧化碳的反应式;(2)CD装置应是除去(1)中所验证的气体;(3)根据E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,判断混合气体中其余气体;
【解答】(1)由无水硫酸铜遇水变蓝和澄清石灰水遇二氧化碳变浑浊的特点可知,混合气体中有水蒸气和二氧化碳;
(2)C装置中应是氢氧化钠溶液,目的是吸收混合气体中的二氧化碳;
(3)E中氧化铜变红,说明有一氧化碳气体或氢气或二者的混合气体;F中无水硫酸铜变蓝,说明有氢气,因为氢气还原氧化铜可生成水;G中澄清石灰水变浑浊,说明有一氧化碳气体,因为一氧化碳还原氧化铜可生成二氧化碳;
16.(1)检验氢气中混有的水是否被浓硫酸吸收完
(2)10.5;70%
(3)解:生成的水的量为: 163.9g-161.2g=2.7g
CuO+H2 Cu+ H2O
80 18
x 2.7g
x=12g,
则氧化铜的纯度为: ×100%=80%
(4)B
【解析】(1)无水硫酸铜遇到水会由白色变成蓝色,因此根据它的颜色是否改变,可以确定氢气中的水是否被完全除去;
(2)将装置丙中反应前后的总质量相减得到氧元素的质量,再根据计算出氧化铜的质量,最后根据计算出样品的纯度。
(3)将装置丁反应前后的总质量相减得到生成水的质量,然后写出氧化铜和氢气反应的方程式,计算出参加反应的氧化铜的质量,最后计算出氧化铜的纯度即可。
(4)将两个同学计算的结果进行比较,然后与各个选项中的成因进行对照即可。
【解答】(1)该实验中,装置乙的作用是:检验氢气中混有的水是否被浓硫酸吸收完;
(2)氧化铜中氧元素的质量:48.8g-46.7g=2.1g;
氧化铜的质量:;
氧化铜样品的纯度为:。
(3)生成的水的量为: 163.9g-161.2g=2.7g
80 18
x 2.7g
解得:x=12g,
则氧化铜的纯度为: ×100%=80%。
(4)将二者比较可知,小明计算出的结果偏大。
A.装置的气密性不好,那么生成的水蒸气会溢出,从而使丁装置的质量偏小,那么计算结果偏小,故A不合题意;
B.空气中的水分被丁处浓硫酸吸收,会使丁装置的质量偏大,那么计算结果偏大,故B符合题意;
C.通入的氢气量不足,那么参加的氧化铜偏少,生成水的质量偏少,计算结果偏小,故C不合题意;
D.空气中的二氧化碳不能被浓硫酸吸收,故D不合题意。
故选B。
(
1
)
同课章节目录
