课题2 金属的化学性质(第1课时)32张ppt
文档属性
| 名称 | 课题2 金属的化学性质(第1课时)32张ppt |
|
|
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-05-06 00:00:00 | ||
图片预览










文档简介
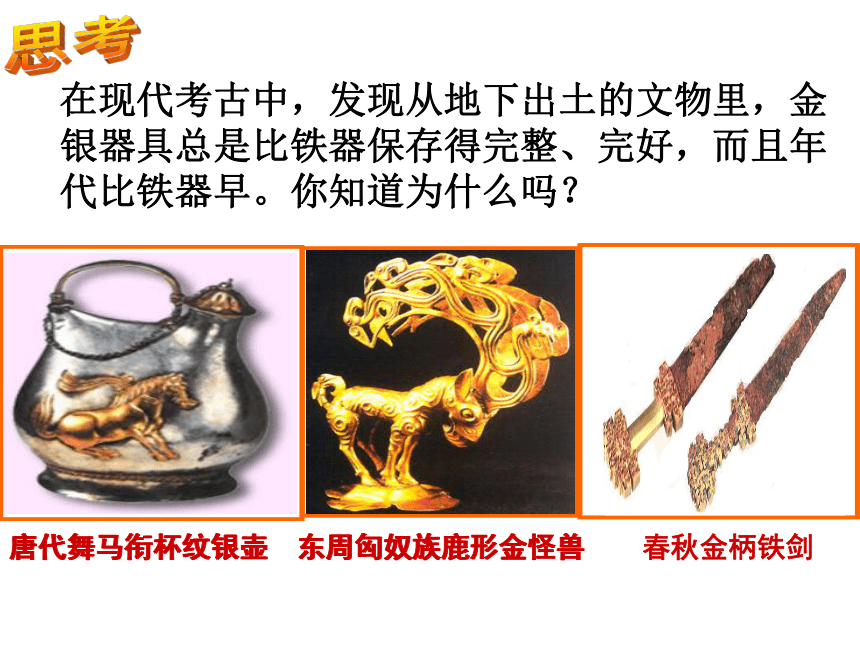
课件32张PPT。在现代考古中,发现从地下出土的文物里,金银器具总是比铁器保存得完整、完好,而且年代比铁器早。你知道为什么吗? 东周匈奴族鹿形金怪兽唐代舞马衔杯纹银壶思考请阅读P9第一自然段并结合如下图片思考:为什么铝具有这么好的抗腐蚀性能呢?阅读课题2 金属的化学性质 第八单元 金属和金属材料(第1课时)一、金属的化学性质
1、金属与氧气的反应 回顾与讨论:
请同学们回忆在学过的知识中,我们已经研究了哪几种金属和氧气的反应?你还能回忆起这些反应的现象并写出化学方程式吗?铁丝在空气中红热,在氧气中剧烈燃烧,火星四射,放出大量的热,生成黑色固体----四氧化三铁知识回顾 点燃
3Fe+2O2=Fe3O4
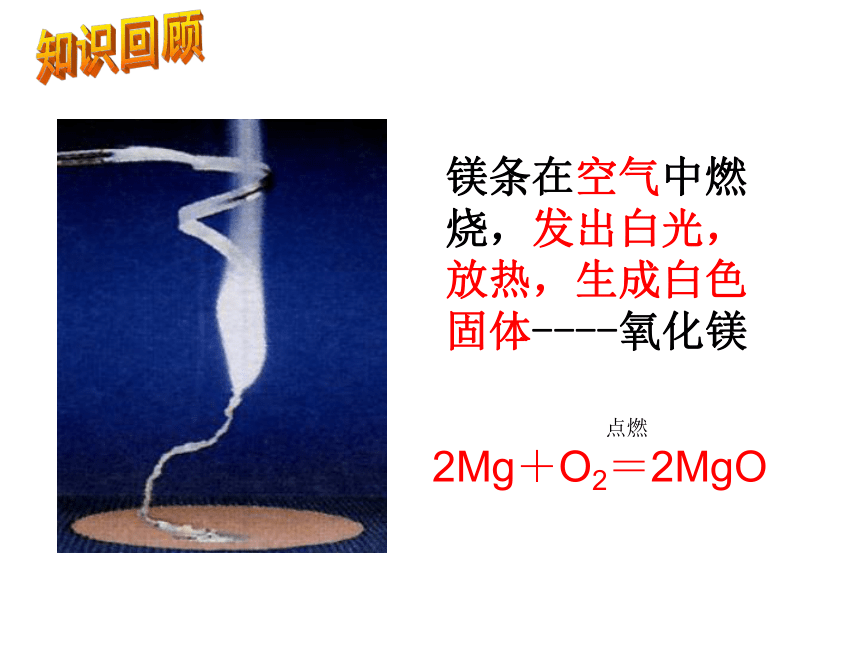
镁条在空气中燃烧,发出白光,放热,生成白色固体----氧化镁知识回顾 点燃
2Mg+O2=2MgO
用坩埚钳夹持铜片在酒精灯上加热。仔细观察金属表面的变化。
现象:
化学方程式:固体由紫红色变成黑色。补充实验(记在书上P9)(1)铝的化学性质很活泼,在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?为什么却很耐腐蚀?铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3
铝制品表面形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。(2)为何不宜用钢刷来擦洗铝制餐具呢?若用钢刷擦洗铝制品,容易破坏氧化铝薄膜,从而起不到保护作用。金在高温下也不能和氧气反应
(3)真金不怕火炼?(划书上P9)阅读与思考这也是判断金属活动性的方法之一。实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。镁、铝在常温下就能与氧气反应。(比较活泼)
铁、铜在常温下几乎不与氧气反应,但在高温时能与氧气反应。 (较不活泼)
金即使在高温时不能与氧气反应。(最不活泼)
活动性:镁、铝 > 铁、铜 > 金(划书上P9)(划书上P9)一种可燃性气体的发现
16世纪中叶,瑞士化学家帕拉塞斯和17世纪英国化学家卡文迪许以及其他一些化学家,都发现有些金属与酸反应可以生成一种可燃性气体,并且发现不同金属反应的剧烈程度不一样。
请你猜想这种气体是什么?(Henry Cavendish,
1731~1810年)科学家的故事很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸和稀硫酸能否反应以及反应的剧烈程度,亦可反映出金属的活泼程度,即活动性。下面我们就来研究金属与酸的反应.....一、金属的化学性质
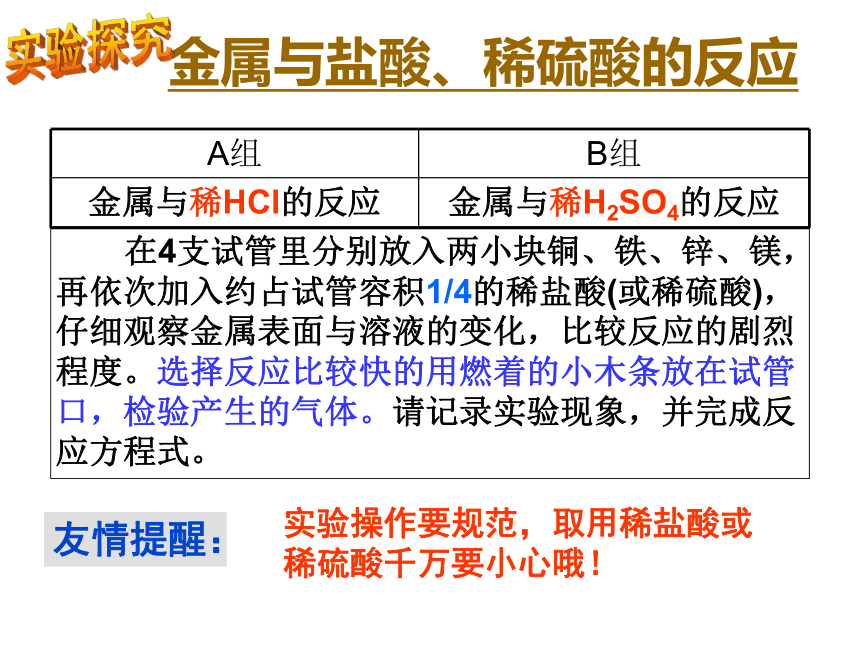
2、金属与酸的反应 在4支试管里分别放入两小块铜、铁、锌、镁,再依次加入约占试管容积1/4的稀盐酸(或稀硫酸),仔细观察金属表面与溶液的变化,比较反应的剧烈程度。选择反应比较快的用燃着的小木条放在试管口,检验产生的气体。请记录实验现象,并完成反应方程式。金属与盐酸、稀硫酸的反应友情提醒:实验操作要规范,取用稀盐酸或稀硫酸千万要小心哦!实验探究A:金属与稀盐酸的反应+2课本笔记溶液呈浅绿色,这是Fe2+的颜色(记在书上P10)B:金属与稀硫酸的反应+2课本笔记(记在书上P10)1.哪些金属能与稀盐酸、稀硫酸发生反应?反应的剧烈程度如何?反应后生成了什么气体?哪些金属不能与稀盐酸、稀硫酸发生反应?根据反应时是否有氢气产生,将金属分为两类。
另外,由图8-12的漫画你可以得到什么启示?交流与讨论⑴铁、镁、锌能和稀盐酸或稀硫酸反应,反应后生成了氢气,铜不能和稀盐酸或稀硫酸反应 ⑵铁、镁、锌和稀盐酸或稀硫酸反应时剧烈程度不同。 _____反应最剧烈,其次是_____ ,然后是 _____ 镁锌铁⑶根据反应时是否有氢气产生,将金属分为活泼金属和不活泼金属.交流与讨论分析与结论(记在书上P10)MgZnFeCu小黑点表示产生的气泡 由此推出 ,金属活动性顺序:
___________________________ Mg > Zn > Fe > Cu结论:分析与结论(记在书上P10) 2.对于能发生的反应,从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?将这一类反应与化合反应、分解反应进行比较。交流与讨论Mg + 2HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4 == FeSO4 + H2 ↑
镁、锌、铁与盐酸、稀硫酸反应的化学方程式比较特点:单质 + 化合物==另一化合物 + 另一单质 置 换 反 应交流与讨论分析与结论二、置换反应:
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
交流与讨论分析与结论特点:单质 + 化合物==另一化合物 + 另一单质 置换反应:A + BC → AC + B 记法:单换单(划在书上P11)(记在书上P11)(1)化合反应:A + B + … → AB…(多合一)
(2)分解反应:AB →A + B + … (一分多)
(3)置换反应:A + BC → AC + B (单换单)
已学过的化学反应的基本类型:回顾与小结(记在书上P11)C思路:从反应物和生成物的物质类别和数量的角度分析置换反应。1、反应前后均为两种物质
2、反应前后均为一种单质和一种化合物例题2.很多金属都能与盐酸或稀硫酸发生 ,但反应的剧烈程度 。3.根据金属与氧气、盐酸或稀硫酸能否反应以及反应的剧烈程度,可以判断金属的活泼程度(即金属活动性)。如:Mg、Zn、Fe的金属活动性依次增强,且都比Cu强,能置换出盐酸或稀硫酸中的氢。置换反应不相同本节回顾1.大多数金属都能与氧气反应,但反应的难易和剧烈程度不同2、据福建《三明日报》报道:2006年5月12日,宁化县公安局抓获一流窜江西、福建等地实施诈骗的团伙。自2006年4月底以来,他们随身携带一枚真黄金戒指,若干枚用黄铜(铜锌合金)制作的,与黄金外观极为相似的假黄金戒指在全国各地分头行骗。诈骗三十余起,骗取金额2万余元。
请你识别真假黄金戒指。要求:不少于三种方法。解:1.灼烧法 2.加酸法 3. 测密度 4.比较硬度…例题3、相同质量的Mg、Zn、Fe和足量的稀盐酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。 (相对原子质量:Mg 24 Fe 56 Zn 65)MgFeZn例题Mg + 2 HCl = MgCl2 + H2↑
24 2
M x =2M/24
Zn + 2HCl = ZnCl2 + H2 ↑
65 2
M x =2M/65
Fe + 2HCl = FeCl2 + H2 ↑
56 2
M x =2M/56 分析所以相同质量的Mg、Zn、Fe和足量的稀盐酸反应,产生氢气的总质量由大到小依次为Mg、 Fe、Zn。且斜线的斜率越大,反应速度越快,金属越活泼,依次为Mg、Zn、Fe,也符合三种金属的活动性顺序。分析规律:
1、金属越活泼则反应速度越快。
2、金属相同质量时,相对原子质量越小则产生的氢气越多。即m(H2)与Ar(金属)成反比。(记在书上P11)1、下列物质不能由金属和酸反应直接生成的是 ( )
A、 ZnCl2 B、 CuSO4
C 、FeCl3 D 、Al2(SO4)3B C练习2、相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。
下列叙述正确的是 ( )
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等 C练习1、很多金属能与盐酸、稀硫酸等发生反应, 但反应的难易和剧烈程度不同,把金属分为活泼金属和不活泼金属2、置换反应本节小结(记在书上P11)课本P13练习与应用1、3、4、8作业布置与疑难解答谢谢大家!再见!祝同学们满载而归
请同学们回忆在学过的知识中,我们已经研究了哪几种金属和氧气的反应?你还能回忆起这些反应的现象并写出化学方程式吗?铁丝在空气中红热,在氧气中剧烈燃烧,火星四射,放出大量的热,生成黑色固体----四氧化三铁知识回顾 点燃
3Fe+2O2=Fe3O4
镁条在空气中燃烧,发出白光,放热,生成白色固体----氧化镁知识回顾 点燃
2Mg+O2=2MgO
用坩埚钳夹持铜片在酒精灯上加热。仔细观察金属表面的变化。
现象:
化学方程式:固体由紫红色变成黑色。补充实验(记在书上P9)(1)铝的化学性质很活泼,在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?为什么却很耐腐蚀?铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3
铝制品表面形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。(2)为何不宜用钢刷来擦洗铝制餐具呢?若用钢刷擦洗铝制品,容易破坏氧化铝薄膜,从而起不到保护作用。金在高温下也不能和氧气反应
(3)真金不怕火炼?(划书上P9)阅读与思考这也是判断金属活动性的方法之一。实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。镁、铝在常温下就能与氧气反应。(比较活泼)
铁、铜在常温下几乎不与氧气反应,但在高温时能与氧气反应。 (较不活泼)
金即使在高温时不能与氧气反应。(最不活泼)
活动性:镁、铝 > 铁、铜 > 金(划书上P9)(划书上P9)一种可燃性气体的发现
16世纪中叶,瑞士化学家帕拉塞斯和17世纪英国化学家卡文迪许以及其他一些化学家,都发现有些金属与酸反应可以生成一种可燃性气体,并且发现不同金属反应的剧烈程度不一样。
请你猜想这种气体是什么?(Henry Cavendish,
1731~1810年)科学家的故事很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸和稀硫酸能否反应以及反应的剧烈程度,亦可反映出金属的活泼程度,即活动性。下面我们就来研究金属与酸的反应.....一、金属的化学性质
2、金属与酸的反应 在4支试管里分别放入两小块铜、铁、锌、镁,再依次加入约占试管容积1/4的稀盐酸(或稀硫酸),仔细观察金属表面与溶液的变化,比较反应的剧烈程度。选择反应比较快的用燃着的小木条放在试管口,检验产生的气体。请记录实验现象,并完成反应方程式。金属与盐酸、稀硫酸的反应友情提醒:实验操作要规范,取用稀盐酸或稀硫酸千万要小心哦!实验探究A:金属与稀盐酸的反应+2课本笔记溶液呈浅绿色,这是Fe2+的颜色(记在书上P10)B:金属与稀硫酸的反应+2课本笔记(记在书上P10)1.哪些金属能与稀盐酸、稀硫酸发生反应?反应的剧烈程度如何?反应后生成了什么气体?哪些金属不能与稀盐酸、稀硫酸发生反应?根据反应时是否有氢气产生,将金属分为两类。
另外,由图8-12的漫画你可以得到什么启示?交流与讨论⑴铁、镁、锌能和稀盐酸或稀硫酸反应,反应后生成了氢气,铜不能和稀盐酸或稀硫酸反应 ⑵铁、镁、锌和稀盐酸或稀硫酸反应时剧烈程度不同。 _____反应最剧烈,其次是_____ ,然后是 _____ 镁锌铁⑶根据反应时是否有氢气产生,将金属分为活泼金属和不活泼金属.交流与讨论分析与结论(记在书上P10)MgZnFeCu小黑点表示产生的气泡 由此推出 ,金属活动性顺序:
___________________________ Mg > Zn > Fe > Cu结论:分析与结论(记在书上P10) 2.对于能发生的反应,从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?将这一类反应与化合反应、分解反应进行比较。交流与讨论Mg + 2HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4 == FeSO4 + H2 ↑
镁、锌、铁与盐酸、稀硫酸反应的化学方程式比较特点:单质 + 化合物==另一化合物 + 另一单质 置 换 反 应交流与讨论分析与结论二、置换反应:
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
交流与讨论分析与结论特点:单质 + 化合物==另一化合物 + 另一单质 置换反应:A + BC → AC + B 记法:单换单(划在书上P11)(记在书上P11)(1)化合反应:A + B + … → AB…(多合一)
(2)分解反应:AB →A + B + … (一分多)
(3)置换反应:A + BC → AC + B (单换单)
已学过的化学反应的基本类型:回顾与小结(记在书上P11)C思路:从反应物和生成物的物质类别和数量的角度分析置换反应。1、反应前后均为两种物质
2、反应前后均为一种单质和一种化合物例题2.很多金属都能与盐酸或稀硫酸发生 ,但反应的剧烈程度 。3.根据金属与氧气、盐酸或稀硫酸能否反应以及反应的剧烈程度,可以判断金属的活泼程度(即金属活动性)。如:Mg、Zn、Fe的金属活动性依次增强,且都比Cu强,能置换出盐酸或稀硫酸中的氢。置换反应不相同本节回顾1.大多数金属都能与氧气反应,但反应的难易和剧烈程度不同2、据福建《三明日报》报道:2006年5月12日,宁化县公安局抓获一流窜江西、福建等地实施诈骗的团伙。自2006年4月底以来,他们随身携带一枚真黄金戒指,若干枚用黄铜(铜锌合金)制作的,与黄金外观极为相似的假黄金戒指在全国各地分头行骗。诈骗三十余起,骗取金额2万余元。
请你识别真假黄金戒指。要求:不少于三种方法。解:1.灼烧法 2.加酸法 3. 测密度 4.比较硬度…例题3、相同质量的Mg、Zn、Fe和足量的稀盐酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。 (相对原子质量:Mg 24 Fe 56 Zn 65)MgFeZn例题Mg + 2 HCl = MgCl2 + H2↑
24 2
M x =2M/24
Zn + 2HCl = ZnCl2 + H2 ↑
65 2
M x =2M/65
Fe + 2HCl = FeCl2 + H2 ↑
56 2
M x =2M/56 分析所以相同质量的Mg、Zn、Fe和足量的稀盐酸反应,产生氢气的总质量由大到小依次为Mg、 Fe、Zn。且斜线的斜率越大,反应速度越快,金属越活泼,依次为Mg、Zn、Fe,也符合三种金属的活动性顺序。分析规律:
1、金属越活泼则反应速度越快。
2、金属相同质量时,相对原子质量越小则产生的氢气越多。即m(H2)与Ar(金属)成反比。(记在书上P11)1、下列物质不能由金属和酸反应直接生成的是 ( )
A、 ZnCl2 B、 CuSO4
C 、FeCl3 D 、Al2(SO4)3B C练习2、相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。
下列叙述正确的是 ( )
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等 C练习1、很多金属能与盐酸、稀硫酸等发生反应, 但反应的难易和剧烈程度不同,把金属分为活泼金属和不活泼金属2、置换反应本节小结(记在书上P11)课本P13练习与应用1、3、4、8作业布置与疑难解答谢谢大家!再见!祝同学们满载而归
同课章节目录
