2022-2023学年高一化学人教版2019必修第二册第六章第一节化学反应与电能(原电池的应用和化学电源)练习题(含解析)
文档属性
| 名称 | 2022-2023学年高一化学人教版2019必修第二册第六章第一节化学反应与电能(原电池的应用和化学电源)练习题(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-29 18:04:02 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2022-2023学年高一化学人教版2019必修第二册第六章
第一节化学反应与电能(原电池的应用和化学电源)练习题
学校:___________姓名:___________班级:___________
一、单选题
1.下列说法正确的是 ( )
A.化学电源均无害
B.化学电源即为可充电电池
C.太阳能电池不是化学电池
D.化学电池所提供的电能居于人类社会现阶段总耗电量的首位
2.《天工开物》中记载:“凡铸钱每十斤,红铜(纯铜)居六七,倭铅(锌)居三四,倭铅每见烈火必耗四分之一……盖铅质先走,其铜色渐高。”可见铜钱材质实乃黄铜。下列说法错误的是( )
A.黄铜是一种铜锌合金材料,其熔点比纯铜低
B.黄铜与黄金外观相似,制作的钱币均具有耐火性
C.从铸钱过程可以看出,锌的沸点低于铜
D.铜钱不易产生铜绿,由于倭铅保护了铜
3.某原电池装置如图所示。下列有关叙述中正确的是( )
A.Fe作正极,发生氧化反应
B.负极反应式:2H++2e-=H2↑
C.电池工作时,盐桥中的Cl-向负极移动
D.工作一段时间后,两烧杯中溶液pH均不变
4.下列关于下图所示原电池装置的说法中,不正确的是
A.Cu为原电池的正极
B.能将化学能转化为电能
C.电子从Cu经导线流向Zn
D.Cu上发生的反应为2H++2e-=H2↑
5.如图所示装置,电流计G指针发生偏转,同时A电极逐渐变粗,B电极逐渐变细,C为电解质溶液,则下列表述中正确的是( )
A.A是,B是,C为稀,电流方向为
B.A是,B是,C为溶液,电子流向为
C.A是,B是,C为溶液,电子流向为
D.A是,B是,C为溶液,电流方向为
6.如图是某同学设计的原电池装置,下列叙述中正确的是( )
A.电极I上发生还原反应,作原电池的负极
B.电极II的电极反应式为Cu2++2e-=Cu
C.该原电池的总反应为2Fe3++Cu=Cu2++2Fe2+
D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
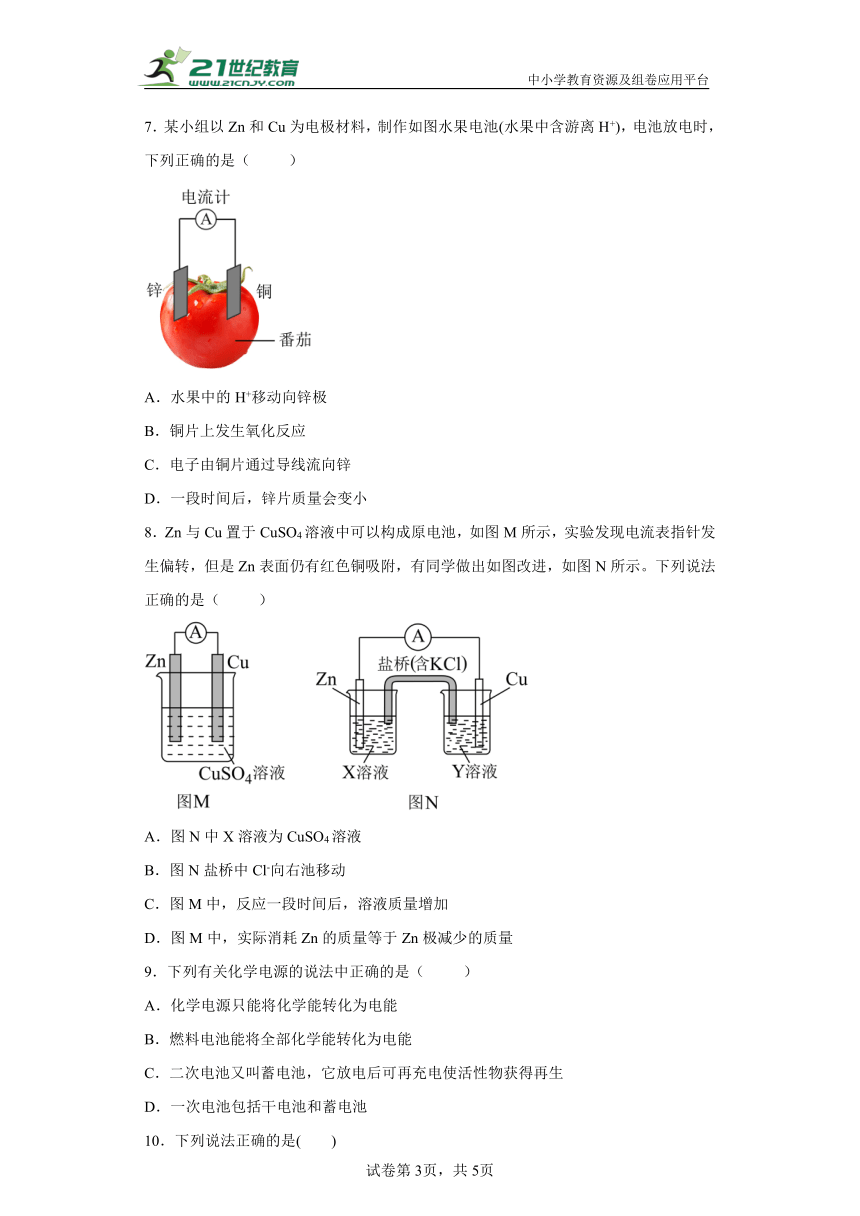
7.某小组以Zn和Cu为电极材料,制作如图水果电池(水果中含游离H+),电池放电时,下列正确的是( )
A.水果中的H+移动向锌极
B.铜片上发生氧化反应
C.电子由铜片通过导线流向锌
D.一段时间后,锌片质量会变小
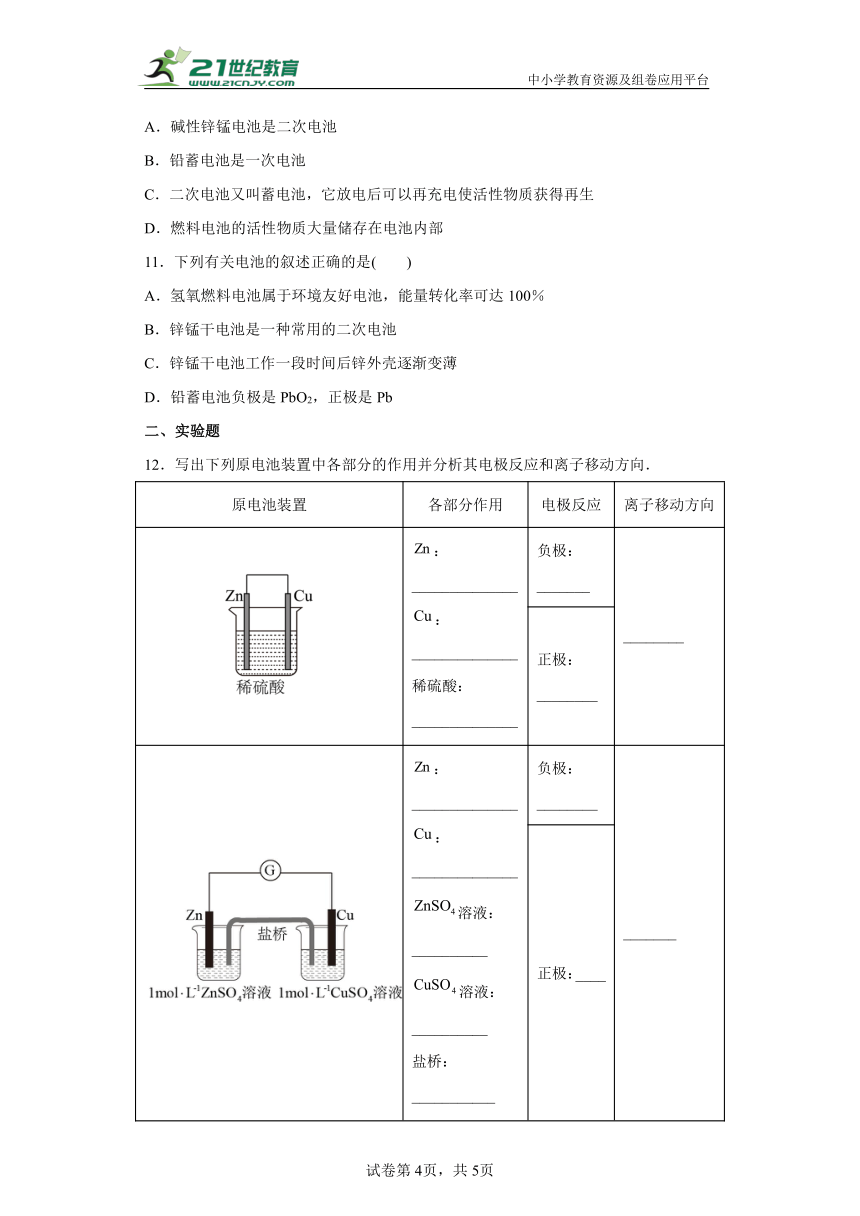
8.Zn与Cu置于CuSO4溶液中可以构成原电池,如图M所示,实验发现电流表指针发生偏转,但是Zn表面仍有红色铜吸附,有同学做出如图改进,如图N所示。下列说法正确的是( )
A.图N中X溶液为CuSO4溶液
B.图N盐桥中Cl-向右池移动
C.图M中,反应一段时间后,溶液质量增加
D.图M中,实际消耗Zn的质量等于Zn极减少的质量
9.下列有关化学电源的说法中正确的是( )
A.化学电源只能将化学能转化为电能
B.燃料电池能将全部化学能转化为电能
C.二次电池又叫蓄电池,它放电后可再充电使活性物获得再生
D.一次电池包括干电池和蓄电池
10.下列说法正确的是( )
A.碱性锌锰电池是二次电池
B.铅蓄电池是一次电池
C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D.燃料电池的活性物质大量储存在电池内部
11.下列有关电池的叙述正确的是( )
A.氢氧燃料电池属于环境友好电池,能量转化率可达100%
B.锌锰干电池是一种常用的二次电池
C.锌锰干电池工作一段时间后锌外壳逐渐变薄
D.铅蓄电池负极是PbO2,正极是Pb
二、实验题
12.写出下列原电池装置中各部分的作用并分析其电极反应和离子移动方向.
原电池装置 各部分作用 电极反应 离子移动方向
:______________:______________稀硫酸:______________ 负极:_______ ________
正极:________
:______________:______________溶液:__________溶液:__________盐桥:___________ 负极:________ _______
正极:____
石墨:_________:______________:______________溶液:___________ 负极:________ ________
正极:_______
三、填空题
13.Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是_________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)此废旧电池的处理方法是回收,目的是为了____________________。
(4)该电池的负极反应式为_________________________________。
14.利用反应Zn+CuSO4=Cu+ZnSO4,设计一个原电池。
(1)选用_______为负极材料,_______为正极材料,电解质溶液为_______。
(2)写出电极反应式:负极_______,正极_______。
(3)试画出上述装置图_______。
参考答案
1.C
【详解】A.部分化学电源含有重金属离子,危害环境和人体健康,A错误;
B.化学电源分为一次电源和二次电源,只有二次电源才是可充电电池,B错误;
C.太阳能电池没有发生化学变化,不是化学电池,C正确;
D.火力发电居于人类社会现阶段总耗电量的首位,不是化学电池,D错误;
答案选C。
2.B
【详解】A.黄铜是一种铜锌合金材料,合金的熔点比各成分熔点低,故黄铜熔点比纯铜低,故A正确;
B.黄铜与黄金外观相似,“倭铅每见烈火必耗四分之一……盖铅质先走”, 制作的钱币不具有耐火性,锌会消耗,故B错误;
C.从铸钱过程可以看出,“倭铅每见烈火必耗四分之一……盖铅质先走”,说明锌的沸点低于铜,故C正确;
D.铜钱不易产生铜绿,由于倭铅比铜活泼,形成原电池,锌做负极,铜做正极,保护了铜,故D正确;
故答案为:B
3.C
【详解】A.铁为负极,发生氧化反应,故A错误;
B.正极发生还原反应, H+得电子被还原生成,电极反应时为2H+ +2e-=H2↑,负极反应为Fe-2e-=Fe2+,故B错误;
C.原电池工作时,铁为负极,阴离子向负极移动Cl-向负极移动,故C正确;
D.工作一段时间后,左边烧杯中生成Fe2+,水解呈酸性,右烧杯发生2H++2e-=H2↑,氢离子浓度减小,则pH增大两烧杯溶液pH都发生变化,故D错误;
故选C。
4.C
【分析】图示原电池装置中,Zn比Cu活泼,Zn作负极,Zn失去电子,发生的电极反应为,Cu作正极本身不反应,硫酸作电解质,溶液中氢离子在正极得电子,发生的电极反应为,
【详解】A.根据上述分析,Cu为原电池的正极,A正确;
B.该装置为原电池,能将化学能转化为电能,B正确;
C.Zn失去电子,经导线流向Cu,氢离子在铜电极得电子产生氢气,C错误;
D.Cu作正极,发生的电极反应为,D正确;
答案选C。
5.D
【详解】根据电极现象可以判断,A电极为正极,B电极为负极,电解质溶液应为相对不活泼金属的盐溶液,这样才能使相对不活泼的金属的离子在正极上得到电子,生成的金属单质附着在A电极上使A电极变粗。电流方向为A→G→B,电子流向为B→G→A,D项,A极析出银,逐渐变粗,B极铁溶解,逐渐变细,故选D项。
6.C
【分析】由电池装置图可知,该电池为原电池,左侧电极I为正极,三价铁离子得到电子变成二价铁,右侧电极II为负极,铜失去电子变成二价铜离子,据此解答。
【详解】A.由分析可知,电极 I为正极,发生还原反应,故A错误;
B.由分析可知,电极 II为负极,电极反应式为Cu-2e-=Cu2+,故B错误;
C.根据该电池的正负极反应可知,该原电池的总反应为2Fe3++Cu=Cu2++2Fe2+,故C正确;
D.盐桥中装有含氯化钾的琼脂,作用是传递离子而不是电子,故D错误;
故答案选C。
7.D
【详解】A.原电池中阳离子移向正极,故A错误;
B.铜片作正极,发生还原反应,故B错误;
C.Zn为负极,电子从负极流向正极,故电子由锌片通过导线流向铜,故C错误;
D.锌电极是该电池的负极,负极逐渐溶解,锌质量减小,故D正确;
答案为D;
8.C
【详解】A.为避免Zn直接与硫酸铜溶液反应造成损耗,X溶液一定不是硫酸铜溶液,可以是硫酸锌溶液,A项错误;
B.总反应为Zn+Cu2+=Zn2++Cu,所以Zn电极为负极,Cu电极为正极,在盐桥中阴离子移向负极,故图N盐桥中Cl-向左池移动,B项错误;
C.图M中总反应为Zn+Cu2+=Zn2++Cu,Zn的相对原子质量大于Cu,所以反应一段时间后,溶液质量增加,C项正确;
D.图M中不仅发生电化学反应,Zn电极还直接与CuSO4发生化学反应,生成的铜会附着在Zn棒上,所以实际消耗Zn的质量大于Zn极减少的质量,D项错误;
综上所述答案为C。
9.C
【详解】
A.化学电源在工作时也会有少量热量产生,所以化学能会有一部分转化为热能,一部分转化为电能,故A错误;
B.燃料电池在工作时,化学能部分转化为电能,部分转化为热能,故B错误;
C.二次电池又叫蓄电池,放电后可以再充电使活性物质获得再生,以达到重复使用的目的,故C正确;
D.干电池是一次电池,蓄电池能连续放电、充电,属于二次电池,故D错误;
答案选C。
10.C
【详解】A.锌锰干电池只能放电不能充电,所以属于一次电池,故A错误;
B.铅蓄电池是二次电池,故B错误;
C.蓄电池是二次电池放电后可以充电重新使用,使活性物质获得再生,故C正确;
D.燃料在两个电极上发生氧化还原反应把化学能转化为电能,不是在电池内部燃烧,故D错误;
故答案为C。
11.C
【详解】A.燃料电池转化率不可能为100%,故A错误;
B.锌锰干电池是一种常用的一次电池,故B错误;
C.锌锰干电池工作过程中,负极反应为:Zn-2e-=Zn2+,锌外壳不断被腐蚀而逐渐变薄,故C正确;
D.铅蓄电池负极是Pb,正极是PbO2,故D错误;
答案选C。
12. 负极 正极 电解质溶液 H+向Cu极移动,向Zn极移动 负极 正极 电解质溶液 电解质溶液 形成闭合回路 Cu2+向Cu极移动,向Zn极移动 负极 负极反应物 正极反应物 电解质 OH-向H2极移动,Na+向O2极移动
【详解】(1)Zn作负极,Cu作正极,稀硫酸:电解质溶液;负极:;正极:;H+向Cu极移动,向Zn极移动。
故答案为:负极;正极;电解质溶液;;H+向Cu极移动,向Zn极移动;。
(2)Zn作负极,Cu作正极,ZnSO4/CuSO4作电解质溶液;盐桥:形成闭合回路;负极:;正极:;Cu2+向Cu极移动,向Zn极移动;
故答案为:负极;正极;电解质溶液;形成闭合回路;;Cu2+向Cu极移动,向Zn极移动;。
(3)石墨作电极,H2作负极反应物,O2作正极反应物,NaOH溶液作电解质;负极:,正极:;OH-向H2极移动,Na+向O2极移动;
故答案为:电极;负极反应物;正极反应物;电解质;;OH-向H2极移动,Na+向O2极移动; 。
13. Zn(或锌) 正极 锌与还原出的铜形成铜锌原电池而加快锌的腐蚀 B 防止电解液污染土壤和金属材料的浪费 Zn 2e Zn2+
【详解】(1)负极上是失电子的,则Zn失电子为负极,电子由负极流向正极。
(2)电化学腐蚀较化学腐蚀更快,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀.题目中a和d选项不能除去杂质离子,c项会引入新杂质,所以应选Zn将Cu2+ 置换为单质而除去。故答案为锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;B。
(3)锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害,此废旧电池的处理方法是回收,目的是为了防止电解液污染土壤和金属材料的浪费。
(4).该电池的负极材料是Zn,负极上是失电子,负极反应方程式为:Zn-2e-=Zn2+。
点睛:考查一次电池,电化学腐蚀,理解失去电子的为负极及原电池的原理,就能很好的作出解答,其中第(2)问容易答错,难度容易。
14.(1) 锌片 铜片(或碳棒) CuSO4溶液
(2) Zn-2e-=Zn2+ Cu2++2e-=Cu
(3)
【详解】(1)根据反应Zn+CuSO4=Cu+ZnSO4可知Zn是还原剂,CuSO4是氧化剂,故用锌片作负极,正极选用金属性弱于锌的金属或能导电的非金属,因此可以是铜片或碳棒为正极材料,电解质溶液为CuSO4溶液;
(2)Zn在负极发生氧化反应生成Zn2+,即Zn-2e-=Zn2+,Cu2+在正极被还原得到Cu,即Cu2++2e-=Cu;
(3)根据反应Zn+CuSO4=Cu+ZnSO4可知Zn是还原剂,CuSO4是氧化剂,故用锌片作负极,铜片或碳棒作正极,电解质溶液为CuSO4溶液,画出上述装置图为:。
试卷第1页,共3页
试卷第1页,共3页
2022-2023学年高一化学人教版2019必修第二册第六章
第一节化学反应与电能(原电池的应用和化学电源)练习题
学校:___________姓名:___________班级:___________
一、单选题
1.下列说法正确的是 ( )
A.化学电源均无害
B.化学电源即为可充电电池
C.太阳能电池不是化学电池
D.化学电池所提供的电能居于人类社会现阶段总耗电量的首位
2.《天工开物》中记载:“凡铸钱每十斤,红铜(纯铜)居六七,倭铅(锌)居三四,倭铅每见烈火必耗四分之一……盖铅质先走,其铜色渐高。”可见铜钱材质实乃黄铜。下列说法错误的是( )
A.黄铜是一种铜锌合金材料,其熔点比纯铜低
B.黄铜与黄金外观相似,制作的钱币均具有耐火性
C.从铸钱过程可以看出,锌的沸点低于铜
D.铜钱不易产生铜绿,由于倭铅保护了铜
3.某原电池装置如图所示。下列有关叙述中正确的是( )
A.Fe作正极,发生氧化反应
B.负极反应式:2H++2e-=H2↑
C.电池工作时,盐桥中的Cl-向负极移动
D.工作一段时间后,两烧杯中溶液pH均不变
4.下列关于下图所示原电池装置的说法中,不正确的是
A.Cu为原电池的正极
B.能将化学能转化为电能
C.电子从Cu经导线流向Zn
D.Cu上发生的反应为2H++2e-=H2↑
5.如图所示装置,电流计G指针发生偏转,同时A电极逐渐变粗,B电极逐渐变细,C为电解质溶液,则下列表述中正确的是( )
A.A是,B是,C为稀,电流方向为
B.A是,B是,C为溶液,电子流向为
C.A是,B是,C为溶液,电子流向为
D.A是,B是,C为溶液,电流方向为
6.如图是某同学设计的原电池装置,下列叙述中正确的是( )
A.电极I上发生还原反应,作原电池的负极
B.电极II的电极反应式为Cu2++2e-=Cu
C.该原电池的总反应为2Fe3++Cu=Cu2++2Fe2+
D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
7.某小组以Zn和Cu为电极材料,制作如图水果电池(水果中含游离H+),电池放电时,下列正确的是( )
A.水果中的H+移动向锌极
B.铜片上发生氧化反应
C.电子由铜片通过导线流向锌
D.一段时间后,锌片质量会变小
8.Zn与Cu置于CuSO4溶液中可以构成原电池,如图M所示,实验发现电流表指针发生偏转,但是Zn表面仍有红色铜吸附,有同学做出如图改进,如图N所示。下列说法正确的是( )
A.图N中X溶液为CuSO4溶液
B.图N盐桥中Cl-向右池移动
C.图M中,反应一段时间后,溶液质量增加
D.图M中,实际消耗Zn的质量等于Zn极减少的质量
9.下列有关化学电源的说法中正确的是( )
A.化学电源只能将化学能转化为电能
B.燃料电池能将全部化学能转化为电能
C.二次电池又叫蓄电池,它放电后可再充电使活性物获得再生
D.一次电池包括干电池和蓄电池
10.下列说法正确的是( )
A.碱性锌锰电池是二次电池
B.铅蓄电池是一次电池
C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D.燃料电池的活性物质大量储存在电池内部
11.下列有关电池的叙述正确的是( )
A.氢氧燃料电池属于环境友好电池,能量转化率可达100%
B.锌锰干电池是一种常用的二次电池
C.锌锰干电池工作一段时间后锌外壳逐渐变薄
D.铅蓄电池负极是PbO2,正极是Pb
二、实验题
12.写出下列原电池装置中各部分的作用并分析其电极反应和离子移动方向.
原电池装置 各部分作用 电极反应 离子移动方向
:______________:______________稀硫酸:______________ 负极:_______ ________
正极:________
:______________:______________溶液:__________溶液:__________盐桥:___________ 负极:________ _______
正极:____
石墨:_________:______________:______________溶液:___________ 负极:________ ________
正极:_______
三、填空题
13.Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是_________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)此废旧电池的处理方法是回收,目的是为了____________________。
(4)该电池的负极反应式为_________________________________。
14.利用反应Zn+CuSO4=Cu+ZnSO4,设计一个原电池。
(1)选用_______为负极材料,_______为正极材料,电解质溶液为_______。
(2)写出电极反应式:负极_______,正极_______。
(3)试画出上述装置图_______。
参考答案
1.C
【详解】A.部分化学电源含有重金属离子,危害环境和人体健康,A错误;
B.化学电源分为一次电源和二次电源,只有二次电源才是可充电电池,B错误;
C.太阳能电池没有发生化学变化,不是化学电池,C正确;
D.火力发电居于人类社会现阶段总耗电量的首位,不是化学电池,D错误;
答案选C。
2.B
【详解】A.黄铜是一种铜锌合金材料,合金的熔点比各成分熔点低,故黄铜熔点比纯铜低,故A正确;
B.黄铜与黄金外观相似,“倭铅每见烈火必耗四分之一……盖铅质先走”, 制作的钱币不具有耐火性,锌会消耗,故B错误;
C.从铸钱过程可以看出,“倭铅每见烈火必耗四分之一……盖铅质先走”,说明锌的沸点低于铜,故C正确;
D.铜钱不易产生铜绿,由于倭铅比铜活泼,形成原电池,锌做负极,铜做正极,保护了铜,故D正确;
故答案为:B
3.C
【详解】A.铁为负极,发生氧化反应,故A错误;
B.正极发生还原反应, H+得电子被还原生成,电极反应时为2H+ +2e-=H2↑,负极反应为Fe-2e-=Fe2+,故B错误;
C.原电池工作时,铁为负极,阴离子向负极移动Cl-向负极移动,故C正确;
D.工作一段时间后,左边烧杯中生成Fe2+,水解呈酸性,右烧杯发生2H++2e-=H2↑,氢离子浓度减小,则pH增大两烧杯溶液pH都发生变化,故D错误;
故选C。
4.C
【分析】图示原电池装置中,Zn比Cu活泼,Zn作负极,Zn失去电子,发生的电极反应为,Cu作正极本身不反应,硫酸作电解质,溶液中氢离子在正极得电子,发生的电极反应为,
【详解】A.根据上述分析,Cu为原电池的正极,A正确;
B.该装置为原电池,能将化学能转化为电能,B正确;
C.Zn失去电子,经导线流向Cu,氢离子在铜电极得电子产生氢气,C错误;
D.Cu作正极,发生的电极反应为,D正确;
答案选C。
5.D
【详解】根据电极现象可以判断,A电极为正极,B电极为负极,电解质溶液应为相对不活泼金属的盐溶液,这样才能使相对不活泼的金属的离子在正极上得到电子,生成的金属单质附着在A电极上使A电极变粗。电流方向为A→G→B,电子流向为B→G→A,D项,A极析出银,逐渐变粗,B极铁溶解,逐渐变细,故选D项。
6.C
【分析】由电池装置图可知,该电池为原电池,左侧电极I为正极,三价铁离子得到电子变成二价铁,右侧电极II为负极,铜失去电子变成二价铜离子,据此解答。
【详解】A.由分析可知,电极 I为正极,发生还原反应,故A错误;
B.由分析可知,电极 II为负极,电极反应式为Cu-2e-=Cu2+,故B错误;
C.根据该电池的正负极反应可知,该原电池的总反应为2Fe3++Cu=Cu2++2Fe2+,故C正确;
D.盐桥中装有含氯化钾的琼脂,作用是传递离子而不是电子,故D错误;
故答案选C。
7.D
【详解】A.原电池中阳离子移向正极,故A错误;
B.铜片作正极,发生还原反应,故B错误;
C.Zn为负极,电子从负极流向正极,故电子由锌片通过导线流向铜,故C错误;
D.锌电极是该电池的负极,负极逐渐溶解,锌质量减小,故D正确;
答案为D;
8.C
【详解】A.为避免Zn直接与硫酸铜溶液反应造成损耗,X溶液一定不是硫酸铜溶液,可以是硫酸锌溶液,A项错误;
B.总反应为Zn+Cu2+=Zn2++Cu,所以Zn电极为负极,Cu电极为正极,在盐桥中阴离子移向负极,故图N盐桥中Cl-向左池移动,B项错误;
C.图M中总反应为Zn+Cu2+=Zn2++Cu,Zn的相对原子质量大于Cu,所以反应一段时间后,溶液质量增加,C项正确;
D.图M中不仅发生电化学反应,Zn电极还直接与CuSO4发生化学反应,生成的铜会附着在Zn棒上,所以实际消耗Zn的质量大于Zn极减少的质量,D项错误;
综上所述答案为C。
9.C
【详解】
A.化学电源在工作时也会有少量热量产生,所以化学能会有一部分转化为热能,一部分转化为电能,故A错误;
B.燃料电池在工作时,化学能部分转化为电能,部分转化为热能,故B错误;
C.二次电池又叫蓄电池,放电后可以再充电使活性物质获得再生,以达到重复使用的目的,故C正确;
D.干电池是一次电池,蓄电池能连续放电、充电,属于二次电池,故D错误;
答案选C。
10.C
【详解】A.锌锰干电池只能放电不能充电,所以属于一次电池,故A错误;
B.铅蓄电池是二次电池,故B错误;
C.蓄电池是二次电池放电后可以充电重新使用,使活性物质获得再生,故C正确;
D.燃料在两个电极上发生氧化还原反应把化学能转化为电能,不是在电池内部燃烧,故D错误;
故答案为C。
11.C
【详解】A.燃料电池转化率不可能为100%,故A错误;
B.锌锰干电池是一种常用的一次电池,故B错误;
C.锌锰干电池工作过程中,负极反应为:Zn-2e-=Zn2+,锌外壳不断被腐蚀而逐渐变薄,故C正确;
D.铅蓄电池负极是Pb,正极是PbO2,故D错误;
答案选C。
12. 负极 正极 电解质溶液 H+向Cu极移动,向Zn极移动 负极 正极 电解质溶液 电解质溶液 形成闭合回路 Cu2+向Cu极移动,向Zn极移动 负极 负极反应物 正极反应物 电解质 OH-向H2极移动,Na+向O2极移动
【详解】(1)Zn作负极,Cu作正极,稀硫酸:电解质溶液;负极:;正极:;H+向Cu极移动,向Zn极移动。
故答案为:负极;正极;电解质溶液;;H+向Cu极移动,向Zn极移动;。
(2)Zn作负极,Cu作正极,ZnSO4/CuSO4作电解质溶液;盐桥:形成闭合回路;负极:;正极:;Cu2+向Cu极移动,向Zn极移动;
故答案为:负极;正极;电解质溶液;形成闭合回路;;Cu2+向Cu极移动,向Zn极移动;。
(3)石墨作电极,H2作负极反应物,O2作正极反应物,NaOH溶液作电解质;负极:,正极:;OH-向H2极移动,Na+向O2极移动;
故答案为:电极;负极反应物;正极反应物;电解质;;OH-向H2极移动,Na+向O2极移动; 。
13. Zn(或锌) 正极 锌与还原出的铜形成铜锌原电池而加快锌的腐蚀 B 防止电解液污染土壤和金属材料的浪费 Zn 2e Zn2+
【详解】(1)负极上是失电子的,则Zn失电子为负极,电子由负极流向正极。
(2)电化学腐蚀较化学腐蚀更快,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀.题目中a和d选项不能除去杂质离子,c项会引入新杂质,所以应选Zn将Cu2+ 置换为单质而除去。故答案为锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;B。
(3)锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害,此废旧电池的处理方法是回收,目的是为了防止电解液污染土壤和金属材料的浪费。
(4).该电池的负极材料是Zn,负极上是失电子,负极反应方程式为:Zn-2e-=Zn2+。
点睛:考查一次电池,电化学腐蚀,理解失去电子的为负极及原电池的原理,就能很好的作出解答,其中第(2)问容易答错,难度容易。
14.(1) 锌片 铜片(或碳棒) CuSO4溶液
(2) Zn-2e-=Zn2+ Cu2++2e-=Cu
(3)
【详解】(1)根据反应Zn+CuSO4=Cu+ZnSO4可知Zn是还原剂,CuSO4是氧化剂,故用锌片作负极,正极选用金属性弱于锌的金属或能导电的非金属,因此可以是铜片或碳棒为正极材料,电解质溶液为CuSO4溶液;
(2)Zn在负极发生氧化反应生成Zn2+,即Zn-2e-=Zn2+,Cu2+在正极被还原得到Cu,即Cu2++2e-=Cu;
(3)根据反应Zn+CuSO4=Cu+ZnSO4可知Zn是还原剂,CuSO4是氧化剂,故用锌片作负极,铜片或碳棒作正极,电解质溶液为CuSO4溶液,画出上述装置图为:。
试卷第1页,共3页
试卷第1页,共3页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
