第五章第二节氮及其化合物第三课时学案 (含答案)高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章第二节氮及其化合物第三课时学案 (含答案)高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 127.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-30 07:51:20 | ||
图片预览

文档简介
第五章 第二节 氮及其化合物
第三课时
【学习目标】
1.掌握HNO3的化学性质
2.掌握HNO3的特性、制备、用途及NO3-的检验
【目标一】硝酸的物理性质
纯硝酸是 色、易挥发、有刺激性气味的液体,密度为1.5027g/cm3,沸点83℃。以任意比与水互溶,98%以上的浓硝酸在空气由于挥发出HNO3而产生“发烟”现象,通常叫做 。
常用浓硝酸的质量分数大约为69%。浓硝酸具有强烈的腐蚀性,使用浓硝酸时要格外小心,
不慎弄到皮肤上,立即 ,再用 洗涤。
三强酸对比:
盐酸 硫酸 硝酸
挥发性 有 无 有
气味 刺激性 无 刺激性
常用浓酸 浓度 37% 98% 69%
密度( g·cm-3) 1.19 1.84 1.42
发黄原因 溶有Fe3+ 分解,溶有NO2
有无纯酸 无 有 有
【目标二】硝酸的化学性质
1.硝酸是一种 酸,具有 的通性。
① 电离:在水溶液中的电离方程式为
② 稀硝酸使紫色石蕊试液变
③ 与碱作用生成 和
HNO3与 Ba(OH)2反应的离子方程式为:
④ 与碱性氧化物作用生成 和
HNO3与CaO反应的离子方程式为:
我们知道在化学性质上,浓硫酸具有酸性、吸水性、脱水性、强氧化性等性质,那么硝酸也是一种强酸,它除了具有酸的通性外,还具有什么性质呢
2.不稳定性:纯净的硝酸或浓硝酸在常温下见光就分解,酸越浓越易分解,受热时分解更快。
4HNO3 (硝酸越浓越易分解)
【思考】
① 久置浓硝酸呈现 ,是因为其分解生成的 溶于硝酸中,
② 久置变黄的硝酸如何除去除黄色? 。
③ 硝酸保存: 。
3.强氧化性
⑴ 钝化:常温下浓硝酸可使铁、铝表面形成致密的氧化膜而钝化,保护内部金属不再与酸反应。
钝化的三要素: 、 、 。
因此可以用 或 盛放浓硝酸。加热时,铁、铝可以与浓硝酸反应。
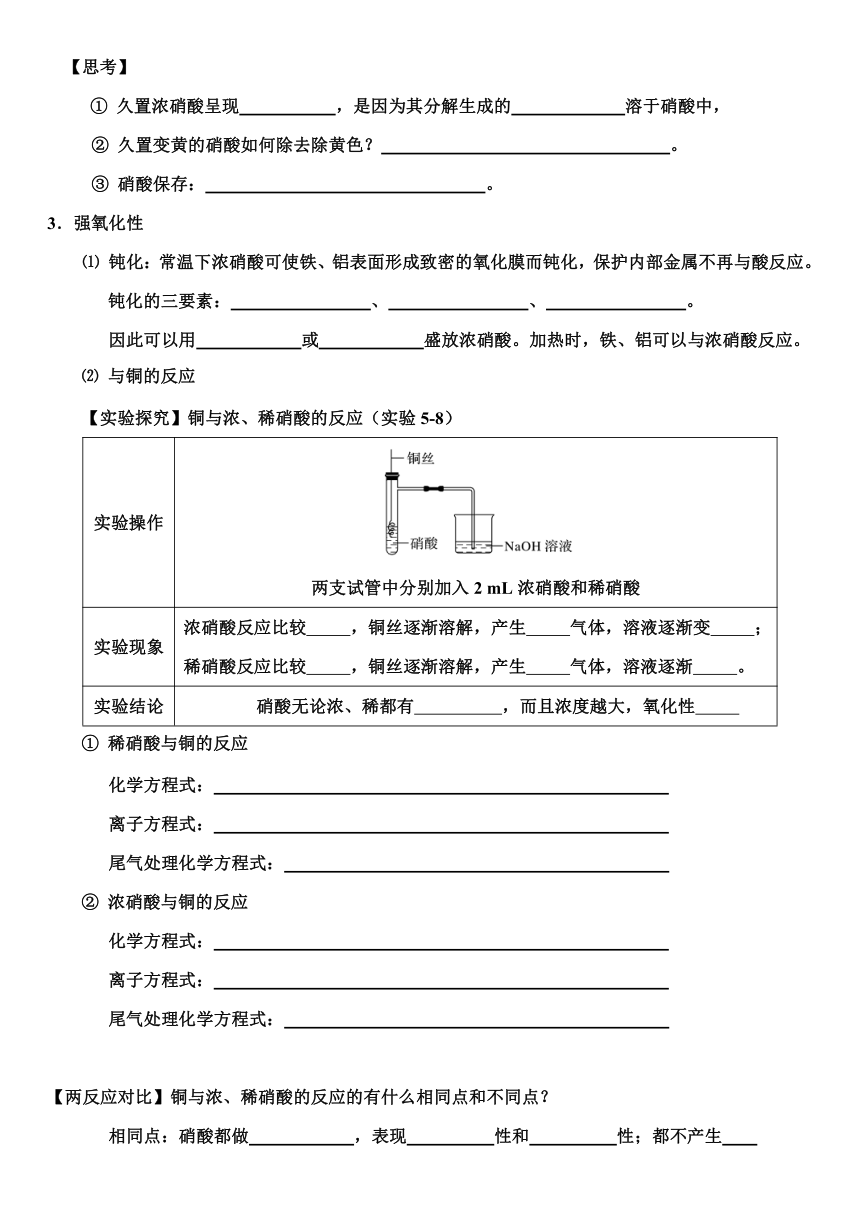
⑵ 与铜的反应
【实验探究】铜与浓、稀硝酸的反应(实验5-8)
实验操作 两支试管中分别加入2 mL浓硝酸和稀硝酸
实验现象 浓硝酸反应比较 ,铜丝逐渐溶解,产生 气体,溶液逐渐变 ;稀硝酸反应比较 ,铜丝逐渐溶解,产生 气体,溶液逐渐 。
实验结论 硝酸无论浓、稀都有 ,而且浓度越大,氧化性
① 稀硝酸与铜的反应
化学方程式:
离子方程式:
尾气处理化学方程式:
② 浓硝酸与铜的反应
化学方程式:
离子方程式:
尾气处理化学方程式:
【两反应对比】铜与浓、稀硝酸的反应的有什么相同点和不同点?
相同点:硝酸都做 ,表现 性和 性;都不产生
不同点:剧烈程度 ,产物
【思考】① HNO3浓度越大,得电子 ,还原产物中N的化合价
② 浓硝酸与足量的铜片反应,随着反应的进行,生成气体的颜色
Cu与盐酸混合不反应,再加入KNO3固体,有何现象?
③ 浓硝酸与过量的铜片反应,硝酸能充分反应消耗完吗?
反应结束后,再加入稀硫酸,有何现象?
④ 将浓硝酸滴在蓝色石蕊试纸上,有何现象?
⑶ 稀硝酸与Fe反应
① HNO3过量: Fe + HNO3(稀) ===
② Fe过量: Fe + HNO3(稀) ===
所得产物为Fe(NO3)3和Fe(NO3)2混合物时,Fe与HNO3的物质的量之比为
⑷ 浓硝酸跟非金属反应
HNO3(浓) + C
HNO3(浓) + S
HNO3(浓) + P
⑸ 硝酸与某些化合物反应(如S2-、SO32-、Fe2+、I-等)
SO32- + NO3- + H+===
Fe2+ + NO3- + H+===
⑹ 王水:
浓硝酸和浓盐酸的混合物(体积比为1∶3)叫王水。能使一些不溶于硝酸的金属如金、铂
等溶解。如:3Pt + 4HNO3 + 18HCl===3H2PtCl6 + 4NO↑+ 8H2O
【目标三】硝酸的制法及检验
1.实验室制法:
(
微热
)
化学方程式:NaNO3 + H2SO4(浓) NaHSO4 + HNO3↑
利用浓硫酸的 制取挥发性的硝酸。
【思考】① 实验室制HNO3的原理与制HCl完全相同,为什么不能加强热?
② 制HNO3发生装置是否与制Cl2完全相同?
(不同,一般制HNO3只能用曲颈甑,若用与制Cl2相同的装置,橡皮塞用铝箔包起来)
2.工业制法-氨的催化氧化法
⑴ 氨的合成
⑵ 氨的氧化(氧化炉)
⑶ NO的氧化
⑷ NO2的吸收和硝酸的生成(吸收塔)
⑸ 尾气吸收(用NaOH溶液) NO2 + NaOH ===
⑹ 稀HNO3浓缩——吸水剂Mg(NO3)2或浓H2SO4再蒸馏
3.NO3-检验:
先将未知溶液加热浓缩,再加浓H2SO4和铜屑,加热,若有红棕色气体生成,则证明溶液中含有NO3-。
【目标四】硝酸的用途
硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料、硝酸盐等;
在实验室里,它是一种重要的化学试剂。
【导练1】下列事实不能说明浓硝酸氧化性比稀硝酸强的是( )
A.浓硝酸遇石蕊溶液变红后褪色,稀硝酸遇石蕊溶液只变红不褪色
B.浓硝酸能与NO反应生成NO2,而稀硝酸不能与NO反应
C.浓硝酸在加热条件下可与碳单质反应,而稀硝酸则不能
D.足量的铜还原1 mol浓硝酸和1 mol稀硝酸转移电子数分别为NA和3NA
【导练2】一瓶溶液可能含有Cl-、CO32-、NO3-和SO42-四种阴离子中的某几种。今取少许溶液分装在三支试管里,进行如下实验操作:
⑴ 将第一支试管里的溶液加热浓缩,加浓H2SO4和铜屑再加热,发现有红棕色气体放出。
⑵ 向第二支试管里逐滴加入稀硝酸,放出无色气体,该气体能使澄清石灰水变浑浊;陆续加稀硝酸到溶液显酸性;加入硝酸钡溶液不生成沉淀;再加AgNO3溶液也不生成沉淀。
⑶ 向第三支试管中加入Ba(NO3)2溶液,生成白色沉淀。试推断这种溶液中:
一定含 ,一定不含 。
第三课时
【学习目标】
1.掌握HNO3的化学性质
2.掌握HNO3的特性、制备、用途及NO3-的检验
【目标一】硝酸的物理性质
纯硝酸是 色、易挥发、有刺激性气味的液体,密度为1.5027g/cm3,沸点83℃。以任意比与水互溶,98%以上的浓硝酸在空气由于挥发出HNO3而产生“发烟”现象,通常叫做 。
常用浓硝酸的质量分数大约为69%。浓硝酸具有强烈的腐蚀性,使用浓硝酸时要格外小心,
不慎弄到皮肤上,立即 ,再用 洗涤。
三强酸对比:
盐酸 硫酸 硝酸
挥发性 有 无 有
气味 刺激性 无 刺激性
常用浓酸 浓度 37% 98% 69%
密度( g·cm-3) 1.19 1.84 1.42
发黄原因 溶有Fe3+ 分解,溶有NO2
有无纯酸 无 有 有
【目标二】硝酸的化学性质
1.硝酸是一种 酸,具有 的通性。
① 电离:在水溶液中的电离方程式为
② 稀硝酸使紫色石蕊试液变
③ 与碱作用生成 和
HNO3与 Ba(OH)2反应的离子方程式为:
④ 与碱性氧化物作用生成 和
HNO3与CaO反应的离子方程式为:
我们知道在化学性质上,浓硫酸具有酸性、吸水性、脱水性、强氧化性等性质,那么硝酸也是一种强酸,它除了具有酸的通性外,还具有什么性质呢
2.不稳定性:纯净的硝酸或浓硝酸在常温下见光就分解,酸越浓越易分解,受热时分解更快。
4HNO3 (硝酸越浓越易分解)
【思考】
① 久置浓硝酸呈现 ,是因为其分解生成的 溶于硝酸中,
② 久置变黄的硝酸如何除去除黄色? 。
③ 硝酸保存: 。
3.强氧化性
⑴ 钝化:常温下浓硝酸可使铁、铝表面形成致密的氧化膜而钝化,保护内部金属不再与酸反应。
钝化的三要素: 、 、 。
因此可以用 或 盛放浓硝酸。加热时,铁、铝可以与浓硝酸反应。
⑵ 与铜的反应
【实验探究】铜与浓、稀硝酸的反应(实验5-8)
实验操作 两支试管中分别加入2 mL浓硝酸和稀硝酸
实验现象 浓硝酸反应比较 ,铜丝逐渐溶解,产生 气体,溶液逐渐变 ;稀硝酸反应比较 ,铜丝逐渐溶解,产生 气体,溶液逐渐 。
实验结论 硝酸无论浓、稀都有 ,而且浓度越大,氧化性
① 稀硝酸与铜的反应
化学方程式:
离子方程式:
尾气处理化学方程式:
② 浓硝酸与铜的反应
化学方程式:
离子方程式:
尾气处理化学方程式:
【两反应对比】铜与浓、稀硝酸的反应的有什么相同点和不同点?
相同点:硝酸都做 ,表现 性和 性;都不产生
不同点:剧烈程度 ,产物
【思考】① HNO3浓度越大,得电子 ,还原产物中N的化合价
② 浓硝酸与足量的铜片反应,随着反应的进行,生成气体的颜色
Cu与盐酸混合不反应,再加入KNO3固体,有何现象?
③ 浓硝酸与过量的铜片反应,硝酸能充分反应消耗完吗?
反应结束后,再加入稀硫酸,有何现象?
④ 将浓硝酸滴在蓝色石蕊试纸上,有何现象?
⑶ 稀硝酸与Fe反应
① HNO3过量: Fe + HNO3(稀) ===
② Fe过量: Fe + HNO3(稀) ===
所得产物为Fe(NO3)3和Fe(NO3)2混合物时,Fe与HNO3的物质的量之比为
⑷ 浓硝酸跟非金属反应
HNO3(浓) + C
HNO3(浓) + S
HNO3(浓) + P
⑸ 硝酸与某些化合物反应(如S2-、SO32-、Fe2+、I-等)
SO32- + NO3- + H+===
Fe2+ + NO3- + H+===
⑹ 王水:
浓硝酸和浓盐酸的混合物(体积比为1∶3)叫王水。能使一些不溶于硝酸的金属如金、铂
等溶解。如:3Pt + 4HNO3 + 18HCl===3H2PtCl6 + 4NO↑+ 8H2O
【目标三】硝酸的制法及检验
1.实验室制法:
(
微热
)
化学方程式:NaNO3 + H2SO4(浓) NaHSO4 + HNO3↑
利用浓硫酸的 制取挥发性的硝酸。
【思考】① 实验室制HNO3的原理与制HCl完全相同,为什么不能加强热?
② 制HNO3发生装置是否与制Cl2完全相同?
(不同,一般制HNO3只能用曲颈甑,若用与制Cl2相同的装置,橡皮塞用铝箔包起来)
2.工业制法-氨的催化氧化法
⑴ 氨的合成
⑵ 氨的氧化(氧化炉)
⑶ NO的氧化
⑷ NO2的吸收和硝酸的生成(吸收塔)
⑸ 尾气吸收(用NaOH溶液) NO2 + NaOH ===
⑹ 稀HNO3浓缩——吸水剂Mg(NO3)2或浓H2SO4再蒸馏
3.NO3-检验:
先将未知溶液加热浓缩,再加浓H2SO4和铜屑,加热,若有红棕色气体生成,则证明溶液中含有NO3-。
【目标四】硝酸的用途
硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料、硝酸盐等;
在实验室里,它是一种重要的化学试剂。
【导练1】下列事实不能说明浓硝酸氧化性比稀硝酸强的是( )
A.浓硝酸遇石蕊溶液变红后褪色,稀硝酸遇石蕊溶液只变红不褪色
B.浓硝酸能与NO反应生成NO2,而稀硝酸不能与NO反应
C.浓硝酸在加热条件下可与碳单质反应,而稀硝酸则不能
D.足量的铜还原1 mol浓硝酸和1 mol稀硝酸转移电子数分别为NA和3NA
【导练2】一瓶溶液可能含有Cl-、CO32-、NO3-和SO42-四种阴离子中的某几种。今取少许溶液分装在三支试管里,进行如下实验操作:
⑴ 将第一支试管里的溶液加热浓缩,加浓H2SO4和铜屑再加热,发现有红棕色气体放出。
⑵ 向第二支试管里逐滴加入稀硝酸,放出无色气体,该气体能使澄清石灰水变浑浊;陆续加稀硝酸到溶液显酸性;加入硝酸钡溶液不生成沉淀;再加AgNO3溶液也不生成沉淀。
⑶ 向第三支试管中加入Ba(NO3)2溶液,生成白色沉淀。试推断这种溶液中:
一定含 ,一定不含 。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
