【期中冲刺】2023学年第二学期浙教版科学八年级专题训练(十):原子结构的模型【word,含解析】
文档属性
| 名称 | 【期中冲刺】2023学年第二学期浙教版科学八年级专题训练(十):原子结构的模型【word,含解析】 |  | |
| 格式 | docx | ||
| 文件大小 | 342.4KB | ||
| 资源类型 | 教案 | ||
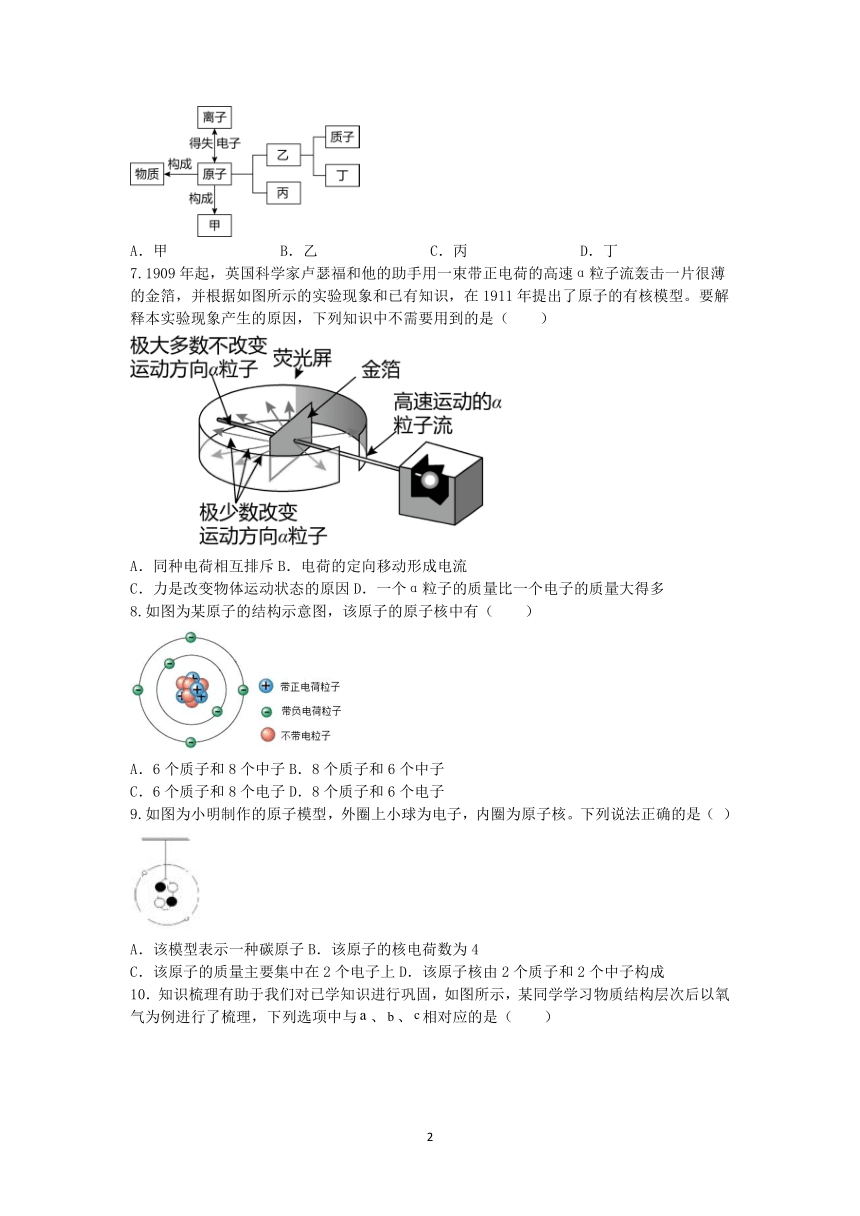
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-30 07:04:44 | ||
图片预览


文档简介
原子结构的模型
1.卢瑟福的α粒子轰击金箔实验为建立现代原子理论打下了基础。如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
A.ad B.abc C.bcd D.abcd
2.下列关于微观粒子的说法正确的是( )
A.分子可分,原子不可分
B.质子数相同微粒不一定属于同种元素
C.原子得失电子形成子后,原子核发生了变化
D.某种微粒由3个氢原子核和2个电子构成,该微粒的组成可用表示
3.有一种人造氢原子(可表示为)的原子核中有3个中子,它可以结合成分子。每个分子中,下列微粒的个数不等于2的是( )
A.原子 B.质子 C.中子 D.电子
4.2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子
A.含有2个质子B.核电荷数为1
C.相对原子质量为4D.质子数和中子数相等
5.探月卫星“嫦娥一号”主要任务之一是探明月球上氦-3的储量。下图是氦-3原子结构示意图,以下说法错误的是( )
A.原子还可分,它们由更小的微粒构成B.氦-3原子由原子核和核外电子构成
C.氦-3原子核内有2个质子和一个中子D.氦元素在周期表中的原子序数3
6.1911年,卢瑟福用带正电的α粒子轰击金属箔,发现多数α粒子穿过金属箔后仍保持原来的运动方向,但有绝少数α粒子发生了较大角度的偏转,于是提出了原子的核式结构模型。这个“核”是指图中的( )
A.甲 B.乙 C.丙 D.丁
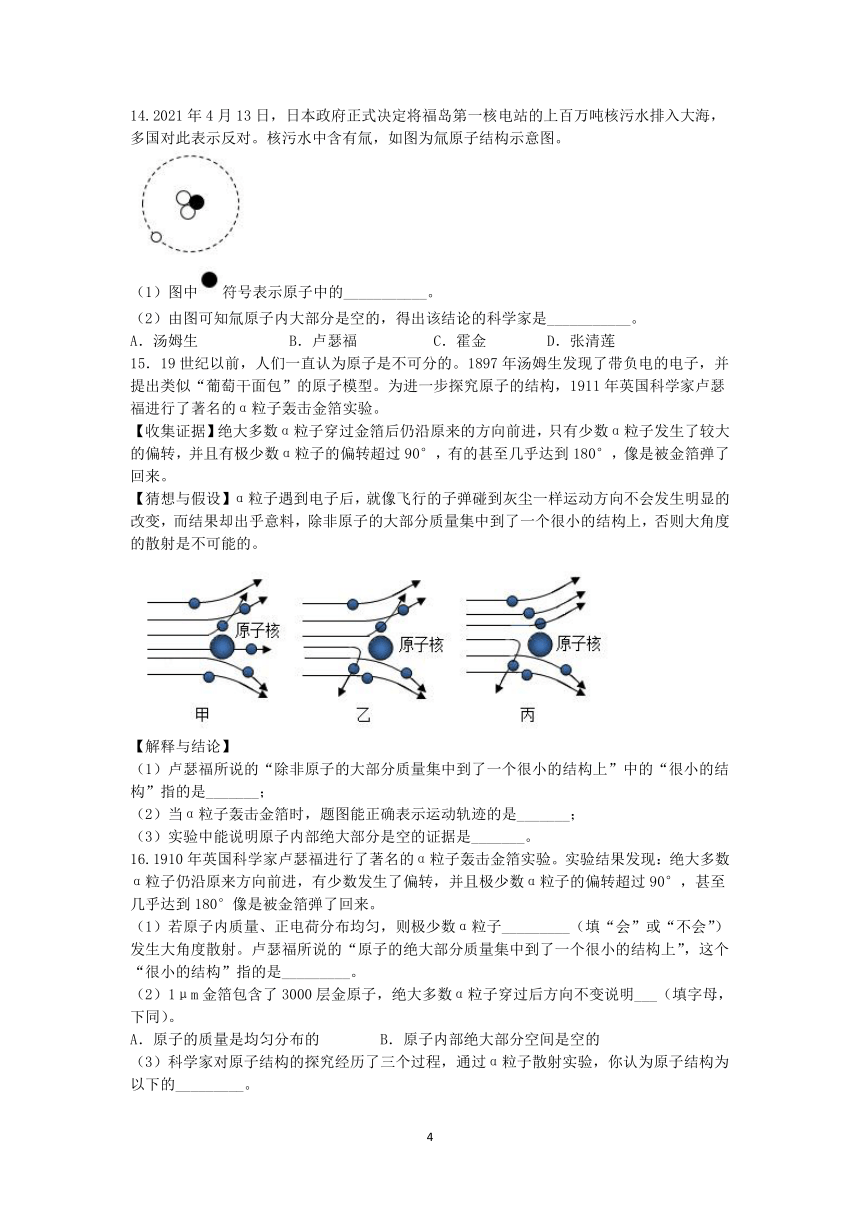
7.1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。要解释本实验现象产生的原因,下列知识中不需要用到的是( )
A.同种电荷相互排斥B.电荷的定向移动形成电流
C.力是改变物体运动状态的原因D.一个α粒子的质量比一个电子的质量大得多
8.如图为某原子的结构示意图,该原子的原子核中有( )
A.6个质子和8个中子B.8个质子和6个中子
C.6个质子和8个电子D.8个质子和6个电子
9.如图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。下列说法正确的是( )
A.该模型表示一种碳原子B.该原子的核电荷数为4
C.该原子的质量主要集中在2个电子上D.该原子核由2个质子和2个中子构成
10.知识梳理有助于我们对已学知识进行巩固,如图所示,某同学学习物质结构层次后以氧气为例进行了梳理,下列选项中与、、相对应的是( )
A.原子、原子核、核外电子 B.原子核、原子、核外电子
C.原子、核外电子、原子核 D.核外电子、原子核、原子
11.1909年卢瑟福领导的团队用一束α粒子(带正电荷)轰击金箔时发现了如图所示的实验现象。由实验得出的结论合理的是( )
A.多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子
B.少数α粒子发生偏移,说明原子核外电子质量较大且带负电
C.极少数α粒子被反弹,说明原子核体积根小、质量较大
D.该实验说明α粒子无法穿透原子与原子间的空隙
12.下图形象地表示了氯化钠的形成过程。下列相关叙述中不正确的是( )
A.钠原子易失去一个电子,氯原子易得到一个电子B.钠可以跟氯气反应生成氯化钠
C.氯化钠是由离子构成的化合物D.钠离子与钠原子的化学性质相同
13.如图为原子核聚变(原理是让上个原子核发生聚合作用,生成质量更大新的原子核)的示意图,①②③表示三种原子(③原子核未画出),表示原子中的不同微粒,聚变前后的微粒种类不变,各微粒总数也不变。
(1)仿照①②,在图中的③中画出其原子核___________;
(2)①②③中属于同种元素的原子是___________(选填序号)。
14.2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图。
(1)图中符号表示原子中的___________。
(2)由图可知氚原子内大部分是空的,得出该结论的科学家是___________。
A.汤姆生 B.卢瑟福 C.霍金 D.张清莲
15.19世纪以前,人们一直认为原子是不可分的。1897年汤姆生发现了带负电的电子,并提出类似“葡萄干面包”的原子模型。为进一步探究原子的结构,1911年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,只有少数α粒子发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是_______;
(2)当α粒子轰击金箔时,题图能正确表示运动轨迹的是_______;
(3)实验中能说明原子内部绝大部分是空的证据是_______。
16.1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验结果发现:绝大多数α粒子仍沿原来方向前进,有少数发生了偏转,并且极少数α粒子的偏转超过90°,甚至几乎达到180°像是被金箔弹了回来。
(1)若原子内质量、正电荷分布均匀,则极少数α粒子_________(填“会”或“不会”)发生大角度散射。卢瑟福所说的“原子的绝大部分质量集中到了一个很小的结构上”,这个“很小的结构”指的是_________。
(2)1μm金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变说明___(填字母,下同)。
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的_________。
A.道尔顿模型特点:不可再分的实心球体
B.汤姆生模型特点:正负电荷均匀分布
C.卢瑟福模型特点:核位于原子中心,质量集中在核上
17.如图中ABCD是四种粒子的结构示意图,请回答下列问题。
(1)以上四种粒子的结构示意图中,属于同种元素的粒子是______(填字母代号);
(2)以上ABC三种粒子中,属于离子的是______(填字母代号),它的符号是______;
(3)D元素的名称是______;D原子中______。
(4)有水()、双氧水()、重水(,“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有______种,从化学性质的角度看,______和水的化学性质有较大差异。
18.科学家为了揭示原子结构的奥秘,经历了漫长的探索过程。原子结构模型发展过程可表示如下:
(1)阴极射线管是能放出阴极射线的仪器,如图。汤姆生在1897年提出阴极射线是从阴极放出的带负电的粒子。若把阴极射线AB看成电荷的定向移动,其电流方向为___________。
(2) 1910年卢瑟福进行了著名的a粒子(a粒子带正电)轰击金箔实验,发现:绝大多数a粒子穿过金箔后仍沿原方向前进,但是有少数a粒子却发生了较大的偏转,并且有极少数a粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来,如图。
①a粒子实质是氦原子核,可由铀、镭等元素得到。在太阳内部,质量较小的氘核和氚核在超高温下可以聚合成氦核,这种反应称为___________。
②在分析实验结果的基础上,卢瑟福提出核式结构模型:在原子的中心有一个很小的原子核,原子的全部正电荷和几乎全部的质量都集中在原子核里,带负电的电子在核外空间绕核运动,就像行星绕太阳运动那样。人们掌握的下列事实或原理,有助于当时建立该模型的是___________。
A.同种电荷互相排斥,异种电荷互相吸引B.力能改变物体的运动状态
C.电荷的定向移动形成电流D.有些原子内没有中子
E.电子由于质量太小无法阻挡a粒子轰击
答案及解析
1.C
【解析】由于原子中原子核体积很小,质量很大,所以α粒子遇到原子核会发生偏转,例如c和d;因为原子的核外电子质量很小,所占的体积很大,电子的质量小,可以忽略不计,所以α粒子可以直接穿过去,例如b;原子核带正电,α粒子也带正电,同种电荷相互排斥,α粒子不可能向原子核靠近,应该远离原子核,故a不是α粒子在该实验中的运动轨迹,故C符合题意,ABD不符合题意。
2.B
【解析】A、分子可以分为原子,原子在化学变化中不能再分,该选项说法错误;
B、质子数相同的微粒不一定属于同种元素,不如水分子和氖原子,该选项说法正确;
C、原子得失电子形成离子后,原子核没有改变,该选项说法错误;
D、某种氢微粒由3个氢原子核(只含质子)和 2个电子,质子带正电,则氢微粒带1个单位的正电荷,则该微粒的组成可用H3+表示,故选项说法错误。
3.C
【解析】人造氢原子也属于氢原子的一种,因此存在质子数=核电荷数=核外电子数=1,因此在人造中,原子数、质子数、电子数均为2,中子数=2×(4-1)=6,故选C。
4.B
【解析】A、根据质子数=核外电子数,可知氚原子含有1个质子,故错误。
B、核电荷数=质子数,据图可知氚原子含有1个质子,因此核电荷数为1,故正确。
C、相对原子质量≈质子数+中子数,据图可知氚原子含有1个质子、2个中子,因此相对原子质量=3,故错误。
D、据图可知氚原子含有1个质子、2个中子,因此质子数和中子数不相等,故错误。
5.D
【解析】A、原子中有质子、中子、电子,质子、电子和中子应是由更小的微粒构成的,所以原子可以再分,故说法正确;
B、由氦-3原子结构示意图可知,氦-3原子由原子核和核外电子构成,故说法正确;
C、由氦-3原子结构示意图可知,氦-3原子核内有2个质子一个中子,故说法正确;
D、由氦-3原子结构示意图可知,氦原子中有2个质子,氦元素在周期表中的原子序数2,故说法错误。
6.B
【解析】原子的核式结构模型中的“核”是原子核,卢瑟福原子结构模型的内容是,物质由大量的原子组成,原子是由原子核和电子构成的,原子的中心有一个很小的原子核,原子的全部正电荷集中在原子核内,原子核由质子和中子组成,故由图知道,乙是原子核,故B符合题意。
7.B
【解析】A.α粒子带正电荷,部分α粒子运动方向改变,是同种电荷相互排斥的结果,故A不符合题意;
B.电荷的定向移动形成电流,但与α粒子的散射实验无关,故B符合题意;
C.部分α粒子运动方向改变,是运动状态改变了,力是改变物体运动状态的原因,故C不符合题意;
D.α粒子穿过原子时,由于α粒子的质量比电子大得多,电子不可能使α粒子的运动方向发生明显的改变,故D不符合题意。
8.A
【解析】因为原子中,质子数=核外电子数,由该原子的结构示意图可知,其原子核外有6个电子,所以原子核内有6个质子,原子核是由质子和中子构成的,故选A。
9.D
【解析】A.该模型表示两个质子,两个中子,两个电子,故A错误;
B.该原子的核电荷数为2,故B错误;
C.该原子的质量主要集中原子核上,故C错误;
D.由图可知该原子核由2个质子和2个中子构成,故D正确。故选D。
10.A
【解析】分子是由原子构成的,故a是原子,原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,故b是原子核,c是核外电子,观察选项,故选A。
11.C
【解析】A.大多数α粒子能穿透金箔,而且不改变原来的前进方向,说明原子核很小,原子核外有很大的空间,不能说明不存在其他粒子,核外有电子质量很小,故A不符合题意;
B.少数α粒子发生偏移,因为原子核内质子所带正电荷的排斥作用,说明原子核的质量很大,故B不符合题意;
C.极少数α粒子被反弹,说明原子核体积很小、质量较大,只有碰到质量比它大很多的物质才被反弹回来,故C符合题意;
D.该实验说明α粒子可以穿透原子与原子间的空隙,故D不符合题意。
12.D
【解析】A、由形成过程图可知,Na变为Na+,失去1个电子,Cl变为Cl-,得到1个电子,说法正确。
B、由图可知钠与氯气反应生成了氯化钠,说法正确。
C、因氯化钠是阴阳离子通过静电作用形成的化合物,其构成微粒为离子,则属于离子化合物,说法正确。
D、钠离子最外层8个电子,性质稳定,而钠原子最外层1个电子,容易失去电子,性质活泼,即钠离子和钠原子化学性质不同,说法不正确。
13. ①②
【解析】(1)根据聚变前后的微粒种类不变,各微粒总数也不改变可知③中核内有2个质子和2个中子。其原子核为: ;
(2)同种元素的核内质子数相同,①为1个质子和1个中子,②为1个质子和2个中子,故①②属于同种元素。
14. 质子 B
【解析】(1)氚原子属于氢元素,其核内的质子数为1,即图中符号表示原子中的质子,故填质子。
(2)A 汤姆生发现了电子,提出了原子结构的葡萄干布丁模型,选项错误;
B 卢瑟福提出了原子核式结构模型,认为原子内大部分是空的,选项正确;
C 霍金发现了能量层级图,选项错误;
D 张清莲为重新测定原子的相对原子质量做出了贡献,选项错误;
15. 原子核 乙 绝大多数α粒子穿过金箔后仍沿原来的方向前进
【解析】(1)原子由原子核和核外电子构成,原子核的体积很小但相对于电子来说质量很大,电子几乎没有质量,卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是原子核;
(2)当α粒子轰击金箔时,由于原子核的排斥力,因此粒子的运动轨迹会向外偏折。极少数正面撞击原子核的粒子受到的作用力最大,因此α粒子有很大的偏转或反弹,故选乙;
(3)实验中能说明原子内部绝大部分是空的证据是:绝大多数α粒子穿过金箔后仍沿原来的方向前进。
16.不会 原子核 B C
【解析】(1)α粒子带正电荷,原子核也带正电荷,则α粒子会受到排斥力而发生散射,如果正电荷分布均匀,则α粒子受到的排斥力比较均匀,因此大幅度散射的数量会很小,即若原子内质量、正电荷分布均匀,则极少数α粒子不会发生大角度散射,故填不会;
原子核的体积很小,但质量很大,处在原子的中间,即这个“很小的结构”指的是原子核,故填原子核。
(2)(2)1μm金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明原子核产生的排斥力范围很小,即原子核本身很小,而原子内部绝大部分空间是空的,故选B。
(3)原子中间为原子核,周围是绕原子核高速旋转的电子,故选C。
17.AB B F- 氩 8 2 双氧水
【解析】(1)由图可知,微粒A、B的质子数均为9,由元素的概念可知,微粒A、B属于同种元素,故填AB。
(2)A、B、C三种微粒中,微粒A、C的质子数等于核外电子数,属于原子,微粒B的质子数为9,核外电子数为10,即质子数≠核外电子数,则微粒B属于离子,故填B;
微粒C的质子数为9,属于氟元素,其核外电子数为10,则微粒C是带1个单位负电荷的氟离子,其符号为F-,故填F-。
(3)D微粒的质子数为18,属于氩元素,该元素名称是氩,故填氩;
原子中,核内质子数等于核外电子数,所以x=18 2 8=8,故填8。
(4)由化学式可知,三种物质均有氢元素与氧元素组成,所以三种物质所含的元素共有氢、氧2种元素,故填2;
1个水分子和1个重水分子均有2个氢原子与1个氧原子构成,而1个双氧水分子由2个氢原子和2个氧原子构成,所以双氧水和水的化学性质有较大差异,故填双氧水。
18. B→A 核聚变(热核反应) ABE
【解析】(1)阴极射线AB看成电荷的定向移动,故电流的方向为B→A
(2)在太阳内部,质量较小的氘核和氚核在超高温下可以聚合成氦核,这种反应叫做核聚变。
(3)卢瑟福进行了著名的a粒子(a粒子带正电)轰击金箔实验发现绝大多数a粒子穿过金箔后仍沿原方向前进,但是有少数a粒子却发生了较大的偏转,并且有极少数a粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来,由于a粒子带正电,所以可以得出同种电荷相互排斥,异种电荷互相吸引,由于a粒子(a粒子带正电)轰击金箔实验有的粒子发生偏转可知力能改变物体的运动状态,由于电子的质量太小也可能无法阻挡a粒子轰击,故选择ABE。
(
1
)
1.卢瑟福的α粒子轰击金箔实验为建立现代原子理论打下了基础。如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
A.ad B.abc C.bcd D.abcd
2.下列关于微观粒子的说法正确的是( )
A.分子可分,原子不可分
B.质子数相同微粒不一定属于同种元素
C.原子得失电子形成子后,原子核发生了变化
D.某种微粒由3个氢原子核和2个电子构成,该微粒的组成可用表示
3.有一种人造氢原子(可表示为)的原子核中有3个中子,它可以结合成分子。每个分子中,下列微粒的个数不等于2的是( )
A.原子 B.质子 C.中子 D.电子
4.2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子
A.含有2个质子B.核电荷数为1
C.相对原子质量为4D.质子数和中子数相等
5.探月卫星“嫦娥一号”主要任务之一是探明月球上氦-3的储量。下图是氦-3原子结构示意图,以下说法错误的是( )
A.原子还可分,它们由更小的微粒构成B.氦-3原子由原子核和核外电子构成
C.氦-3原子核内有2个质子和一个中子D.氦元素在周期表中的原子序数3
6.1911年,卢瑟福用带正电的α粒子轰击金属箔,发现多数α粒子穿过金属箔后仍保持原来的运动方向,但有绝少数α粒子发生了较大角度的偏转,于是提出了原子的核式结构模型。这个“核”是指图中的( )
A.甲 B.乙 C.丙 D.丁
7.1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。要解释本实验现象产生的原因,下列知识中不需要用到的是( )
A.同种电荷相互排斥B.电荷的定向移动形成电流
C.力是改变物体运动状态的原因D.一个α粒子的质量比一个电子的质量大得多
8.如图为某原子的结构示意图,该原子的原子核中有( )
A.6个质子和8个中子B.8个质子和6个中子
C.6个质子和8个电子D.8个质子和6个电子
9.如图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。下列说法正确的是( )
A.该模型表示一种碳原子B.该原子的核电荷数为4
C.该原子的质量主要集中在2个电子上D.该原子核由2个质子和2个中子构成
10.知识梳理有助于我们对已学知识进行巩固,如图所示,某同学学习物质结构层次后以氧气为例进行了梳理,下列选项中与、、相对应的是( )
A.原子、原子核、核外电子 B.原子核、原子、核外电子
C.原子、核外电子、原子核 D.核外电子、原子核、原子
11.1909年卢瑟福领导的团队用一束α粒子(带正电荷)轰击金箔时发现了如图所示的实验现象。由实验得出的结论合理的是( )
A.多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子
B.少数α粒子发生偏移,说明原子核外电子质量较大且带负电
C.极少数α粒子被反弹,说明原子核体积根小、质量较大
D.该实验说明α粒子无法穿透原子与原子间的空隙
12.下图形象地表示了氯化钠的形成过程。下列相关叙述中不正确的是( )
A.钠原子易失去一个电子,氯原子易得到一个电子B.钠可以跟氯气反应生成氯化钠
C.氯化钠是由离子构成的化合物D.钠离子与钠原子的化学性质相同
13.如图为原子核聚变(原理是让上个原子核发生聚合作用,生成质量更大新的原子核)的示意图,①②③表示三种原子(③原子核未画出),表示原子中的不同微粒,聚变前后的微粒种类不变,各微粒总数也不变。
(1)仿照①②,在图中的③中画出其原子核___________;
(2)①②③中属于同种元素的原子是___________(选填序号)。
14.2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图。
(1)图中符号表示原子中的___________。
(2)由图可知氚原子内大部分是空的,得出该结论的科学家是___________。
A.汤姆生 B.卢瑟福 C.霍金 D.张清莲
15.19世纪以前,人们一直认为原子是不可分的。1897年汤姆生发现了带负电的电子,并提出类似“葡萄干面包”的原子模型。为进一步探究原子的结构,1911年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,只有少数α粒子发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是_______;
(2)当α粒子轰击金箔时,题图能正确表示运动轨迹的是_______;
(3)实验中能说明原子内部绝大部分是空的证据是_______。
16.1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验结果发现:绝大多数α粒子仍沿原来方向前进,有少数发生了偏转,并且极少数α粒子的偏转超过90°,甚至几乎达到180°像是被金箔弹了回来。
(1)若原子内质量、正电荷分布均匀,则极少数α粒子_________(填“会”或“不会”)发生大角度散射。卢瑟福所说的“原子的绝大部分质量集中到了一个很小的结构上”,这个“很小的结构”指的是_________。
(2)1μm金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变说明___(填字母,下同)。
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的_________。
A.道尔顿模型特点:不可再分的实心球体
B.汤姆生模型特点:正负电荷均匀分布
C.卢瑟福模型特点:核位于原子中心,质量集中在核上
17.如图中ABCD是四种粒子的结构示意图,请回答下列问题。
(1)以上四种粒子的结构示意图中,属于同种元素的粒子是______(填字母代号);
(2)以上ABC三种粒子中,属于离子的是______(填字母代号),它的符号是______;
(3)D元素的名称是______;D原子中______。
(4)有水()、双氧水()、重水(,“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有______种,从化学性质的角度看,______和水的化学性质有较大差异。
18.科学家为了揭示原子结构的奥秘,经历了漫长的探索过程。原子结构模型发展过程可表示如下:
(1)阴极射线管是能放出阴极射线的仪器,如图。汤姆生在1897年提出阴极射线是从阴极放出的带负电的粒子。若把阴极射线AB看成电荷的定向移动,其电流方向为___________。
(2) 1910年卢瑟福进行了著名的a粒子(a粒子带正电)轰击金箔实验,发现:绝大多数a粒子穿过金箔后仍沿原方向前进,但是有少数a粒子却发生了较大的偏转,并且有极少数a粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来,如图。
①a粒子实质是氦原子核,可由铀、镭等元素得到。在太阳内部,质量较小的氘核和氚核在超高温下可以聚合成氦核,这种反应称为___________。
②在分析实验结果的基础上,卢瑟福提出核式结构模型:在原子的中心有一个很小的原子核,原子的全部正电荷和几乎全部的质量都集中在原子核里,带负电的电子在核外空间绕核运动,就像行星绕太阳运动那样。人们掌握的下列事实或原理,有助于当时建立该模型的是___________。
A.同种电荷互相排斥,异种电荷互相吸引B.力能改变物体的运动状态
C.电荷的定向移动形成电流D.有些原子内没有中子
E.电子由于质量太小无法阻挡a粒子轰击
答案及解析
1.C
【解析】由于原子中原子核体积很小,质量很大,所以α粒子遇到原子核会发生偏转,例如c和d;因为原子的核外电子质量很小,所占的体积很大,电子的质量小,可以忽略不计,所以α粒子可以直接穿过去,例如b;原子核带正电,α粒子也带正电,同种电荷相互排斥,α粒子不可能向原子核靠近,应该远离原子核,故a不是α粒子在该实验中的运动轨迹,故C符合题意,ABD不符合题意。
2.B
【解析】A、分子可以分为原子,原子在化学变化中不能再分,该选项说法错误;
B、质子数相同的微粒不一定属于同种元素,不如水分子和氖原子,该选项说法正确;
C、原子得失电子形成离子后,原子核没有改变,该选项说法错误;
D、某种氢微粒由3个氢原子核(只含质子)和 2个电子,质子带正电,则氢微粒带1个单位的正电荷,则该微粒的组成可用H3+表示,故选项说法错误。
3.C
【解析】人造氢原子也属于氢原子的一种,因此存在质子数=核电荷数=核外电子数=1,因此在人造中,原子数、质子数、电子数均为2,中子数=2×(4-1)=6,故选C。
4.B
【解析】A、根据质子数=核外电子数,可知氚原子含有1个质子,故错误。
B、核电荷数=质子数,据图可知氚原子含有1个质子,因此核电荷数为1,故正确。
C、相对原子质量≈质子数+中子数,据图可知氚原子含有1个质子、2个中子,因此相对原子质量=3,故错误。
D、据图可知氚原子含有1个质子、2个中子,因此质子数和中子数不相等,故错误。
5.D
【解析】A、原子中有质子、中子、电子,质子、电子和中子应是由更小的微粒构成的,所以原子可以再分,故说法正确;
B、由氦-3原子结构示意图可知,氦-3原子由原子核和核外电子构成,故说法正确;
C、由氦-3原子结构示意图可知,氦-3原子核内有2个质子一个中子,故说法正确;
D、由氦-3原子结构示意图可知,氦原子中有2个质子,氦元素在周期表中的原子序数2,故说法错误。
6.B
【解析】原子的核式结构模型中的“核”是原子核,卢瑟福原子结构模型的内容是,物质由大量的原子组成,原子是由原子核和电子构成的,原子的中心有一个很小的原子核,原子的全部正电荷集中在原子核内,原子核由质子和中子组成,故由图知道,乙是原子核,故B符合题意。
7.B
【解析】A.α粒子带正电荷,部分α粒子运动方向改变,是同种电荷相互排斥的结果,故A不符合题意;
B.电荷的定向移动形成电流,但与α粒子的散射实验无关,故B符合题意;
C.部分α粒子运动方向改变,是运动状态改变了,力是改变物体运动状态的原因,故C不符合题意;
D.α粒子穿过原子时,由于α粒子的质量比电子大得多,电子不可能使α粒子的运动方向发生明显的改变,故D不符合题意。
8.A
【解析】因为原子中,质子数=核外电子数,由该原子的结构示意图可知,其原子核外有6个电子,所以原子核内有6个质子,原子核是由质子和中子构成的,故选A。
9.D
【解析】A.该模型表示两个质子,两个中子,两个电子,故A错误;
B.该原子的核电荷数为2,故B错误;
C.该原子的质量主要集中原子核上,故C错误;
D.由图可知该原子核由2个质子和2个中子构成,故D正确。故选D。
10.A
【解析】分子是由原子构成的,故a是原子,原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,故b是原子核,c是核外电子,观察选项,故选A。
11.C
【解析】A.大多数α粒子能穿透金箔,而且不改变原来的前进方向,说明原子核很小,原子核外有很大的空间,不能说明不存在其他粒子,核外有电子质量很小,故A不符合题意;
B.少数α粒子发生偏移,因为原子核内质子所带正电荷的排斥作用,说明原子核的质量很大,故B不符合题意;
C.极少数α粒子被反弹,说明原子核体积很小、质量较大,只有碰到质量比它大很多的物质才被反弹回来,故C符合题意;
D.该实验说明α粒子可以穿透原子与原子间的空隙,故D不符合题意。
12.D
【解析】A、由形成过程图可知,Na变为Na+,失去1个电子,Cl变为Cl-,得到1个电子,说法正确。
B、由图可知钠与氯气反应生成了氯化钠,说法正确。
C、因氯化钠是阴阳离子通过静电作用形成的化合物,其构成微粒为离子,则属于离子化合物,说法正确。
D、钠离子最外层8个电子,性质稳定,而钠原子最外层1个电子,容易失去电子,性质活泼,即钠离子和钠原子化学性质不同,说法不正确。
13. ①②
【解析】(1)根据聚变前后的微粒种类不变,各微粒总数也不改变可知③中核内有2个质子和2个中子。其原子核为: ;
(2)同种元素的核内质子数相同,①为1个质子和1个中子,②为1个质子和2个中子,故①②属于同种元素。
14. 质子 B
【解析】(1)氚原子属于氢元素,其核内的质子数为1,即图中符号表示原子中的质子,故填质子。
(2)A 汤姆生发现了电子,提出了原子结构的葡萄干布丁模型,选项错误;
B 卢瑟福提出了原子核式结构模型,认为原子内大部分是空的,选项正确;
C 霍金发现了能量层级图,选项错误;
D 张清莲为重新测定原子的相对原子质量做出了贡献,选项错误;
15. 原子核 乙 绝大多数α粒子穿过金箔后仍沿原来的方向前进
【解析】(1)原子由原子核和核外电子构成,原子核的体积很小但相对于电子来说质量很大,电子几乎没有质量,卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是原子核;
(2)当α粒子轰击金箔时,由于原子核的排斥力,因此粒子的运动轨迹会向外偏折。极少数正面撞击原子核的粒子受到的作用力最大,因此α粒子有很大的偏转或反弹,故选乙;
(3)实验中能说明原子内部绝大部分是空的证据是:绝大多数α粒子穿过金箔后仍沿原来的方向前进。
16.不会 原子核 B C
【解析】(1)α粒子带正电荷,原子核也带正电荷,则α粒子会受到排斥力而发生散射,如果正电荷分布均匀,则α粒子受到的排斥力比较均匀,因此大幅度散射的数量会很小,即若原子内质量、正电荷分布均匀,则极少数α粒子不会发生大角度散射,故填不会;
原子核的体积很小,但质量很大,处在原子的中间,即这个“很小的结构”指的是原子核,故填原子核。
(2)(2)1μm金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明原子核产生的排斥力范围很小,即原子核本身很小,而原子内部绝大部分空间是空的,故选B。
(3)原子中间为原子核,周围是绕原子核高速旋转的电子,故选C。
17.AB B F- 氩 8 2 双氧水
【解析】(1)由图可知,微粒A、B的质子数均为9,由元素的概念可知,微粒A、B属于同种元素,故填AB。
(2)A、B、C三种微粒中,微粒A、C的质子数等于核外电子数,属于原子,微粒B的质子数为9,核外电子数为10,即质子数≠核外电子数,则微粒B属于离子,故填B;
微粒C的质子数为9,属于氟元素,其核外电子数为10,则微粒C是带1个单位负电荷的氟离子,其符号为F-,故填F-。
(3)D微粒的质子数为18,属于氩元素,该元素名称是氩,故填氩;
原子中,核内质子数等于核外电子数,所以x=18 2 8=8,故填8。
(4)由化学式可知,三种物质均有氢元素与氧元素组成,所以三种物质所含的元素共有氢、氧2种元素,故填2;
1个水分子和1个重水分子均有2个氢原子与1个氧原子构成,而1个双氧水分子由2个氢原子和2个氧原子构成,所以双氧水和水的化学性质有较大差异,故填双氧水。
18. B→A 核聚变(热核反应) ABE
【解析】(1)阴极射线AB看成电荷的定向移动,故电流的方向为B→A
(2)在太阳内部,质量较小的氘核和氚核在超高温下可以聚合成氦核,这种反应叫做核聚变。
(3)卢瑟福进行了著名的a粒子(a粒子带正电)轰击金箔实验发现绝大多数a粒子穿过金箔后仍沿原方向前进,但是有少数a粒子却发生了较大的偏转,并且有极少数a粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来,由于a粒子带正电,所以可以得出同种电荷相互排斥,异种电荷互相吸引,由于a粒子(a粒子带正电)轰击金箔实验有的粒子发生偏转可知力能改变物体的运动状态,由于电子的质量太小也可能无法阻挡a粒子轰击,故选择ABE。
(
1
)
同课章节目录
