2023年中考化学专题复习课件(06) 计算题(鲁教版)(共21张PPT)
文档属性
| 名称 | 2023年中考化学专题复习课件(06) 计算题(鲁教版)(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 900.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-29 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
专题(六) 计算题
例1 [宿迁]在煤中加入适量的生石灰制成供居民采暖用的“环保煤”,以减少二氧化硫的排放,减弱二氧化硫对空气的污染。“环保煤”燃烧时生石灰吸收二氧化硫的化学方程式为2CaO+mSO2+O2 nCaSO4。请回答下列问题。
(1)m值是 。
(2)若煤厂一次共加入含氧化钙80%的生石灰70 t,则理论上最多可吸收二氧化硫多少吨
类型一
文字叙述型 (8年1考)
2
(2)若煤厂一次共加入含氧化钙80%的生石灰70 t,则理论上最多可吸收二氧化硫多少吨
(2)解:设理论上最多可吸收二氧化硫的质量为x。
含氧化钙80%的生石灰70 t中,氧化钙的质量为70 t×80%=56 t。
2CaO+2SO2+O2 2CaSO4
112 128
56 t x
= x=64 t
答:理论上最多可吸收二氧化硫64 t。
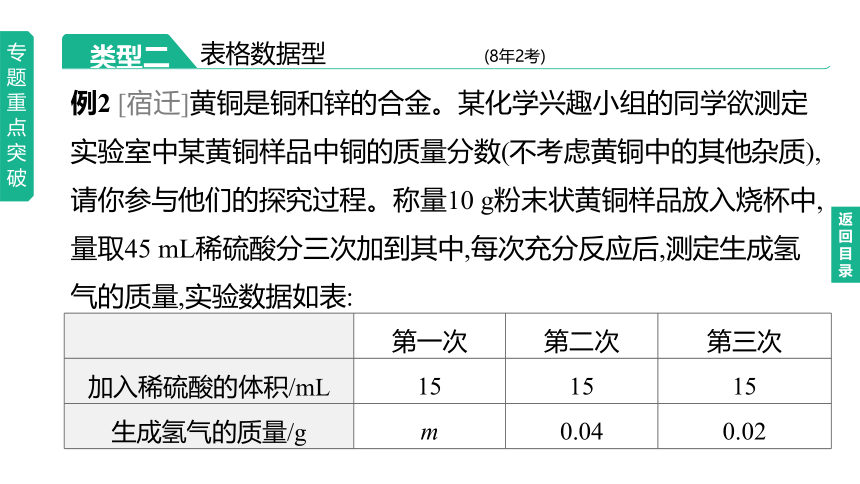
例2 [宿迁]黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10 g粉末状黄铜样品放入烧杯中,量取45 mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
类型二
表格数据型 (8年2考)
第一次 第二次 第三次
加入稀硫酸的体积/mL 15 15 15
生成氢气的质量/g m 0.04 0.02
试求:(1)m的数值为 。
(2)此黄铜样品中铜的质量分数是多少 (写出计算过程)
0.04
(2)解:锌完全反应后生成氢气的总质量为0.04 g+0.04 g+0.02 g=0.1 g。
设黄铜样品中锌的质量为x。
Zn+H2SO4 ZnSO4+H2↑
65 2
x 0.1 g
= x=3.25 g
此黄铜样品中铜的质量分数为×100%=67.5%。
答:此黄铜样品中铜的质量分数是67.5%。
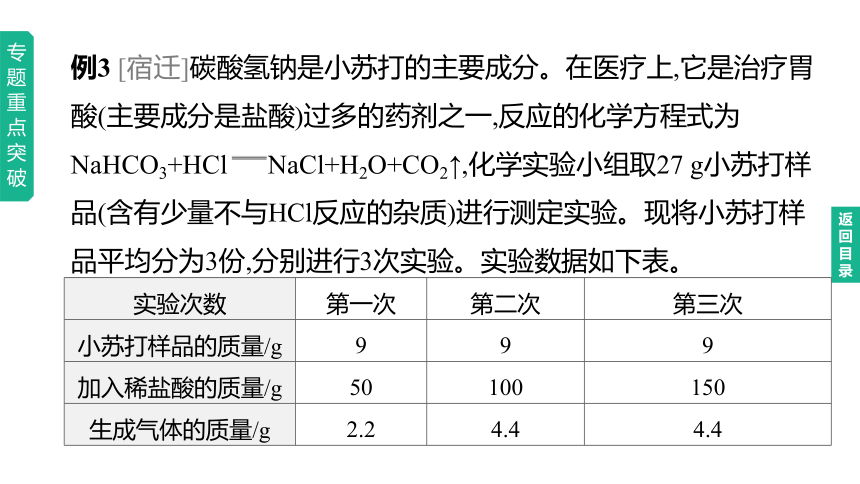
例3 [宿迁]碳酸氢钠是小苏打的主要成分。在医疗上,它是治疗胃酸(主要成分是盐酸)过多的药剂之一,反应的化学方程式为NaHCO3+HCl NaCl+H2O+CO2↑,化学实验小组取27 g小苏打样品(含有少量不与HCl反应的杂质)进行测定实验。现将小苏打样品平均分为3份,分别进行3次实验。实验数据如下表。
实验次数 第一次 第二次 第三次
小苏打样品的质量/g 9 9 9
加入稀盐酸的质量/g 50 100 150
生成气体的质量/g 2.2 4.4 4.4
(1)第 次实验中NaHCO3和HCl恰好完全反应。
(2)计算27 g小苏打样品中碳酸氢钠的质量。(写出计算过程,结果精确到0.1 g)
二
解:(2)设9 g小苏打样品中碳酸氢钠的质量为x。
NaHCO3+HCl NaCl+H2O+CO2↑
84 44
x 4.4 g
= x=8.4 g
则27 g小苏打样品中碳酸氢钠的质量为8.4 g×3=25.2 g。
答:27 g小苏打样品中碳酸氢钠的质量为25.2 g。
例4 [宿迁]某硫酸厂欲测定排放的废水中硫酸的质量分数(假设废水中只含硫酸一种溶质),取废水样品
200 g,逐滴加入溶质质量分数为5%的
氢氧化钠溶液,废水中硫酸的质量随加入
氢氧化钠溶液质量的变化关系如图T6-1所示。
(1)要配制100 g 5%的氢氧化钠溶液,需氢氧化钠固体质量为 g。
(2)计算该废水中硫酸的质量分数。(写出计算过程)
类型三
坐标曲线型 (8年3考)
图T6-1
5
(2)计算该废水中硫酸的质量分数。(写出计算过程)
(2)解:设该废水中硫酸的质量为x。
2NaOH + H2SO4 Na2SO4+2H2O
80 98
80 g×5% x
= x=4.9 g
废水中硫酸的质量分数为×100%=2.45%。
答:该废水中硫酸的质量分数为2.45%。
例5 [2022·宿迁]向一定量的H2SO4和CuSO4的混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,
生成沉淀的质量与加入NaOH溶液的
质量关系如图T6-2所示。
(1)当加入NaOH溶液质量为a g时,
溶液中含有的溶质为 。
(2)原混合溶液中,溶质H2SO4的质量。(写出计算过程,下同)
(3)恰好完全反应时,消耗NaOH溶液的总质量。
图T6-2
Na2SO4、NaOH
(2)原混合溶液中,溶质H2SO4的质量。(写出计算过程,下同)
解:(2)设原混合溶液中H2SO4的质量为x。
H2SO4+2NaOH Na2SO4+2H2O
98 80
x 40 g×10%
=
x=4.9 g
答:原混合溶液中,溶质H2SO4的质量为4.9 g
(3)恰好完全反应时,消耗NaOH溶液的总质量。
(3)设与CuSO4反应的NaOH的质量为y。
CuSO4+2NaOH Na2SO4+Cu(OH)2↓
80 98
y 9.8 g
=
y=8 g
氢氧化钠溶液的总质量为40 g+=120 g。
答:恰好完全反应时,消耗NaOH溶液的总质量为120 g。
例6 [宿迁]某补钙药剂的标签主要内容如图T6-3所示,现测定该钙片含量是否符合标注,做如下
实验:取10片该钙片,放入干燥、洁净
的烧杯中,再向烧杯中加入50 g
某浓度稀盐酸,恰好完全反应
(钙片中其他成分不溶于水,也不和
稀盐酸反应,反应中产生的气体全部
放出),反应后称量烧杯内剩余物质的质量为64.5 g。
类型四
标签型 (8年1考)
××儿童咀嚼片
(50片装)
[主要成分] 碳酸钙、维生素D
[功 效] 补钙
[规 格] 2 g/片
每片中含钙(以Ca计)≥0.6 g
[食用方法] 嚼食,每日1片
图T6-3
(1)反应中生成 g二氧化碳,此反应的基本反应类型为 。
(2)通过计算说明实际钙含量是否与标注相符。
(3)试计算所用稀盐酸的溶质质量分数。
5.5
复分解反应
(2)通过计算说明实际钙含量是否与标注相符。
解:(2)设10片钙片中碳酸钙的质量为x,消耗盐酸中HCl的质量为y。
CaCO3+2HCl CaCl2+H2O+CO2↑
100 73 44
x y 5.5 g
= x=12.5 g
= y=9.125 g
每片钙片中钙含量是=0.5 g,因为0.5 g<0.6 g,所以实际钙含量与标注不相符。
答:实际钙含量与标注不相符
(3)试计算所用稀盐酸的溶质质量分数。
(3)所用稀盐酸的溶质质量分数为×100%=18.25%。
答:所用稀盐酸的溶质质量分数为18.25%。
例7 [宿迁]牙膏中的摩擦剂可以增强牙膏对牙齿的摩擦作用和去污效果。已知某品牌牙膏中的摩擦剂是CaCO3和SiO2(SiO2不溶于水也不与稀盐酸反应)。为了测定摩擦剂中CaCO3的质量分数,通过实验测得如图T6-4所示数据:
类型五
实物图型 (8年1考)
图T6-4
(1)生成CO2的质量为 g。
2.2
(2)求摩擦剂中CaCO3的质量分数。
解:设摩擦剂中CaCO3的质量为x。
2HCl+CaCO3 CaCl2+H2O+CO2↑
100 44
x 2.2 g
= x=5 g
摩擦剂中CaCO3的质量分数为×100%=50%。
答:摩擦剂中CaCO3的质量分数为50%。
专题(六) 计算题
例1 [宿迁]在煤中加入适量的生石灰制成供居民采暖用的“环保煤”,以减少二氧化硫的排放,减弱二氧化硫对空气的污染。“环保煤”燃烧时生石灰吸收二氧化硫的化学方程式为2CaO+mSO2+O2 nCaSO4。请回答下列问题。
(1)m值是 。
(2)若煤厂一次共加入含氧化钙80%的生石灰70 t,则理论上最多可吸收二氧化硫多少吨
类型一
文字叙述型 (8年1考)
2
(2)若煤厂一次共加入含氧化钙80%的生石灰70 t,则理论上最多可吸收二氧化硫多少吨
(2)解:设理论上最多可吸收二氧化硫的质量为x。
含氧化钙80%的生石灰70 t中,氧化钙的质量为70 t×80%=56 t。
2CaO+2SO2+O2 2CaSO4
112 128
56 t x
= x=64 t
答:理论上最多可吸收二氧化硫64 t。
例2 [宿迁]黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10 g粉末状黄铜样品放入烧杯中,量取45 mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
类型二
表格数据型 (8年2考)
第一次 第二次 第三次
加入稀硫酸的体积/mL 15 15 15
生成氢气的质量/g m 0.04 0.02
试求:(1)m的数值为 。
(2)此黄铜样品中铜的质量分数是多少 (写出计算过程)
0.04
(2)解:锌完全反应后生成氢气的总质量为0.04 g+0.04 g+0.02 g=0.1 g。
设黄铜样品中锌的质量为x。
Zn+H2SO4 ZnSO4+H2↑
65 2
x 0.1 g
= x=3.25 g
此黄铜样品中铜的质量分数为×100%=67.5%。
答:此黄铜样品中铜的质量分数是67.5%。
例3 [宿迁]碳酸氢钠是小苏打的主要成分。在医疗上,它是治疗胃酸(主要成分是盐酸)过多的药剂之一,反应的化学方程式为NaHCO3+HCl NaCl+H2O+CO2↑,化学实验小组取27 g小苏打样品(含有少量不与HCl反应的杂质)进行测定实验。现将小苏打样品平均分为3份,分别进行3次实验。实验数据如下表。
实验次数 第一次 第二次 第三次
小苏打样品的质量/g 9 9 9
加入稀盐酸的质量/g 50 100 150
生成气体的质量/g 2.2 4.4 4.4
(1)第 次实验中NaHCO3和HCl恰好完全反应。
(2)计算27 g小苏打样品中碳酸氢钠的质量。(写出计算过程,结果精确到0.1 g)
二
解:(2)设9 g小苏打样品中碳酸氢钠的质量为x。
NaHCO3+HCl NaCl+H2O+CO2↑
84 44
x 4.4 g
= x=8.4 g
则27 g小苏打样品中碳酸氢钠的质量为8.4 g×3=25.2 g。
答:27 g小苏打样品中碳酸氢钠的质量为25.2 g。
例4 [宿迁]某硫酸厂欲测定排放的废水中硫酸的质量分数(假设废水中只含硫酸一种溶质),取废水样品
200 g,逐滴加入溶质质量分数为5%的
氢氧化钠溶液,废水中硫酸的质量随加入
氢氧化钠溶液质量的变化关系如图T6-1所示。
(1)要配制100 g 5%的氢氧化钠溶液,需氢氧化钠固体质量为 g。
(2)计算该废水中硫酸的质量分数。(写出计算过程)
类型三
坐标曲线型 (8年3考)
图T6-1
5
(2)计算该废水中硫酸的质量分数。(写出计算过程)
(2)解:设该废水中硫酸的质量为x。
2NaOH + H2SO4 Na2SO4+2H2O
80 98
80 g×5% x
= x=4.9 g
废水中硫酸的质量分数为×100%=2.45%。
答:该废水中硫酸的质量分数为2.45%。
例5 [2022·宿迁]向一定量的H2SO4和CuSO4的混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,
生成沉淀的质量与加入NaOH溶液的
质量关系如图T6-2所示。
(1)当加入NaOH溶液质量为a g时,
溶液中含有的溶质为 。
(2)原混合溶液中,溶质H2SO4的质量。(写出计算过程,下同)
(3)恰好完全反应时,消耗NaOH溶液的总质量。
图T6-2
Na2SO4、NaOH
(2)原混合溶液中,溶质H2SO4的质量。(写出计算过程,下同)
解:(2)设原混合溶液中H2SO4的质量为x。
H2SO4+2NaOH Na2SO4+2H2O
98 80
x 40 g×10%
=
x=4.9 g
答:原混合溶液中,溶质H2SO4的质量为4.9 g
(3)恰好完全反应时,消耗NaOH溶液的总质量。
(3)设与CuSO4反应的NaOH的质量为y。
CuSO4+2NaOH Na2SO4+Cu(OH)2↓
80 98
y 9.8 g
=
y=8 g
氢氧化钠溶液的总质量为40 g+=120 g。
答:恰好完全反应时,消耗NaOH溶液的总质量为120 g。
例6 [宿迁]某补钙药剂的标签主要内容如图T6-3所示,现测定该钙片含量是否符合标注,做如下
实验:取10片该钙片,放入干燥、洁净
的烧杯中,再向烧杯中加入50 g
某浓度稀盐酸,恰好完全反应
(钙片中其他成分不溶于水,也不和
稀盐酸反应,反应中产生的气体全部
放出),反应后称量烧杯内剩余物质的质量为64.5 g。
类型四
标签型 (8年1考)
××儿童咀嚼片
(50片装)
[主要成分] 碳酸钙、维生素D
[功 效] 补钙
[规 格] 2 g/片
每片中含钙(以Ca计)≥0.6 g
[食用方法] 嚼食,每日1片
图T6-3
(1)反应中生成 g二氧化碳,此反应的基本反应类型为 。
(2)通过计算说明实际钙含量是否与标注相符。
(3)试计算所用稀盐酸的溶质质量分数。
5.5
复分解反应
(2)通过计算说明实际钙含量是否与标注相符。
解:(2)设10片钙片中碳酸钙的质量为x,消耗盐酸中HCl的质量为y。
CaCO3+2HCl CaCl2+H2O+CO2↑
100 73 44
x y 5.5 g
= x=12.5 g
= y=9.125 g
每片钙片中钙含量是=0.5 g,因为0.5 g<0.6 g,所以实际钙含量与标注不相符。
答:实际钙含量与标注不相符
(3)试计算所用稀盐酸的溶质质量分数。
(3)所用稀盐酸的溶质质量分数为×100%=18.25%。
答:所用稀盐酸的溶质质量分数为18.25%。
例7 [宿迁]牙膏中的摩擦剂可以增强牙膏对牙齿的摩擦作用和去污效果。已知某品牌牙膏中的摩擦剂是CaCO3和SiO2(SiO2不溶于水也不与稀盐酸反应)。为了测定摩擦剂中CaCO3的质量分数,通过实验测得如图T6-4所示数据:
类型五
实物图型 (8年1考)
图T6-4
(1)生成CO2的质量为 g。
2.2
(2)求摩擦剂中CaCO3的质量分数。
解:设摩擦剂中CaCO3的质量为x。
2HCl+CaCO3 CaCl2+H2O+CO2↑
100 44
x 2.2 g
= x=5 g
摩擦剂中CaCO3的质量分数为×100%=50%。
答:摩擦剂中CaCO3的质量分数为50%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
