2023年中考化学一轮复习课件 第05单元 定量研究化学反应(鲁教版)(共50张PPT)
文档属性
| 名称 | 2023年中考化学一轮复习课件 第05单元 定量研究化学反应(鲁教版)(共50张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-29 12:23:42 | ||
图片预览








文档简介
(共50张PPT)
第五单元 定量研究化学反应
第五单元 定量研究化学反应
知识体系
质量
质量
化学变化
数目
元素
分子种类
分子数目
化学式
化学反应
客观事实
质量守恒定律
1.参加化学反应的各物质的质量总和,一定等于反应后生成的各物质的质量总和 ( )
2.在化学反应前后,物质的总体积一定保持不变( )
3.在化学反应前后,分子的种类、数目一定发生改变( )
4.根据质量守恒定律可以推断化学方程式中某一反应物或生成物的化学式、化学计量数 ( )
易错判断
√
×
×
√
5.化学反应前后:参加反应的反应物的总质量等于生成物总质量,元素种类不变,元素质量不变;原子种类不变,原子数目不变,原子质量不变( )
6.为了使反应前后各原子总数相等,可以改动化学式中元素符号右下角的数字 ( )
7.化学反应前后元素的化合价一定发生改变 ( )
8.6 g碳与6 g氧气充分反应,生成12 g二氧化碳 ( )
√
×
×
×
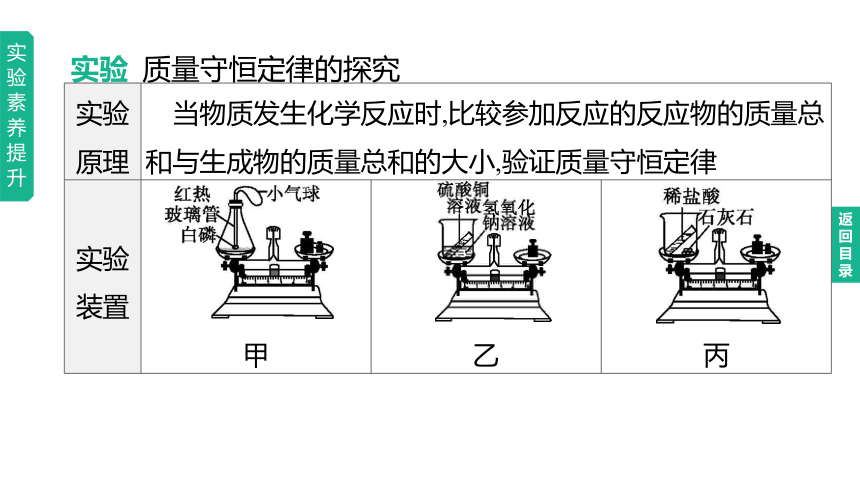
实验 质量守恒定律的探究
实验原理 当物质发生化学反应时,比较参加反应的反应物的质量总和与生成物的质量总和的大小,验证质量守恒定律 实验装置 甲 乙
丙
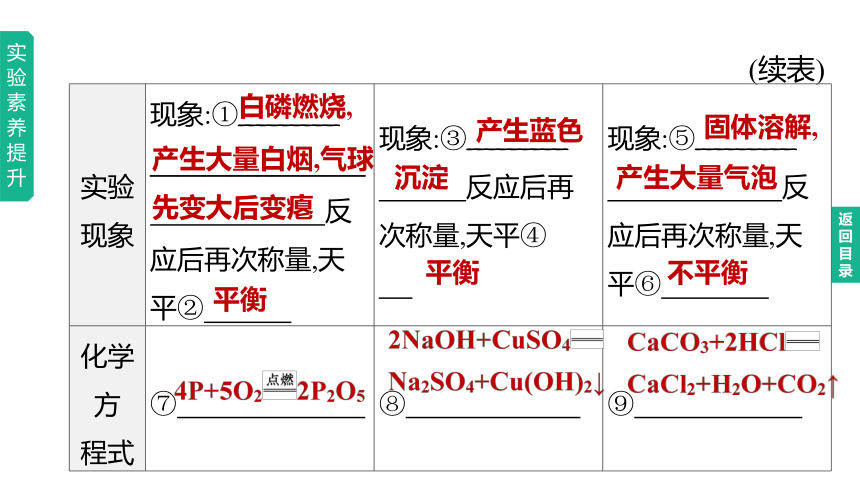
(续表)
实验现象 现象:①_________ ________________ 反应后再次称量,天平② 现象:③_________ 反应后再次称量,天平④ 现象:⑤_________
反应后再次称量,天平⑥
化学方 程式 ⑦ ⑧ ⑨
白磷燃烧,
产生大量白烟,气球
先变大后变瘪
平衡
产生蓝色
沉淀
平衡
固体溶解,
产生大量气泡
不平衡
(续表)
实验分析 容器密闭,没有物质进入或散失 反应无气体参加,无气体生成,没有物质进入烧杯或从烧杯中散失 反应后,质量减小的原因:⑩
_______________________________
启发:验证质量守恒定律时,有气体参加或生成的化学反应,必须在密闭装置中进行
反应生成的CO2逸散到空气中
(续表)
注意事项 实验甲 (1)小气球的作用:缓冲作用, ;密闭作用,防止
(2)锥形瓶底铺一层细沙的作用:防止白磷燃烧使锥形瓶炸裂
(3)需冷却至室温再称量的原因:气球胀大时,所受浮力会对称量结果造成影响
(4)实验结束指针偏右的原因:装置气密性不好,使白烟逸散到了空气中,所以实验前要
防止压强过大冲开橡皮塞
与外界发生物质交换
检查装置的气密性
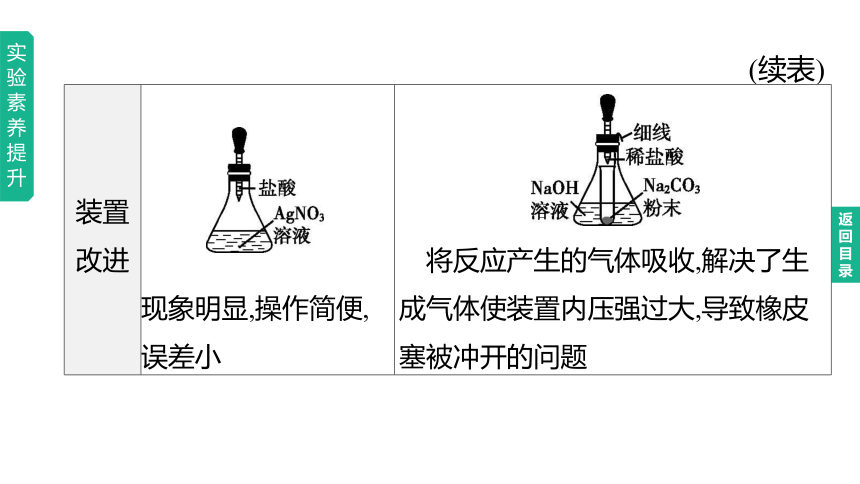
(续表)
注意事项 实验丙 (5)若想用此实验验证质量守恒定律,应在密闭装置中进行
(6)质量守恒定律只适用于 ,验证质量守恒定律只能选择化学反应 实验结论 参加化学反应的各物质的质量总和, 反应后生成的各物质的质量总和 化学变化
等于
(续表)
装置改进 现象明显,操作简便,误差小
将反应产生的气体吸收,解决了生成气体使装置内压强过大,导致橡皮塞被冲开的问题
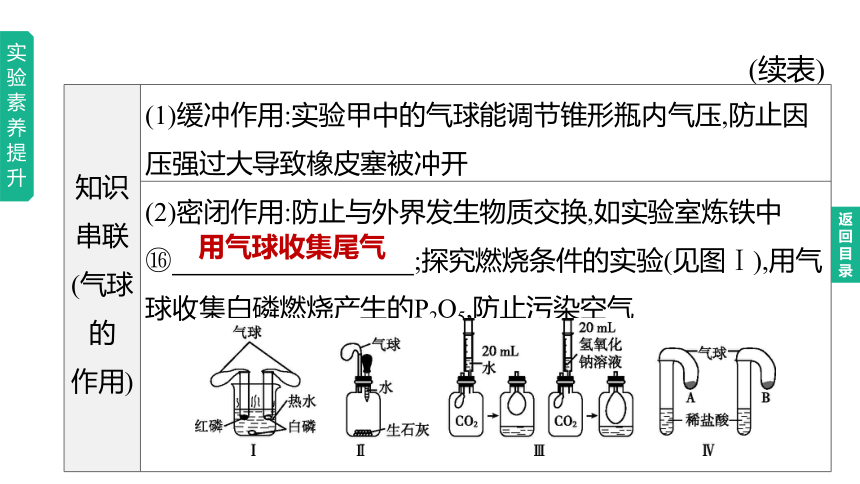
(续表)
知识串联 (气球的 作用) (1)缓冲作用:实验甲中的气球能调节锥形瓶内气压,防止因压强过大导致橡皮塞被冲开
(2)密闭作用:防止与外界发生物质交换,如实验室炼铁中
;探究燃烧条件的实验(见图Ⅰ),用气球收集白磷燃烧产生的P2O5,防止污染空气
用气球收集尾气
(续表)
知识串联 (气球的 作用) (3)体现压强变化:温度升降(见图Ⅱ)和气体增减(见图Ⅲ),均会引起装置中压强的改变,从而导致气球的胀大或缩小,如图Ⅲ实验中气球鼓起的程度不同可证明氢氧化钠与CO2发生了反应
(续表)
知识串联 (气球的 作用) (4)体现反应速率的快慢(见图Ⅳ):比较金属活动性,如在试管中装等体积、等浓度的稀盐酸,系上装有等质量金属粉末的气球,气球胀大得快的是活动性强的金属
1.为验证质量守恒定律,甲、乙、丙三位同学分别做了如图5-1所示三组实验,请回答下列问题。
(1)甲同学实验时,两种溶液混合后,
小烧杯内观察到的现象是
。
|基础训练|
图5-1
产生蓝色沉淀
(2)乙同学实验后,观察到天平不平衡,原因是_______________
。
(3)由上述乙、丙同学的实验可知,
对于有气体生成或参加的反应,在
进行验证质量守恒定律的实验时,
对反应装置的要求是
。
反应生成的二氧
化碳逸出装置
装置密闭
2.早在300多年前,波义耳和拉瓦锡两位化学家先后对化学反应进行了定量研究,并提出了他们不同的观点。
(1)从“化学反应的定量关
系”分析,你认为谁的观点
更具科学性 。
|变形拓展|
图5-2
拉瓦锡
(2)有人设计如图5-3所示的实验来验证质量守恒定律。随着蜡烛的燃烧,发现天平指针逐渐向右偏。你认为该实验设计是否合理 若不合理,应如何改进
。
图5-3
不合理,实验应该改为在密闭装置中进行
(3)有同学建议,波义耳可以采用如图5-4所示的实验装置来验证质量守恒定律,你认为不可行的是 (填序号)。
图5-4
A
(详见实验素养提升)
考向一
质量守恒定律的探究 (8年1考,1分)
1.[2022·扬州]FeCl3溶液用于制作印刷电路板,反应为2FeCl3+
Cu CuCl2+2X。X的化学式是 ( )
A.Fe B.FeCl2
C.Fe(OH)2 D.Fe(OH)3
考向二
质量守恒定律的应用 (必考,2分)
B
2.[2022·黄冈]为了缓解碳排放引起的温室效应,我国科学家成功合成新型催化剂,将二氧化碳转化为甲醇,该过程的微观示意图如图5-5所示。下列说法正确的是 ( )
A.丙中氢、氧两种元素的质量比为4∶1
B.甲、丙、丁均为氧化物
C.参加反应的甲和乙分子个
数比为1∶1
D.生成丙和丁的质量比为16∶9
图5-5
D
3.[2022·连云港]NH3的合成开启了工业催化新纪元,为世界粮食增产作出了巨大贡献。以N2和H2为反应物合成NH3的微观过程如下:
下列说法正确的是 ( )
A. 表示氢气分子
B.过程中有“NH”“NH2”原子团生成
C.参加反应的H2与生成的NH3分子个数比为2∶3
D.反应结束后催化剂的质量增加
图5-6
B
4.[2022·随州]化学学习常用化学思维去认识和理解世界,下列说法错误的个数有 ( )
(1)反应中甲和丙的质量比为1∶8 (2)x=4
(3)该反应为化合反应 (4)乙可能是催化剂
(5)若甲与丁的化学计量数之比为2∶3;则其相对分子质量之比为3∶16
A.1个 B.2个 C.3个 D.4个
物质 甲 乙 丙 丁
反应前质量/g 10 5 12 20
反应后质量/g 8 5 30 x
A
5.[2022·天津]将16 g纯净物R在足量氧气中完全燃烧,生成44 g二氧化碳和36 g水。下列判断正确的是 ( )
A.R只含碳、氢元素
B.消耗氧气32 g
C.R含碳、氢、氧三种元素
D.R中碳元素的质量分数为70%
A
6.[2022·梧州]一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图5-7所示,图中x、y分别表示乙和丙的质量。下列说法错误的是 ( )
A.反应后甲的质量分数是8%
B.x的取值范围:0≤x≤40
C.y≤30时,生成物只有一种
D.参加反应的甲与丁的质量比为2∶1
图5-7
B
7.[2022·苏州]下列指定反应的化学方程式正确的是( )
A.磷在氧气中燃烧:P+O2 P2O5
B.铜丝插入硝酸银溶液中:Cu+AgNO3 CuNO3+Ag
C.高锰酸钾受热分解:2KMnO4 K2MnO4+O2↑
D.绿色植物的光合作用:6CO2+6H2O C6H12O6+6O2
考向三
化学方程式的书写及反应类型 (必考,2分)
D
A
9.[2022·荆州]我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。实现“碳中和”通常可采取如下措施:
(1)碳减排:使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为2B+6X
2B(OH)3+3H2↑,则X的化学式为 ,B(OH)3中B的化合价为 。
H2O
+3
(2)碳“捕捉”与封存:碳“捕捉”可用氢氧化钠溶液吸收空气中的二氧化碳,该反应的化学方程式为
。
(3)碳转化:一定条件下,可将二氧化碳在催化剂表面转化成某种有机清洁燃料,其反应原理如图5-8所示,该反应的化学方程式为 。
图5-8
角度1 文字叙述型计算题(8年1考,5分)
10.[2022·天津]现有一定质量的碳酸钠和氯化钠的固体混合物,其中含氯元素7.1 g。向该混合物中加入138.1 g一定溶质质量分数的稀盐酸,恰好完全反应,得到氯化钠溶液并生成4.4 g气体。计算:
(1)原固体混合物中氯化钠的质量。
(2)反应后所得溶液中溶质的质量分数。
考向四
化学方程式的计算
(1)原固体混合物中氯化钠的质量。
解:(1)原固体混合物中氯化钠的质量为=11.7 g。
答:(1)原固体混合物中氯化钠的质量为11.7 g;
(2)反应后所得溶液中溶质的质量分数。
(2)设参加反应的碳酸钠质量为x,生成的氯化钠质量为y。
Na2CO3+2HCl 2NaCl+H2O+CO2↑
106 117 44
x y 4.4 g
= x=10.6 g
= y=11.7 g
反应后所得溶液中溶质的质量分数为×100%=15%。
答:(2)反应后所得溶液中溶质的质量分数为15%。
角度2 表格数据型计算题(8年2考,5分)
11.[2022·菏泽]孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],另外还含有少量的SO2等杂质(杂质不与硫酸发生反应)。某化学兴趣小组为测定孔雀石中Cu2(OH)2CO3的含量进行如下实验:取30 g孔雀石样品,粉碎后放入烧杯中,将200 g稀硫酸分成四等份,分四次加入烧杯中,测出每次完全反应后烧杯内物质的总质量,实验数据记录如下:
次数 加稀硫酸前 1 2 3 4
加入稀硫 酸的质量/g 0 50 50 50 50
烧杯内物质 的总质量/g 30 77.8 125.6 174.5 224.5
请完成:
(1)Cu2(OH)2CO3+2H2SO4 2CuSO4+CO2↑+ 。
(2)该反应中生成气体的总质量是 。
3H2O
5.5 g
(3)所用稀硫酸的溶质质量分数。(写出计算过程)
解:第1次加入50 g稀硫酸后生成CO2的质量为30 g+50 g-77.8 g
=2.2 g。
设50 g稀硫酸中溶质的质量为x。
Cu2(OH)2CO3+2H2SO4 2CuSO4+CO2↑+3H2O
196 44
x 2.2 g
= x=9.8 g
所用稀硫酸的溶质质量分数为×100%=19.6%。
答:所用稀硫酸的溶质质量分数为19.6%。
角度3 坐标曲线型计算题(8年3考,4~6分)
12.[2022·眉山]常温下,一锥形瓶中盛有10 g溶质质量分数为4%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加一定溶质质量分数的稀盐酸,用pH传感器测得溶液pH与加入稀盐酸的关系曲线如图5-9所示。请回答下列
问题。
(1)图中B点溶液呈 色。
(2)计算稀盐酸中溶质质量分数。(写出计算过程)
图5-9
无
(2)计算稀盐酸中溶质质量分数。(写出计算过程)
解:设10 g稀盐酸中溶质的质量为x。
HCl + NaOH NaCl+H2O
36.5 40
x 10 g×4%
= x=0.365 g
稀盐酸中溶质质量分数为×100%=3.65%。
答:稀盐酸中溶质质量分数为3.65%。
角度4 实验图示型计算题(8年1考,4分)
13.[2022·陕西]学习小组的同学通过下面实验测定一瓶失去标签的稀硫酸中溶质的质量分数。
请完成下列分析与计算。
(1)反应中用去稀硫酸的质量为 g。
(2)计算稀硫酸中溶质的质量分数。
图5-10
20
(2)计算稀硫酸中溶质的质量分数。
解:设参加反应的H2SO4的质量为x。
H2SO4+2NaOH Na2SO4+2H2O
98 80
x 20 g×20%
= x=4.9 g
稀硫酸中溶质的质量分数为×100%=24.5%。
答:稀硫酸中溶质的质量分数为24.5%。
角度5 标签型计算题(8年1考,5分)
14.图5-11所示为某琥珀酸亚铁口服片的说明书。请计算:
(1)琥珀酸亚铁中氢元素与铁元素的
质量比为 (填最简整数比)。
(2)按治疗用量服用,成人每天最多补充
铁元素的质量为__________________
(只列出计算式即可,不要求计算结果)。
名称:琥珀酸亚铁口服片
主要成分的化学式:C4H4FeO4
主要成分的相对分子质量:172
含量:每片含琥珀酸亚铁0.1 g
适应症:用于治疗缺铁性贫血
治疗用量:成人一日2~4片
儿童一日1~3片
图5-11
1∶14
0.1 g×4××100%
1.[2016·宿迁]判断正误:化学反应前后分子的总数可能会发生变化 ( )
√
2.[2022·宿迁]科学家发现,利用催化剂可有效消除室内装修材料释放的甲醛,其反应微观示意图如图5-12所示。下列说法正确的是 ( )
A.该反应中两种生成物的
分子个数比为1∶1
B.该反应属于置换反应
C.该反应前后元素的化合价都没有发生变化
D.甲醛中碳、氢、氧三种元素质量比为1∶2∶1
图5-12
A
3.[2015·宿迁]将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法正确的是 ( )
A.a和b是反应物
B.x=2.0
C.该反应是分解反应
D.d可能是催化剂
物质 a b c d
反应前的质量/g 6.4 4.0 3.2 2.8
反应后的质量/g 5.2 7.2 x 2.8
D
4.[宿迁]图5-13是氢气和氧气反应的微观示意图,请回答相关问题。
(1)将A图中缺少的微粒示意图补画出来: 。
(2)该反应的化学方程式为 ,其基本反应类型为 。
(3)参加反应的氢气和氧气的质量之
比为 。
图5-13
化合反应
1∶8
5.[2015·宿迁]如图5-14 A是某金属元素形成微粒的结构示意图,该金属在空气中燃烧时放出大量的热并发出耀眼的白光,图B是该反应的微观示意图,请根据以上信息回答下列问题。
(1)该金属元素原子核外电子数= ,图A所示微粒的符号为 ;写出一种与图A所示具有相同电子层结构的阴离子的符号 。
图5-14
12
Mg2+
O2-
5.[2015·宿迁]如图5-14 A是某金属元素形成微粒的结构示意图,该金属在空气中燃烧时放出大量的热并发出耀眼的白光,图B是该反应的微观示意图,请根据以上信息回答下列问题。
(2)写出图B所示的化学方程式: 。
图5-14
6.[2017·宿迁节选]联系学过的化学知识,回答下列问题。
碳酸氢钠(NaHCO3)可用作干粉灭火剂,灭火时,碳酸氢钠粉末受热生成碳酸钠和两种常见的氧化物,请写出该反应的化学方程式: ,其基本反应类型为 。
分解反应
第五单元 定量研究化学反应
第五单元 定量研究化学反应
知识体系
质量
质量
化学变化
数目
元素
分子种类
分子数目
化学式
化学反应
客观事实
质量守恒定律
1.参加化学反应的各物质的质量总和,一定等于反应后生成的各物质的质量总和 ( )
2.在化学反应前后,物质的总体积一定保持不变( )
3.在化学反应前后,分子的种类、数目一定发生改变( )
4.根据质量守恒定律可以推断化学方程式中某一反应物或生成物的化学式、化学计量数 ( )
易错判断
√
×
×
√
5.化学反应前后:参加反应的反应物的总质量等于生成物总质量,元素种类不变,元素质量不变;原子种类不变,原子数目不变,原子质量不变( )
6.为了使反应前后各原子总数相等,可以改动化学式中元素符号右下角的数字 ( )
7.化学反应前后元素的化合价一定发生改变 ( )
8.6 g碳与6 g氧气充分反应,生成12 g二氧化碳 ( )
√
×
×
×
实验 质量守恒定律的探究
实验原理 当物质发生化学反应时,比较参加反应的反应物的质量总和与生成物的质量总和的大小,验证质量守恒定律 实验装置 甲 乙
丙
(续表)
实验现象 现象:①_________ ________________ 反应后再次称量,天平② 现象:③_________ 反应后再次称量,天平④ 现象:⑤_________
反应后再次称量,天平⑥
化学方 程式 ⑦ ⑧ ⑨
白磷燃烧,
产生大量白烟,气球
先变大后变瘪
平衡
产生蓝色
沉淀
平衡
固体溶解,
产生大量气泡
不平衡
(续表)
实验分析 容器密闭,没有物质进入或散失 反应无气体参加,无气体生成,没有物质进入烧杯或从烧杯中散失 反应后,质量减小的原因:⑩
_______________________________
启发:验证质量守恒定律时,有气体参加或生成的化学反应,必须在密闭装置中进行
反应生成的CO2逸散到空气中
(续表)
注意事项 实验甲 (1)小气球的作用:缓冲作用, ;密闭作用,防止
(2)锥形瓶底铺一层细沙的作用:防止白磷燃烧使锥形瓶炸裂
(3)需冷却至室温再称量的原因:气球胀大时,所受浮力会对称量结果造成影响
(4)实验结束指针偏右的原因:装置气密性不好,使白烟逸散到了空气中,所以实验前要
防止压强过大冲开橡皮塞
与外界发生物质交换
检查装置的气密性
(续表)
注意事项 实验丙 (5)若想用此实验验证质量守恒定律,应在密闭装置中进行
(6)质量守恒定律只适用于 ,验证质量守恒定律只能选择化学反应 实验结论 参加化学反应的各物质的质量总和, 反应后生成的各物质的质量总和 化学变化
等于
(续表)
装置改进 现象明显,操作简便,误差小
将反应产生的气体吸收,解决了生成气体使装置内压强过大,导致橡皮塞被冲开的问题
(续表)
知识串联 (气球的 作用) (1)缓冲作用:实验甲中的气球能调节锥形瓶内气压,防止因压强过大导致橡皮塞被冲开
(2)密闭作用:防止与外界发生物质交换,如实验室炼铁中
;探究燃烧条件的实验(见图Ⅰ),用气球收集白磷燃烧产生的P2O5,防止污染空气
用气球收集尾气
(续表)
知识串联 (气球的 作用) (3)体现压强变化:温度升降(见图Ⅱ)和气体增减(见图Ⅲ),均会引起装置中压强的改变,从而导致气球的胀大或缩小,如图Ⅲ实验中气球鼓起的程度不同可证明氢氧化钠与CO2发生了反应
(续表)
知识串联 (气球的 作用) (4)体现反应速率的快慢(见图Ⅳ):比较金属活动性,如在试管中装等体积、等浓度的稀盐酸,系上装有等质量金属粉末的气球,气球胀大得快的是活动性强的金属
1.为验证质量守恒定律,甲、乙、丙三位同学分别做了如图5-1所示三组实验,请回答下列问题。
(1)甲同学实验时,两种溶液混合后,
小烧杯内观察到的现象是
。
|基础训练|
图5-1
产生蓝色沉淀
(2)乙同学实验后,观察到天平不平衡,原因是_______________
。
(3)由上述乙、丙同学的实验可知,
对于有气体生成或参加的反应,在
进行验证质量守恒定律的实验时,
对反应装置的要求是
。
反应生成的二氧
化碳逸出装置
装置密闭
2.早在300多年前,波义耳和拉瓦锡两位化学家先后对化学反应进行了定量研究,并提出了他们不同的观点。
(1)从“化学反应的定量关
系”分析,你认为谁的观点
更具科学性 。
|变形拓展|
图5-2
拉瓦锡
(2)有人设计如图5-3所示的实验来验证质量守恒定律。随着蜡烛的燃烧,发现天平指针逐渐向右偏。你认为该实验设计是否合理 若不合理,应如何改进
。
图5-3
不合理,实验应该改为在密闭装置中进行
(3)有同学建议,波义耳可以采用如图5-4所示的实验装置来验证质量守恒定律,你认为不可行的是 (填序号)。
图5-4
A
(详见实验素养提升)
考向一
质量守恒定律的探究 (8年1考,1分)
1.[2022·扬州]FeCl3溶液用于制作印刷电路板,反应为2FeCl3+
Cu CuCl2+2X。X的化学式是 ( )
A.Fe B.FeCl2
C.Fe(OH)2 D.Fe(OH)3
考向二
质量守恒定律的应用 (必考,2分)
B
2.[2022·黄冈]为了缓解碳排放引起的温室效应,我国科学家成功合成新型催化剂,将二氧化碳转化为甲醇,该过程的微观示意图如图5-5所示。下列说法正确的是 ( )
A.丙中氢、氧两种元素的质量比为4∶1
B.甲、丙、丁均为氧化物
C.参加反应的甲和乙分子个
数比为1∶1
D.生成丙和丁的质量比为16∶9
图5-5
D
3.[2022·连云港]NH3的合成开启了工业催化新纪元,为世界粮食增产作出了巨大贡献。以N2和H2为反应物合成NH3的微观过程如下:
下列说法正确的是 ( )
A. 表示氢气分子
B.过程中有“NH”“NH2”原子团生成
C.参加反应的H2与生成的NH3分子个数比为2∶3
D.反应结束后催化剂的质量增加
图5-6
B
4.[2022·随州]化学学习常用化学思维去认识和理解世界,下列说法错误的个数有 ( )
(1)反应中甲和丙的质量比为1∶8 (2)x=4
(3)该反应为化合反应 (4)乙可能是催化剂
(5)若甲与丁的化学计量数之比为2∶3;则其相对分子质量之比为3∶16
A.1个 B.2个 C.3个 D.4个
物质 甲 乙 丙 丁
反应前质量/g 10 5 12 20
反应后质量/g 8 5 30 x
A
5.[2022·天津]将16 g纯净物R在足量氧气中完全燃烧,生成44 g二氧化碳和36 g水。下列判断正确的是 ( )
A.R只含碳、氢元素
B.消耗氧气32 g
C.R含碳、氢、氧三种元素
D.R中碳元素的质量分数为70%
A
6.[2022·梧州]一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图5-7所示,图中x、y分别表示乙和丙的质量。下列说法错误的是 ( )
A.反应后甲的质量分数是8%
B.x的取值范围:0≤x≤40
C.y≤30时,生成物只有一种
D.参加反应的甲与丁的质量比为2∶1
图5-7
B
7.[2022·苏州]下列指定反应的化学方程式正确的是( )
A.磷在氧气中燃烧:P+O2 P2O5
B.铜丝插入硝酸银溶液中:Cu+AgNO3 CuNO3+Ag
C.高锰酸钾受热分解:2KMnO4 K2MnO4+O2↑
D.绿色植物的光合作用:6CO2+6H2O C6H12O6+6O2
考向三
化学方程式的书写及反应类型 (必考,2分)
D
A
9.[2022·荆州]我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。实现“碳中和”通常可采取如下措施:
(1)碳减排:使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为2B+6X
2B(OH)3+3H2↑,则X的化学式为 ,B(OH)3中B的化合价为 。
H2O
+3
(2)碳“捕捉”与封存:碳“捕捉”可用氢氧化钠溶液吸收空气中的二氧化碳,该反应的化学方程式为
。
(3)碳转化:一定条件下,可将二氧化碳在催化剂表面转化成某种有机清洁燃料,其反应原理如图5-8所示,该反应的化学方程式为 。
图5-8
角度1 文字叙述型计算题(8年1考,5分)
10.[2022·天津]现有一定质量的碳酸钠和氯化钠的固体混合物,其中含氯元素7.1 g。向该混合物中加入138.1 g一定溶质质量分数的稀盐酸,恰好完全反应,得到氯化钠溶液并生成4.4 g气体。计算:
(1)原固体混合物中氯化钠的质量。
(2)反应后所得溶液中溶质的质量分数。
考向四
化学方程式的计算
(1)原固体混合物中氯化钠的质量。
解:(1)原固体混合物中氯化钠的质量为=11.7 g。
答:(1)原固体混合物中氯化钠的质量为11.7 g;
(2)反应后所得溶液中溶质的质量分数。
(2)设参加反应的碳酸钠质量为x,生成的氯化钠质量为y。
Na2CO3+2HCl 2NaCl+H2O+CO2↑
106 117 44
x y 4.4 g
= x=10.6 g
= y=11.7 g
反应后所得溶液中溶质的质量分数为×100%=15%。
答:(2)反应后所得溶液中溶质的质量分数为15%。
角度2 表格数据型计算题(8年2考,5分)
11.[2022·菏泽]孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],另外还含有少量的SO2等杂质(杂质不与硫酸发生反应)。某化学兴趣小组为测定孔雀石中Cu2(OH)2CO3的含量进行如下实验:取30 g孔雀石样品,粉碎后放入烧杯中,将200 g稀硫酸分成四等份,分四次加入烧杯中,测出每次完全反应后烧杯内物质的总质量,实验数据记录如下:
次数 加稀硫酸前 1 2 3 4
加入稀硫 酸的质量/g 0 50 50 50 50
烧杯内物质 的总质量/g 30 77.8 125.6 174.5 224.5
请完成:
(1)Cu2(OH)2CO3+2H2SO4 2CuSO4+CO2↑+ 。
(2)该反应中生成气体的总质量是 。
3H2O
5.5 g
(3)所用稀硫酸的溶质质量分数。(写出计算过程)
解:第1次加入50 g稀硫酸后生成CO2的质量为30 g+50 g-77.8 g
=2.2 g。
设50 g稀硫酸中溶质的质量为x。
Cu2(OH)2CO3+2H2SO4 2CuSO4+CO2↑+3H2O
196 44
x 2.2 g
= x=9.8 g
所用稀硫酸的溶质质量分数为×100%=19.6%。
答:所用稀硫酸的溶质质量分数为19.6%。
角度3 坐标曲线型计算题(8年3考,4~6分)
12.[2022·眉山]常温下,一锥形瓶中盛有10 g溶质质量分数为4%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加一定溶质质量分数的稀盐酸,用pH传感器测得溶液pH与加入稀盐酸的关系曲线如图5-9所示。请回答下列
问题。
(1)图中B点溶液呈 色。
(2)计算稀盐酸中溶质质量分数。(写出计算过程)
图5-9
无
(2)计算稀盐酸中溶质质量分数。(写出计算过程)
解:设10 g稀盐酸中溶质的质量为x。
HCl + NaOH NaCl+H2O
36.5 40
x 10 g×4%
= x=0.365 g
稀盐酸中溶质质量分数为×100%=3.65%。
答:稀盐酸中溶质质量分数为3.65%。
角度4 实验图示型计算题(8年1考,4分)
13.[2022·陕西]学习小组的同学通过下面实验测定一瓶失去标签的稀硫酸中溶质的质量分数。
请完成下列分析与计算。
(1)反应中用去稀硫酸的质量为 g。
(2)计算稀硫酸中溶质的质量分数。
图5-10
20
(2)计算稀硫酸中溶质的质量分数。
解:设参加反应的H2SO4的质量为x。
H2SO4+2NaOH Na2SO4+2H2O
98 80
x 20 g×20%
= x=4.9 g
稀硫酸中溶质的质量分数为×100%=24.5%。
答:稀硫酸中溶质的质量分数为24.5%。
角度5 标签型计算题(8年1考,5分)
14.图5-11所示为某琥珀酸亚铁口服片的说明书。请计算:
(1)琥珀酸亚铁中氢元素与铁元素的
质量比为 (填最简整数比)。
(2)按治疗用量服用,成人每天最多补充
铁元素的质量为__________________
(只列出计算式即可,不要求计算结果)。
名称:琥珀酸亚铁口服片
主要成分的化学式:C4H4FeO4
主要成分的相对分子质量:172
含量:每片含琥珀酸亚铁0.1 g
适应症:用于治疗缺铁性贫血
治疗用量:成人一日2~4片
儿童一日1~3片
图5-11
1∶14
0.1 g×4××100%
1.[2016·宿迁]判断正误:化学反应前后分子的总数可能会发生变化 ( )
√
2.[2022·宿迁]科学家发现,利用催化剂可有效消除室内装修材料释放的甲醛,其反应微观示意图如图5-12所示。下列说法正确的是 ( )
A.该反应中两种生成物的
分子个数比为1∶1
B.该反应属于置换反应
C.该反应前后元素的化合价都没有发生变化
D.甲醛中碳、氢、氧三种元素质量比为1∶2∶1
图5-12
A
3.[2015·宿迁]将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法正确的是 ( )
A.a和b是反应物
B.x=2.0
C.该反应是分解反应
D.d可能是催化剂
物质 a b c d
反应前的质量/g 6.4 4.0 3.2 2.8
反应后的质量/g 5.2 7.2 x 2.8
D
4.[宿迁]图5-13是氢气和氧气反应的微观示意图,请回答相关问题。
(1)将A图中缺少的微粒示意图补画出来: 。
(2)该反应的化学方程式为 ,其基本反应类型为 。
(3)参加反应的氢气和氧气的质量之
比为 。
图5-13
化合反应
1∶8
5.[2015·宿迁]如图5-14 A是某金属元素形成微粒的结构示意图,该金属在空气中燃烧时放出大量的热并发出耀眼的白光,图B是该反应的微观示意图,请根据以上信息回答下列问题。
(1)该金属元素原子核外电子数= ,图A所示微粒的符号为 ;写出一种与图A所示具有相同电子层结构的阴离子的符号 。
图5-14
12
Mg2+
O2-
5.[2015·宿迁]如图5-14 A是某金属元素形成微粒的结构示意图,该金属在空气中燃烧时放出大量的热并发出耀眼的白光,图B是该反应的微观示意图,请根据以上信息回答下列问题。
(2)写出图B所示的化学方程式: 。
图5-14
6.[2017·宿迁节选]联系学过的化学知识,回答下列问题。
碳酸氢钠(NaHCO3)可用作干粉灭火剂,灭火时,碳酸氢钠粉末受热生成碳酸钠和两种常见的氧化物,请写出该反应的化学方程式: ,其基本反应类型为 。
分解反应
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
