化学人教九下9.3溶液的浓度 同步提分练(含答案)
文档属性
| 名称 | 化学人教九下9.3溶液的浓度 同步提分练(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 459.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-29 00:00:00 | ||
图片预览




文档简介
9.3溶液的浓度
一、选择题(共15题)
时, 的溶解度为 。 时,将 固体加入盛有 水的烧杯中,充分溶解得到溶液。下列说法正确的是
A.得到的是饱和溶液
B.溶液的质量是
C.溶液中溶质质量分数的计算式为
D.若再向烧杯中加入一定量的水,此时溶液中溶质的质量分数一定减小
时,在三个各盛有 水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各 ,充分溶解后,情况如下表所示,有关说法不正确的是
A. 时,甲的溶解度最小
B.三溶液中溶质质量分数乙 丙 甲
C.所得溶液可能都是饱和溶液
D.升高温度,三溶液中溶质质量分数一定都会改变
甲和乙两种固态物质的饱和溶液中溶质质量分数()与温度()的关系如图所示。下列叙述错误的是
A. 时,甲和乙两种物质的溶解度相等
B. 时,甲和乙两种物质溶液的溶质质量分数相等
C. 乙物质完全溶于 水中所需的最低温度是
D. 时,若甲和乙两种物质的饱和溶液中析出等质量的固体,需要蒸发掉较多水的是乙物质的饱和溶液
将溶质质量分数为 的某溶液 分别做如下处理:①蒸发掉 水且无晶体析出;②加入 同样的溶液;③加入 同种溶质,使之全部溶解;④加入 水,搅拌使其混合均匀。经四种方法处理过的溶液中,溶质质量分数由大到小的顺序为
A.④ ③ ② ① B.③ ① ② ④
C.① ③ ② ④ D.③ ② ① ④
时,向 硫酸铜饱和溶液中加入少量硫酸铜粉末,若保持温度不变,下列物理量中不会发生变化的是
A.溶液质量 B.溶剂质量 C.溶质质量 D.溶质质量分数
对“ 的白砂糖水溶液”含义解释错误的是
A. 白砂糖溶液中溶解了 白砂糖
B.将 白砂糖溶于 水中所得到的溶液
C.将白砂糖与水按照 的质量比配成的溶液
D. 水中溶解了 白砂糖
如图是 和 的溶解度曲线。下列说法正确
A. 溶解度大于 的溶解度
B. 时,两种物质的饱和溶液中溶质的质量分数相等
C. 时, 加入到 水中可得到饱和溶液
D.将 时一定质量的 的饱和溶液降温到 ,该溶液中溶质的质量保持不变
密闭容器中有 、 、 、 四种物质,在一定条件下发生化学反应,测得反应前后有关数据如下,关于此反应说法正确的是
A.物质 一定是该反应的催化剂
B.待测数值是
C.该反应是化合反应
D.在此反应中 与 的质量比
时,将 放入 水中,搅拌后,所得溶液中 的质量分数是(已知 时, 的溶解度为 水
A. B.
C. D.
下列有关溶液的说法正确的是
A.将植物油与水混合,得到的是溶液
B.配制溶液时,搅拌溶液可以增大溶质的溶解度
C.将 的 ,溶液倒出一半,剩余溶液中溶质的质量分数为
D.将 溶液蒸干得到 固体,则原溶液中溶质的质量分数为
室温时,分别向盛有 水的 、 两个烧杯中加入 、 硫酸铜均全部溶解,如图所示。则下列说法正确的是
A. 烧杯中溶液的颜色浅,溶质质量分数大
B. 烧杯中溶液的颜色深,溶质质量分数小
C. 烧杯中溶液的颜色深,溶质质量分数大
D. 烧杯中溶液的颜色浅,溶质质量分数小
溶液在工农业生产和人们的日常生活中有着极其广泛的用途。下列有关溶液的叙述中正确的是
A.均一、稳定、无色、透明的液体一定都是溶液
B.某物质的饱和溶液其溶质质量分数一定大于该物质的不饱和溶液中该溶质的质量分数
C.固体的溶解度一定随溶剂质量的增大而增大
D.某物质的溶液降温析出晶体后溶液的溶质质量分数一定变小
已知 时, 水中最多溶解 氯化钾。 时,向烧杯中加入 氯化钾,将 蒸馏水平均分成 次加入烧杯中,充分搅拌,现象如图所示。
溶液中溶质质量分数为 的是
A. B. C. D.
某患者根据需要输了 克溶质质量分数为 的葡萄糖注射液,则进入其体内的葡萄糖质量为
A. 克 B. 克 C. 克 D. 克
如图所示,海水淡化可采用膜分离技术,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
二、综合题(共5题)
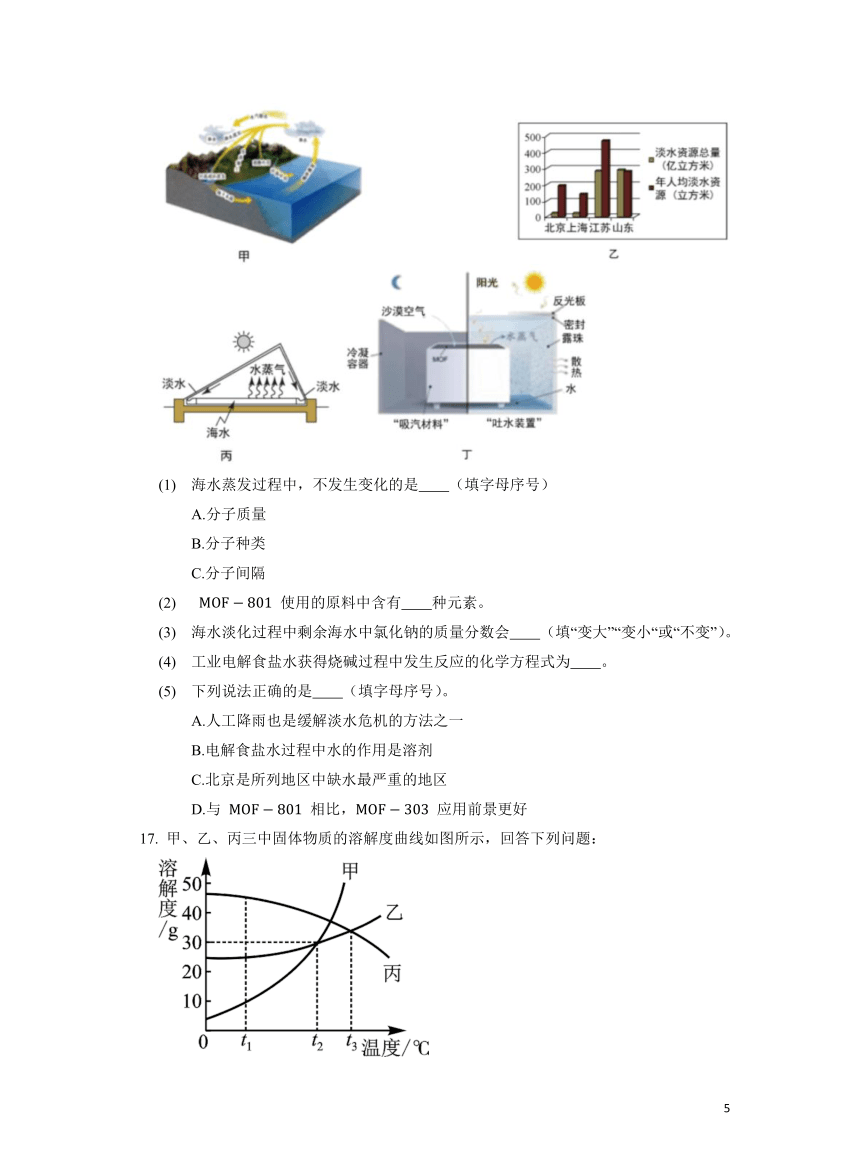
地球是一个蓝色的水球,自然界中的水有如图甲所示的循环过程。
地球上的淡水资源只占总水量的 ,且分布不均匀。图乙为我国部分地区淡水储量及年人均拥有量的相关数据。
沿海地区解决淡水危机的有效措施之一是海水淡化。图丙是海水淡化过程简单示意图。
最近,科学家创造了强大的“吸汽材料”( 材料)并开发出在沙漠也能“吐水″的“集水神器”(图丁)。 材料具有亲水孔道,对空气中的水蒸气具有超强的吸附作用。 材料可选择的金属原料很多,像 使用的氧氯化锆()原料,价格比较昂贵。而合成 的原料是便宜易得的氯化铝(),可大大降低成本。
水在居民生活、农业灌溉和工业生产中充当重要角色。工业上,水常用作冷却剂、溶剂或原料。如工业上通过电解食盐水获得氢气、氯气和氢氧化钠(俗称烧碱)。回答下列问题:
(1) 海水蒸发过程中,不发生变化的是 (填字母序号)
A.分子质量
B.分子种类
C.分子间隔
(2) 使用的原料中含有 种元素。
(3) 海水淡化过程中剩余海水中氯化钠的质量分数会 (填“变大”“变小“或“不变”)。
(4) 工业电解食盐水获得烧碱过程中发生反应的化学方程式为 。
(5) 下列说法正确的是 (填字母序号)。
A.人工降雨也是缓解淡水危机的方法之一
B.电解食盐水过程中水的作用是溶剂
C.北京是所列地区中缺水最严重的地区
D.与 相比, 应用前景更好
甲、乙、丙三中固体物质的溶解度曲线如图所示,回答下列问题:
(1) 时,甲、乙、丙三物质的溶解度由大到小的顺序是 ;
(2) 时,甲和乙的溶解度 (填“相等”或“不相等”);
(3) 时,甲物质的饱和溶液中溶质与溶剂的质量比为 (写最简比);
(4) 将乙和丙两种物质的饱和溶液降低到 ,所得溶液中溶质的质量分数大小关系为:乙 丙(填“”、“”或“”)。
如图 是甲、乙两种物质的溶解度曲线,请结合该图回答问题。
(1) 时甲、乙两种物质的溶解度相等。
(2) 溶解度随温度升高而降低的物质是 (填“甲”或“乙”)。
(3) 时,分别将甲乙两种物质的饱和溶液降温到 ,甲溶液的溶质质量分数 (填“大于”、“等于”或“小于”)乙溶液的溶质质量分数。
(4) 小明同学用甲物质进行如图 实验,实验过程中 、 、 对应的溶液一定为饱和溶液的 。
(5) 、 、 溶液的浓度由大到小的顺序为 。
某化学兴趣小组通过实验测出了甲、乙、丙三种物质在不同温度下的溶解度,并通过描点法绘制出如图的溶解度曲线图,请根据图示回答问题:
(1) 时甲、乙、丙的饱和溶液,升高温度到 有固体析出的是 。
(2) 在温度不变的前提下,将 时乙的不饱和溶液转化为饱和溶液,写出一种可采用的方法 。
(3) 时甲、乙、丙三种物质的饱和溶液,溶质质量分数最大的是 。
(4) 时,将 甲物质加入到盛有 水的烧杯中,成分溶解再降温到 后,烧杯中固体质量为 克。
请根据图中甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1) 在 时,甲、丙两种物质的溶解度相等。
(2) 在 时,向盛有 甲物质的烧杯中加入 水,充分溶解后,所得溶液的质量为 。
(3) 若乙物质中混有少量甲物质,最好采用 (填“降温结晶”或“蒸发结晶”)的方法提纯乙。
(4) 时,甲、乙、丙三种物质的饱和溶液同时降温至 ,所得溶液中溶质质量分数由大到小的顺序为 。
答案解析部分
一、选择题(共15题)
1. 【答案】A
【解析】 时, 的溶解度为 ,因此 水中最多溶解 ,所以得到的溶液为饱和溶液,A正确。溶液的质量为 ,B不正确。溶液中溶质质量分数的计算式为 ,C不正确。若向烧杯中加入水的质量小于等于 ,溶液中溶质质量分数不变,D不正确。
2. 【答案】D
3. 【答案】B
4. 【答案】B
【解析】①蒸发掉 水且无晶体析出,溶液的溶质质量分数 ;
②加入 同样的溶液,溶液的溶质质量分数不变,仍为 ;
③加入 同种溶质,使之全部溶解,溶质质量分数的 ;
④加入 水,溶质质量分数小于 ,因此溶质质量分数由大到小的顺序为③ ① ② ④。
5. 【答案】D
【解析】向 饱和硫酸铜溶液中加入少量硫酸铜粉末,此时硫酸铜会结合水形成皛体,由于溶液中溶剂减少,溶质也会析岀,故此时溶液质量、溶质质量、溶剂质量都减小,但由于温度不变,此溶液仍然是该温度下的饱和溶液,其质量分数不发生变化。
6. 【答案】C
7. 【答案】B
8. 【答案】C
【解析】由表中数据分析可知,反应前后 的质量增加了 ,故是生成物,生成的质量为 ;同理可以确定 的质量不变,可能作该反应的催化剂,也可能没有参加反应; 是反应物,参加反应的质量为 ;由质量守恒定律, 应是反应物,且参加反应的 的质量为 ,故待测的数值为 。
A、 的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
B、待测数值是 ,故选项说法错误。
C、该反应的反应物为 和 ,生成物是 ,符合“多变一”的形式,属于化合反应,故选项说法正确。
D、在此反应中 与 的质量比 ,故选项说法错误。
故选:C。
9. 【答案】D
10. 【答案】D
【解析】A、溶液的特点:均一性、稳定性、属于混合物,植物油不溶于水,二者混合后得到的不是溶液,故A错误;
B、固体溶解度的影响因素主要是温度,搅拌只能加快溶解速度,不能影响溶解度,故B错误;
C、由于溶液是均一的,将 的 ,溶液倒出一半,剩余溶液中溶质的质量分数仍为 ,故C错误;
D、将 溶液蒸干得到 固体,所以溶质质量是 ,溶液质量是 ,则原溶液中溶质的质量分数为 ,故D正确。
故选:D。
11. 【答案】C
【解析】分别向盛有 水的 、 两个烧杯中加入 、 硫酸铜均全部溶解, 中含有的溶质少,溶液颜色浅,溶质质量分数小; 中含有的溶质多,溶液颜色深,溶质质量分数大。
12. 【答案】D
【解析】A . 溶液是均一、稳定的混合物,不一定是无色,例如硫酸铜溶液是蓝色,故A错误;
B . 在同一温度,同一溶质饱和溶液比不饱和溶液浓,即饱和溶液中溶质质量分数一定大于不饱和溶液中该溶质的质量分数,故B错误;
C . 固体的溶解度影响因素是温度,与溶剂质量无关,故C错误;
D . 某物质的溶液降温析出晶体后溶液的溶质质量分数一定变小,故D正确。
13. 【答案】C
14. 【答案】A
15. 【答案】B
【解析】由题图知,水分子可以透过淡化膜到左侧淡水池,而右侧海水中的各种离子不能通过淡化膜,所以右侧海水中溶质质量不变,故A错误;
右侧海水中溶剂质量减少,故B正确;
右侧海水中溶液质量减少,故C错误;
右侧海水中溶质质量分数增大,故D错误。
二、综合题(共5题)
16. 【答案】
(1) AB
(2)
(3) 变大
(4)
(5) D
【解析】
(1) 水变成水蒸气的过程中,没有新物质生成,属于物理变化,水分子本身没有改变,只是水分子间的间隔发生改变。
A.分子质量不改变,故A正确;
B.分子种类不改变,故B正确;
C.分子间隔改变,故C错误。
(2) 使用的氧氯化锆()原料,故含有 种元素。
(3) 海水淡化将一定量的海水暴晒一段时间后,水分蒸发,则溶液中溶质质量不变,溶剂的质量减少,则剩余海水中氯化钠的质量分数会变大。
(4) 工业上常用电解饱和食盐水的方法制备氢氧化钠,其化学方程式为
。
(5) A.人工降雨也是解决旱情的方法之一,不是缓解淡水危机,故A错误;
B.电解食盐水过程中水的作用不仅是溶剂,也参与反应产生氢气,故B错误;
C.上海是所列地区中缺水最严重的地区,故C错误;
D.与 相比, 应用前景更好,因为合成 的原料是便宜易得的氯化铝(),可大大降低成本,故D正确;
故选D。
17. 【答案】
(1) 丙 乙 甲
(2) 相等
(3)
(4)
【解析】
(1) 时甲、乙、丙三种物质的溶解度曲线,丙的曲线在最上方,此时物质丙的溶解度最大;甲的曲线在最下方,此时物质甲的溶解度最小;因此,三种物质的溶解度由大到小的顺序为丙 乙 甲。
(2) 在 时,甲、乙两物质的溶解度曲线交于一点,说明在 时,两物质的溶解度相等。
(3) 据溶解度曲线知, 时甲物质的溶解度为 ,即 溶剂,溶解 甲,故 时,甲物质的饱和溶液中溶质与溶剂的质量比为 。
(4) 乙的溶解度随温度降低而减小,丙的溶解度随温度降低而增大,所以将 时乙、丙两种物质的饱和溶液降温至 时,乙析出晶体,溶质的质量分数减小,丙的溶解度变大,溶质、溶剂的质量不变,所以溶质质量分数与降温前相等,故降温后所得溶液的溶质质量分数大小关系是乙 丙。
18. 【答案】
(1)
(2) 乙
(3) 大于
(4) 、
(5)
【解析】
(1) 通过分析溶解度曲线可知, 时甲、乙两种物质的溶解度相等。
(2) 通过分析溶解度曲线可知,溶解度随温度升高而降低的物质是乙。
(3) 甲在 时的溶解度大于乙在 时的溶解度,所以 时,分别将甲乙两种物质的饱和溶液降温到 ,甲物质会析出晶体,乙物质不会析出晶体,甲溶液的溶质质量分数大于乙溶液的溶质质量分数。
(4) 时,甲物质的溶解度是 , 时,甲物质的溶解度是 ,所以
时, 水中可以溶解 ,所以 是不饱和溶液,再加入 的固体 ,固体质量为 ,所以 是饱和溶液, 时, 水中可以溶解 ,所以 是饱和溶液,实验过程中, 、 、 对应的溶液为饱和溶液的是 、 。
(5) 溶液的溶质质量分数为:,
溶液的溶质质量分数为:,
溶液的溶质质量分数为:,
所以 、 、 溶液的浓度由大到小的顺序为:。
19. 【答案】
(1) 丙
(2) 增加溶质
(3) 甲
(4)
【解析】
(1) 时甲、乙、丙均为饱和溶液,当升高温度到 时,甲、乙的溶解度增大,不会有固体析出,丙的溶解度降低,有固体析出。
(2) 在温度不变的前提下,将 时乙的不饱和溶液转化为饱和溶液可采用加入过量溶质或蒸发掉溶剂的方法。
(3) 时甲、乙、丙三种物质的饱和溶液的溶解度大小关系是甲 乙 丙,根据饱和溶液溶质质量分数 ,可知在 时,甲、乙、丙三种物质的饱和溶液,溶质质量分数大小关系是甲 乙 丙。
(4) 时,甲物质的溶解度是 ,即 水中最多溶解 甲,有 甲未溶解,降温到 后,甲物质的溶解度是 ,即 水最多溶解 甲,有 甲析出,故烧杯中固体质量为:。
20. 【答案】
(1)
(2)
(3) 蒸发结晶
(4) 乙 甲 丙
【解析】
(1) 通过分析溶解度曲线可知,在 时,甲、丙两种物质的溶解度相等。
(2) 在 时,甲物质的溶解度是 ,所以向盛有 甲物质的烧杯中加入 水,充分溶解后,只能溶解 的晶体,所得溶液的质量为 。
(3) 乙物质的溶解度受温度变化影响较小,甲物质的溶解度受温度变化影响较大,所以若乙物质中混有少量甲物质,最好采用蒸发结晶的方法提纯乙。
(4) 时,乙物质的溶解度最大,甲、丙物质的溶解度相等, 时,甲、乙、丙三种物质的饱和溶液同时降温至 ,甲、乙物质的溶解度减小,析出晶体,丙物质的溶解度增大,不会析出晶体,应该按照 时的溶解度计算,所以所得溶液中溶质质量分数由大到小的顺序为乙 甲 丙。
1
一、选择题(共15题)
时, 的溶解度为 。 时,将 固体加入盛有 水的烧杯中,充分溶解得到溶液。下列说法正确的是
A.得到的是饱和溶液
B.溶液的质量是
C.溶液中溶质质量分数的计算式为
D.若再向烧杯中加入一定量的水,此时溶液中溶质的质量分数一定减小
时,在三个各盛有 水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各 ,充分溶解后,情况如下表所示,有关说法不正确的是
A. 时,甲的溶解度最小
B.三溶液中溶质质量分数乙 丙 甲
C.所得溶液可能都是饱和溶液
D.升高温度,三溶液中溶质质量分数一定都会改变
甲和乙两种固态物质的饱和溶液中溶质质量分数()与温度()的关系如图所示。下列叙述错误的是
A. 时,甲和乙两种物质的溶解度相等
B. 时,甲和乙两种物质溶液的溶质质量分数相等
C. 乙物质完全溶于 水中所需的最低温度是
D. 时,若甲和乙两种物质的饱和溶液中析出等质量的固体,需要蒸发掉较多水的是乙物质的饱和溶液
将溶质质量分数为 的某溶液 分别做如下处理:①蒸发掉 水且无晶体析出;②加入 同样的溶液;③加入 同种溶质,使之全部溶解;④加入 水,搅拌使其混合均匀。经四种方法处理过的溶液中,溶质质量分数由大到小的顺序为
A.④ ③ ② ① B.③ ① ② ④
C.① ③ ② ④ D.③ ② ① ④
时,向 硫酸铜饱和溶液中加入少量硫酸铜粉末,若保持温度不变,下列物理量中不会发生变化的是
A.溶液质量 B.溶剂质量 C.溶质质量 D.溶质质量分数
对“ 的白砂糖水溶液”含义解释错误的是
A. 白砂糖溶液中溶解了 白砂糖
B.将 白砂糖溶于 水中所得到的溶液
C.将白砂糖与水按照 的质量比配成的溶液
D. 水中溶解了 白砂糖
如图是 和 的溶解度曲线。下列说法正确
A. 溶解度大于 的溶解度
B. 时,两种物质的饱和溶液中溶质的质量分数相等
C. 时, 加入到 水中可得到饱和溶液
D.将 时一定质量的 的饱和溶液降温到 ,该溶液中溶质的质量保持不变
密闭容器中有 、 、 、 四种物质,在一定条件下发生化学反应,测得反应前后有关数据如下,关于此反应说法正确的是
A.物质 一定是该反应的催化剂
B.待测数值是
C.该反应是化合反应
D.在此反应中 与 的质量比
时,将 放入 水中,搅拌后,所得溶液中 的质量分数是(已知 时, 的溶解度为 水
A. B.
C. D.
下列有关溶液的说法正确的是
A.将植物油与水混合,得到的是溶液
B.配制溶液时,搅拌溶液可以增大溶质的溶解度
C.将 的 ,溶液倒出一半,剩余溶液中溶质的质量分数为
D.将 溶液蒸干得到 固体,则原溶液中溶质的质量分数为
室温时,分别向盛有 水的 、 两个烧杯中加入 、 硫酸铜均全部溶解,如图所示。则下列说法正确的是
A. 烧杯中溶液的颜色浅,溶质质量分数大
B. 烧杯中溶液的颜色深,溶质质量分数小
C. 烧杯中溶液的颜色深,溶质质量分数大
D. 烧杯中溶液的颜色浅,溶质质量分数小
溶液在工农业生产和人们的日常生活中有着极其广泛的用途。下列有关溶液的叙述中正确的是
A.均一、稳定、无色、透明的液体一定都是溶液
B.某物质的饱和溶液其溶质质量分数一定大于该物质的不饱和溶液中该溶质的质量分数
C.固体的溶解度一定随溶剂质量的增大而增大
D.某物质的溶液降温析出晶体后溶液的溶质质量分数一定变小
已知 时, 水中最多溶解 氯化钾。 时,向烧杯中加入 氯化钾,将 蒸馏水平均分成 次加入烧杯中,充分搅拌,现象如图所示。
溶液中溶质质量分数为 的是
A. B. C. D.
某患者根据需要输了 克溶质质量分数为 的葡萄糖注射液,则进入其体内的葡萄糖质量为
A. 克 B. 克 C. 克 D. 克
如图所示,海水淡化可采用膜分离技术,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
二、综合题(共5题)
地球是一个蓝色的水球,自然界中的水有如图甲所示的循环过程。
地球上的淡水资源只占总水量的 ,且分布不均匀。图乙为我国部分地区淡水储量及年人均拥有量的相关数据。
沿海地区解决淡水危机的有效措施之一是海水淡化。图丙是海水淡化过程简单示意图。
最近,科学家创造了强大的“吸汽材料”( 材料)并开发出在沙漠也能“吐水″的“集水神器”(图丁)。 材料具有亲水孔道,对空气中的水蒸气具有超强的吸附作用。 材料可选择的金属原料很多,像 使用的氧氯化锆()原料,价格比较昂贵。而合成 的原料是便宜易得的氯化铝(),可大大降低成本。
水在居民生活、农业灌溉和工业生产中充当重要角色。工业上,水常用作冷却剂、溶剂或原料。如工业上通过电解食盐水获得氢气、氯气和氢氧化钠(俗称烧碱)。回答下列问题:
(1) 海水蒸发过程中,不发生变化的是 (填字母序号)
A.分子质量
B.分子种类
C.分子间隔
(2) 使用的原料中含有 种元素。
(3) 海水淡化过程中剩余海水中氯化钠的质量分数会 (填“变大”“变小“或“不变”)。
(4) 工业电解食盐水获得烧碱过程中发生反应的化学方程式为 。
(5) 下列说法正确的是 (填字母序号)。
A.人工降雨也是缓解淡水危机的方法之一
B.电解食盐水过程中水的作用是溶剂
C.北京是所列地区中缺水最严重的地区
D.与 相比, 应用前景更好
甲、乙、丙三中固体物质的溶解度曲线如图所示,回答下列问题:
(1) 时,甲、乙、丙三物质的溶解度由大到小的顺序是 ;
(2) 时,甲和乙的溶解度 (填“相等”或“不相等”);
(3) 时,甲物质的饱和溶液中溶质与溶剂的质量比为 (写最简比);
(4) 将乙和丙两种物质的饱和溶液降低到 ,所得溶液中溶质的质量分数大小关系为:乙 丙(填“”、“”或“”)。
如图 是甲、乙两种物质的溶解度曲线,请结合该图回答问题。
(1) 时甲、乙两种物质的溶解度相等。
(2) 溶解度随温度升高而降低的物质是 (填“甲”或“乙”)。
(3) 时,分别将甲乙两种物质的饱和溶液降温到 ,甲溶液的溶质质量分数 (填“大于”、“等于”或“小于”)乙溶液的溶质质量分数。
(4) 小明同学用甲物质进行如图 实验,实验过程中 、 、 对应的溶液一定为饱和溶液的 。
(5) 、 、 溶液的浓度由大到小的顺序为 。
某化学兴趣小组通过实验测出了甲、乙、丙三种物质在不同温度下的溶解度,并通过描点法绘制出如图的溶解度曲线图,请根据图示回答问题:
(1) 时甲、乙、丙的饱和溶液,升高温度到 有固体析出的是 。
(2) 在温度不变的前提下,将 时乙的不饱和溶液转化为饱和溶液,写出一种可采用的方法 。
(3) 时甲、乙、丙三种物质的饱和溶液,溶质质量分数最大的是 。
(4) 时,将 甲物质加入到盛有 水的烧杯中,成分溶解再降温到 后,烧杯中固体质量为 克。
请根据图中甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1) 在 时,甲、丙两种物质的溶解度相等。
(2) 在 时,向盛有 甲物质的烧杯中加入 水,充分溶解后,所得溶液的质量为 。
(3) 若乙物质中混有少量甲物质,最好采用 (填“降温结晶”或“蒸发结晶”)的方法提纯乙。
(4) 时,甲、乙、丙三种物质的饱和溶液同时降温至 ,所得溶液中溶质质量分数由大到小的顺序为 。
答案解析部分
一、选择题(共15题)
1. 【答案】A
【解析】 时, 的溶解度为 ,因此 水中最多溶解 ,所以得到的溶液为饱和溶液,A正确。溶液的质量为 ,B不正确。溶液中溶质质量分数的计算式为 ,C不正确。若向烧杯中加入水的质量小于等于 ,溶液中溶质质量分数不变,D不正确。
2. 【答案】D
3. 【答案】B
4. 【答案】B
【解析】①蒸发掉 水且无晶体析出,溶液的溶质质量分数 ;
②加入 同样的溶液,溶液的溶质质量分数不变,仍为 ;
③加入 同种溶质,使之全部溶解,溶质质量分数的 ;
④加入 水,溶质质量分数小于 ,因此溶质质量分数由大到小的顺序为③ ① ② ④。
5. 【答案】D
【解析】向 饱和硫酸铜溶液中加入少量硫酸铜粉末,此时硫酸铜会结合水形成皛体,由于溶液中溶剂减少,溶质也会析岀,故此时溶液质量、溶质质量、溶剂质量都减小,但由于温度不变,此溶液仍然是该温度下的饱和溶液,其质量分数不发生变化。
6. 【答案】C
7. 【答案】B
8. 【答案】C
【解析】由表中数据分析可知,反应前后 的质量增加了 ,故是生成物,生成的质量为 ;同理可以确定 的质量不变,可能作该反应的催化剂,也可能没有参加反应; 是反应物,参加反应的质量为 ;由质量守恒定律, 应是反应物,且参加反应的 的质量为 ,故待测的数值为 。
A、 的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
B、待测数值是 ,故选项说法错误。
C、该反应的反应物为 和 ,生成物是 ,符合“多变一”的形式,属于化合反应,故选项说法正确。
D、在此反应中 与 的质量比 ,故选项说法错误。
故选:C。
9. 【答案】D
10. 【答案】D
【解析】A、溶液的特点:均一性、稳定性、属于混合物,植物油不溶于水,二者混合后得到的不是溶液,故A错误;
B、固体溶解度的影响因素主要是温度,搅拌只能加快溶解速度,不能影响溶解度,故B错误;
C、由于溶液是均一的,将 的 ,溶液倒出一半,剩余溶液中溶质的质量分数仍为 ,故C错误;
D、将 溶液蒸干得到 固体,所以溶质质量是 ,溶液质量是 ,则原溶液中溶质的质量分数为 ,故D正确。
故选:D。
11. 【答案】C
【解析】分别向盛有 水的 、 两个烧杯中加入 、 硫酸铜均全部溶解, 中含有的溶质少,溶液颜色浅,溶质质量分数小; 中含有的溶质多,溶液颜色深,溶质质量分数大。
12. 【答案】D
【解析】A . 溶液是均一、稳定的混合物,不一定是无色,例如硫酸铜溶液是蓝色,故A错误;
B . 在同一温度,同一溶质饱和溶液比不饱和溶液浓,即饱和溶液中溶质质量分数一定大于不饱和溶液中该溶质的质量分数,故B错误;
C . 固体的溶解度影响因素是温度,与溶剂质量无关,故C错误;
D . 某物质的溶液降温析出晶体后溶液的溶质质量分数一定变小,故D正确。
13. 【答案】C
14. 【答案】A
15. 【答案】B
【解析】由题图知,水分子可以透过淡化膜到左侧淡水池,而右侧海水中的各种离子不能通过淡化膜,所以右侧海水中溶质质量不变,故A错误;
右侧海水中溶剂质量减少,故B正确;
右侧海水中溶液质量减少,故C错误;
右侧海水中溶质质量分数增大,故D错误。
二、综合题(共5题)
16. 【答案】
(1) AB
(2)
(3) 变大
(4)
(5) D
【解析】
(1) 水变成水蒸气的过程中,没有新物质生成,属于物理变化,水分子本身没有改变,只是水分子间的间隔发生改变。
A.分子质量不改变,故A正确;
B.分子种类不改变,故B正确;
C.分子间隔改变,故C错误。
(2) 使用的氧氯化锆()原料,故含有 种元素。
(3) 海水淡化将一定量的海水暴晒一段时间后,水分蒸发,则溶液中溶质质量不变,溶剂的质量减少,则剩余海水中氯化钠的质量分数会变大。
(4) 工业上常用电解饱和食盐水的方法制备氢氧化钠,其化学方程式为
。
(5) A.人工降雨也是解决旱情的方法之一,不是缓解淡水危机,故A错误;
B.电解食盐水过程中水的作用不仅是溶剂,也参与反应产生氢气,故B错误;
C.上海是所列地区中缺水最严重的地区,故C错误;
D.与 相比, 应用前景更好,因为合成 的原料是便宜易得的氯化铝(),可大大降低成本,故D正确;
故选D。
17. 【答案】
(1) 丙 乙 甲
(2) 相等
(3)
(4)
【解析】
(1) 时甲、乙、丙三种物质的溶解度曲线,丙的曲线在最上方,此时物质丙的溶解度最大;甲的曲线在最下方,此时物质甲的溶解度最小;因此,三种物质的溶解度由大到小的顺序为丙 乙 甲。
(2) 在 时,甲、乙两物质的溶解度曲线交于一点,说明在 时,两物质的溶解度相等。
(3) 据溶解度曲线知, 时甲物质的溶解度为 ,即 溶剂,溶解 甲,故 时,甲物质的饱和溶液中溶质与溶剂的质量比为 。
(4) 乙的溶解度随温度降低而减小,丙的溶解度随温度降低而增大,所以将 时乙、丙两种物质的饱和溶液降温至 时,乙析出晶体,溶质的质量分数减小,丙的溶解度变大,溶质、溶剂的质量不变,所以溶质质量分数与降温前相等,故降温后所得溶液的溶质质量分数大小关系是乙 丙。
18. 【答案】
(1)
(2) 乙
(3) 大于
(4) 、
(5)
【解析】
(1) 通过分析溶解度曲线可知, 时甲、乙两种物质的溶解度相等。
(2) 通过分析溶解度曲线可知,溶解度随温度升高而降低的物质是乙。
(3) 甲在 时的溶解度大于乙在 时的溶解度,所以 时,分别将甲乙两种物质的饱和溶液降温到 ,甲物质会析出晶体,乙物质不会析出晶体,甲溶液的溶质质量分数大于乙溶液的溶质质量分数。
(4) 时,甲物质的溶解度是 , 时,甲物质的溶解度是 ,所以
时, 水中可以溶解 ,所以 是不饱和溶液,再加入 的固体 ,固体质量为 ,所以 是饱和溶液, 时, 水中可以溶解 ,所以 是饱和溶液,实验过程中, 、 、 对应的溶液为饱和溶液的是 、 。
(5) 溶液的溶质质量分数为:,
溶液的溶质质量分数为:,
溶液的溶质质量分数为:,
所以 、 、 溶液的浓度由大到小的顺序为:。
19. 【答案】
(1) 丙
(2) 增加溶质
(3) 甲
(4)
【解析】
(1) 时甲、乙、丙均为饱和溶液,当升高温度到 时,甲、乙的溶解度增大,不会有固体析出,丙的溶解度降低,有固体析出。
(2) 在温度不变的前提下,将 时乙的不饱和溶液转化为饱和溶液可采用加入过量溶质或蒸发掉溶剂的方法。
(3) 时甲、乙、丙三种物质的饱和溶液的溶解度大小关系是甲 乙 丙,根据饱和溶液溶质质量分数 ,可知在 时,甲、乙、丙三种物质的饱和溶液,溶质质量分数大小关系是甲 乙 丙。
(4) 时,甲物质的溶解度是 ,即 水中最多溶解 甲,有 甲未溶解,降温到 后,甲物质的溶解度是 ,即 水最多溶解 甲,有 甲析出,故烧杯中固体质量为:。
20. 【答案】
(1)
(2)
(3) 蒸发结晶
(4) 乙 甲 丙
【解析】
(1) 通过分析溶解度曲线可知,在 时,甲、丙两种物质的溶解度相等。
(2) 在 时,甲物质的溶解度是 ,所以向盛有 甲物质的烧杯中加入 水,充分溶解后,只能溶解 的晶体,所得溶液的质量为 。
(3) 乙物质的溶解度受温度变化影响较小,甲物质的溶解度受温度变化影响较大,所以若乙物质中混有少量甲物质,最好采用蒸发结晶的方法提纯乙。
(4) 时,乙物质的溶解度最大,甲、丙物质的溶解度相等, 时,甲、乙、丙三种物质的饱和溶液同时降温至 ,甲、乙物质的溶解度减小,析出晶体,丙物质的溶解度增大,不会析出晶体,应该按照 时的溶解度计算,所以所得溶液中溶质质量分数由大到小的顺序为乙 甲 丙。
1
同课章节目录
