化学人教版九下分层练习:10.1 常见的酸和碱第3课时 常见的碱(含解析)
文档属性
| 名称 | 化学人教版九下分层练习:10.1 常见的酸和碱第3课时 常见的碱(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 104.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-29 22:07:18 | ||
图片预览


文档简介
10.1 常见的酸和碱
第3课时 常见的碱
【基础训练】
1.下列物质必须密封保存的是( )
A.木炭 B.氢氧化钠
C.石灰石 D.氯化钠
2.常用于改良酸性土壤的物质是( )
A. 熟石灰 B. 烧碱
C. 硝酸钾 D. 硫酸铵
3.下列物质常温下露置在空气中,放置一段时间后,因发生化学反应而质量增加的是( )
A. 浓硫酸 B. 浓盐酸
C. 氢氧化钠 D. 氯化钠
4.下列溶液在空气中敞口久置,因发生化学变化导致溶液质量减小的是( )
A. 浓盐酸 B. 浓硫酸
C. 石灰水 D. 烧碱溶液
5.下列关于氢氧化钠的描述中错误的是( )
A. 对皮肤有强烈的腐蚀作用 B. 其水溶液能使石蕊溶液变红
C. 能去除油污,可作炉具清洁剂 D. 易溶于水,溶解时放出热量
6.石灰窑一“宁德被人遗忘的古代科技文明”,其生产的熟石灰不能用于( )
A. 建筑材料 B. 制波尔多液
C. 治疗胃酸过多 D. 处理硫酸厂废水
7.下列判断错误的是( )
A. NaOH固体有吸水性——物理性质
B. NaOH固体为白色片状——物理性质
C. NaOH固体溶于水得到的溶液显碱性——物理性质
D. NaOH固体放在空气中易变质——化学性质
8.下列物质的变化属于物理变化的是( )
A. 石灰浆抹墙后,墙壁变硬 B. 用稀硫酸除去铁锈
C. 用烧碱干燥氮气、氧气 D. 酚酞试液遇碱性溶液变为红色
9.下列气体中不能用固体氢氧化钠干燥的是( )
A. O2 B. CO2
C. H2 D. CO
10.能鉴别稀硫酸、烧碱溶液、氯化钠溶液的试剂是( )
A.酚酞 B.石蕊
C.澄清石灰水 D.稀盐酸
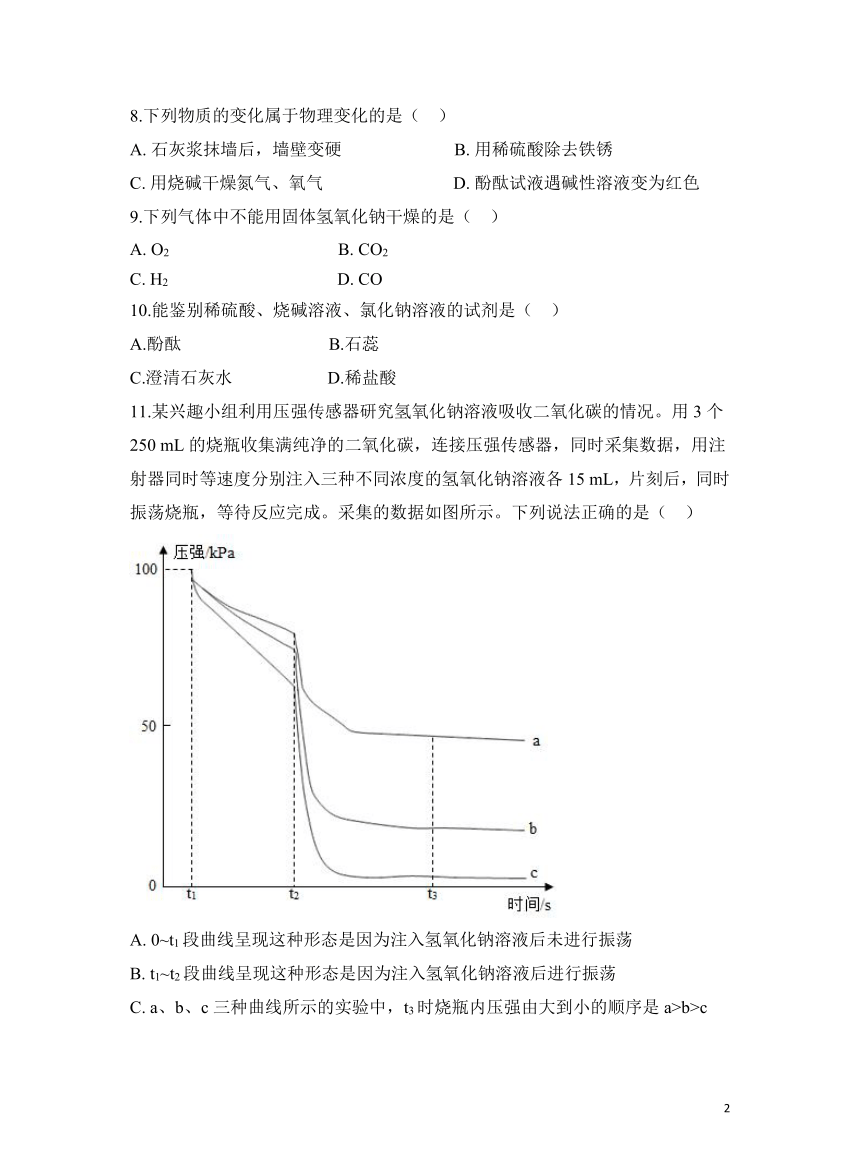
11.某兴趣小组利用压强传感器研究氢氧化钠溶液吸收二氧化碳的情况。用3个250 mL的烧瓶收集满纯净的二氧化碳,连接压强传感器,同时采集数据,用注射器同时等速度分别注入三种不同浓度的氢氧化钠溶液各15 mL,片刻后,同时振荡烧瓶,等待反应完成。采集的数据如图所示。下列说法正确的是( )
A. 0~t1段曲线呈现这种形态是因为注入氢氧化钠溶液后未进行振荡
B. t1~t2段曲线呈现这种形态是因为注入氢氧化钠溶液后进行振荡
C. a、b、c三种曲线所示的实验中,t3时烧瓶内压强由大到小的顺序是a>b>c
D. a、b、c三种曲线所示的实验中,t3时被吸收的二氧化碳的体积由大到小的顺序是a>b>c
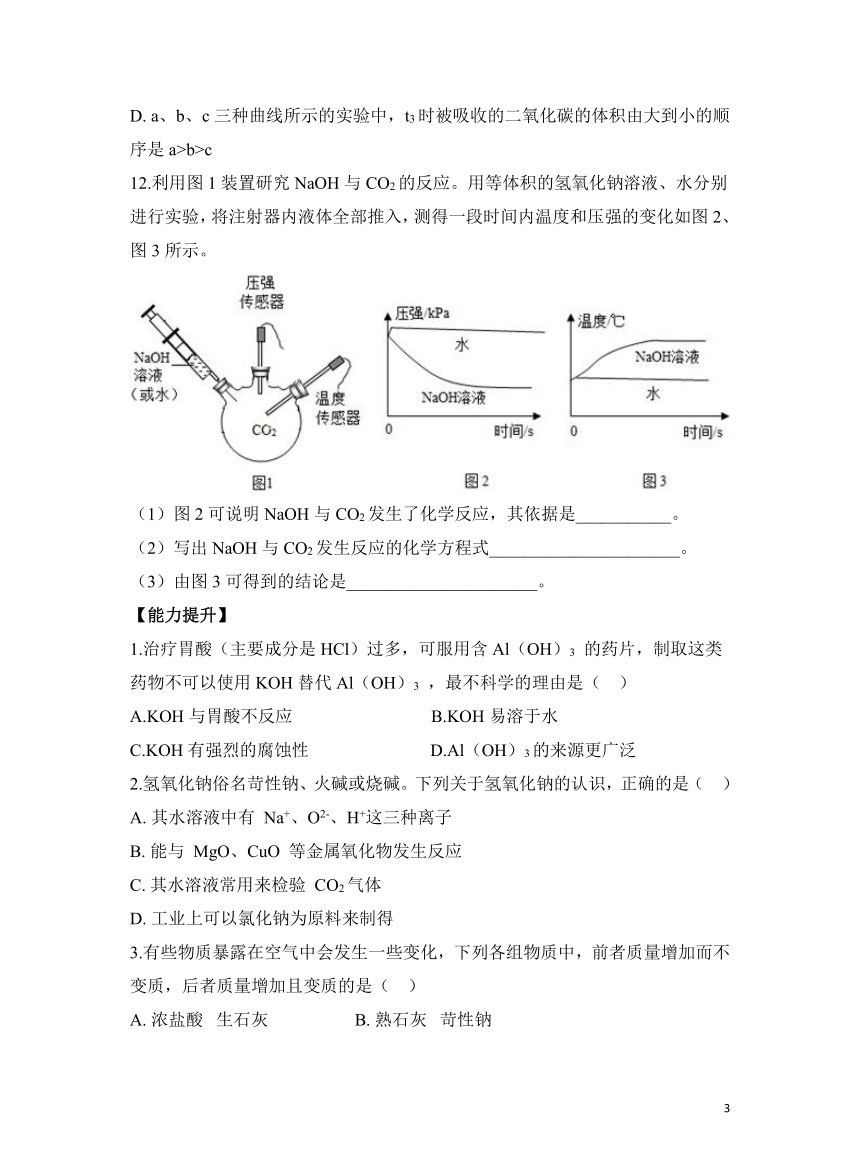
12.利用图1装置研究NaOH与CO2的反应。用等体积的氢氧化钠溶液、水分别进行实验,将注射器内液体全部推入,测得一段时间内温度和压强的变化如图2、图3所示。
(1)图2可说明NaOH与CO2发生了化学反应,其依据是___________。
(2)写出NaOH与CO2发生反应的化学方程式______________________。
(3)由图3可得到的结论是______________________。
【能力提升】
1.治疗胃酸(主要成分是HCl)过多,可服用含Al(OH)3 的药片,制取这类药物不可以使用KOH替代Al(OH)3 ,最不科学的理由是( )
A.KOH与胃酸不反应 B.KOH易溶于水
C.KOH有强烈的腐蚀性 D.Al(OH)3的来源更广泛
2.氢氧化钠俗名苛性钠、火碱或烧碱。下列关于氢氧化钠的认识,正确的是( )
A. 其水溶液中有 Na+、O2-、H+这三种离子
B. 能与 MgO、CuO 等金属氧化物发生反应
C. 其水溶液常用来检验 CO2气体
D. 工业上可以氯化钠为原料来制得
3.有些物质暴露在空气中会发生一些变化,下列各组物质中,前者质量增加而不变质,后者质量增加且变质的是( )
A. 浓盐酸 生石灰 B. 熟石灰 苛性钠
C. 浓硫酸 火碱 D. 生石灰 熟石灰
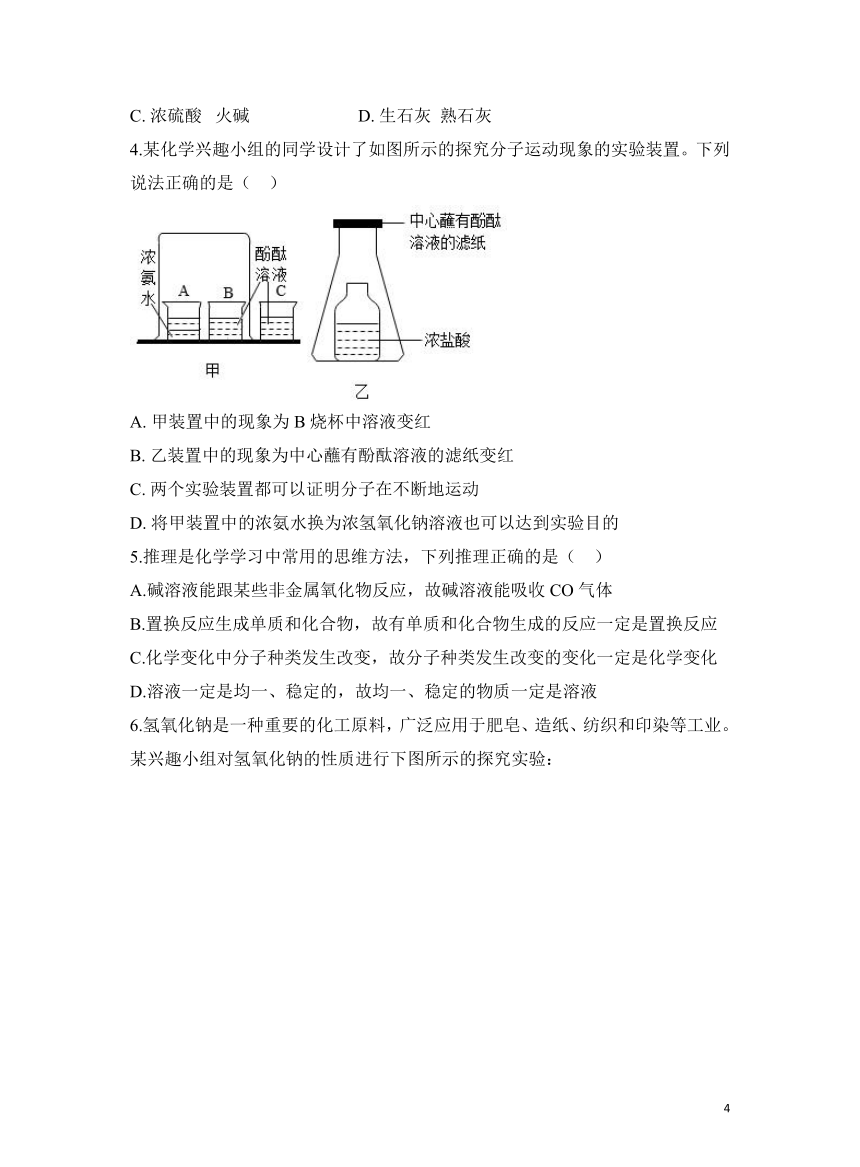
4.某化学兴趣小组的同学设计了如图所示的探究分子运动现象的实验装置。下列说法正确的是( )
A. 甲装置中的现象为B烧杯中溶液变红
B. 乙装置中的现象为中心蘸有酚酞溶液的滤纸变红
C. 两个实验装置都可以证明分子在不断地运动
D. 将甲装置中的浓氨水换为浓氢氧化钠溶液也可以达到实验目的
5.推理是化学学习中常用的思维方法,下列推理正确的是( )
A.碱溶液能跟某些非金属氧化物反应,故碱溶液能吸收CO气体
B.置换反应生成单质和化合物,故有单质和化合物生成的反应一定是置换反应
C.化学变化中分子种类发生改变,故分子种类发生改变的变化一定是化学变化
D.溶液一定是均一、稳定的,故均一、稳定的物质一定是溶液
6.氢氧化钠是一种重要的化工原料,广泛应用于肥皂、造纸、纺织和印染等工业。某兴趣小组对氢氧化钠的性质进行下图所示的探究实验:
(1)探究一:NaOH溶液与Al的反应
(査阅资料)
①氢氧化钠、铝和水常温下反应生成偏铝酸钠( NaAlO2)和一种气体;
②铝表面有一层致密的氧化铝(Al2O3)薄膜;
③
(实验设计)按图I装置进行探究,实验开始时无明显现象,反应一段时间后,有气泡产生,用点燃的木条检验产生的气体,气体能够燃烧。
(实验分析)
该实验产生的气体是________,反应的化学方程式为________。
(2)实验开始时无明显现象的原因是________。
(3)(拓展延伸)NaOH是管道疏通剂的主要成分,管道疏通剂一般________(填“能”或“不能”)用于铝制管道的疏通。
(4)探究二:利用数字化传感器探究NaOH与CO2的反应
(实验方案)在锥形瓶内收集满CO2, 按图Ⅱ进行实验,将注射器内的液体同时迅速注入锥形瓶内,关闭活塞,t1时刻,同时振荡锥形瓶,观察到甲中有白色沉淀生成,乙中无明显现象,通过压强传感器测得锥形瓶内压强随时间的变化如图Ⅲ所示。
(实验分析)
乙中发生反应的化学方程式为________。
(5)导致CD段压强快速变小的原因是________。
(6)通过图Ⅲ可知,曲线1的注射器里装的溶液是________(填“NaOH溶液”或“澄清石灰水”)。
(7)(拓展延伸)通过上述探究,实验室中NaOH和Ca(OH)2应________保存。
参考答案
【基础练习】
1.【答案】 B
【解析】氢氧化钠会与空气中的二氧化碳、水发生反应导致变质,所以需密封保存。
故答案为:B。
2.【答案】 A
【解析】A.熟石灰是氢氧化钙的俗称,具有碱性,常用于改良酸性土壤,故A符合题意;
B.烧碱是氢氧化钠的俗称,具有强烈的腐蚀性,不能用于改良酸性土壤,故B不符合题意;
C.硝酸钾不显碱性,不能用于改良酸性土壤,故C不符合题意;
D.硫酸铵显酸性,用于改良碱性土壤,故D不符合题意;
故答案为:A。
3.【答案】 C
【解析】A.浓硫酸具有吸水性,放置在空气中会吸收空气中的水分,使其质量增加,但发生的是物理变化,不符合题意;
B.浓盐酸具有挥发性,会使其质量减少,不符合题意;
C.氢氧化钠敞口放置在空气中,能与空气中的二氧化碳发生化学反应生成碳酸钠和水,发生了化学反应导致质量增加,符合题意;
D.氯化钠固体不与空气中的成分发生化学反应,质量不变,不符合题意。
故答案为:C。
4.【答案】 C
【解析】A.浓盐酸易挥发,导致溶液的质量减小,但未发生化学变化,故A不符合题意;
B.浓硫酸易吸水,导致溶液的质量增大,故B不符合题意;
C.石灰水与空气中的二氧化碳反应生成碳酸钙沉淀和水,溶液中增加二氧化碳的质量小于减少的碳酸钙沉淀的质量,因发生化学变化导致溶液的质量减小,故C符合题意;
D.烧碱溶液中的氢氧化钠与二氧化碳反应生成碳酸钠和水,溶液增加二氧化碳的质量,故D不符合题意。
故答案为:C。
5.【答案】 B
【解析】A.氢氧化钠具有强腐蚀性,能够腐蚀皮肤,故A不符合题意;
B.氢氧化钠溶液是碱性的,能使紫色石蕊变蓝色,故B符合题意;
C.炉具清洁剂中含义氢氧化钠和油污能够反应,故C不符合题意;
D.氢氧化钠溶解放出热量,故D不符合题意。
故答案为:B。
6.【答案】 C
【解析】A.氢氧化钙能与二氧化碳反应生成碳酸钙,可用作建筑材料,不符合题意;
B.氢氧化钙和硫酸铜可用于制波尔多液,不符合题意;
C.氢氧化钙腐蚀性较强,不能用来治疗胃酸过多,符合题意;
D.氢氧化钙能与硫酸反应生成硫酸钙和水,可用于处理硫酸厂废水,不符合题意。
故答案为:C。
7.【答案】 C
【解析】A.氢氧化钠吸水没有新的物质生成,属于氢氧化钠的物理性质,不符合题意;
B.白色片状是氢氧化钠的物理性质,不符合题意;
C.碱性是氢氧化钠的化学性质,符合题意;
D.氢氧化钠易吸收空气中的二氧化碳生成碳酸钠和水,有新的物质生成,属于氢氧化钠的化学性质,不符合题意。
故答案为:C。
8.【答案】 C
【解析】物理变化是指没有生成其他物质的变化,化学变化是指生成了其他物质的变化。
A.石灰浆抹墙后,墙壁变硬,生成了碳酸钙,属于化学变化;
B.用稀硫酸除去铁锈,生成氯化铁和水,属于化学变化;
C.用烧碱干燥氮气、氧气,没有生成其他物质,属于物理变化;
D.酚酞试液遇碱性溶液变为红色,生成了其他物质,属于化学变化。
故答案为:C。
9.【答案】 B
【解析】A. 氧气不能与氢氧化钠反应,所以氧气能用固体氢氧化钠干燥,故不符合题意;
B. 二氧化碳能与氢氧化钠反应生成碳酸钠和水,所以不能用固体氢氧化钠干燥,故符合题意;
C. 氢气不能与氢氧化钠反应,所以氢气能用固体氢氧化钠干燥,故不符合题意;
D. 一氧化碳不能与氢氧化钠反应,所以一氧化碳能用固体氢氧化钠干燥,故不符合题意;
故答案为:B。
10.【答案】 B
【解析】选用试剂进行鉴别,所选物质要与待鉴别物质混合出现不同的现象。稀硫酸显酸性,烧碱溶液显碱性,氯化钠溶液显中性。A. 酚酞遇碱性溶液变红,遇中性、酸性溶液不变色,不符合题意;
B. 石蕊遇酸性溶液变红,遇碱性溶液变蓝,遇中性溶液不变色,符合题意;
C. 澄清石灰水不与氯化钠溶液反应,无现象,不与烧碱溶液反应,无现象,与稀硫酸反应生成的硫酸钙微溶于水,可能会出现白色沉淀,不符合题意;
D. 稀盐酸不与稀硫酸反应,无现象,不与氯化钠溶液反应,无现象,与烧碱溶液反应,但无现象,不符合题意。
故答案为:B。
11.【答案】 C
【解析】A. 0~t1段注入氢氧化钠溶液注入液体压缩了瓶内的气体,所以其实阶段压强都快速增大,故不符合题意;
B. t1~t2段曲线呈现这种形态是氢氧化钠注入氢氧化钠和二氧化碳缓慢反应,故不符合题意;
C. 根据图可知,t3时烧瓶内压强由大到小的顺序是a>b>c,故符合题意;
D. a、b、c三种曲线所示的实验中,压强越大,说明吸收的二氧化碳体积越小,t3时被吸收的二氧化碳的体积由大到小的顺序是c>b>a,故不符合题意。
故答案为:C。
12.【答案】 (1)推入NaOH溶液比推入等体积的水后瓶中压强减小得更多
(2)
(3)氢氧化钠与二氧化碳反应放热
【解析】(1)由图可知,加入氢氧化钠溶液后装置内压强会大幅度减小,那么可以说明此时装置内的二氧化碳被消耗,且由加入水时压强先增加后不变可知,二氧化碳是与氢氧化钠反应消耗了,由此可看出二氧化碳可以与氢氧化钠反应,故①填:推入NaOH溶液比推入等体积的水后瓶中压强减小得更多。
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,化学反应方程式为: 。
(3)由图可知,将氢氧化钠溶液加入到装置内后,温度逐渐升高,说明二氧化碳和氢氧化钠反应时会放热,故③填:氢氧化钠与二氧化碳反应放热。
【能力提升】
1.【答案】 C
【解析】治疗胃酸(主要成分是HCl)过多,可服用含Al(OH)3 的药片,制取这类药物不可以使用KOH替代 ,是因为氢氧化钾具有强烈的腐蚀性。
故答案为:C。
2.【答案】 D
【解析】A.氢氧化钠溶液中含有钠离子和氢氧根离子,不符合题意;
B.氢氧化钠不能和氧化镁、氧化铜反应,不符合题意;
C.氢氧化钠和二氧化碳反应生成碳酸钠和水,无明显现象,不能检验二氧化碳,不符合题意;
D.工业上,可以通过电解食盐水制取氢氧化钠,符合题意。
故答案为:D。
3.【答案】C
【解析】A. 浓盐酸有挥发性,敞口放置,溶液的质量变小,也不变质, 生石灰敞口放置时,能与空气中的水反应生成氢氧化钙,质量增加且变质,不符合题意;
B. 熟石灰敞口放置时能与二氧化碳反应生成碳酸钙质量增加且变质,苛性钠即氢氧化钠,敞口放置时能与二氧化碳反应生成碳酸钠质量增加且变质,不符合题意;
C. 浓硫酸有吸水性,敞口放置时,吸收空气中的水质量增加但不变质,火碱即氢氧化钠,敞口放置时能与二氧化碳反应生成碳酸钠质量增加且变质,符合题意;
D. 生石灰敞口放置时,能与空气中的水反应生成氢氧化钙,质量增加且变质; 熟石灰熟石灰敞口放置时能与二氧化碳反应生成碳酸钙质量增加且变质,不符合题意。
故答案为:C。
4.【答案】A
【解析】A.A中的浓氨水挥发出氨气,氨分子不断运动到B中,溶于水形成氨水,氨水使酚酞溶液变红,说法符合题意;
B.盐酸虽然有挥发性,但是酚酞遇酸不变色,说法不符合题意;
C.甲装置中B烧杯中溶液变红,可以证明分子在不断地运动,乙装置中没有颜色的变化,不能证明分子在不断地运动,说法不符合题意;
D.浓氨水有碱性且易挥发,浓氢氧化钠溶液有碱性但无挥发性,就不会使B烧杯中溶液变红,就不能达到实验目的,说法不符合题意。
故答案为:A。
5.【答案】 C
【解析】A.碱溶液能跟某些非金属氧化物反应,但碱溶液能不能吸收CO气体,此选项不符合题意;
B.置换反应生成单质和化合物,但有单质和化合物生成的反应不一定是置换反应,如过氧化氢分解生成水和氧气的反应属于分解反应,此选项不符合题意;
C.化学变化中分子种类发生改变,新的分子构成新的物质,有新物质生成的变化一定是化学变化,故分子种类发生改变的变化一定是化学变化,此选项符合题意;
D.溶液一定是均一、稳定的,但均一、稳定的物质不一定是溶液,如水、酒精具有均一性、稳定性,但不是溶液,此选项不符合题意。
故答案为:C。
6.【答案】 (1)氢气;
(2)铝表面有一层致密的氧化铝薄膜
(3)不能
(4)
(5)振荡锥形瓶
(6)澄清石灰水
(7)密封
【解析】(1)该实验产生的气体能够燃烧,参与反应的元素为Na、Al、O、H,能够形成可燃气体的只能是氢气,故①为氢气,又因反应一段时间后才产生气泡,则反应物为Al和NaOH,方程式②为:2NaOH + 2H2O + 2 Al= 2NaAlO2+ 3H2↑ ;
(2)实验开始时无明显现象是因为铝表面有一层致密的氧化铝(Al2O3)薄膜,且氧化铝与氢氧化钠反应无明显现象,故③为铝表面有一层致密的氧化铝(Al2O3)薄膜;NaOH与氧化铝和单质铝均会发生反应,所以疏通剂不能铝制管道的疏通,故④为不能;
实验分析
(4)甲中是石灰水与二氧化碳生成碳酸钙沉淀,乙中是氢氧化钠与二氧化碳反应,故方程式⑤:2NaOH+CO2=Na2CO3+H2O;
(5)甲乙两瓶均为收集满的二氧化碳,初始压强相同,注射器注入液体,压强增高,反应开始后二氧化碳消耗压强降低,CD段压强快速变小是因为振荡锥形瓶,加快反应速率,故⑥为振荡锥形瓶;
(6)BC压强降低慢,说明反应相对缓慢,二氧化碳与氢氧化钠反应更快,则曲线1为澄清石灰水的反应,故⑦为澄清石灰水;
(7)拓展延伸 通过上述探究,NaOH和Ca(OH)2均易与二氧化碳反应,且空气中存在二氧化碳,所以实验室中NaOH和Ca(OH)2应密封保存,故⑧为密封。
1
第3课时 常见的碱
【基础训练】
1.下列物质必须密封保存的是( )
A.木炭 B.氢氧化钠
C.石灰石 D.氯化钠
2.常用于改良酸性土壤的物质是( )
A. 熟石灰 B. 烧碱
C. 硝酸钾 D. 硫酸铵
3.下列物质常温下露置在空气中,放置一段时间后,因发生化学反应而质量增加的是( )
A. 浓硫酸 B. 浓盐酸
C. 氢氧化钠 D. 氯化钠
4.下列溶液在空气中敞口久置,因发生化学变化导致溶液质量减小的是( )
A. 浓盐酸 B. 浓硫酸
C. 石灰水 D. 烧碱溶液
5.下列关于氢氧化钠的描述中错误的是( )
A. 对皮肤有强烈的腐蚀作用 B. 其水溶液能使石蕊溶液变红
C. 能去除油污,可作炉具清洁剂 D. 易溶于水,溶解时放出热量
6.石灰窑一“宁德被人遗忘的古代科技文明”,其生产的熟石灰不能用于( )
A. 建筑材料 B. 制波尔多液
C. 治疗胃酸过多 D. 处理硫酸厂废水
7.下列判断错误的是( )
A. NaOH固体有吸水性——物理性质
B. NaOH固体为白色片状——物理性质
C. NaOH固体溶于水得到的溶液显碱性——物理性质
D. NaOH固体放在空气中易变质——化学性质
8.下列物质的变化属于物理变化的是( )
A. 石灰浆抹墙后,墙壁变硬 B. 用稀硫酸除去铁锈
C. 用烧碱干燥氮气、氧气 D. 酚酞试液遇碱性溶液变为红色
9.下列气体中不能用固体氢氧化钠干燥的是( )
A. O2 B. CO2
C. H2 D. CO
10.能鉴别稀硫酸、烧碱溶液、氯化钠溶液的试剂是( )
A.酚酞 B.石蕊
C.澄清石灰水 D.稀盐酸
11.某兴趣小组利用压强传感器研究氢氧化钠溶液吸收二氧化碳的情况。用3个250 mL的烧瓶收集满纯净的二氧化碳,连接压强传感器,同时采集数据,用注射器同时等速度分别注入三种不同浓度的氢氧化钠溶液各15 mL,片刻后,同时振荡烧瓶,等待反应完成。采集的数据如图所示。下列说法正确的是( )
A. 0~t1段曲线呈现这种形态是因为注入氢氧化钠溶液后未进行振荡
B. t1~t2段曲线呈现这种形态是因为注入氢氧化钠溶液后进行振荡
C. a、b、c三种曲线所示的实验中,t3时烧瓶内压强由大到小的顺序是a>b>c
D. a、b、c三种曲线所示的实验中,t3时被吸收的二氧化碳的体积由大到小的顺序是a>b>c
12.利用图1装置研究NaOH与CO2的反应。用等体积的氢氧化钠溶液、水分别进行实验,将注射器内液体全部推入,测得一段时间内温度和压强的变化如图2、图3所示。
(1)图2可说明NaOH与CO2发生了化学反应,其依据是___________。
(2)写出NaOH与CO2发生反应的化学方程式______________________。
(3)由图3可得到的结论是______________________。
【能力提升】
1.治疗胃酸(主要成分是HCl)过多,可服用含Al(OH)3 的药片,制取这类药物不可以使用KOH替代Al(OH)3 ,最不科学的理由是( )
A.KOH与胃酸不反应 B.KOH易溶于水
C.KOH有强烈的腐蚀性 D.Al(OH)3的来源更广泛
2.氢氧化钠俗名苛性钠、火碱或烧碱。下列关于氢氧化钠的认识,正确的是( )
A. 其水溶液中有 Na+、O2-、H+这三种离子
B. 能与 MgO、CuO 等金属氧化物发生反应
C. 其水溶液常用来检验 CO2气体
D. 工业上可以氯化钠为原料来制得
3.有些物质暴露在空气中会发生一些变化,下列各组物质中,前者质量增加而不变质,后者质量增加且变质的是( )
A. 浓盐酸 生石灰 B. 熟石灰 苛性钠
C. 浓硫酸 火碱 D. 生石灰 熟石灰
4.某化学兴趣小组的同学设计了如图所示的探究分子运动现象的实验装置。下列说法正确的是( )
A. 甲装置中的现象为B烧杯中溶液变红
B. 乙装置中的现象为中心蘸有酚酞溶液的滤纸变红
C. 两个实验装置都可以证明分子在不断地运动
D. 将甲装置中的浓氨水换为浓氢氧化钠溶液也可以达到实验目的
5.推理是化学学习中常用的思维方法,下列推理正确的是( )
A.碱溶液能跟某些非金属氧化物反应,故碱溶液能吸收CO气体
B.置换反应生成单质和化合物,故有单质和化合物生成的反应一定是置换反应
C.化学变化中分子种类发生改变,故分子种类发生改变的变化一定是化学变化
D.溶液一定是均一、稳定的,故均一、稳定的物质一定是溶液
6.氢氧化钠是一种重要的化工原料,广泛应用于肥皂、造纸、纺织和印染等工业。某兴趣小组对氢氧化钠的性质进行下图所示的探究实验:
(1)探究一:NaOH溶液与Al的反应
(査阅资料)
①氢氧化钠、铝和水常温下反应生成偏铝酸钠( NaAlO2)和一种气体;
②铝表面有一层致密的氧化铝(Al2O3)薄膜;
③
(实验设计)按图I装置进行探究,实验开始时无明显现象,反应一段时间后,有气泡产生,用点燃的木条检验产生的气体,气体能够燃烧。
(实验分析)
该实验产生的气体是________,反应的化学方程式为________。
(2)实验开始时无明显现象的原因是________。
(3)(拓展延伸)NaOH是管道疏通剂的主要成分,管道疏通剂一般________(填“能”或“不能”)用于铝制管道的疏通。
(4)探究二:利用数字化传感器探究NaOH与CO2的反应
(实验方案)在锥形瓶内收集满CO2, 按图Ⅱ进行实验,将注射器内的液体同时迅速注入锥形瓶内,关闭活塞,t1时刻,同时振荡锥形瓶,观察到甲中有白色沉淀生成,乙中无明显现象,通过压强传感器测得锥形瓶内压强随时间的变化如图Ⅲ所示。
(实验分析)
乙中发生反应的化学方程式为________。
(5)导致CD段压强快速变小的原因是________。
(6)通过图Ⅲ可知,曲线1的注射器里装的溶液是________(填“NaOH溶液”或“澄清石灰水”)。
(7)(拓展延伸)通过上述探究,实验室中NaOH和Ca(OH)2应________保存。
参考答案
【基础练习】
1.【答案】 B
【解析】氢氧化钠会与空气中的二氧化碳、水发生反应导致变质,所以需密封保存。
故答案为:B。
2.【答案】 A
【解析】A.熟石灰是氢氧化钙的俗称,具有碱性,常用于改良酸性土壤,故A符合题意;
B.烧碱是氢氧化钠的俗称,具有强烈的腐蚀性,不能用于改良酸性土壤,故B不符合题意;
C.硝酸钾不显碱性,不能用于改良酸性土壤,故C不符合题意;
D.硫酸铵显酸性,用于改良碱性土壤,故D不符合题意;
故答案为:A。
3.【答案】 C
【解析】A.浓硫酸具有吸水性,放置在空气中会吸收空气中的水分,使其质量增加,但发生的是物理变化,不符合题意;
B.浓盐酸具有挥发性,会使其质量减少,不符合题意;
C.氢氧化钠敞口放置在空气中,能与空气中的二氧化碳发生化学反应生成碳酸钠和水,发生了化学反应导致质量增加,符合题意;
D.氯化钠固体不与空气中的成分发生化学反应,质量不变,不符合题意。
故答案为:C。
4.【答案】 C
【解析】A.浓盐酸易挥发,导致溶液的质量减小,但未发生化学变化,故A不符合题意;
B.浓硫酸易吸水,导致溶液的质量增大,故B不符合题意;
C.石灰水与空气中的二氧化碳反应生成碳酸钙沉淀和水,溶液中增加二氧化碳的质量小于减少的碳酸钙沉淀的质量,因发生化学变化导致溶液的质量减小,故C符合题意;
D.烧碱溶液中的氢氧化钠与二氧化碳反应生成碳酸钠和水,溶液增加二氧化碳的质量,故D不符合题意。
故答案为:C。
5.【答案】 B
【解析】A.氢氧化钠具有强腐蚀性,能够腐蚀皮肤,故A不符合题意;
B.氢氧化钠溶液是碱性的,能使紫色石蕊变蓝色,故B符合题意;
C.炉具清洁剂中含义氢氧化钠和油污能够反应,故C不符合题意;
D.氢氧化钠溶解放出热量,故D不符合题意。
故答案为:B。
6.【答案】 C
【解析】A.氢氧化钙能与二氧化碳反应生成碳酸钙,可用作建筑材料,不符合题意;
B.氢氧化钙和硫酸铜可用于制波尔多液,不符合题意;
C.氢氧化钙腐蚀性较强,不能用来治疗胃酸过多,符合题意;
D.氢氧化钙能与硫酸反应生成硫酸钙和水,可用于处理硫酸厂废水,不符合题意。
故答案为:C。
7.【答案】 C
【解析】A.氢氧化钠吸水没有新的物质生成,属于氢氧化钠的物理性质,不符合题意;
B.白色片状是氢氧化钠的物理性质,不符合题意;
C.碱性是氢氧化钠的化学性质,符合题意;
D.氢氧化钠易吸收空气中的二氧化碳生成碳酸钠和水,有新的物质生成,属于氢氧化钠的化学性质,不符合题意。
故答案为:C。
8.【答案】 C
【解析】物理变化是指没有生成其他物质的变化,化学变化是指生成了其他物质的变化。
A.石灰浆抹墙后,墙壁变硬,生成了碳酸钙,属于化学变化;
B.用稀硫酸除去铁锈,生成氯化铁和水,属于化学变化;
C.用烧碱干燥氮气、氧气,没有生成其他物质,属于物理变化;
D.酚酞试液遇碱性溶液变为红色,生成了其他物质,属于化学变化。
故答案为:C。
9.【答案】 B
【解析】A. 氧气不能与氢氧化钠反应,所以氧气能用固体氢氧化钠干燥,故不符合题意;
B. 二氧化碳能与氢氧化钠反应生成碳酸钠和水,所以不能用固体氢氧化钠干燥,故符合题意;
C. 氢气不能与氢氧化钠反应,所以氢气能用固体氢氧化钠干燥,故不符合题意;
D. 一氧化碳不能与氢氧化钠反应,所以一氧化碳能用固体氢氧化钠干燥,故不符合题意;
故答案为:B。
10.【答案】 B
【解析】选用试剂进行鉴别,所选物质要与待鉴别物质混合出现不同的现象。稀硫酸显酸性,烧碱溶液显碱性,氯化钠溶液显中性。A. 酚酞遇碱性溶液变红,遇中性、酸性溶液不变色,不符合题意;
B. 石蕊遇酸性溶液变红,遇碱性溶液变蓝,遇中性溶液不变色,符合题意;
C. 澄清石灰水不与氯化钠溶液反应,无现象,不与烧碱溶液反应,无现象,与稀硫酸反应生成的硫酸钙微溶于水,可能会出现白色沉淀,不符合题意;
D. 稀盐酸不与稀硫酸反应,无现象,不与氯化钠溶液反应,无现象,与烧碱溶液反应,但无现象,不符合题意。
故答案为:B。
11.【答案】 C
【解析】A. 0~t1段注入氢氧化钠溶液注入液体压缩了瓶内的气体,所以其实阶段压强都快速增大,故不符合题意;
B. t1~t2段曲线呈现这种形态是氢氧化钠注入氢氧化钠和二氧化碳缓慢反应,故不符合题意;
C. 根据图可知,t3时烧瓶内压强由大到小的顺序是a>b>c,故符合题意;
D. a、b、c三种曲线所示的实验中,压强越大,说明吸收的二氧化碳体积越小,t3时被吸收的二氧化碳的体积由大到小的顺序是c>b>a,故不符合题意。
故答案为:C。
12.【答案】 (1)推入NaOH溶液比推入等体积的水后瓶中压强减小得更多
(2)
(3)氢氧化钠与二氧化碳反应放热
【解析】(1)由图可知,加入氢氧化钠溶液后装置内压强会大幅度减小,那么可以说明此时装置内的二氧化碳被消耗,且由加入水时压强先增加后不变可知,二氧化碳是与氢氧化钠反应消耗了,由此可看出二氧化碳可以与氢氧化钠反应,故①填:推入NaOH溶液比推入等体积的水后瓶中压强减小得更多。
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,化学反应方程式为: 。
(3)由图可知,将氢氧化钠溶液加入到装置内后,温度逐渐升高,说明二氧化碳和氢氧化钠反应时会放热,故③填:氢氧化钠与二氧化碳反应放热。
【能力提升】
1.【答案】 C
【解析】治疗胃酸(主要成分是HCl)过多,可服用含Al(OH)3 的药片,制取这类药物不可以使用KOH替代 ,是因为氢氧化钾具有强烈的腐蚀性。
故答案为:C。
2.【答案】 D
【解析】A.氢氧化钠溶液中含有钠离子和氢氧根离子,不符合题意;
B.氢氧化钠不能和氧化镁、氧化铜反应,不符合题意;
C.氢氧化钠和二氧化碳反应生成碳酸钠和水,无明显现象,不能检验二氧化碳,不符合题意;
D.工业上,可以通过电解食盐水制取氢氧化钠,符合题意。
故答案为:D。
3.【答案】C
【解析】A. 浓盐酸有挥发性,敞口放置,溶液的质量变小,也不变质, 生石灰敞口放置时,能与空气中的水反应生成氢氧化钙,质量增加且变质,不符合题意;
B. 熟石灰敞口放置时能与二氧化碳反应生成碳酸钙质量增加且变质,苛性钠即氢氧化钠,敞口放置时能与二氧化碳反应生成碳酸钠质量增加且变质,不符合题意;
C. 浓硫酸有吸水性,敞口放置时,吸收空气中的水质量增加但不变质,火碱即氢氧化钠,敞口放置时能与二氧化碳反应生成碳酸钠质量增加且变质,符合题意;
D. 生石灰敞口放置时,能与空气中的水反应生成氢氧化钙,质量增加且变质; 熟石灰熟石灰敞口放置时能与二氧化碳反应生成碳酸钙质量增加且变质,不符合题意。
故答案为:C。
4.【答案】A
【解析】A.A中的浓氨水挥发出氨气,氨分子不断运动到B中,溶于水形成氨水,氨水使酚酞溶液变红,说法符合题意;
B.盐酸虽然有挥发性,但是酚酞遇酸不变色,说法不符合题意;
C.甲装置中B烧杯中溶液变红,可以证明分子在不断地运动,乙装置中没有颜色的变化,不能证明分子在不断地运动,说法不符合题意;
D.浓氨水有碱性且易挥发,浓氢氧化钠溶液有碱性但无挥发性,就不会使B烧杯中溶液变红,就不能达到实验目的,说法不符合题意。
故答案为:A。
5.【答案】 C
【解析】A.碱溶液能跟某些非金属氧化物反应,但碱溶液能不能吸收CO气体,此选项不符合题意;
B.置换反应生成单质和化合物,但有单质和化合物生成的反应不一定是置换反应,如过氧化氢分解生成水和氧气的反应属于分解反应,此选项不符合题意;
C.化学变化中分子种类发生改变,新的分子构成新的物质,有新物质生成的变化一定是化学变化,故分子种类发生改变的变化一定是化学变化,此选项符合题意;
D.溶液一定是均一、稳定的,但均一、稳定的物质不一定是溶液,如水、酒精具有均一性、稳定性,但不是溶液,此选项不符合题意。
故答案为:C。
6.【答案】 (1)氢气;
(2)铝表面有一层致密的氧化铝薄膜
(3)不能
(4)
(5)振荡锥形瓶
(6)澄清石灰水
(7)密封
【解析】(1)该实验产生的气体能够燃烧,参与反应的元素为Na、Al、O、H,能够形成可燃气体的只能是氢气,故①为氢气,又因反应一段时间后才产生气泡,则反应物为Al和NaOH,方程式②为:2NaOH + 2H2O + 2 Al= 2NaAlO2+ 3H2↑ ;
(2)实验开始时无明显现象是因为铝表面有一层致密的氧化铝(Al2O3)薄膜,且氧化铝与氢氧化钠反应无明显现象,故③为铝表面有一层致密的氧化铝(Al2O3)薄膜;NaOH与氧化铝和单质铝均会发生反应,所以疏通剂不能铝制管道的疏通,故④为不能;
实验分析
(4)甲中是石灰水与二氧化碳生成碳酸钙沉淀,乙中是氢氧化钠与二氧化碳反应,故方程式⑤:2NaOH+CO2=Na2CO3+H2O;
(5)甲乙两瓶均为收集满的二氧化碳,初始压强相同,注射器注入液体,压强增高,反应开始后二氧化碳消耗压强降低,CD段压强快速变小是因为振荡锥形瓶,加快反应速率,故⑥为振荡锥形瓶;
(6)BC压强降低慢,说明反应相对缓慢,二氧化碳与氢氧化钠反应更快,则曲线1为澄清石灰水的反应,故⑦为澄清石灰水;
(7)拓展延伸 通过上述探究,NaOH和Ca(OH)2均易与二氧化碳反应,且空气中存在二氧化碳,所以实验室中NaOH和Ca(OH)2应密封保存,故⑧为密封。
1
同课章节目录
