人教版(2019)高中化学必修第二册《化工生产中的重要非金属元素》学案
文档属性
| 名称 | 人教版(2019)高中化学必修第二册《化工生产中的重要非金属元素》学案 | 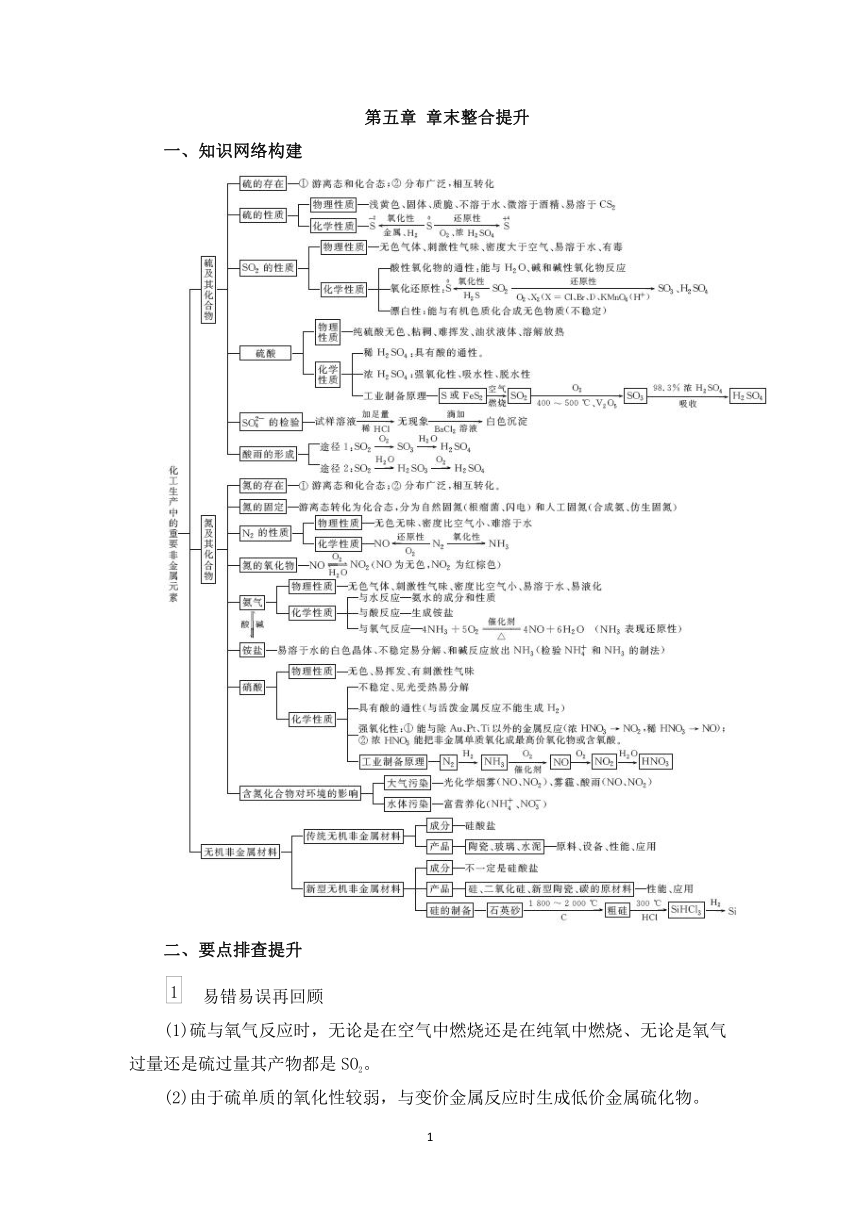 | |
| 格式 | docx | ||
| 文件大小 | 84.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-30 08:04:18 | ||
图片预览


文档简介
第五章 章末整合提升
一、知识网络构建
二、要点排查提升
易错易误再回顾
(1)硫与氧气反应时,无论是在空气中燃烧还是在纯氧中燃烧、无论是氧气过量还是硫过量其产物都是SO2。[来源:学科
(2)由于硫单质的氧化性较弱,与变价金属反应时生成低价金属硫化物。
(3)洗去试管内壁上沾有的硫可用热的NaOH溶液和CS2,但原理不同,用热的NaOH溶液洗涤是由于发生反应生成了可溶性物质,用CS2洗涤是由于溶解了硫。
(4)并不是所有与SO2有关的褪色现象都属于SO2的漂白性,如①SO2能使滴有酚酞的NaOH溶液褪色是因为SO2与碱发生反应;②SO2能使溴水和酸性KMnO4溶液褪色是因为SO2的还原性。[]
(5)SO2不能漂白酸碱指示剂,例如SO2能使紫色石蕊试液变红色,但不褪色。
(6)虽说SO2有毒,但不超过国家规定的使用范围和最大使用量,还可用作食品添加剂。
(7)SO2和CO2都能使澄清石灰水变浑浊,检验SO2和CO2混合气体中既有CO2又有SO2的方法是先用品红溶液检验出SO2,然后用酸性KMnO4溶液除去SO2,再用澄清石灰水检验CO2。
(8)SO2、活性炭和HClO、Na2O2的漂白原理不相同,HClO、Na2O2的漂白是因为具有强氧化性, SO2的漂白原理是与有色物质化合形成无色物质,活性炭的漂白是由于具有吸附性。
(9)检验SO时既不能用Ba(NO3)2溶液也不能用硝酸酸化,因为在酸性条件下,SO、HSO等会被溶液中的NO氧化为SO。
(10)常温下,Fe、Al遇到浓H2SO4、浓HNO3会发生“钝化”,“钝化”不是不反应,而是生成的致密氧化膜阻止了金属继续反应。
(11)NO容易和空气中的O2反应,只能用排水法收集,NO2与H2O反应,只能用向上排空气法收集。
(12)氨是中学阶段学习的唯一溶于水,并且其水溶液显碱性的气体,但氨气本身没碱性。
(13)氨水中氮元素主要以NH3·H2O的形式存在,但氨水的溶质是NH3而非NH3·H2O。
(14)铵盐与碱在溶液中反应,若加热或为浓溶液,生成NH3和H2O,若为稀溶液,生成NH3·H2O。
(15)实验室不能用加热NH4Cl的方法制取NH3,因为生成的NH3和HCl遇冷重新结合生成NH4Cl;一般也不用NH4NO3、NH4HCO3与碱加热制NH3,因为NH4NO3受热易爆炸,NH4HCO3易分解而产生杂质;还不能用NaOH固体代替Ca(OH)2固体,因为用NaOH固体与铵盐反应时易结块,且腐蚀试管。
(16)CaCl2虽说是中性干燥剂,但由于能与NH3反应生成配合物CaCl2·8NH3,所以不能用CaCl2干燥NH3。
(17)金属和硝酸反应不能生成氢气是由于硝酸中NO的氧化能力大于H+。
(18)把浓HNO3滴到紫色石蕊试纸上的现象是先变红后褪色,先变红是因为硝酸具有酸性,后褪色是因为浓硝酸有强氧化性,将石蕊氧化而使红色褪去。
(19)酸性条件下NO表现出强氧化性,但中性和碱性溶液中NO无氧化性。
(20)单晶硅由于具有良好的半导体性能可用于制造芯片和太阳能电池;二氧化硅具有良好的传输光信号的性能,可用于制造光导纤维。
(21)传统无机非金属材料都是以含硅物质为原料,经过高温发生复杂的物理、化学变化制成的硅酸盐产品。新型无机非金属材料的的成分大都不是硅酸盐。
重要方程式再书写
写出下列反应的化学方程式,是离子反应的写出离子方程式。
(1)S溶于热的烧碱溶液生成两种钠盐: 3S+6OH-2S2-+SO+3H2O ;
(2)把H2S气体通入CuSO4溶液中: H2S+Cu2+==CuS↓+2H+ ;
(3)Na2S溶液在空气中放置变浑浊: 2S2-+O2+2H2O==2S↓+4OH- ;
(4)将SO2气体通入到氢硫酸中: SO2+2H2S==3S↓+2H2O ;
(5)把H2S气体通入到FeCl3溶液中: H2S+2Fe3+==S↓+2Fe2++2H+ ;
(6)SO2通入足量的澄清石灰水: SO2+Ca2++2OH-==CaSO3↓+H2O ;
(7)SO2通入溴水中,使溴水褪色: SO2+Br2+2H2O==SO+2Br-+4H+ ;
(8)用足量氨水吸收SO2尾气: 2NH3·H2O+SO2==2NH+SO+H2O ;
(9)Cu和浓硫酸的反应: Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O ;
(10)C和浓硫酸反应: C+2H2SO4(浓)CO2↑+2SO2↑+2H2O ;
(11)浓H2SO4与Na2SO3固体反应: H2SO4(浓)+Na2SO3==Na2SO4+H2O+SO2↑ ;
(12)把NH3通入水中: NH3+H2ONH3·H2ONH+OH- ;
(13)用NH4Cl固体和Ca(OH)2固体混合加热制备NH3: 2NH4Cl+Ca(OH)22NH3↑+2H2O+CaCl2 ;
(14)NH3的催化氧化: 4NH3+5O24NO+6H2O ;
(15)NH4HCO3溶液中加入过量稀NaOH溶液: NH+HCO+2OH-==NH3·H2O+CO+H2O ;
(16)NO2溶于水: 3NO2+H2O==2H++2NO+NO ;[]
(17)NO2被烧碱溶液吸收生成两种钠盐: 2NO2+2OH-==NO+NO+H2O ;
(18)物质的量之比为1∶1的NO和NO2混合气体恰好被烧碱溶液吸收生成一种钠盐: NO+NO2+2OH-==2NO+H2O ;[]
(19)Cu和稀HNO3的反应: 3Cu+8H++2NO==3Cu2++2NO↑+4H2O ;
(20)Cu和浓HNO3的反应: Cu+4H++2NO==Cu2++2NO2↑+2H2O ;
(21)Fe和过量稀HNO3的反应: Fe+4H++NO==Fe3++NO↑+2H2O ;
(22)C和浓HNO3的反应: C+4H++4NOCO2↑+4NO2↑+2H2O ;
(23)浓硝酸见光分解: 4HNO3(浓)4NO2↑+O2↑+2H2O ;
(24)粗硅的制备: SiO2+2CSi+2CO↑ ;
(25)粗硅的提纯: Si+3HClSiHCl3+H2、SiHCl3+H2Si+3HCl 。
答题语言再规范
(1)检验SO2和CO2混合气体中既有CO2又有SO2的方法是:__将气体依次通入品红溶液(溶液褪色,检验SO2)—酸性KMnO4溶液(溶液颜色变浅或褪色,除SO2)—品红溶液(红色不褪,检验SO2已除尽)—澄清石灰水(石灰水变浑浊,检验CO2)__。
(2)SO的检验方法:__取少量试样于试管中,先加入足量的稀盐酸酸化,若无沉淀,再加入适量的BaCl2溶液,若有无白色沉淀生成,则含有SO__。[]
(3)NH的检验方法:__取少量试样于试管中,加入适量氢氧化钠溶液并加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则含有NH__。
1
一、知识网络构建
二、要点排查提升
易错易误再回顾
(1)硫与氧气反应时,无论是在空气中燃烧还是在纯氧中燃烧、无论是氧气过量还是硫过量其产物都是SO2。[来源:学科
(2)由于硫单质的氧化性较弱,与变价金属反应时生成低价金属硫化物。
(3)洗去试管内壁上沾有的硫可用热的NaOH溶液和CS2,但原理不同,用热的NaOH溶液洗涤是由于发生反应生成了可溶性物质,用CS2洗涤是由于溶解了硫。
(4)并不是所有与SO2有关的褪色现象都属于SO2的漂白性,如①SO2能使滴有酚酞的NaOH溶液褪色是因为SO2与碱发生反应;②SO2能使溴水和酸性KMnO4溶液褪色是因为SO2的还原性。[]
(5)SO2不能漂白酸碱指示剂,例如SO2能使紫色石蕊试液变红色,但不褪色。
(6)虽说SO2有毒,但不超过国家规定的使用范围和最大使用量,还可用作食品添加剂。
(7)SO2和CO2都能使澄清石灰水变浑浊,检验SO2和CO2混合气体中既有CO2又有SO2的方法是先用品红溶液检验出SO2,然后用酸性KMnO4溶液除去SO2,再用澄清石灰水检验CO2。
(8)SO2、活性炭和HClO、Na2O2的漂白原理不相同,HClO、Na2O2的漂白是因为具有强氧化性, SO2的漂白原理是与有色物质化合形成无色物质,活性炭的漂白是由于具有吸附性。
(9)检验SO时既不能用Ba(NO3)2溶液也不能用硝酸酸化,因为在酸性条件下,SO、HSO等会被溶液中的NO氧化为SO。
(10)常温下,Fe、Al遇到浓H2SO4、浓HNO3会发生“钝化”,“钝化”不是不反应,而是生成的致密氧化膜阻止了金属继续反应。
(11)NO容易和空气中的O2反应,只能用排水法收集,NO2与H2O反应,只能用向上排空气法收集。
(12)氨是中学阶段学习的唯一溶于水,并且其水溶液显碱性的气体,但氨气本身没碱性。
(13)氨水中氮元素主要以NH3·H2O的形式存在,但氨水的溶质是NH3而非NH3·H2O。
(14)铵盐与碱在溶液中反应,若加热或为浓溶液,生成NH3和H2O,若为稀溶液,生成NH3·H2O。
(15)实验室不能用加热NH4Cl的方法制取NH3,因为生成的NH3和HCl遇冷重新结合生成NH4Cl;一般也不用NH4NO3、NH4HCO3与碱加热制NH3,因为NH4NO3受热易爆炸,NH4HCO3易分解而产生杂质;还不能用NaOH固体代替Ca(OH)2固体,因为用NaOH固体与铵盐反应时易结块,且腐蚀试管。
(16)CaCl2虽说是中性干燥剂,但由于能与NH3反应生成配合物CaCl2·8NH3,所以不能用CaCl2干燥NH3。
(17)金属和硝酸反应不能生成氢气是由于硝酸中NO的氧化能力大于H+。
(18)把浓HNO3滴到紫色石蕊试纸上的现象是先变红后褪色,先变红是因为硝酸具有酸性,后褪色是因为浓硝酸有强氧化性,将石蕊氧化而使红色褪去。
(19)酸性条件下NO表现出强氧化性,但中性和碱性溶液中NO无氧化性。
(20)单晶硅由于具有良好的半导体性能可用于制造芯片和太阳能电池;二氧化硅具有良好的传输光信号的性能,可用于制造光导纤维。
(21)传统无机非金属材料都是以含硅物质为原料,经过高温发生复杂的物理、化学变化制成的硅酸盐产品。新型无机非金属材料的的成分大都不是硅酸盐。
重要方程式再书写
写出下列反应的化学方程式,是离子反应的写出离子方程式。
(1)S溶于热的烧碱溶液生成两种钠盐: 3S+6OH-2S2-+SO+3H2O ;
(2)把H2S气体通入CuSO4溶液中: H2S+Cu2+==CuS↓+2H+ ;
(3)Na2S溶液在空气中放置变浑浊: 2S2-+O2+2H2O==2S↓+4OH- ;
(4)将SO2气体通入到氢硫酸中: SO2+2H2S==3S↓+2H2O ;
(5)把H2S气体通入到FeCl3溶液中: H2S+2Fe3+==S↓+2Fe2++2H+ ;
(6)SO2通入足量的澄清石灰水: SO2+Ca2++2OH-==CaSO3↓+H2O ;
(7)SO2通入溴水中,使溴水褪色: SO2+Br2+2H2O==SO+2Br-+4H+ ;
(8)用足量氨水吸收SO2尾气: 2NH3·H2O+SO2==2NH+SO+H2O ;
(9)Cu和浓硫酸的反应: Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O ;
(10)C和浓硫酸反应: C+2H2SO4(浓)CO2↑+2SO2↑+2H2O ;
(11)浓H2SO4与Na2SO3固体反应: H2SO4(浓)+Na2SO3==Na2SO4+H2O+SO2↑ ;
(12)把NH3通入水中: NH3+H2ONH3·H2ONH+OH- ;
(13)用NH4Cl固体和Ca(OH)2固体混合加热制备NH3: 2NH4Cl+Ca(OH)22NH3↑+2H2O+CaCl2 ;
(14)NH3的催化氧化: 4NH3+5O24NO+6H2O ;
(15)NH4HCO3溶液中加入过量稀NaOH溶液: NH+HCO+2OH-==NH3·H2O+CO+H2O ;
(16)NO2溶于水: 3NO2+H2O==2H++2NO+NO ;[]
(17)NO2被烧碱溶液吸收生成两种钠盐: 2NO2+2OH-==NO+NO+H2O ;
(18)物质的量之比为1∶1的NO和NO2混合气体恰好被烧碱溶液吸收生成一种钠盐: NO+NO2+2OH-==2NO+H2O ;[]
(19)Cu和稀HNO3的反应: 3Cu+8H++2NO==3Cu2++2NO↑+4H2O ;
(20)Cu和浓HNO3的反应: Cu+4H++2NO==Cu2++2NO2↑+2H2O ;
(21)Fe和过量稀HNO3的反应: Fe+4H++NO==Fe3++NO↑+2H2O ;
(22)C和浓HNO3的反应: C+4H++4NOCO2↑+4NO2↑+2H2O ;
(23)浓硝酸见光分解: 4HNO3(浓)4NO2↑+O2↑+2H2O ;
(24)粗硅的制备: SiO2+2CSi+2CO↑ ;
(25)粗硅的提纯: Si+3HClSiHCl3+H2、SiHCl3+H2Si+3HCl 。
答题语言再规范
(1)检验SO2和CO2混合气体中既有CO2又有SO2的方法是:__将气体依次通入品红溶液(溶液褪色,检验SO2)—酸性KMnO4溶液(溶液颜色变浅或褪色,除SO2)—品红溶液(红色不褪,检验SO2已除尽)—澄清石灰水(石灰水变浑浊,检验CO2)__。
(2)SO的检验方法:__取少量试样于试管中,先加入足量的稀盐酸酸化,若无沉淀,再加入适量的BaCl2溶液,若有无白色沉淀生成,则含有SO__。[]
(3)NH的检验方法:__取少量试样于试管中,加入适量氢氧化钠溶液并加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则含有NH__。
1
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
