人教版(2019)高中化学必修第二册《化工生产中重要的非金属元素》学考通关(含答案)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册《化工生产中重要的非金属元素》学考通关(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 954.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-30 08:05:31 | ||
图片预览




文档简介
《化工生产中重要的非金属元素》学考通关
一、选择题
1.[重庆巴蜀中学2020高一期中]化学与生产、生活密切相关,下列说法不正确的是
( )
A.液氨可用作制冷剂,工业上常将浓氨水滴入生石灰或固体NaOH中快速制取氨
B.葡萄酒中通常添加少量SO2,既可以杀菌,又可防止营养成分被氧化
C.“明如镜、声如磐”的瓷器由黏土经高温烧结而成,主要化学成分是硅酸盐
D.84消毒液是以NaClO为有效成分的消毒液,与白醋混合可以提升消毒效果
2.下列物质在一定条件下与碳作用所产生的无色气体能与H2S反应的是( )
A.二氧化硅
B.浓硫酸
C.浓硝酸
D.水
3.下列说法正确的是( )
A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.NH3液化时吸收大量的热,因此,氨常用作制冷剂
C.CO2、NO2或SO2都会导致酸雨的形成
D.活性炭、SO2、Na2O2都能使品红溶液褪色,原理不同
4.[山东德州2020高一期末]如图是进行气体性质实验的常用装置,下列对有关实验现象的描述中,不正确的是( )
A.若水槽中盛有水,试管中充满SO2,可看到试管中液面上升
B.若水槽中盛有水,试管中充满NO2,可看到试管中液面上升,液体充满试管
C.若水槽中盛有水(滴有酚酞溶液),试管中是NH3,可看到试管内液面上升,液体呈红色
D.若水槽中盛有NaOH溶液,试管中是Cl2,可看到试管内液面上升,黄绿色褪去
5.下列物质之间的转化都能一步实现的是( )
A.
B.
C.
D.
6.[辽宁省实验中学2020高一期中]利用如图所示装置进行下列实验,能得出相应实验结论的是( )
A.A
B.B
C.C
D.D
7.[山东新泰一中2019高一质检]为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学设计了如图所示的实验。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )
A.原溶液中一定含有SO42-
B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl-
D.原溶液中一定含有Fe3+
8.把3 mol NO2气体依次通过盛有①1 L 1 mol·L-1碳酸钠溶液、②浓硫酸、③足量Na2O2的装置后(假设每一步的反应都是充分的,忽略气体在水中的溶解),再用排水法收集残留气体,则收集到的气体是( )
A.1 mol NO
B.1 mol NO2和0.5 mol O2
C.0.25 mol O2
D.mol NO
9.将气体a通入b中,始终无明显变化的是( )
A.A
B.B
C.C
D.D
10.已知某物质X能发生如图所示转化:
下列有关该转化关系中物质及其反应的叙述错误的是( )
A.若X为N2,则A为硝酸
B.若X为S,则A为硫酸
C.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
D.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
11.将9g铜和铁的混合物投入100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO,若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
A.原混合物中铜和铁各0.065 mol
B.稀硝酸的物质的量浓度为4.0 mol.L-1
C.第一次剩余的4.8 g金属为铜和铁的混合物
D.向反应后的溶液中再加入该稀硝酸100 mL,又得到的NO在标准状况下的体积为0.56 L
二、填空题
12.A、B、C、D均为中学化学常见的物质,且均含有同一种元素,其中A是单质,它们之间存在如图转化关系。
Ⅰ.若D是红棕色气体;B气体溶于水后,溶液为碱性。
(1)请写出A的化学式: ,反应③的化学方程式为 。
(2)D溶于水形成的稀溶液与铜反应的离子方程式为 ,该反应的实验现象为 (写出两条)。
Ⅱ.若B、D既能与强酸溶液反应,又能与强碱溶液反应,反应②③均为强酸条件。
反应④可以通过滴加氨水实现,该反应的离子方程式为 。
请写出A用于焊接铁轨的化学方程式: 。
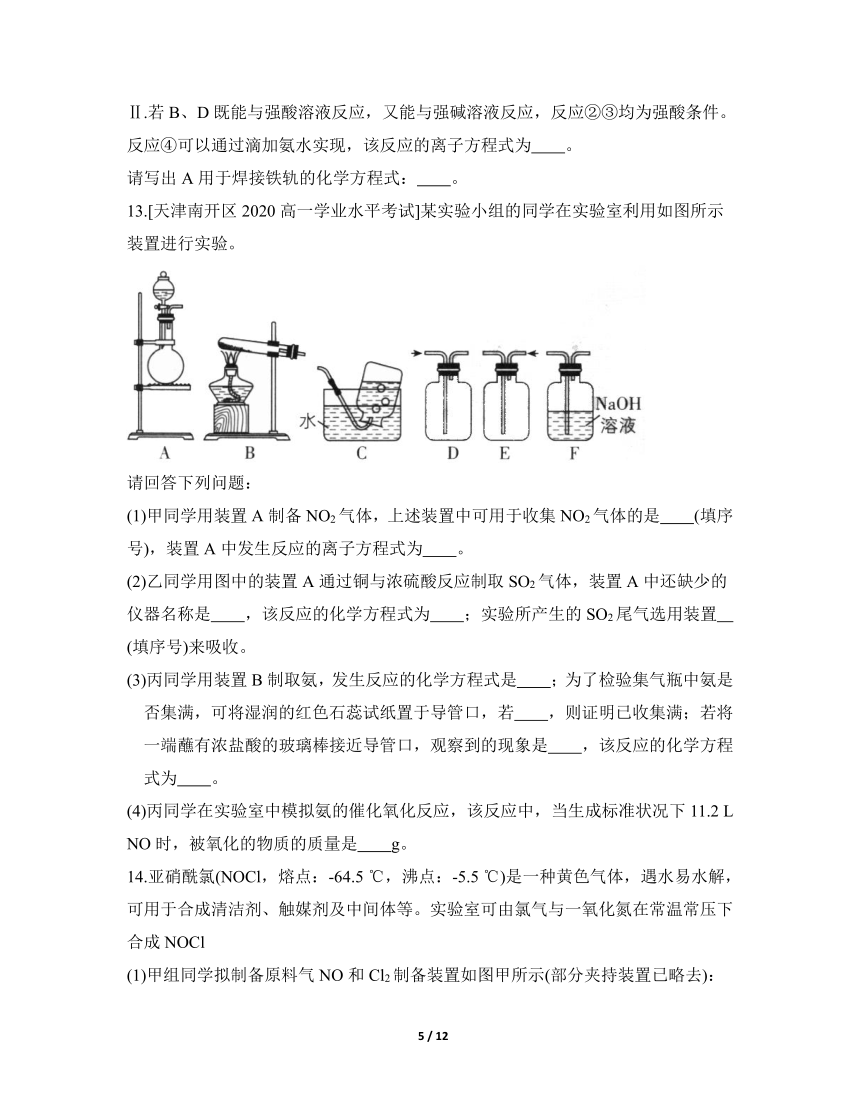
13.[天津南开区2020高一学业水平考试]某实验小组的同学在实验室利用如图所示装置进行实验。
请回答下列问题:
(1)甲同学用装置A制备NO2气体,上述装置中可用于收集NO2气体的是 (填序号),装置A中发生反应的离子方程式为 。
(2)乙同学用图中的装置A通过铜与浓硫酸反应制取SO2气体,装置A中还缺少的仪器名称是 ,该反应的化学方程式为 ;实验所产生的SO2尾气选用装置 (填序号)来吸收。
(3)丙同学用装置B制取氨,发生反应的化学方程式是 ;为了检验集气瓶中氨是否集满,可将湿润的红色石蕊试纸置于导管口,若 ,则证明已收集满;若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是 ,该反应的化学方程式为 。
(4)丙同学在实验室中模拟氨的催化氧化反应,该反应中,当生成标准状况下11.2 L NO时,被氧化的物质的质量是 g。
14.亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成NOCl
(1)甲组同学拟制备原料气NO和Cl2制备装置如图甲所示(部分夹持装置已略去):
为制备纯净干燥的气体,填写下表中缺少的药品。
(2)乙组同学利用甲组同学制得的NO和Cl2制备NOCl,装置如图乙所示:
①装置连接顺序为a→ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是 。
③装置Ⅷ的作用是 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为 。
参考答案
1.答案:A
解析:工业上常用氮气、氢气在高温、高压和催化剂存在的条件下合成氨,故A错误;SO2具有还原性,葡萄酒中通常添加少量SO2,既可以杀菌,又可防止营养成分被氧化,故B正确;瓷器由黏土经高温烧结而成,主要化学成分是硅酸盐,故C正确;NaClO与白醋中的醋酸反应生成次氯酸,次氯酸氧化性强,所以可以提升消毒效果,故D正确。
2.答案:B
解析:二氧化硅可以和碳单质反应得到硅单质和一氧化碳,一氧化碳和硫化氢不反应,A错误;浓硫酸可以和碳单质反应得到二氧化碳、二氧化硫以及水,无色气体二氧化硫可以和硫化氢反应生成硫单质和水,B正确;浓硝酸可以和碳单质反应得到二氧化碳、二氧化氮以及水,二氧化氮是红棕色气体,二氧化碳和硫化氢不反应,C错误;水和碳单质在高温下反应生成氢气和一氧化碳,二者与硫化氢均不反应,D错误。
3.答案:D
解析:NO易被氧气氧化,不能在空气中稳定存在,故A错误;液氨汽化时需要吸收大量的热,导致周围环境的温度迅速降低,因此液氨可作制冷剂,故B错误;CO2不会导致酸雨的形成,SO2、NO2都会导致酸雨的形成,故C错误;活性炭使品红溶液褪色是因为其具有吸附性,二氧化硫与品红反应生成无色物质从而使溶液褪色,过氧化钠使品红溶液褪色是因为其具有强氧化性,三者使品红溶液褪色的原理不同,故D正确。
4.答案:B
解析:二氧化硫易溶于水,与水反应生成亚硫酸,则可以看到液面上升,A正确;二氧化氮与水反应生成硝酸和NO,NO不溶于水,则可看到液面上升,但液体不会充满试管,B错误;氨极易溶于水,与水反应生成一水合氨,一水合氨电离使溶液显碱性,使酚酞变红,则可看到试管内液面上升,液体呈红色,C正确;氯气与NaOH溶液反应生成NaCl、NaClO和水,则可看到试管内液面上升,黄绿色褪去,D正确。
5.答案:C
解析:二氧化硅不能一步反应生成硅酸,可先反应生成可溶性的硅酸盐,再与酸反应获得硅酸,A项错误;氧化铝不能一步反应生成氢氧化铝,可由可溶性铝盐与碱反应或偏铝酸盐与酸反应得到氢氧化铝沉淀,B项错误;氮气与氢气在高温、高压及催化剂作用下反应生成氨,氨催化氧化得到一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,浓硝酸与铜反应生成二氧化氮,各物质之间的转化均能一步完成,C项正确;硫与氧气反应只能生成二氧化硫,不能一步转化为三氧化硫,D项错误。
6.答案:B
解析:氯气与水反应产生了盐酸和次氯酸,次氯酸具有漂白性,氯气不具有漂白性、酸性,故A错误;浓硫酸具有脱水性,使蔗糖脱水变为碳,又因浓硫酸具有强氧化性,与碳发生氧化还原反应,生成的二氧化硫能使溴水褪色,按照装置中的实验现象能说明浓硫酸具有脱水性、氧化性,故B正确;稀硝酸把Na2SO3氧化为Na2SO4,不能用稀硝酸和Na2SO3反应制取SO2,故C错误;浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀,则不能比较碳酸与硅酸的酸性强弱,也就不能比较C、Si非金属性的强弱,应排除硝酸的干扰,故D错误。
7.答案:B
解析:原溶液中加入盐酸酸化的硝酸钡溶液,如果原溶液中含有亚硫酸根离子,则会被氧化为硫酸根离子,所以产生白色沉淀不能说明原溶液中一定含有SO42-,A错误;能使湿润的红色石蕊试纸变蓝的气体是氮,向血红色溶液中加入NaOH溶液得到NH3,所以原溶液中一定含有铵根离子,B正确;原溶液中加入稀盐酸,引入了氯离子,能和硝酸银反应生成氯化银白色沉淀,故原溶液中不一定含有氯离子,C错误;原溶液中加入盐酸酸化的硝酸钡溶液,如果原溶液中含有亚铁离子,则亚铁离子会被氧化为铁离子,Fe3+和KSCN反应使溶液变为血红色,所以原溶液中不一定含有Fe3+,D错误。
8.答案:D
解析:3 mol NO2气体通过碳酸钠溶液,首先发生反应:,生成1 mol NO、2 mol HNO3,再发生反应:,生成1 mol CO2,通过浓硫酸干燥后所得气体为1 mol NO、1 mol CO2,将气体通过足量的过氧化钠,发生反应:,生成0.5 mol O2,再发生反应:2NO +O22NO2,1 mol NO消耗0.5 mol O2,生成1 mol NO2,故最终得到的气体为1 mol NO2,再用排水法收集,发生反应,故最终收集到的气体为mol NO,D正确。
9.答案:B
解析:氯气能够置换出溴,溶液由无色变为橙色,A不符合题意;二氧化碳与氯化钙溶液不反应,B符合题意;二氧化硫溶于水生成H2SO3,H2SO3电离出H+,在酸性条件下SO32-能够被NO氧化为SO42-,Ba2+与SO42-反应生成硫酸钡沉淀,C不符合题意;二氧化氮与水反应生成硝酸,硝酸将Fe2+氧化为Fe3+,溶液由浅绿色变为黄色,D不符合题意。
10.答案:C
解析:若x为N2,则Y是NO,Z是NO2,A为硝酸,故A正确;若X为S,则Y是SO2,Z是SO3,A为硫酸,故B正确;若X为N2,Y是NO,Z是NO2,NO2与水反应生成硝酸和NO,反应①、②、③均属于氧化还原反应,故C错误;若X为H2S,则Y为S,Z是SO2,A为亚硫酸,亚硫酸不能与金属铜反应,故D正确。
11.答案:D
解析:整个过程可以看作是9g铜和铁的混合物与200 mL稀硝酸反应生成0.1 mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生反应的化学方程式为,设铁的物质的量为x mol,铜的物质的量为y mol,根据二者质量与生成NO的体积列方程:56 g·mol-1×x mol + 64 g·mol-1×y mol =9 g,×(x mol +y mol)=,解得x =0.075、y=0.075,由上述分析可知,原混合物中铜和铁的物质的量均为0.075 mol,故A错误;根据化学方程式可知,n(HNO3)=4n(NO)=0.4 mol,稀硝酸的物质的量浓度为,故B错误;9 g混合物中含铁的质量为0.075 mol x 56 g·mol-l =4.2 g,含铜的质量为0.075 mol x64 g·mol-l=4.8 g,则第一次剩余的金属为Cu,故C错误;再加入100 mL该稀硝酸,Fe2+与稀硝酸反应生成NO与硝酸铁,溶液中Fe2+的物质的量为0.075 mol,后加入的稀硝酸中含HNO3的物质的量为0.1 L×2.0mol·L-1=0.2 mol,反应中存在关系式:3Fe2+~4HNO3~ NO,HNO3过量,Fe2+完全反应,得到的NO的物质的量为0.025 mol,标准状况下其体积为0.025 mol ×22.4 L·mol-1 =0.56 L,故D正确。
12.解析:Ⅰ.根据图示的转化关系,若D是红棕色气体,则D为二氧化氮;B气体溶于水后,溶液为碱性,则B为氨;A为单质,则A为氮气;C为一氧化氮。
(1)A的化学式为N2,反应③的化学方程式为
(2)D溶于水形成的稀溶液为稀硝酸,与铜反应的离子方程式为,该反应的实验现象为红色固体溶解,溶液变为蓝色,产生无色气泡,在试管口有红棕色气体生成。
Ⅱ.若B、D既能与强酸溶液反应,又能与强碱溶液反应,结合图示的转化关系,则推测A为铝,B为氧化铝,C为铝盐,D为氢氧化铝。
(1)反应④的离子方程式为。
(2)A用于焊接铁轨的化学方程式为。
答案:
Ⅰ.(1)N2/
(2) /红色固体溶解,溶液变为蓝色(或产生无色气泡,在试管口有红棕色气体生成)
Ⅱ.(1)
(2)
13.解析:实验室采用铜与浓硝酸反应制备二氧化氮,二氧化氮的密度比空气的大,且能与水反应,故用向上排空气法收集;实验室可采用浓硫酸与铜在加热条件下反应制备二氧化硫;实验室采用加热氢氧化钙与氯化铵固体混合物的方法制备氨。
(1)甲同学用装置A通过铜与浓硝酸反应制备NO,气体,则装置A中发生反应的离子方程式为;二氧化氮的密度比空气的大,且能与水反应,故用向上排空气法收集,题给装置中可用于收集NO2气体的是装置D。
(2)铜与浓硫酸要在加热条件下反应,故用装置A通过铜与浓硫酸反应制取SO2气体时,装置A中还缺少的仪器名称是酒精灯,该反应的化学方程式为 ;二氧化硫有毒,为酸性氧化物,能与氢氧化钠反应,故实验所产生的S0,尾气选用装置F来吸收。(3)丙同学采用固固加热制备气体的装置,可通过加热氢氧化钙与氯化铵固体制备氨,发生反应的化学方程式是;为了检验集气瓶中氨是否集满,可将湿润的红色石蕊试纸置于导管口,氨溶于水使溶液显弱碱性,故若湿润的红色石蕊试纸变蓝,则证明已收集满;氨与氯化氢气体反应生成NH4Cl,化学方程式为,故若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是产生白烟。
(4)丙同学在实验室中模拟氨的催化氧化反应,即,反应中氮元素由-3价变为+2价,故NH3被氧化,当生成标准状况下11.2 L(即0.5 mol)NO时,有0.5 mol NH3被氧化,其质量是0.5 mol × 17 g·mol-1=8.5 g。
答案:
D /
酒精灯 / /F
(3) /湿润的红色石蕊试纸变蓝/产生白烟 /
(4)8.5
14.解析:(1)实验室通常用浓盐酸和MnO2混合加热制氯气,因盐酸有挥发性,氯气中混有的HCl气体需要用饱和食盐水除去,最后再用浓硫酸干燥即可得到纯净干燥的Cl2;用铜和稀硝酸反应制NO气体,因装置中混有的氧气和NO反应生成少量NO2,因此需要通过水除去可能混有NO2,最后再用浓硫酸干燥即可得到纯净干燥的NO。
(2)①亚硝酰氯的熔、沸点较低,易液化,遇水易水解,故需要除去混合气体混有的水蒸气,保持装置内干燥,同时需要考虑Cl和NOCl尾气对环境的污染,需要用NaOH溶液除去尾气,则装置连接顺序为a→。②装置Ⅳ、Ⅴ除可进一步干燥NO、C12外,还可以通过观察气泡调节气体的流速,控制NO和Cl2的比例。③亚硝酰氯遇水易水解,装置Ⅶ的作用是防止水蒸气进入装置区中与收集到的NOCl反应。④装置Ⅷ中 NaOH溶液能吸收Cl2及NOCl,其中NOCl与NaOH发生反应的化学方程式为。
(3)浓硝酸与浓盐酸在一定条件下反应生成亚硝酰氯和氯气;发生反应的化学方程式为。
答案:
(1)①浓盐酸 /②饱和食盐水 /③稀硝酸 /④水
(2)① /②通过观察气泡调节气体的流速 / ③防止水蒸气进入装置 中与收集到的NOCl反应 /④
(3)
12 / 12
一、选择题
1.[重庆巴蜀中学2020高一期中]化学与生产、生活密切相关,下列说法不正确的是
( )
A.液氨可用作制冷剂,工业上常将浓氨水滴入生石灰或固体NaOH中快速制取氨
B.葡萄酒中通常添加少量SO2,既可以杀菌,又可防止营养成分被氧化
C.“明如镜、声如磐”的瓷器由黏土经高温烧结而成,主要化学成分是硅酸盐
D.84消毒液是以NaClO为有效成分的消毒液,与白醋混合可以提升消毒效果
2.下列物质在一定条件下与碳作用所产生的无色气体能与H2S反应的是( )
A.二氧化硅
B.浓硫酸
C.浓硝酸
D.水
3.下列说法正确的是( )
A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.NH3液化时吸收大量的热,因此,氨常用作制冷剂
C.CO2、NO2或SO2都会导致酸雨的形成
D.活性炭、SO2、Na2O2都能使品红溶液褪色,原理不同
4.[山东德州2020高一期末]如图是进行气体性质实验的常用装置,下列对有关实验现象的描述中,不正确的是( )
A.若水槽中盛有水,试管中充满SO2,可看到试管中液面上升
B.若水槽中盛有水,试管中充满NO2,可看到试管中液面上升,液体充满试管
C.若水槽中盛有水(滴有酚酞溶液),试管中是NH3,可看到试管内液面上升,液体呈红色
D.若水槽中盛有NaOH溶液,试管中是Cl2,可看到试管内液面上升,黄绿色褪去
5.下列物质之间的转化都能一步实现的是( )
A.
B.
C.
D.
6.[辽宁省实验中学2020高一期中]利用如图所示装置进行下列实验,能得出相应实验结论的是( )
A.A
B.B
C.C
D.D
7.[山东新泰一中2019高一质检]为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学设计了如图所示的实验。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )
A.原溶液中一定含有SO42-
B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl-
D.原溶液中一定含有Fe3+
8.把3 mol NO2气体依次通过盛有①1 L 1 mol·L-1碳酸钠溶液、②浓硫酸、③足量Na2O2的装置后(假设每一步的反应都是充分的,忽略气体在水中的溶解),再用排水法收集残留气体,则收集到的气体是( )
A.1 mol NO
B.1 mol NO2和0.5 mol O2
C.0.25 mol O2
D.mol NO
9.将气体a通入b中,始终无明显变化的是( )
A.A
B.B
C.C
D.D
10.已知某物质X能发生如图所示转化:
下列有关该转化关系中物质及其反应的叙述错误的是( )
A.若X为N2,则A为硝酸
B.若X为S,则A为硫酸
C.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
D.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
11.将9g铜和铁的混合物投入100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO,若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
A.原混合物中铜和铁各0.065 mol
B.稀硝酸的物质的量浓度为4.0 mol.L-1
C.第一次剩余的4.8 g金属为铜和铁的混合物
D.向反应后的溶液中再加入该稀硝酸100 mL,又得到的NO在标准状况下的体积为0.56 L
二、填空题
12.A、B、C、D均为中学化学常见的物质,且均含有同一种元素,其中A是单质,它们之间存在如图转化关系。
Ⅰ.若D是红棕色气体;B气体溶于水后,溶液为碱性。
(1)请写出A的化学式: ,反应③的化学方程式为 。
(2)D溶于水形成的稀溶液与铜反应的离子方程式为 ,该反应的实验现象为 (写出两条)。
Ⅱ.若B、D既能与强酸溶液反应,又能与强碱溶液反应,反应②③均为强酸条件。
反应④可以通过滴加氨水实现,该反应的离子方程式为 。
请写出A用于焊接铁轨的化学方程式: 。
13.[天津南开区2020高一学业水平考试]某实验小组的同学在实验室利用如图所示装置进行实验。
请回答下列问题:
(1)甲同学用装置A制备NO2气体,上述装置中可用于收集NO2气体的是 (填序号),装置A中发生反应的离子方程式为 。
(2)乙同学用图中的装置A通过铜与浓硫酸反应制取SO2气体,装置A中还缺少的仪器名称是 ,该反应的化学方程式为 ;实验所产生的SO2尾气选用装置 (填序号)来吸收。
(3)丙同学用装置B制取氨,发生反应的化学方程式是 ;为了检验集气瓶中氨是否集满,可将湿润的红色石蕊试纸置于导管口,若 ,则证明已收集满;若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是 ,该反应的化学方程式为 。
(4)丙同学在实验室中模拟氨的催化氧化反应,该反应中,当生成标准状况下11.2 L NO时,被氧化的物质的质量是 g。
14.亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成NOCl
(1)甲组同学拟制备原料气NO和Cl2制备装置如图甲所示(部分夹持装置已略去):
为制备纯净干燥的气体,填写下表中缺少的药品。
(2)乙组同学利用甲组同学制得的NO和Cl2制备NOCl,装置如图乙所示:
①装置连接顺序为a→ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是 。
③装置Ⅷ的作用是 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为 。
参考答案
1.答案:A
解析:工业上常用氮气、氢气在高温、高压和催化剂存在的条件下合成氨,故A错误;SO2具有还原性,葡萄酒中通常添加少量SO2,既可以杀菌,又可防止营养成分被氧化,故B正确;瓷器由黏土经高温烧结而成,主要化学成分是硅酸盐,故C正确;NaClO与白醋中的醋酸反应生成次氯酸,次氯酸氧化性强,所以可以提升消毒效果,故D正确。
2.答案:B
解析:二氧化硅可以和碳单质反应得到硅单质和一氧化碳,一氧化碳和硫化氢不反应,A错误;浓硫酸可以和碳单质反应得到二氧化碳、二氧化硫以及水,无色气体二氧化硫可以和硫化氢反应生成硫单质和水,B正确;浓硝酸可以和碳单质反应得到二氧化碳、二氧化氮以及水,二氧化氮是红棕色气体,二氧化碳和硫化氢不反应,C错误;水和碳单质在高温下反应生成氢气和一氧化碳,二者与硫化氢均不反应,D错误。
3.答案:D
解析:NO易被氧气氧化,不能在空气中稳定存在,故A错误;液氨汽化时需要吸收大量的热,导致周围环境的温度迅速降低,因此液氨可作制冷剂,故B错误;CO2不会导致酸雨的形成,SO2、NO2都会导致酸雨的形成,故C错误;活性炭使品红溶液褪色是因为其具有吸附性,二氧化硫与品红反应生成无色物质从而使溶液褪色,过氧化钠使品红溶液褪色是因为其具有强氧化性,三者使品红溶液褪色的原理不同,故D正确。
4.答案:B
解析:二氧化硫易溶于水,与水反应生成亚硫酸,则可以看到液面上升,A正确;二氧化氮与水反应生成硝酸和NO,NO不溶于水,则可看到液面上升,但液体不会充满试管,B错误;氨极易溶于水,与水反应生成一水合氨,一水合氨电离使溶液显碱性,使酚酞变红,则可看到试管内液面上升,液体呈红色,C正确;氯气与NaOH溶液反应生成NaCl、NaClO和水,则可看到试管内液面上升,黄绿色褪去,D正确。
5.答案:C
解析:二氧化硅不能一步反应生成硅酸,可先反应生成可溶性的硅酸盐,再与酸反应获得硅酸,A项错误;氧化铝不能一步反应生成氢氧化铝,可由可溶性铝盐与碱反应或偏铝酸盐与酸反应得到氢氧化铝沉淀,B项错误;氮气与氢气在高温、高压及催化剂作用下反应生成氨,氨催化氧化得到一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,浓硝酸与铜反应生成二氧化氮,各物质之间的转化均能一步完成,C项正确;硫与氧气反应只能生成二氧化硫,不能一步转化为三氧化硫,D项错误。
6.答案:B
解析:氯气与水反应产生了盐酸和次氯酸,次氯酸具有漂白性,氯气不具有漂白性、酸性,故A错误;浓硫酸具有脱水性,使蔗糖脱水变为碳,又因浓硫酸具有强氧化性,与碳发生氧化还原反应,生成的二氧化硫能使溴水褪色,按照装置中的实验现象能说明浓硫酸具有脱水性、氧化性,故B正确;稀硝酸把Na2SO3氧化为Na2SO4,不能用稀硝酸和Na2SO3反应制取SO2,故C错误;浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀,则不能比较碳酸与硅酸的酸性强弱,也就不能比较C、Si非金属性的强弱,应排除硝酸的干扰,故D错误。
7.答案:B
解析:原溶液中加入盐酸酸化的硝酸钡溶液,如果原溶液中含有亚硫酸根离子,则会被氧化为硫酸根离子,所以产生白色沉淀不能说明原溶液中一定含有SO42-,A错误;能使湿润的红色石蕊试纸变蓝的气体是氮,向血红色溶液中加入NaOH溶液得到NH3,所以原溶液中一定含有铵根离子,B正确;原溶液中加入稀盐酸,引入了氯离子,能和硝酸银反应生成氯化银白色沉淀,故原溶液中不一定含有氯离子,C错误;原溶液中加入盐酸酸化的硝酸钡溶液,如果原溶液中含有亚铁离子,则亚铁离子会被氧化为铁离子,Fe3+和KSCN反应使溶液变为血红色,所以原溶液中不一定含有Fe3+,D错误。
8.答案:D
解析:3 mol NO2气体通过碳酸钠溶液,首先发生反应:,生成1 mol NO、2 mol HNO3,再发生反应:,生成1 mol CO2,通过浓硫酸干燥后所得气体为1 mol NO、1 mol CO2,将气体通过足量的过氧化钠,发生反应:,生成0.5 mol O2,再发生反应:2NO +O22NO2,1 mol NO消耗0.5 mol O2,生成1 mol NO2,故最终得到的气体为1 mol NO2,再用排水法收集,发生反应,故最终收集到的气体为mol NO,D正确。
9.答案:B
解析:氯气能够置换出溴,溶液由无色变为橙色,A不符合题意;二氧化碳与氯化钙溶液不反应,B符合题意;二氧化硫溶于水生成H2SO3,H2SO3电离出H+,在酸性条件下SO32-能够被NO氧化为SO42-,Ba2+与SO42-反应生成硫酸钡沉淀,C不符合题意;二氧化氮与水反应生成硝酸,硝酸将Fe2+氧化为Fe3+,溶液由浅绿色变为黄色,D不符合题意。
10.答案:C
解析:若x为N2,则Y是NO,Z是NO2,A为硝酸,故A正确;若X为S,则Y是SO2,Z是SO3,A为硫酸,故B正确;若X为N2,Y是NO,Z是NO2,NO2与水反应生成硝酸和NO,反应①、②、③均属于氧化还原反应,故C错误;若X为H2S,则Y为S,Z是SO2,A为亚硫酸,亚硫酸不能与金属铜反应,故D正确。
11.答案:D
解析:整个过程可以看作是9g铜和铁的混合物与200 mL稀硝酸反应生成0.1 mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生反应的化学方程式为,设铁的物质的量为x mol,铜的物质的量为y mol,根据二者质量与生成NO的体积列方程:56 g·mol-1×x mol + 64 g·mol-1×y mol =9 g,×(x mol +y mol)=,解得x =0.075、y=0.075,由上述分析可知,原混合物中铜和铁的物质的量均为0.075 mol,故A错误;根据化学方程式可知,n(HNO3)=4n(NO)=0.4 mol,稀硝酸的物质的量浓度为,故B错误;9 g混合物中含铁的质量为0.075 mol x 56 g·mol-l =4.2 g,含铜的质量为0.075 mol x64 g·mol-l=4.8 g,则第一次剩余的金属为Cu,故C错误;再加入100 mL该稀硝酸,Fe2+与稀硝酸反应生成NO与硝酸铁,溶液中Fe2+的物质的量为0.075 mol,后加入的稀硝酸中含HNO3的物质的量为0.1 L×2.0mol·L-1=0.2 mol,反应中存在关系式:3Fe2+~4HNO3~ NO,HNO3过量,Fe2+完全反应,得到的NO的物质的量为0.025 mol,标准状况下其体积为0.025 mol ×22.4 L·mol-1 =0.56 L,故D正确。
12.解析:Ⅰ.根据图示的转化关系,若D是红棕色气体,则D为二氧化氮;B气体溶于水后,溶液为碱性,则B为氨;A为单质,则A为氮气;C为一氧化氮。
(1)A的化学式为N2,反应③的化学方程式为
(2)D溶于水形成的稀溶液为稀硝酸,与铜反应的离子方程式为,该反应的实验现象为红色固体溶解,溶液变为蓝色,产生无色气泡,在试管口有红棕色气体生成。
Ⅱ.若B、D既能与强酸溶液反应,又能与强碱溶液反应,结合图示的转化关系,则推测A为铝,B为氧化铝,C为铝盐,D为氢氧化铝。
(1)反应④的离子方程式为。
(2)A用于焊接铁轨的化学方程式为。
答案:
Ⅰ.(1)N2/
(2) /红色固体溶解,溶液变为蓝色(或产生无色气泡,在试管口有红棕色气体生成)
Ⅱ.(1)
(2)
13.解析:实验室采用铜与浓硝酸反应制备二氧化氮,二氧化氮的密度比空气的大,且能与水反应,故用向上排空气法收集;实验室可采用浓硫酸与铜在加热条件下反应制备二氧化硫;实验室采用加热氢氧化钙与氯化铵固体混合物的方法制备氨。
(1)甲同学用装置A通过铜与浓硝酸反应制备NO,气体,则装置A中发生反应的离子方程式为;二氧化氮的密度比空气的大,且能与水反应,故用向上排空气法收集,题给装置中可用于收集NO2气体的是装置D。
(2)铜与浓硫酸要在加热条件下反应,故用装置A通过铜与浓硫酸反应制取SO2气体时,装置A中还缺少的仪器名称是酒精灯,该反应的化学方程式为 ;二氧化硫有毒,为酸性氧化物,能与氢氧化钠反应,故实验所产生的S0,尾气选用装置F来吸收。(3)丙同学采用固固加热制备气体的装置,可通过加热氢氧化钙与氯化铵固体制备氨,发生反应的化学方程式是;为了检验集气瓶中氨是否集满,可将湿润的红色石蕊试纸置于导管口,氨溶于水使溶液显弱碱性,故若湿润的红色石蕊试纸变蓝,则证明已收集满;氨与氯化氢气体反应生成NH4Cl,化学方程式为,故若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是产生白烟。
(4)丙同学在实验室中模拟氨的催化氧化反应,即,反应中氮元素由-3价变为+2价,故NH3被氧化,当生成标准状况下11.2 L(即0.5 mol)NO时,有0.5 mol NH3被氧化,其质量是0.5 mol × 17 g·mol-1=8.5 g。
答案:
D /
酒精灯 / /F
(3) /湿润的红色石蕊试纸变蓝/产生白烟 /
(4)8.5
14.解析:(1)实验室通常用浓盐酸和MnO2混合加热制氯气,因盐酸有挥发性,氯气中混有的HCl气体需要用饱和食盐水除去,最后再用浓硫酸干燥即可得到纯净干燥的Cl2;用铜和稀硝酸反应制NO气体,因装置中混有的氧气和NO反应生成少量NO2,因此需要通过水除去可能混有NO2,最后再用浓硫酸干燥即可得到纯净干燥的NO。
(2)①亚硝酰氯的熔、沸点较低,易液化,遇水易水解,故需要除去混合气体混有的水蒸气,保持装置内干燥,同时需要考虑Cl和NOCl尾气对环境的污染,需要用NaOH溶液除去尾气,则装置连接顺序为a→。②装置Ⅳ、Ⅴ除可进一步干燥NO、C12外,还可以通过观察气泡调节气体的流速,控制NO和Cl2的比例。③亚硝酰氯遇水易水解,装置Ⅶ的作用是防止水蒸气进入装置区中与收集到的NOCl反应。④装置Ⅷ中 NaOH溶液能吸收Cl2及NOCl,其中NOCl与NaOH发生反应的化学方程式为。
(3)浓硝酸与浓盐酸在一定条件下反应生成亚硝酰氯和氯气;发生反应的化学方程式为。
答案:
(1)①浓盐酸 /②饱和食盐水 /③稀硝酸 /④水
(2)① /②通过观察气泡调节气体的流速 / ③防止水蒸气进入装置 中与收集到的NOCl反应 /④
(3)
12 / 12
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
