第3章 物质在水溶液中的行为 测试卷(含答案) 2022-2023学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第3章 物质在水溶液中的行为 测试卷(含答案) 2022-2023学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 579.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-30 15:42:11 | ||
图片预览




文档简介
第3章《物质在水溶液中的行为》测试卷
一、单选题
1.常温下,下列各组离子在指定溶液中能大量共存的是
A.的溶液中:、、、
B.的溶液中:、、、
C.的溶液中:、、、
D.与铝反应生成氢气的溶液中:、、、
2.下列表示对应化学反应的离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:+2H+=SO2↑ +H2O
B.向Na2SiO3溶液中通入过量SO2:+SO2+H2O=H2SiO3↓ +
C.向碳酸氢铵溶液中加入足量石灰水:Ca2+++OH-=CaCO3↓+H2O
D.将SO2通入KMnO4溶液中:5SO2 +2MnO+2H2O =5SO+2Mn2++4H+
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.电解精炼铜时,若阴极析出3.2 g铜,则阳极失电子数大于0.1NA
B.1L 0.1mol/LNa2CO3溶液中阴离子总数大于0.1NA
C.氢氧燃料电池工作时,正极消耗 11.2 L 气体,电路中转移电子数为0.1NA
D.25℃时,pH=13的Ba(OH)2溶液中含有的OH 数目为0.1NA
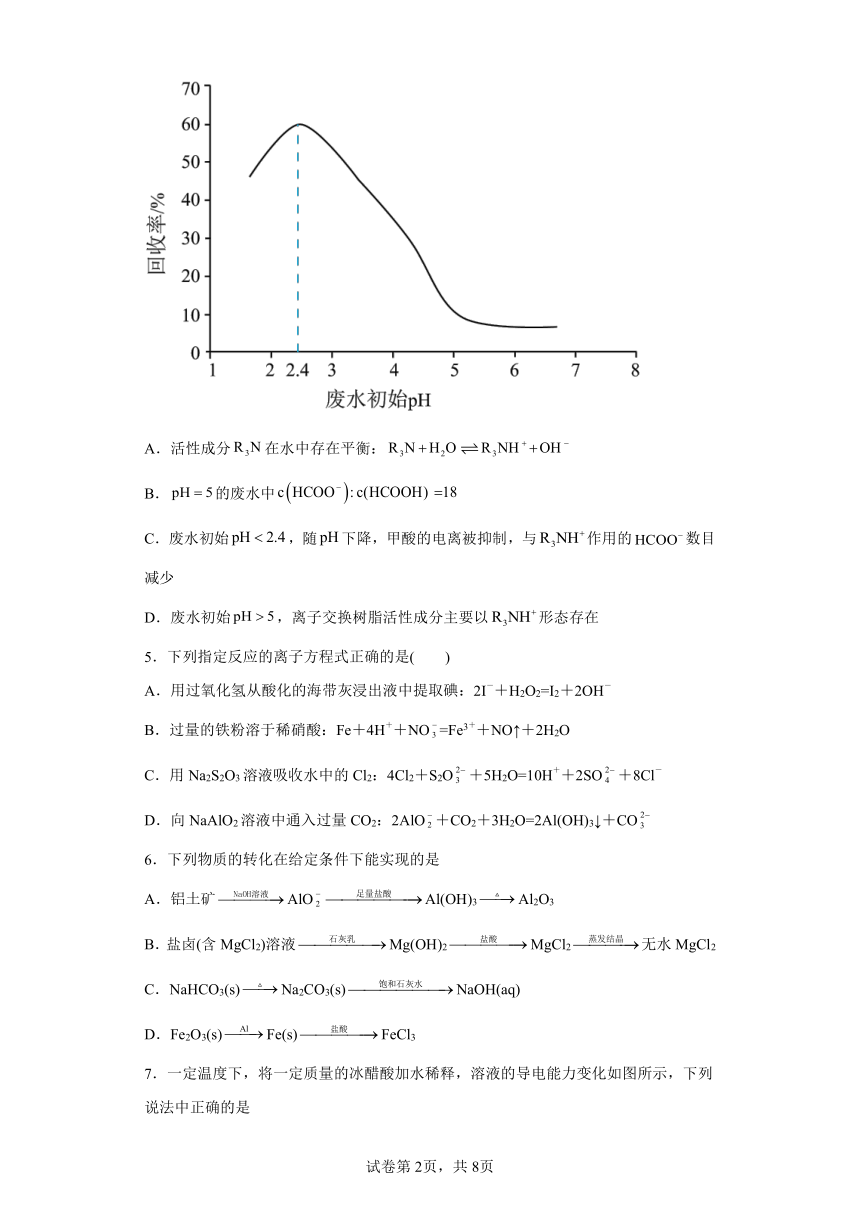
4.甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法不正确的是
A.活性成分在水中存在平衡:
B.的废水中
C.废水初始,随下降,甲酸的电离被抑制,与作用的数目减少
D.废水初始,离子交换树脂活性成分主要以形态存在
5.下列指定反应的离子方程式正确的是( )
A.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
B.过量的铁粉溶于稀硝酸:Fe+4H++NO=Fe3++NO↑+2H2O
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O+5H2O=10H++2SO+8Cl-
D.向NaAlO2溶液中通入过量CO2:2AlO+CO2+3H2O=2Al(OH)3↓+CO
6.下列物质的转化在给定条件下能实现的是
A.铝土矿AlOAl(OH)3Al2O3
B.盐卤(含MgCl2)溶液Mg(OH)2MgCl2无水MgCl2
C.NaHCO3(s)Na2CO3(s)NaOH(aq)
D.Fe2O3(s)Fe(s)FeCl3
7.一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中正确的是
A.a、b、c三点对应的溶液中,醋酸的电离程度最大的是b点
B.若使c点对应的溶液中c(CH3COO-)增大,可以采取的措施为:加水
C.a、b、c三点溶液用1 mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积最多的为b点
D.a、b、c三点溶液中的c(H+): c<a<b
8.下列表示对应化学反应的离子方程式正确的是
A.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
B.向稀硝酸中滴加Na2SO3溶液:SO+2H+=SO2↑+H2O
C.向Al2(SO4)3溶液中加入过量NH3·H2O:Al3++4NH3·H2O=[Al(OH)4]-+4NH
D.向Na2SiO3溶液中通入过量SO2:SiO+SO2+H2O=H2SiO3↓+SO
9.NA为阿伏加德罗常数的值。下列说法正确的是
A.C2H6(g)+2CO2(g) 4CO(g)+3H2(g) ΔH =+430 kJ·mol 1。向容器中充入1 mol [C2H6(g) + 2CO2(g) ],充分反应,吸收热量430 kJ
B.18 g的H218O和D216O,所含电子数和中子数均为9 NA
C.常温下CH3COONH4溶液的pH=7,则1 L该溶液中水电离出的H+数为10 7 NA
D.28 g晶体硅中含有的硅硅键数为4 NA
10.下列性质中,不能说明乙酸是弱电解质的是
A.乙酸钠溶液显碱性
B.常温时,0.1mol L-1乙酸溶液的pH约为3
C.10mL1mol L-1乙酸溶液与10mL1mol L-1的NaOH溶液恰好完全反应
D.在相同温度下,同物质的量浓度的乙酸溶液的导电性比盐酸溶液的弱
11.室温下,将盐酸逐滴滴入氨水中,溶液的随加入盐酸体积变化曲线如图所示。由图可知
A.M点所示溶液:
B.
C.N点所示溶液中:
D.的过程中,水的电离程度一直在增大
12.能正确表示反应的离子方程式是
A.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
B.CuSO4溶液中滴加稀氨水:Cu2++2OH-=Cu(OH)2↓
C.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO+Ba2+=BaSO4↓
D.SO2使酸性高锰酸钾溶液褪色:3SO2+2MnO+4H+=3SO+2Mn2++2H2O
13.设NA为阿伏加德罗常数的数值,下列说法正确的是
A.等质量的乙炔和苯分别完全燃烧,乙炔和苯都消耗7.5NA个氧气分子
B.1molNaH与足量水作用制备H2转移电子数为NA个
C.0.5mol雄黄(As4S4),结构如图,含有NA个S—S键
D.2molCO2与足量NaOH溶液完全反应,则n(CO)+n(HCO)+n(H2CO3)=1mol可能成立
14.室温下,通过下列实验探究亚硫酸盐的性质。已知:、。
实验 实验操作和现象
1 向溶液中通入(标准状况),测得约为9
2 向溶液中通入至溶液
3 向溶液中通入(标准状况)测得约为3
4 取实验3所得溶液,加入溶液,产生白色沉淀
下列说法错误的是A.实验1得到的溶液中:
B.实验2得到的溶液中:
C.实验3得到的溶液中
D.实验4中可知:
15.与盐酸反应有黄绿色气体生成,离子方程式正确的是
A.
B.
C.
D.
二、填空题
16.在室温下,下列五种溶液:
①0.1 mol·L-1NH4Cl ②0.1 mol·L-1CH3COONH4 ③0.1 mol·L-1NH4HSO4
④0.1 mol·L-1NH3·H2O和 0.1 mol·L-1NH4Cl混合液 ⑤pH=a的CH3COOH
请根据要求填写下列空白:
(1)溶液①呈________性(填“酸”“碱”或“中”),其原因是______________(用离子方程式表示)。
(2)比较溶液②、③中c()的大小关系是②________③(填“>”“<”或“=”)。
(3)在溶液④中,NH3·H2O和________物质的量浓度之和为0.2 mol·L-1(填微粒符号)。
(4)室温,溶液②的pH=7,CH3COO-与浓度的大小关系是c(CH3COO-)______c()(填“>”“<”或“=”)。
(5)溶液⑤稀释100倍后所得溶液pH_______a+2(填“>”或“<”或“=”)。
17.写出下列反应的离子反应方程式
①锌与稀硫酸反应_______;
②少量二氧化碳通入澄清石灰水中_______;
③硫酸铜溶液和氢氧化钡溶液混合__________;
④氢氧化钠溶液与稀硫酸_______;
⑤硫酸氢钠溶液与氢氧化钡溶液混合至中性_______。
三、计算题
18.计算25 ℃时下列溶液的pH:
(1)1 mL pH=2的溶液加水稀释至100 mL,pH=_______;
(2)的盐酸,pH=_______;
(3)的NaOH溶液,pH=_______;
19.已知:常温下,,。试推测常温下,溶液呈_______(填“酸性”“碱性”或“中性”),其原因是_______(用必要的文字说明)。
四、实验题
20.MnO2是中学化学常用的试剂。某课外兴趣小组制取MnO2,并探究MnO2的性质。
(1)向MnO2中加入浓HCl并加热,有黄绿色气体产生。推测MnO2具有_______性。
(2)该小组通过双氧水分解速率的影响因素,运用对比实验获得以下数据:
①
实验序号 MnO2用量/g H2O2溶液质量分数 H2O2溶液的体积/mL 反应温度/℃ 收集O2体积/mL 所需时间/s
a 0 0.30 5 85 2 3.8
b 0.1 0.15 2 20 2 2.8
c 0.2 0.15 2 20 2 2.2
d 0 0.30 V 55 2 10.5
e 0.1 0.05 2 20 2 7.4
①实验b和c得出结论:_______。
②实验b和e得出结论:_______。
③若想测定温度对反应的影响,V=_______。
(3)已知:一定条件下,MnO可与Mn2+反应生成MnO2。此反应的离子方程式是_______。
21.二草酸合铜(Ⅱ)酸钾晶体,化学式为K2[Cu(C2O4)2]·xH2O,是一种工业化工原料。微溶于冷水和酒精,虽可溶于热水但会慢慢分解,干燥时较为稳定,在150℃时会失去结晶水,260℃以上会分解。
(1)实验室以胆矾和草酸为原料制备二草酸合铜(Ⅱ)酸钾晶体的流程如图甲回答下列问题:(已知:H2C2O4=CO↑+CO2↑+H2O)
①制取KHC2O4溶液过程中,不用KOH粉末代替K2CO3粉末的原因是_______。
②CuO与混合液中的KHC2O4水浴加热时,反应的化学方程式为_______。
③“系列操作”中用酒精洗涤而不用冷水洗涤的优点是_______。
(2)产品纯度的测定
已知:K2[Cu(C2O4)2]·xH2O的摩尔质量为Mg·mol-1。准确称取制得的晶体试样cg于小烧杯中,加入氨水使其溶解,再加入一定量的水,使其全部溶解,然后转移至250mL的容量瓶中,洗涤后加水定容。取试样溶液25.00mL,加入一定量稀硫酸酸化,用amol·L 1的KMnO4标准液滴定,消耗KMnO4标准液bmL
①滴定时,盛装KMnO4标准液的仪器为_______(填“a”或“b”)。
(2)该产品的纯度为_______。
(3)甲酸钠法是制草酸的主要方法,但易产生大量的含铅废水,主要有草酸铅、硫酸铅、草酸等成分。为中和废酸除去铅可采用氢氧化物沉降法。向其中加入NaOH,草酸中离子的有关数据与pH的变化关系如图(数据均为常温下测定):
图中表示lg与pH关系的是_______(填“K”或“L”),曲线m点溶液中,2c(C2O)+c(HC2O)-c(Na+)_______mol·L-1(填计算式),由图可知=_______。若向废水中加入过量的碱会使生成的Pb(OH)2沉淀转化为HPbO,使沉淀物溶解而影响处理效果,写出由Pb(OH)2生成HPbO的离子方程式_______。
试卷第2页,共8页
试卷第1页,共8页
(北京)股份有限公司
(北京)股份有限公司
参考答案:
1.C
【详解】A.的溶液中含有大量,在酸性条件下,与因发生氧化还原反应而不能大量共存,A项错误;
B.与因发生离子反应而不能大量共存,B项错误;
C.的溶液显酸性,四种离子可以大量共存,C项正确;
D.与铝反应生成氢气的溶液可能显酸性,也可能显碱性,溶液显酸性时,不能大量存在,溶液显碱性时,不能大量存在,D项错误。
故答案选:C。
2.D
【详解】A. 硝酸有强氧化性,亚硫酸根有还原性,二者会发生氧化还原反应,正确的离子方程式为:2+3+2H+=3+H2O+2NO↑,故A错误;
B.Na2SiO3溶液中通入过量SO2会生成亚硫酸氢根而不是亚硫酸根,正确的离子方程式为:+2SO2+2H2O=H2SiO3↓ +2,故B错误;
C. 向碳酸氢铵溶液中加入足量石灰水,正确的离子方程式为:+Ca2+++2OH-=CaCO3↓+H2O+ NH3·H2O,故C错误;
D. 将SO2通入KMnO4溶液中,发生氧化还原反应,离子方程式正确,故D正确;
答案选D。
3.B
【详解】A.电解精炼铜时阴极上发生Cu2++2e-=Cu,析出3.2g即0.05mol铜时转移0.1mol电子,根据电子守恒可知阳极失电子数也为0.1NA,故A错误;
B.1L 0.1mol/LNa2CO3溶液中含有0.1molNa2CO3,含有0.1mol CO,碳酸钠溶液中存在水解平衡:CO+H2OHCO+OH-,HCO+H2OH2CO3+OH-,可知由于碳酸根的水解使溶液中阴离子总数大于原碳酸根的总数,所以溶液中阴离子总数大于0.1NA,故B正确;
C.温度和压强未知无法计算11.2L气体的物质的量,无法计算转移电子数,故C错误;
D.溶液体积未知,无法计算溶液中的离子数目,故D错误;
综上所述答案为B。
4.D
【详解】A.由图可知,溶液呈碱性,溶液中存在如下平衡,故A正确;
B.由电离常数公式可知,溶液中=,当溶液pH为5时,溶液中==18,故B正确;
C.由图可知,溶液pH为2.4时,废水中的甲酸及其盐回收率最高,当溶液中pH小于2.4时,随溶液pH下降,溶液中氢离子浓度增大,甲酸的电离被抑制,溶液中甲酸根个离子浓度减小,与作用的数目减小,故C正确;
D.由图可知,溶液呈碱性,溶液中存在如下平衡,当废水初始pH大于5时,平衡向左移动,离子交换树脂活性成分主要以R3N形态存在,故D错误;
故选D。
5.C
【详解】A.酸性条件下,过氧化氢与海带灰浸出液中的碘离子反应生成单质碘和水,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O,故A错误;
B.过量的铁粉溶于稀硝酸生成硝酸亚铁、一氧化氮和水,反应的离子方程式为3Fe+2NO+8H+=3Fe2++2NO↑+4H2O,故B错误;
C.Na2S2O3溶液与Cl2反应生成硫酸和盐酸,反应的离子方程式为4Cl2+S2O+5H2O=10H++2SO+8Cl-,故C正确;
D.NaAlO2溶液中与过量的CO2反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为AlO+CO2+2H2O=Al(OH)3↓+HCO,故D错误;
故选C。
6.C
【详解】A.氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液中加入足量的盐酸,生成氯化铝,得不到氢氧化铝,故A错误;
B.盐卤(含MgCl2)与石灰乳反应生成氢氧化镁沉淀,氢氧化镁与盐酸反应生成氯化镁溶液,由于Mg2+水解Mg2++2H2O Mg(OH)2+2H+,加热蒸发时HCl挥发,平衡向右移动,所以得不到无水MgCl2,故B错误;
C.NaHCO3(s)不稳定,加热分解生成Na2CO3(s),Na2CO3(s)与饱和石灰水生成碳酸钙沉淀和NaOH(aq),故C正确;
D.Fe与盐酸反应生成FeCl2,故D错误;
故答案为C。
7.D
【分析】冰醋酸加水稀释,醋酸不断电离,溶液中离子浓度不断增大,溶液导电能力增大,到一定程度后,电离出的离子使浓度增大的程度低于加水量使浓度减小的程度,溶液中离子浓度减小,导电能力下降。
【详解】A.弱电解质越稀释越电离,a、b、c三点对应的溶液中,醋酸的电离程度最大的是c点,A错误;
B.c点已经处于分析中的导电能力下降阶段,加水只会导致c(CH3COO-)减小,B错误;
C.醋酸与氢氧化钠溶液中和,消耗氢氧化钠的量与醋酸的总物质的量有关,与醋酸的电离程度无关,与加水量无关,C错误;
D.醋酸的导电能力由其电离出的离子浓度大小决定,a、b、c三点溶液中的离子浓度关系是b>a>c,醋酸溶液中c(H+)由其电离决定,故c(H+): c<a<b,D正确;
故选D。
8.A
【详解】A.过氧化钠溶于水生成氢氧化钠和氧气,氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜沉淀,A正确;
B.硝酸具有强氧化性,与亚硫酸钠发生氧化还原反应,生成硫酸钠、NO和水,B错误;
C.氨水是弱碱,不能溶解氢氧化铝,生成物是氢氧化铝、硫酸铵,C错误;
D.二氧化硫过量,生成物是硅酸和亚硫酸氢钠,D错误;
答案选A。
9.B
【详解】A.已知C2H6(g)+2CO2(g)4CO(g)+3H2(g) ΔH =+430 kJ·mol 1,该反应为可逆反应,表示的含义为:生成4molCO和3molH2吸收430kJ能量,向容器中充入1 mol [C2H6(g) + 2CO2(g) ],充分反应,生成的CO小于4mol,吸收热量小于430 kJ,故A错误;
B.H218O和D216O的电子数和中子数均为10,所以18 g的H218O为0.9mol,电子数和中子数为9 NA,18 g的D216O为0.9mol,电子数和中子数为9 NA,故B正确;
C.常温下CH3COONH4中阴阳离子都能水解,促进水的电离,所以1 L该溶液中水电离出的H+数大于10 7 NA,故C错误;
D.28 g晶体硅为1mol,1mol晶体硅含有的硅硅键数为2NA,故D错误;
故选B。
10.C
【详解】A. 乙酸钠溶液显碱性,说明乙酸钠是强碱弱酸盐,则证明乙酸是弱酸,为弱电解质,故A不选;
B. 常温时,0.1 mol L 1乙酸溶液的pH约为3,溶液中氢离子浓度小于酸浓度,说明乙酸不完全电离为弱电解质,故B不选;
C. 10mL 1mol L 1乙酸溶液与10mL1mol L 1的NaOH溶液恰好完全反应,说明乙酸是一元酸不能说明乙酸部分电离,所以不能证明乙酸是弱电解质,故C选;
D. 相同温度下,同物质的量浓度的乙酸溶液的导电性比甲酸(为弱酸)溶液的弱,说明乙酸电离程度小于甲酸,甲酸是弱酸,则乙酸也是弱酸,故D不选;
答案选C。
【点睛】弱电解质在水溶液里部分电离,只要说明乙酸在水溶液里部分电离就能证明乙酸是弱电解质,可以根据一定浓度的pH、其钠盐溶液酸碱性等判断。
11.C
【详解】A.M点溶液呈碱性,为的混合溶液,则溶液中有,故A错;
B.恰好完全反应得到溶液呈酸性,Q点溶液呈中性,则氨水稍微过量,所以a<20.00mL,故B错;
C.N点溶液呈酸性,溶液中,结合电荷守恒,可知,故选C;
D.的过程中,M点溶液呈碱性,为的混合溶液,会抑制水的电离;Q呈中性,水的电离程度最大;N溶液呈酸性,则溶液由的混合溶液,会抑制水的电离,所以的过程中水的电离程度先增大后减小,故D错。
答案选C
12.A
【详解】A.FeCl3溶液和Cu反应生成FeCl2和CuCl2,离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故A正确;
B.NH3H2O为弱电解质,不能拆开写,正确的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2N,故B错误;
C.OH-先与Fe2+反应,再和N反应,由于Ba(OH)2溶液较少,N不参与反应,正确的离子方程式为:Fe2++SO+Ba2++2OH-=BaSO4↓+Fe(OH)2↓,故C错误;
D.二者发生氧化还原反应生成锰离子、硫酸根离子,转移电子不守恒,正确的离子方程式为:5SO2+2MnO+2H2O=5SO+2Mn2+ +4H+,故D错误;
答案选A。
13.B
【详解】A.等质量并没有给出具体质量是多少,所以无法确定消耗的氧气的量,A错误;
B.NaH与水反应的化学方程式为NaH+H2O=NaOH+H2↑,为归中反应,该反应中NaH为唯一还原剂,氢元素由-1价升高到0价,所以1molNaH完全反应转移NA个电子,B正确;
C.As最外层有5个电子,S最外层有6个电子,所以白球应为S原子,所以该物质中并没有S-S键,C错误;
D.根据物料守恒n(CO)+n(HCO)+n(H2CO3)=2mol,D错误;
综上所述答案为B。
14.C
【详解】A.11.2mL(标准状况)SO2的物质的量为=0.0005mol,故实验1得到Na2SO3溶液中,根据质子守恒可得2c(H2SO3)+c(HS)+c(H+)=c(OH-),又Na2SO3溶液中2c(H2SO3)c(OH-),A正确;
B.实验2得到的溶液pH=7,即c(H+)=c(OH-),溶液中电荷守恒有:,则有,B正确;
C.22.4mL(标准状况)SO2的物质的量为=0.001mol,与溶液反应,故实验3得到NaHSO3溶液,其浓度为0.1mol/L,c(H+)+c(Na+)=c(HS)+2c(S)+c(OH-),由Kh(HS)==c(OH-),且c(S)>c(H2SO3),可知:c(H+)+c(Na+)>c(HS)+2c(H2SO3)+c(OH-),C错误;
D.实验4中亚硫酸氢钠浓度为0.1mol/L,BaCl2溶液0.01mol/L,各1mL等体积混合,混合液c(Ba2+)=,c(S)==,则Qc(BaSO3)=c(Ba2+)·c(S)==0.005×5×10-6=2.5×10-8,该溶液产生白色沉淀,说明Qc(BaSO3)>Ksp(BaSO3),故,D正确;
故选C。
15.C
【详解】与盐酸反应有黄绿色气体生成,说明氯离子被氧化为氯气,则被还原为,难溶于水,不能拆写为离子,反应的离子方程式是,故选C。
16.(1) 酸
(2)<
(3)
(4)=
(5)<
【解析】(1)
NH4Cl为强酸弱碱盐,铵根离子水解溶液显酸性,水解的离子方程式为;故正确答案:酸;;
(2)
水解程度越大,则离子浓度越小,0.1mol/L CH3COONH4中铵根离子和醋酸根离子发生相互促进的水解,水解程度较大,铵根离子浓度小于0.1mol/L;0.1mol/L NH4HSO4中电离的氢离子抑制铵根离子水解,铵根离子水解程度较小,铵根离子浓度大于0.1mol/L;所以CH3COONH4中铵根离子浓度小于NH4HSO4中铵根离子浓度;故正确答案:<;
(3)
0.1 mol·L-1NH3·H2O和0.1 mol·L-1NH4Cl混合液中,存在物料守恒,则NH3 H2O和的物质的量浓度之和为0.2mol/L;故正确答案:;
(4)
0.1mol/L CH3COONH4的pH=7,显中性,则CH3COO-的水解程度与的水解程度相同,CH3COONH4溶液中存在电荷守恒:,已知显中性,则,所以,故正确答案:=;
(5)
稀释促进醋酸的电离,pH=a的CH3COOH溶液稀释100倍后,醋酸的电离平衡向右移动,氢离子的物质的量增加,则稀释后溶液中氢离子浓度大于原来的1/100,因此所得溶液pH17. Zn+2H+=Zn2++H2↑ CO2+Ca2++2OH-=CaCO3↓+H2O Cu2+++Ba2++2OH-=BaSO4↓+Cu(OH)2↓ H++OH-=H2O 2H+++Ba2++2OH-=BaSO4↓+2H2O
【详解】①锌与稀硫酸反应产生ZnSO4、H2,根据物质拆分原则,可得该反应的离子方程式为:Zn+2H+=Zn2++H2↑;
②少量二氧化碳通入澄清石灰水中,反应产生CaCO3沉淀和H2O,该反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O;
③硫酸铜溶液和氢氧化钡溶液混合,反应产生BaSO4沉淀和Cu(OH)2沉淀,该反应的离子方程式为:Cu2+++Ba2++2OH-=BaSO4↓+Cu(OH)2↓;
④氢氧化钠溶液与稀硫酸混合,发生中和反应产生Na2SO4和H2O,该反应的离子方程式为:H++OH-=H2O;
⑤硫酸氢钠溶液与氢氧化钡溶液混合至中性,反应产生BaSO4沉淀、Na2SO4和H2O,该反应的离子方程式为:2H+++Ba2++2OH-=BaSO4↓+2H2O。
【点睛】酸性氧化物与碱反应或酸式盐与碱反应时,两种物质的相对物质的量多少不同,发生的反应也不同,在书写离子方程式时,要注意二者相对量的多少对反应产物的影响,结合物质的溶解性及物质的拆分原则进行书写。
18.(1)4
(2)3
(3)12
【详解】(1)1 mL pH=2的 H2SO4 溶液加水稀释至100 mL,溶液体积变为原来的100倍,则H+浓度降低到原来的,则溶液的pH增大2,所以稀释后溶液的pH=4。
(2)0.001mol L 1 的盐酸中c(H+)=0.001mol/L,所以pH=-lgc(H+)=3。
(3)常温下,0.01mol L 1 的NaOH溶液中c(OH-)=0.01mol/L,则c(H+)==10-12mol/L,所以溶液的pH=12。
19. 酸性 在溶液中可发生水解,其水解常数,在溶液中也可以发生电离,,即的水解程度小于其电离程度,溶液呈酸性
【详解】在溶液中可发生水解,其水解常数,在溶液中也可以发生电离,,即的水解程度小于其电离程度,溶液呈酸性。
20.(1)氧化
(2) 在其它条件不变时,MnO2用量越多,接触面积加大,使H2O2分解速率加快 在其它条件不变时,增大反应物(H2O2)浓度,H2O2分解速率加快 5 mL
(3)2+3Mn2++2H2O=5MnO2+4H+
【分析】MnO2与浓盐酸在加热条件下反应制取黄绿色的气体Cl2。MnO2是H2O2分解反应的催化剂,在探究外界条件对化学反应速率影响时,要采用控制变量方法研究,即其它条件都相同,只改变一个条件,看这个条件与化学反应速率的关系。
【详解】(1)MnO2与浓盐酸在加热条件下反应制取黄绿色的气体Cl2。该反应方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,在该反应中,Mn元素化合价由反应前MnO2中的+4价变为反应后MnCl2中的+2价,元素的化合价降低,得到电子被还原,所以白反应说明MnO2具有强氧化性;
(2)①实验b和c只有MnO2的量不同,其它外界条件都相同,我们看到:在其它条件不变时,MnO2用量越多,接触面积加大,使H2O2分解速率加快;
②实验b和e只有H2O2溶液质量分数不同,其它外界条件都相同,我们看到:在其它条件不变时,增大反应物(H2O2)浓度,H2O2分解速率加快;
③若想测定温度对反应的影响,则应该只有温度这个条件不同,其它条件都相同,对比表格实验数据,可知实验a、d的温度不同,其它外界条件相同,则V=5 mL;
(3)已知:一定条件下,可与Mn2+反应生成MnO2。根据电子守恒、电荷守恒、原子守恒,可得反应的离子方程式是2+3Mn2++2H2O=5MnO2+4H+。
21.(1) 氢氧化钾溶解显著放热,与草酸反应也放出大量的热,会导致溶液温度过高,使草酸分解 CuO+2KHC2O4K2[Cu(C2O4)2]+H2O K2[Cu(C2O4)2]·xH2O干燥时较为稳定,酒精易挥发,便于干燥二草酸合铜(Ⅱ)酸钾晶体
(2) a
(3) L 10-2-10-12 103 Pb(OH)2+OH =HPbO+H2O
【分析】(1)草酸固体加水微热溶解,防止草酸受热分解,之后分批加一定量K3CO3粉末,得到KHC2O4和H2C2O4的混合溶液;胆矾晶体加水溶解,加入适量的NaOH溶液,生成氢氧化铜,加热煮沸过滤得到CuO;将CuO与KHC2O4和H2C2O4的混合溶液混合,水浴加热反应得到K2[Cu(C2O4)2]溶液,蒸发浓缩、冷却结晶、过滤洗涤得到K2[Cu(C2O4)2]·xH2O。
(1)
①氢氧化钾溶解显著放热,与草酸反应也放出大量的热,会导致溶液温度过高,使草酸分解,所以不用KOH粉末代替K2CO3粉末;
②根据题意CuO与KHC2O4加热反应得到K2[Cu(C2O4)2],根据元素守恒可得化学方程式为CuO+2KHC2O4K2[Cu(C2O4)2]+H2O;
③K2[Cu(C2O4)2]·xH2O干燥时较为稳定,酒精易挥发,便于干燥二草酸合铜(Ⅱ)酸钾晶体,防止其分解;
(2)
①KMnO4标准液有强氧化性,需用酸式滴定管盛放,故选a;
②滴定过程中草酸根会被KMnO4氧化为CO2,根据电子守恒可知存在数量关系n{K2[Cu(C2O4)2]·xH2O}=1.25n(KMnO4),所以25.00mL待测液中n{K2[Cu(C2O4)2]·xH2O}=1.25×amol/L×b×10-3L=1.25×ab×10-3mol,所以250mL待测液中n{K2[Cu(C2O4)2]·xH2O}=1.25ab×10-2mol,所以产品纯度为×100%=;
(3)
=,pH越大,c(H+)越小,则越小,即lg越小,所以L表示lg与pH的关系;m点处pH=2,即c(H+)=10-2mol/L,c(OH )=10-12mol/L,溶液中存在电荷守恒2c(C2O)+c(HC2O)+c(OH )=c(Na+)+c(H+),所以2c(C2O)+c(HC2O)-c(Na+)=c(H+)-c(OH )=(10-2-10-12)mol/L;Ka1=,根据曲线K可知当lg=0.7时,pH=2,即=100.7时,c(H+)=10-2mol/L,所以Ka1=10-1.3;Ka2=,根据曲线L可知,当lg=1.3时,pH=3,即=10-1.3时,c(H+)=10-3mol/L,所以Ka2=10-4.3,则==103;根据题意Pb(OH)2沉淀与OH 反应可以得到HPbO,根据元素守恒可得离子方程式为Pb(OH)2+OH =HPbO+H2O
一、单选题
1.常温下,下列各组离子在指定溶液中能大量共存的是
A.的溶液中:、、、
B.的溶液中:、、、
C.的溶液中:、、、
D.与铝反应生成氢气的溶液中:、、、
2.下列表示对应化学反应的离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:+2H+=SO2↑ +H2O
B.向Na2SiO3溶液中通入过量SO2:+SO2+H2O=H2SiO3↓ +
C.向碳酸氢铵溶液中加入足量石灰水:Ca2+++OH-=CaCO3↓+H2O
D.将SO2通入KMnO4溶液中:5SO2 +2MnO+2H2O =5SO+2Mn2++4H+
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.电解精炼铜时,若阴极析出3.2 g铜,则阳极失电子数大于0.1NA
B.1L 0.1mol/LNa2CO3溶液中阴离子总数大于0.1NA
C.氢氧燃料电池工作时,正极消耗 11.2 L 气体,电路中转移电子数为0.1NA
D.25℃时,pH=13的Ba(OH)2溶液中含有的OH 数目为0.1NA
4.甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法不正确的是
A.活性成分在水中存在平衡:
B.的废水中
C.废水初始,随下降,甲酸的电离被抑制,与作用的数目减少
D.废水初始,离子交换树脂活性成分主要以形态存在
5.下列指定反应的离子方程式正确的是( )
A.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
B.过量的铁粉溶于稀硝酸:Fe+4H++NO=Fe3++NO↑+2H2O
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O+5H2O=10H++2SO+8Cl-
D.向NaAlO2溶液中通入过量CO2:2AlO+CO2+3H2O=2Al(OH)3↓+CO
6.下列物质的转化在给定条件下能实现的是
A.铝土矿AlOAl(OH)3Al2O3
B.盐卤(含MgCl2)溶液Mg(OH)2MgCl2无水MgCl2
C.NaHCO3(s)Na2CO3(s)NaOH(aq)
D.Fe2O3(s)Fe(s)FeCl3
7.一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中正确的是
A.a、b、c三点对应的溶液中,醋酸的电离程度最大的是b点
B.若使c点对应的溶液中c(CH3COO-)增大,可以采取的措施为:加水
C.a、b、c三点溶液用1 mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积最多的为b点
D.a、b、c三点溶液中的c(H+): c<a<b
8.下列表示对应化学反应的离子方程式正确的是
A.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
B.向稀硝酸中滴加Na2SO3溶液:SO+2H+=SO2↑+H2O
C.向Al2(SO4)3溶液中加入过量NH3·H2O:Al3++4NH3·H2O=[Al(OH)4]-+4NH
D.向Na2SiO3溶液中通入过量SO2:SiO+SO2+H2O=H2SiO3↓+SO
9.NA为阿伏加德罗常数的值。下列说法正确的是
A.C2H6(g)+2CO2(g) 4CO(g)+3H2(g) ΔH =+430 kJ·mol 1。向容器中充入1 mol [C2H6(g) + 2CO2(g) ],充分反应,吸收热量430 kJ
B.18 g的H218O和D216O,所含电子数和中子数均为9 NA
C.常温下CH3COONH4溶液的pH=7,则1 L该溶液中水电离出的H+数为10 7 NA
D.28 g晶体硅中含有的硅硅键数为4 NA
10.下列性质中,不能说明乙酸是弱电解质的是
A.乙酸钠溶液显碱性
B.常温时,0.1mol L-1乙酸溶液的pH约为3
C.10mL1mol L-1乙酸溶液与10mL1mol L-1的NaOH溶液恰好完全反应
D.在相同温度下,同物质的量浓度的乙酸溶液的导电性比盐酸溶液的弱
11.室温下,将盐酸逐滴滴入氨水中,溶液的随加入盐酸体积变化曲线如图所示。由图可知
A.M点所示溶液:
B.
C.N点所示溶液中:
D.的过程中,水的电离程度一直在增大
12.能正确表示反应的离子方程式是
A.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
B.CuSO4溶液中滴加稀氨水:Cu2++2OH-=Cu(OH)2↓
C.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO+Ba2+=BaSO4↓
D.SO2使酸性高锰酸钾溶液褪色:3SO2+2MnO+4H+=3SO+2Mn2++2H2O
13.设NA为阿伏加德罗常数的数值,下列说法正确的是
A.等质量的乙炔和苯分别完全燃烧,乙炔和苯都消耗7.5NA个氧气分子
B.1molNaH与足量水作用制备H2转移电子数为NA个
C.0.5mol雄黄(As4S4),结构如图,含有NA个S—S键
D.2molCO2与足量NaOH溶液完全反应,则n(CO)+n(HCO)+n(H2CO3)=1mol可能成立
14.室温下,通过下列实验探究亚硫酸盐的性质。已知:、。
实验 实验操作和现象
1 向溶液中通入(标准状况),测得约为9
2 向溶液中通入至溶液
3 向溶液中通入(标准状况)测得约为3
4 取实验3所得溶液,加入溶液,产生白色沉淀
下列说法错误的是A.实验1得到的溶液中:
B.实验2得到的溶液中:
C.实验3得到的溶液中
D.实验4中可知:
15.与盐酸反应有黄绿色气体生成,离子方程式正确的是
A.
B.
C.
D.
二、填空题
16.在室温下,下列五种溶液:
①0.1 mol·L-1NH4Cl ②0.1 mol·L-1CH3COONH4 ③0.1 mol·L-1NH4HSO4
④0.1 mol·L-1NH3·H2O和 0.1 mol·L-1NH4Cl混合液 ⑤pH=a的CH3COOH
请根据要求填写下列空白:
(1)溶液①呈________性(填“酸”“碱”或“中”),其原因是______________(用离子方程式表示)。
(2)比较溶液②、③中c()的大小关系是②________③(填“>”“<”或“=”)。
(3)在溶液④中,NH3·H2O和________物质的量浓度之和为0.2 mol·L-1(填微粒符号)。
(4)室温,溶液②的pH=7,CH3COO-与浓度的大小关系是c(CH3COO-)______c()(填“>”“<”或“=”)。
(5)溶液⑤稀释100倍后所得溶液pH_______a+2(填“>”或“<”或“=”)。
17.写出下列反应的离子反应方程式
①锌与稀硫酸反应_______;
②少量二氧化碳通入澄清石灰水中_______;
③硫酸铜溶液和氢氧化钡溶液混合__________;
④氢氧化钠溶液与稀硫酸_______;
⑤硫酸氢钠溶液与氢氧化钡溶液混合至中性_______。
三、计算题
18.计算25 ℃时下列溶液的pH:
(1)1 mL pH=2的溶液加水稀释至100 mL,pH=_______;
(2)的盐酸,pH=_______;
(3)的NaOH溶液,pH=_______;
19.已知:常温下,,。试推测常温下,溶液呈_______(填“酸性”“碱性”或“中性”),其原因是_______(用必要的文字说明)。
四、实验题
20.MnO2是中学化学常用的试剂。某课外兴趣小组制取MnO2,并探究MnO2的性质。
(1)向MnO2中加入浓HCl并加热,有黄绿色气体产生。推测MnO2具有_______性。
(2)该小组通过双氧水分解速率的影响因素,运用对比实验获得以下数据:
①
实验序号 MnO2用量/g H2O2溶液质量分数 H2O2溶液的体积/mL 反应温度/℃ 收集O2体积/mL 所需时间/s
a 0 0.30 5 85 2 3.8
b 0.1 0.15 2 20 2 2.8
c 0.2 0.15 2 20 2 2.2
d 0 0.30 V 55 2 10.5
e 0.1 0.05 2 20 2 7.4
①实验b和c得出结论:_______。
②实验b和e得出结论:_______。
③若想测定温度对反应的影响,V=_______。
(3)已知:一定条件下,MnO可与Mn2+反应生成MnO2。此反应的离子方程式是_______。
21.二草酸合铜(Ⅱ)酸钾晶体,化学式为K2[Cu(C2O4)2]·xH2O,是一种工业化工原料。微溶于冷水和酒精,虽可溶于热水但会慢慢分解,干燥时较为稳定,在150℃时会失去结晶水,260℃以上会分解。
(1)实验室以胆矾和草酸为原料制备二草酸合铜(Ⅱ)酸钾晶体的流程如图甲回答下列问题:(已知:H2C2O4=CO↑+CO2↑+H2O)
①制取KHC2O4溶液过程中,不用KOH粉末代替K2CO3粉末的原因是_______。
②CuO与混合液中的KHC2O4水浴加热时,反应的化学方程式为_______。
③“系列操作”中用酒精洗涤而不用冷水洗涤的优点是_______。
(2)产品纯度的测定
已知:K2[Cu(C2O4)2]·xH2O的摩尔质量为Mg·mol-1。准确称取制得的晶体试样cg于小烧杯中,加入氨水使其溶解,再加入一定量的水,使其全部溶解,然后转移至250mL的容量瓶中,洗涤后加水定容。取试样溶液25.00mL,加入一定量稀硫酸酸化,用amol·L 1的KMnO4标准液滴定,消耗KMnO4标准液bmL
①滴定时,盛装KMnO4标准液的仪器为_______(填“a”或“b”)。
(2)该产品的纯度为_______。
(3)甲酸钠法是制草酸的主要方法,但易产生大量的含铅废水,主要有草酸铅、硫酸铅、草酸等成分。为中和废酸除去铅可采用氢氧化物沉降法。向其中加入NaOH,草酸中离子的有关数据与pH的变化关系如图(数据均为常温下测定):
图中表示lg与pH关系的是_______(填“K”或“L”),曲线m点溶液中,2c(C2O)+c(HC2O)-c(Na+)_______mol·L-1(填计算式),由图可知=_______。若向废水中加入过量的碱会使生成的Pb(OH)2沉淀转化为HPbO,使沉淀物溶解而影响处理效果,写出由Pb(OH)2生成HPbO的离子方程式_______。
试卷第2页,共8页
试卷第1页,共8页
(北京)股份有限公司
(北京)股份有限公司
参考答案:
1.C
【详解】A.的溶液中含有大量,在酸性条件下,与因发生氧化还原反应而不能大量共存,A项错误;
B.与因发生离子反应而不能大量共存,B项错误;
C.的溶液显酸性,四种离子可以大量共存,C项正确;
D.与铝反应生成氢气的溶液可能显酸性,也可能显碱性,溶液显酸性时,不能大量存在,溶液显碱性时,不能大量存在,D项错误。
故答案选:C。
2.D
【详解】A. 硝酸有强氧化性,亚硫酸根有还原性,二者会发生氧化还原反应,正确的离子方程式为:2+3+2H+=3+H2O+2NO↑,故A错误;
B.Na2SiO3溶液中通入过量SO2会生成亚硫酸氢根而不是亚硫酸根,正确的离子方程式为:+2SO2+2H2O=H2SiO3↓ +2,故B错误;
C. 向碳酸氢铵溶液中加入足量石灰水,正确的离子方程式为:+Ca2+++2OH-=CaCO3↓+H2O+ NH3·H2O,故C错误;
D. 将SO2通入KMnO4溶液中,发生氧化还原反应,离子方程式正确,故D正确;
答案选D。
3.B
【详解】A.电解精炼铜时阴极上发生Cu2++2e-=Cu,析出3.2g即0.05mol铜时转移0.1mol电子,根据电子守恒可知阳极失电子数也为0.1NA,故A错误;
B.1L 0.1mol/LNa2CO3溶液中含有0.1molNa2CO3,含有0.1mol CO,碳酸钠溶液中存在水解平衡:CO+H2OHCO+OH-,HCO+H2OH2CO3+OH-,可知由于碳酸根的水解使溶液中阴离子总数大于原碳酸根的总数,所以溶液中阴离子总数大于0.1NA,故B正确;
C.温度和压强未知无法计算11.2L气体的物质的量,无法计算转移电子数,故C错误;
D.溶液体积未知,无法计算溶液中的离子数目,故D错误;
综上所述答案为B。
4.D
【详解】A.由图可知,溶液呈碱性,溶液中存在如下平衡,故A正确;
B.由电离常数公式可知,溶液中=,当溶液pH为5时,溶液中==18,故B正确;
C.由图可知,溶液pH为2.4时,废水中的甲酸及其盐回收率最高,当溶液中pH小于2.4时,随溶液pH下降,溶液中氢离子浓度增大,甲酸的电离被抑制,溶液中甲酸根个离子浓度减小,与作用的数目减小,故C正确;
D.由图可知,溶液呈碱性,溶液中存在如下平衡,当废水初始pH大于5时,平衡向左移动,离子交换树脂活性成分主要以R3N形态存在,故D错误;
故选D。
5.C
【详解】A.酸性条件下,过氧化氢与海带灰浸出液中的碘离子反应生成单质碘和水,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O,故A错误;
B.过量的铁粉溶于稀硝酸生成硝酸亚铁、一氧化氮和水,反应的离子方程式为3Fe+2NO+8H+=3Fe2++2NO↑+4H2O,故B错误;
C.Na2S2O3溶液与Cl2反应生成硫酸和盐酸,反应的离子方程式为4Cl2+S2O+5H2O=10H++2SO+8Cl-,故C正确;
D.NaAlO2溶液中与过量的CO2反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为AlO+CO2+2H2O=Al(OH)3↓+HCO,故D错误;
故选C。
6.C
【详解】A.氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液中加入足量的盐酸,生成氯化铝,得不到氢氧化铝,故A错误;
B.盐卤(含MgCl2)与石灰乳反应生成氢氧化镁沉淀,氢氧化镁与盐酸反应生成氯化镁溶液,由于Mg2+水解Mg2++2H2O Mg(OH)2+2H+,加热蒸发时HCl挥发,平衡向右移动,所以得不到无水MgCl2,故B错误;
C.NaHCO3(s)不稳定,加热分解生成Na2CO3(s),Na2CO3(s)与饱和石灰水生成碳酸钙沉淀和NaOH(aq),故C正确;
D.Fe与盐酸反应生成FeCl2,故D错误;
故答案为C。
7.D
【分析】冰醋酸加水稀释,醋酸不断电离,溶液中离子浓度不断增大,溶液导电能力增大,到一定程度后,电离出的离子使浓度增大的程度低于加水量使浓度减小的程度,溶液中离子浓度减小,导电能力下降。
【详解】A.弱电解质越稀释越电离,a、b、c三点对应的溶液中,醋酸的电离程度最大的是c点,A错误;
B.c点已经处于分析中的导电能力下降阶段,加水只会导致c(CH3COO-)减小,B错误;
C.醋酸与氢氧化钠溶液中和,消耗氢氧化钠的量与醋酸的总物质的量有关,与醋酸的电离程度无关,与加水量无关,C错误;
D.醋酸的导电能力由其电离出的离子浓度大小决定,a、b、c三点溶液中的离子浓度关系是b>a>c,醋酸溶液中c(H+)由其电离决定,故c(H+): c<a<b,D正确;
故选D。
8.A
【详解】A.过氧化钠溶于水生成氢氧化钠和氧气,氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜沉淀,A正确;
B.硝酸具有强氧化性,与亚硫酸钠发生氧化还原反应,生成硫酸钠、NO和水,B错误;
C.氨水是弱碱,不能溶解氢氧化铝,生成物是氢氧化铝、硫酸铵,C错误;
D.二氧化硫过量,生成物是硅酸和亚硫酸氢钠,D错误;
答案选A。
9.B
【详解】A.已知C2H6(g)+2CO2(g)4CO(g)+3H2(g) ΔH =+430 kJ·mol 1,该反应为可逆反应,表示的含义为:生成4molCO和3molH2吸收430kJ能量,向容器中充入1 mol [C2H6(g) + 2CO2(g) ],充分反应,生成的CO小于4mol,吸收热量小于430 kJ,故A错误;
B.H218O和D216O的电子数和中子数均为10,所以18 g的H218O为0.9mol,电子数和中子数为9 NA,18 g的D216O为0.9mol,电子数和中子数为9 NA,故B正确;
C.常温下CH3COONH4中阴阳离子都能水解,促进水的电离,所以1 L该溶液中水电离出的H+数大于10 7 NA,故C错误;
D.28 g晶体硅为1mol,1mol晶体硅含有的硅硅键数为2NA,故D错误;
故选B。
10.C
【详解】A. 乙酸钠溶液显碱性,说明乙酸钠是强碱弱酸盐,则证明乙酸是弱酸,为弱电解质,故A不选;
B. 常温时,0.1 mol L 1乙酸溶液的pH约为3,溶液中氢离子浓度小于酸浓度,说明乙酸不完全电离为弱电解质,故B不选;
C. 10mL 1mol L 1乙酸溶液与10mL1mol L 1的NaOH溶液恰好完全反应,说明乙酸是一元酸不能说明乙酸部分电离,所以不能证明乙酸是弱电解质,故C选;
D. 相同温度下,同物质的量浓度的乙酸溶液的导电性比甲酸(为弱酸)溶液的弱,说明乙酸电离程度小于甲酸,甲酸是弱酸,则乙酸也是弱酸,故D不选;
答案选C。
【点睛】弱电解质在水溶液里部分电离,只要说明乙酸在水溶液里部分电离就能证明乙酸是弱电解质,可以根据一定浓度的pH、其钠盐溶液酸碱性等判断。
11.C
【详解】A.M点溶液呈碱性,为的混合溶液,则溶液中有,故A错;
B.恰好完全反应得到溶液呈酸性,Q点溶液呈中性,则氨水稍微过量,所以a<20.00mL,故B错;
C.N点溶液呈酸性,溶液中,结合电荷守恒,可知,故选C;
D.的过程中,M点溶液呈碱性,为的混合溶液,会抑制水的电离;Q呈中性,水的电离程度最大;N溶液呈酸性,则溶液由的混合溶液,会抑制水的电离,所以的过程中水的电离程度先增大后减小,故D错。
答案选C
12.A
【详解】A.FeCl3溶液和Cu反应生成FeCl2和CuCl2,离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故A正确;
B.NH3H2O为弱电解质,不能拆开写,正确的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2N,故B错误;
C.OH-先与Fe2+反应,再和N反应,由于Ba(OH)2溶液较少,N不参与反应,正确的离子方程式为:Fe2++SO+Ba2++2OH-=BaSO4↓+Fe(OH)2↓,故C错误;
D.二者发生氧化还原反应生成锰离子、硫酸根离子,转移电子不守恒,正确的离子方程式为:5SO2+2MnO+2H2O=5SO+2Mn2+ +4H+,故D错误;
答案选A。
13.B
【详解】A.等质量并没有给出具体质量是多少,所以无法确定消耗的氧气的量,A错误;
B.NaH与水反应的化学方程式为NaH+H2O=NaOH+H2↑,为归中反应,该反应中NaH为唯一还原剂,氢元素由-1价升高到0价,所以1molNaH完全反应转移NA个电子,B正确;
C.As最外层有5个电子,S最外层有6个电子,所以白球应为S原子,所以该物质中并没有S-S键,C错误;
D.根据物料守恒n(CO)+n(HCO)+n(H2CO3)=2mol,D错误;
综上所述答案为B。
14.C
【详解】A.11.2mL(标准状况)SO2的物质的量为=0.0005mol,故实验1得到Na2SO3溶液中,根据质子守恒可得2c(H2SO3)+c(HS)+c(H+)=c(OH-),又Na2SO3溶液中2c(H2SO3)
B.实验2得到的溶液pH=7,即c(H+)=c(OH-),溶液中电荷守恒有:,则有,B正确;
C.22.4mL(标准状况)SO2的物质的量为=0.001mol,与溶液反应,故实验3得到NaHSO3溶液,其浓度为0.1mol/L,c(H+)+c(Na+)=c(HS)+2c(S)+c(OH-),由Kh(HS)==
D.实验4中亚硫酸氢钠浓度为0.1mol/L,BaCl2溶液0.01mol/L,各1mL等体积混合,混合液c(Ba2+)=,c(S)==,则Qc(BaSO3)=c(Ba2+)·c(S)==0.005×5×10-6=2.5×10-8,该溶液产生白色沉淀,说明Qc(BaSO3)>Ksp(BaSO3),故,D正确;
故选C。
15.C
【详解】与盐酸反应有黄绿色气体生成,说明氯离子被氧化为氯气,则被还原为,难溶于水,不能拆写为离子,反应的离子方程式是,故选C。
16.(1) 酸
(2)<
(3)
(4)=
(5)<
【解析】(1)
NH4Cl为强酸弱碱盐,铵根离子水解溶液显酸性,水解的离子方程式为;故正确答案:酸;;
(2)
水解程度越大,则离子浓度越小,0.1mol/L CH3COONH4中铵根离子和醋酸根离子发生相互促进的水解,水解程度较大,铵根离子浓度小于0.1mol/L;0.1mol/L NH4HSO4中电离的氢离子抑制铵根离子水解,铵根离子水解程度较小,铵根离子浓度大于0.1mol/L;所以CH3COONH4中铵根离子浓度小于NH4HSO4中铵根离子浓度;故正确答案:<;
(3)
0.1 mol·L-1NH3·H2O和0.1 mol·L-1NH4Cl混合液中,存在物料守恒,则NH3 H2O和的物质的量浓度之和为0.2mol/L;故正确答案:;
(4)
0.1mol/L CH3COONH4的pH=7,显中性,则CH3COO-的水解程度与的水解程度相同,CH3COONH4溶液中存在电荷守恒:,已知显中性,则,所以,故正确答案:=;
(5)
稀释促进醋酸的电离,pH=a的CH3COOH溶液稀释100倍后,醋酸的电离平衡向右移动,氢离子的物质的量增加,则稀释后溶液中氢离子浓度大于原来的1/100,因此所得溶液pH
【详解】①锌与稀硫酸反应产生ZnSO4、H2,根据物质拆分原则,可得该反应的离子方程式为:Zn+2H+=Zn2++H2↑;
②少量二氧化碳通入澄清石灰水中,反应产生CaCO3沉淀和H2O,该反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O;
③硫酸铜溶液和氢氧化钡溶液混合,反应产生BaSO4沉淀和Cu(OH)2沉淀,该反应的离子方程式为:Cu2+++Ba2++2OH-=BaSO4↓+Cu(OH)2↓;
④氢氧化钠溶液与稀硫酸混合,发生中和反应产生Na2SO4和H2O,该反应的离子方程式为:H++OH-=H2O;
⑤硫酸氢钠溶液与氢氧化钡溶液混合至中性,反应产生BaSO4沉淀、Na2SO4和H2O,该反应的离子方程式为:2H+++Ba2++2OH-=BaSO4↓+2H2O。
【点睛】酸性氧化物与碱反应或酸式盐与碱反应时,两种物质的相对物质的量多少不同,发生的反应也不同,在书写离子方程式时,要注意二者相对量的多少对反应产物的影响,结合物质的溶解性及物质的拆分原则进行书写。
18.(1)4
(2)3
(3)12
【详解】(1)1 mL pH=2的 H2SO4 溶液加水稀释至100 mL,溶液体积变为原来的100倍,则H+浓度降低到原来的,则溶液的pH增大2,所以稀释后溶液的pH=4。
(2)0.001mol L 1 的盐酸中c(H+)=0.001mol/L,所以pH=-lgc(H+)=3。
(3)常温下,0.01mol L 1 的NaOH溶液中c(OH-)=0.01mol/L,则c(H+)==10-12mol/L,所以溶液的pH=12。
19. 酸性 在溶液中可发生水解,其水解常数,在溶液中也可以发生电离,,即的水解程度小于其电离程度,溶液呈酸性
【详解】在溶液中可发生水解,其水解常数,在溶液中也可以发生电离,,即的水解程度小于其电离程度,溶液呈酸性。
20.(1)氧化
(2) 在其它条件不变时,MnO2用量越多,接触面积加大,使H2O2分解速率加快 在其它条件不变时,增大反应物(H2O2)浓度,H2O2分解速率加快 5 mL
(3)2+3Mn2++2H2O=5MnO2+4H+
【分析】MnO2与浓盐酸在加热条件下反应制取黄绿色的气体Cl2。MnO2是H2O2分解反应的催化剂,在探究外界条件对化学反应速率影响时,要采用控制变量方法研究,即其它条件都相同,只改变一个条件,看这个条件与化学反应速率的关系。
【详解】(1)MnO2与浓盐酸在加热条件下反应制取黄绿色的气体Cl2。该反应方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,在该反应中,Mn元素化合价由反应前MnO2中的+4价变为反应后MnCl2中的+2价,元素的化合价降低,得到电子被还原,所以白反应说明MnO2具有强氧化性;
(2)①实验b和c只有MnO2的量不同,其它外界条件都相同,我们看到:在其它条件不变时,MnO2用量越多,接触面积加大,使H2O2分解速率加快;
②实验b和e只有H2O2溶液质量分数不同,其它外界条件都相同,我们看到:在其它条件不变时,增大反应物(H2O2)浓度,H2O2分解速率加快;
③若想测定温度对反应的影响,则应该只有温度这个条件不同,其它条件都相同,对比表格实验数据,可知实验a、d的温度不同,其它外界条件相同,则V=5 mL;
(3)已知:一定条件下,可与Mn2+反应生成MnO2。根据电子守恒、电荷守恒、原子守恒,可得反应的离子方程式是2+3Mn2++2H2O=5MnO2+4H+。
21.(1) 氢氧化钾溶解显著放热,与草酸反应也放出大量的热,会导致溶液温度过高,使草酸分解 CuO+2KHC2O4K2[Cu(C2O4)2]+H2O K2[Cu(C2O4)2]·xH2O干燥时较为稳定,酒精易挥发,便于干燥二草酸合铜(Ⅱ)酸钾晶体
(2) a
(3) L 10-2-10-12 103 Pb(OH)2+OH =HPbO+H2O
【分析】(1)草酸固体加水微热溶解,防止草酸受热分解,之后分批加一定量K3CO3粉末,得到KHC2O4和H2C2O4的混合溶液;胆矾晶体加水溶解,加入适量的NaOH溶液,生成氢氧化铜,加热煮沸过滤得到CuO;将CuO与KHC2O4和H2C2O4的混合溶液混合,水浴加热反应得到K2[Cu(C2O4)2]溶液,蒸发浓缩、冷却结晶、过滤洗涤得到K2[Cu(C2O4)2]·xH2O。
(1)
①氢氧化钾溶解显著放热,与草酸反应也放出大量的热,会导致溶液温度过高,使草酸分解,所以不用KOH粉末代替K2CO3粉末;
②根据题意CuO与KHC2O4加热反应得到K2[Cu(C2O4)2],根据元素守恒可得化学方程式为CuO+2KHC2O4K2[Cu(C2O4)2]+H2O;
③K2[Cu(C2O4)2]·xH2O干燥时较为稳定,酒精易挥发,便于干燥二草酸合铜(Ⅱ)酸钾晶体,防止其分解;
(2)
①KMnO4标准液有强氧化性,需用酸式滴定管盛放,故选a;
②滴定过程中草酸根会被KMnO4氧化为CO2,根据电子守恒可知存在数量关系n{K2[Cu(C2O4)2]·xH2O}=1.25n(KMnO4),所以25.00mL待测液中n{K2[Cu(C2O4)2]·xH2O}=1.25×amol/L×b×10-3L=1.25×ab×10-3mol,所以250mL待测液中n{K2[Cu(C2O4)2]·xH2O}=1.25ab×10-2mol,所以产品纯度为×100%=;
(3)
=,pH越大,c(H+)越小,则越小,即lg越小,所以L表示lg与pH的关系;m点处pH=2,即c(H+)=10-2mol/L,c(OH )=10-12mol/L,溶液中存在电荷守恒2c(C2O)+c(HC2O)+c(OH )=c(Na+)+c(H+),所以2c(C2O)+c(HC2O)-c(Na+)=c(H+)-c(OH )=(10-2-10-12)mol/L;Ka1=,根据曲线K可知当lg=0.7时,pH=2,即=100.7时,c(H+)=10-2mol/L,所以Ka1=10-1.3;Ka2=,根据曲线L可知,当lg=1.3时,pH=3,即=10-1.3时,c(H+)=10-3mol/L,所以Ka2=10-4.3,则==103;根据题意Pb(OH)2沉淀与OH 反应可以得到HPbO,根据元素守恒可得离子方程式为Pb(OH)2+OH =HPbO+H2O
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
