6.1化学反应与热能 教案(共一课时) 高中化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1化学反应与热能 教案(共一课时) 高中化学人教版(2019)必修第二册 |

|
|
| 格式 | doc | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-30 14:49:59 | ||
图片预览



文档简介
化学反应与热能
【学习目标】
1、知道化学键的断裂与形成是化学反应中能量变化的主要原因
2、知道反应物与生成物总能量的相对高低是反应过程中能量变化的决定因素
3、熟悉常见的吸热反应和放热反应
【主干知识梳理】
一、化学反应过程中存在热量变化
1、实验探究
(1)镁和稀盐酸的反应
实验过程 在一支试管中加入2 mL 2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化
实验操作示意图
实验现象 有气泡产生;用手触摸反应后的试管,温热;用温度计测得反应后温度升高
离子反应 Mg+2H+===Mg2++H2↑
实验结论 活泼金属与酸反应是放热反应
(2)Ba(OH)2·8H2O和氯化铵反应
实验过程 将20 g Ba(OH)2·8H2O晶体研细后与NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸杯壁下部,试着用手拿起烧杯。观察现象
实验操作示意图
实验现象 混合物呈糊状;闻到刺激性气味;用手触摸杯壁下部,冰凉;用手拿起烧杯,木片与烧杯粘在一起
化学反应 Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
实验结论 该反应是吸热反应
(3)结论:化学反应中总会伴随着能量变化,通常主要表现为热能的变化,有的放出热量,有的吸收热量
2、吸热反应和放热反应
(1)概念
①放热反应:把释放热量的化学反应称为放热反应
②吸热反应:把吸收热量的化学反应称为吸热反应
(2)常见的放热反应和吸热反应
①常见的放热反应
a.所有的燃烧反应,如:木炭、CH4等在空气或氧气中的燃烧,Na、H2在Cl2中燃烧,镁条在CO2中燃烧
b.所有的酸碱中和反应,如:HCl+NaOH===NaCl+H2O
c.大多数的化合反应,如:CaO+H2O===Ca(OH)2 H2+F2===2HF
d.活泼金属与水、与酸的反应,如:2Na+2H2O===2NaOH+H2↑ Mg+2H+===Mg2++H2↑
e.铝热反应,如:2Al+Fe2O3 2Fe+Al2O3
f.生成沉淀的反应,如:SO42-+Ba2+===BaSO4↓
②常见的吸热反应
a.大多数分解反应,如:NH4ClNH3↑+HCl↑ CaCO3CaO+CO2↑
b.以碳、CO、H2为还原剂的氧化还原反应:如:H2+CuOH2O+Cu
c.Ba(OH)2·8H2O与NH4Cl的反应(固态铵盐与碱的反应)
d.C和CO2发生的化合反应及C和H2O(g)的反应
e.NaHCO3与盐酸的反应
【微点拨】
(1)吸热反应和放热反应的理解
①“四个不一定”
a.需加热才能发生的反应不一定是吸热反应,如:碳和氧气的反应
b.放热反应在常温下不一定容易发生,如:N2与H2合成NH3
c.高温条件下进行的反应不一定是吸热反应,如:铝热反应
d.吸热反应也不一定需要加热,如:Ba(OH)2·8H2O晶体和NH4Cl晶体的反应
②吸热反应和放热反应都是化学变化,如:NaOH固体溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应
③反应前需要加热的化学反应,停止加热后若反应还能继续进行,则该反应为放热反应
④一般情况下,持续加热或持续高温的化学反应,通常为吸热反应
(2)化学反应的能量变化,除转化为热能外,还转化为机械能、光、声、电等多种能量形式
(3)化学反应遵循的两条基本规律:质量守恒定律和能量守恒定律
(4)物质发生化学反应一定伴随着能量变化,但伴随能量变化的物质变化不一定都是化学变化
如:水蒸气变成液态水的过程放热,但该变化为物理变化
(5)能量越低越稳定。同一物质能量由高到低:气体(g)>液体(l)>固体(s);稳定性:气体(g)<液体(l)<固体(s)
(6)任何化学反应在发生物质变化的同时都伴随着能量的变化,通常表现为热量变化,即放出热量或吸收热量
【对点训练1】
1、下列反应是吸热反应的是( )
A.硫的燃烧 B.水的分解 C.食物的氧化变质 D.中和反应
2、下列说法正确的是( )
A.Fe与S在加热条件下才能发生反应,所以该反应属于吸热反应
B.HNO3、H2SO4分别与NaOH溶液反应都放出热量
C.分解反应都是吸热反应,化合反应都是放热反应
D.合成氨的反应是放热反应,所以N2与其他物质的反应也是放热反应
二、化学反应存在能量变化的原因
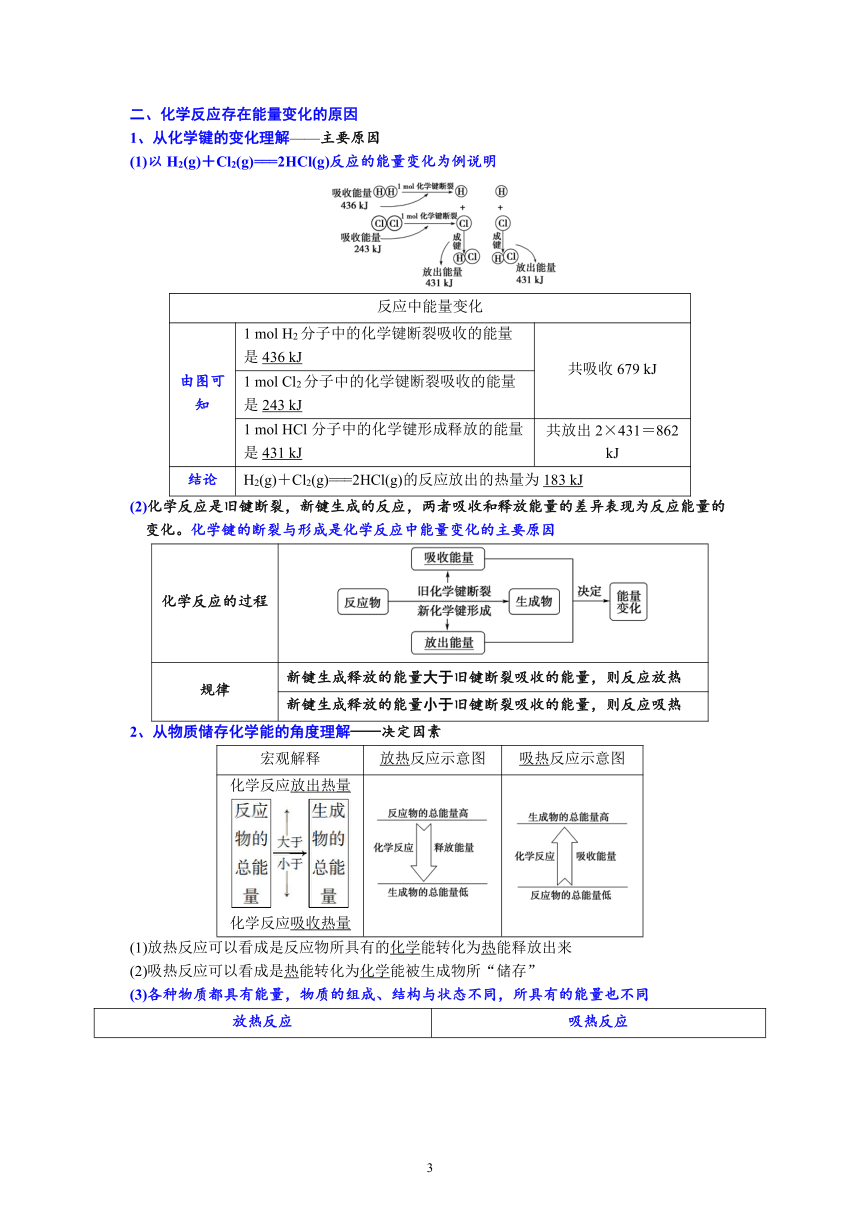
1、从化学键的变化理解——主要原因
(1)以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明
反应中能量变化
由图可知 1 mol H2分子中的化学键断裂吸收的能量是436 kJ 共吸收679 kJ
1 mol Cl2分子中的化学键断裂吸收的能量是243 kJ
1 mol HCl分子中的化学键形成释放的能量是431 kJ 共放出2×431=862 kJ
结论 H2(g)+Cl2(g)===2HCl(g)的反应放出的热量为183 kJ
(2)化学反应是旧键断裂,新键生成的反应,两者吸收和释放能量的差异表现为反应能量的变化。化学键的断裂与形成是化学反应中能量变化的主要原因
化学反应的过程
规律 新键生成释放的能量大于旧键断裂吸收的能量,则反应放热
新键生成释放的能量小于旧键断裂吸收的能量,则反应吸热
2、从物质储存化学能的角度理解——决定因素
宏观解释 放热反应示意图 吸热反应示意图
化学反应放出热量化学反应吸收热量
(1)放热反应可以看成是反应物所具有的化学能转化为热能释放出来
(2)吸热反应可以看成是热能转化为化学能被生成物所“储存”
(3)各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同
放热反应 吸热反应
反应物总能量大于生成物总能量,反应放热 反应物总能量小于生成物总能量,反应吸热
【微点拨】
①破坏反应物中的化学键吸收的能量越小,说明反应物越不稳定,本身的能量越高
②形成生成物的化学键放出的能量越多,说明生成物越稳定,本身的能量越低
3、放热反应与吸热反应的比较
类型比较 放热反应 吸热反应
定义 释放热量的化学反应 吸收热量的化学反应
形成原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
与化学键的关系 生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
反应过程图示
4、吸热反应和放热反应的判断方法
(1)根据反应物和生成物的总能量的相对大小判断——决定因素
若反应物的总能量大于生成物的总能量,属于放热反应,反之是吸热反应
(2)根据化学键断裂或形成时的能量变化判断——主要原因
若断裂反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量,属于放热反应,反之是吸热反应
(3)根据反应物和生成物的相对稳定性判断
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应
(4)根据反应条件判断
凡是持续加热才能进行的反应一般就是吸热反应
【对点训练2】
1、下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小
④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有③④ B.只有①② C.①②③④ D.②③④
2、已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对
H2(g)+I2(g)2HI(g)的反应类型判断错误的是( )
A.放出能量的反应 B.吸收能量的反应
C.氧化还原反应 D.可逆反应
3、下列反应中能量变化趋势与如图一致的是( )
A.氢氧化钡晶体与氯化铵晶体混合 B.中和反应
C.木炭在氧气中发生不完全燃烧 D.生石灰和水的反应
4、下图中,能表示灼热的炭与二氧化碳反应的能量变化的是( )
5、已知化学反应N2+3H22NH3的能量变化如图所示:
(1)1 mol N和3 mol H生成1 mol NH3(g)是________(填“吸收”或“释放”)能量的过程
(2)由 mol N2(g)和 mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量
三、化学能与热能相互转化的应用
1、化学能与热能的相互转化在生活、生产中的应用
化学物质中的化学能通过化学反应转化成热能,提供了人类生存和发展所需要的能量和动力,如:化石燃料的燃烧、炸药开山、发射火箭等;而热能转化为化学能是人们进行化工生产、研制新物质不可或缺的条件和途径,如:高温冶炼金属、分解化合物等
2、生物体中的能量转化及利用
能源物质在人体中氧化分解生成CO2和H2O,产生的能量一部分以热量的形式散失;另一部分作为可转移能量在人体内利用(如:合成代谢)
3、人类利用能源的三个阶段:柴草时期、化石能源时期和多能源结构时期。可再生能源和清洁能源是两类重要的新能源,主要有太阳能、氢能、核能、生物质能等。
4、现阶段人类获取热能的主要途径是:物质的燃烧,使用最多的常规能源是:化石燃料(煤、石油和天然气)。
5、化石燃料获取能量面临的问题
(1)储量有限,短期内不可再生
(2)影响环境:煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源
6、节能减排的措施
(1)燃料燃烧阶段提高燃料的燃烧效率——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率
(2)能量利用阶段提高能源的利用率——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率
(3)开发使用新能源,目前人们比较关注的新能源有太阳能、风能、地热能、海洋能和氢能等
①特点:资源丰富、可以再生、对环境无污染等
②人们比较关注的新能源:太阳能、风能、地热能、海洋能和氢能等
【对点训练3】
1、冰岛火山爆发再一次向人类敲响了警钟,必须发展“低碳经济”。氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车备受青睐。下列不是氢能优点的是( )
A.原料来源广 B.易燃烧,放出热量多 C.生成物无污染 D.制取H2简单易行
2、新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列能达到新能源标准的是( )
①地热能 ②煤 ②天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A.②⑤⑦⑧ B.①④⑤⑦⑧ C.④⑤⑦⑧ D.②③⑥⑦⑧
3、有专家指出,如果利用太阳能使燃烧产物如CO2、H2O、N2等重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。观察下面图示,判断在此构想的物质循环中,太阳能最终转化为( )
A.化学能 B.热能 C.生物质能 D.电能
4、“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是( )
A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
【课后作业】
1、将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是( )
A.NH4HCO3和盐酸的反应是放热反应 B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量 D.NH4HCO3的能量一定低于NH4Cl的能量
2、下列说法不正确的是( )
A.当今社会人们所需的能量绝大部分是由化学反应产生的
B.目前,全球仍处于化石能源时代
C.人体生命活动所需要的能量,是由氧化还原反应提供的
D.凡是放出热量的化学反应均可用来造福人类
3、下列关于能源和作为能源使用的物质的叙述中错误的是( )
A.化石能源物质内部蕴含着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在一定条件下转化为热能、电能,为人类所利用
D.吸热反应没有利用价值
4、下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
5、下列变化中属于吸热反应的是( )
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化
④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应
A.①④ B.②③ C.①④⑤ D.②④
6、化学反应的发生必然伴随能量的转化,其最根本的原因是( )
A.化学反应中一定有新物质生成
B.化学反应中旧化学键的断裂需要吸收能量,新化学键的形成需要放出能量
C.化学反应通常需要加热等条件才能发生
D.能量变化是化学反应的基本特征之一
7、下列有关化学反应能量变化的叙述中正确的是( )
①如果反应物的总能量低于生成物的总能量,该反应一定是吸热反应
②只要是在点燃条件下进行的反应就一定是吸热反应
③只要是在常温常压下进行的反应就一定是放热反应
④燃烧反应一定是放热反应
⑤化合反应都是放热反应,分解反应都是吸热反应
A.①④ B.①②③ C.③⑤ D.④⑤
8、已知反应A+B===C+D的能量变化如图所示,下列说法正确的是( )
A.该反应是放热反应
B.只有在加热条件下才能进行
C.反应物的总能量高于生成物的总能量
D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量
9、在25 ℃,101 kPa下,1 mol的白磷(化学式为P4)完全燃烧放出的热量比4 mol的红磷(化学式为P)完全燃烧放出的热量多。化学方程式分别为P4(s)+5O2(g)===P4O10(s);4P(s)+5O2(g)===P4O10(s)。由此判断,下列说法正确的是( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
10、北京奥运会开幕式在李宁点燃鸟巢主火炬时达到高潮。奥运火炬采用的是环保型燃料——丙烷,其燃烧时发生反应的化学方程式为C3H8+5O23CO2+4H2O。下列说法中不正确的是( )
A.火炬燃烧时化学能只转化为热能
B.所有的燃烧反应都会释放热量
C.1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
11、为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
12、已知2SO2+O22SO3为放热反应,下列关于该反应的说法正确的是( )
A.O2的能量一定高于SO2的能量 B.2 mol SO2和1 mol O2的总能量一定高于2 mol SO3的总能量
C.SO2的能量一定高于SO3的能量 D.因该反应放热,故不加热反应就可发生
13、化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应 B.断裂1 mol A—A键和1 mol B—B键放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量 D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
14、氢气燃烧生成水蒸气的能量变化如图所示。下列说法正确的是( )
A.燃烧时化学能全部转化为热能
B.断开1 mol氢氧键吸收930 kJ的能量
C.相同条件下,1 mol氢原子的能量为E1,1 mol氢分子的能量为E2,则2E1<E2
D.该反应生成1 mol水蒸气时放出能量245 kJ
15、肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N键为942、O===O键为500、N—N键为154,则断裂1 mol N—H键所需的能量(kJ)是( )
A.194 B.391 C.516 D.658
15、B。解析:利用图示可知1 mol肼和氧气变成原子时断键需要的能量为2 752 kJ-534 kJ=2 218 kJ。肼和氧气断键变为原子时要断裂1个N—N键、4个N—H键和1个O===O键,所以1×154 kJ+4×E(N—H)+1×500 kJ=2 218 kJ,解得断裂1 mol N—H键所需的能量为391 kJ。
16、化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图表示N2(g)与O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
A.1 mol N2(g)与1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)与O2(g)混合能直接生成NO(g)
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
17、液态储氢技术就是在常温常压下将氢气融入到一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是( )
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
18、下列有关新能源的说法不正确的是( )
A.绿色植物通过光合作用,将光能转化为化学能
B.风能、太阳能是清洁能源
C.氢能还未进入实用阶段的主要原因是其燃烧所放热量低于相同质量的矿物燃料
D.共享单车利用太阳能发电完成卫星定位,有利于节能环保
19、如图所示,在小试管里加入2 g新制备的无水硫酸铜,把小试管套在具支试管内。在U形管内加入少量红墨水。打开T形管螺旋夹,使U形管内两边的液面处于同一水平面。再夹紧螺旋夹,把水滴入小试管内,白色的无水硫酸铜完全变成蓝色的五水硫酸铜晶体,可观察到U形管右侧的液面立即下降,左侧的液面上升。
(1)①写出上述反应的化学方程式:_________________________________________________________
②该反应是________(填“吸热”或“放热”)反应
③反应中的硫酸铜和水具有的总能量________(填“大于”或“小于”)硫酸铜晶体的总能量
(2)如果U形管内两边的液面处于同一水平面后,在小试管内先加入Ba(OH)2·8H2O晶体,再加入NH4Cl固体,用玻璃棒不断搅拌,则可观察到U形管中的现象为__________________________________
【化学反应与热能】答案
【对点训练1】
1、B
2、B。解析:Fe与S虽然需加热才能发生反应,但反应开始后,停止加热,反应能继续进行,加热只是为了引发反应,所以该反应是放热反应,A错误;中和反应都是放热反应,B正确;分解反应不一定是吸热反应,如H2O2的分解反应就是放热反应,化合反应也不一定是放热反应,如CO2与C的反应就是吸热反应,C错误;与N2反应的物质不同,能量变化也不同,不能根据合成氨反应的能量变化来类推N2与其他物质反应的能量变化,如N2和O2在放电条件下生成NO就是吸热反应,D错误。
【对点训练2】
1、A。解析:加热才能发生的反应不一定是吸热反应,如铜在氯气中燃烧;放热反应在常温下不一定容易发生,如N2与H2合成NH3;反应是放热还是吸热取决于反应物、生成物所具有的总能量的相对大小;需要加热才能发生的放热反应,如果反应放出的热量达到反应所需要的热量,停止加热反应也能继续进行,如Fe+SFeS。
2、B。解析:依题意,断裂1 mol H—H键和1 mol I—I键吸收的能量为436 kJ+151 kJ=587 kJ,生成2 mol H—I键放出的能量为299 kJ×2=598 kJ,因为598 kJ>587 kJ,所以该反应是放出能量的反应;根据反应式可知该反应是可逆反应,也是氧化还原反应。
3、A。解析:生成物的总能量大于反应物的总能量,说明此反应为吸热反应。Ba(OH)2·8H2O和NH4Cl的反应为吸热反应,A项正确;中和反应、2C+O22CO、CaO+H2O===Ca(OH)2均为放热反应,B、C、D项错误。
4、C。解析:C和CO2反应生成CO是吸热反应,生成物总能量应大于反应物总能量。
5、(1)释放
(2)释放 (b-a)
解析:如果反应物具有的总能量大于生成物具有的总能量,整个反应就放出能量,反之就吸收能量。
(1)由图像可知1 mol N和3 mol H具有的总能量比1 mol NH3(g)的能量高b kJ,所以1 mol N和3 mol H生成1 mol NH3(g)是释放能量的过程。
(2)由图像可知 mol N2(g)和 mol H2(g)总能量比1 mol N 和3 mol H具有的总能量低a kJ,而1 mol NH3(g)具有的总能量比1 mol N和3 mol H具有的总能量低b kJ,b>a,所以由 mol N2(g)和 mol H2(g)生成1 mol NH3(g)的过程释放出(b-a)kJ能量。
【对点训练3】
1、D。解析:工业上制取H2的原料是H2O,来源广,A正确;H2易燃烧且等质量物质中放出的热量较多,产物为H2O,无污染,B、C正确;工业上利用水制取H2需消耗大量能量且效率低,D错。
2、B。解析:煤、石油、天然气是化石能源,不可再生,不属于新能源;新能源有:太阳能、地热能、海洋能、风能、氢能、生物质能等,这些新能源对环境污染小,属于环境友好型能源,即符合条件的是①④⑤⑦⑧,故选B。
3、B。解析:理解图示的转化关系便可顺利解题。关键信息是利用太阳能使CO2、H2O、N2等重新组合,根据图示可知燃料燃烧后转化为燃烧产物并放出热量,燃烧产物又结合太阳能转化为燃料,如此循环可知太阳能最终转化为热能。故选B。
4、C。解析:A项,煤炭、石油不是新能源,也不是可再生能源;B项,天然气不是新能源,也不是可再生能源;D项,地热能是来自地球内部的能源,核能不是可再生能源,也不是来自太阳的能源。
【课后作业】
1、B。解析:醋酸逐渐凝固,说明NH4HCO3与盐酸反应使醋酸的温度降低,因此该反应为吸热反应,A错误;吸热反应中反应物吸收能量,吸收的能量转化为生成物内部的能量储存在生成物中,B正确;由于NH4HCO3和盐酸的反应是吸热反应,故反应物的总能量低于生成物的总能量,C错误;NH4HCO3粉末与盐酸的反应是吸热反应,是各反应物的总能量低于各生成物的总能量,而NH4HCO3仅是两种反应物之一、NH4Cl仅是三种生成物之一,故无法得出NH4HCO3的能量一定低于NH4Cl的能量的结论,D错误。
2、D
3、D。解析:任何反应都有有利和不利的一面,如C+CO2高温,2CO是吸热反应,在钢铁冶炼中可以利用该反应获得更多的还原剂CO,故D项错误。
4、B。解析:锌粒与稀硫酸的反应、甲烷的燃烧反应均是放热反应,不合题意;Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是吸热反应,但元素的化合价无变化,是非氧化还原反应,D项不合题意。
5、D
6、B
7、A。解析:②燃烧反应和铝热反应虽需点燃,但属于放热反应。③NH4Cl和Ba(OH)2·8H2O的反应是吸热反应。⑤C和CO2生成CO的反应属于吸热反应,而分解反应通常是吸热反应。
8、D。解析:根据图像可知反应物的总能量低于生成物的总能量,则反应是吸热反应。A.该反应是吸热反应,错误;B.反应条件与反应是放热反应还是吸热反应无关系,错误;C.反应物的总能量低于生成物的总能量,错误;D.反应吸热,则反应中断开化学键吸收的总能量高于形成化学键放出的总能量,正确。
9、D。解析:白磷和红磷燃烧的生成物相同,但白磷释放的热量较多,说明等质量的白磷具有较高的能量,白磷转化为红磷要放热,反之要吸热。
10、A。解析:火炬燃烧时还有化学能与光能的转化,A错;燃烧都是放热反应,B对;因为丙烷燃烧为放热反应,所以据反应的化学方程式可知,C对;丙烷完全燃烧时产物为CO2与H2O,对环境无污染,D对。
11、D。解析:水的分解是吸热反应,A错误;氢能源由于受贮存和运输等因素的限制,还未普遍使用,但有巨大的开发利用价值,B、C错误;2 mol H2在1 mol O2中完全燃烧生成2 mol H2O,并放出大量的热,D正确。
12、B。解析:放热反应中反应物的总能量大于生成物的总能量,该反应为放热反应,故2 mol SO2和1 mol O2的总能量一定高于2 mol SO3的总能量,该反应需加热且有催化剂存在才能进行。
13、C。解析:从题图可以看出,反应物的总能量高于生成物的总能量,该反应是放热反应,A、D项错误;断键时需要吸收能量,B项错误,C项正确。
14、D。解析:燃烧时化学能可转化为热能、光能等,A项错误;由题图可知,断开2 mol氢氧键吸收930 kJ的能量,B项错误;氢分子变成氢原子要吸收能量,所以2E1>E2,C项错误;该反应生成1 mol水蒸气时放出的能量为930 kJ-436 kJ-249 kJ=245 kJ,D项正确。
16、B。解析:A.1 mol N2(g)与1 mol O2(g)反应吸收的能量为946 kJ+498 kJ-2×632 kJ=180 kJ,A错误;B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,B正确;C.在放电条件下,N2(g)与O2(g)混合能直接生成NO(g),C错误;D.NO不是酸性氧化物,与NaOH溶液不反应,D错误。
17、A。解析:“氢油”便于储存和运输,说明比较稳定,故A错误;氢气燃烧生成水,水分解又生成氢气,故属于可再生能源,故B正确;常温常压下可以将氢气融入到一种化合物“储油”中,故该技术实现了常温常压下储氢技术的新突破,故C正确;液态储氢解决了氢能储存难、运输难的问题,能实现氢能的广泛应用,故有利于发展氢能源电动机,从而带来新能源汽车的升级,故D正确。
18、C
19、(1)①CuSO4+5H2O===CuSO4·5H2O ②放热 ③大于
(2)U形管右侧液面上升,左侧液面下降
解析:(1)滴入水后,CuSO4+5H2O===CuSO4·5H2O,由现象U形管右侧液面下降,左侧液面上升,可知是具支试管内气体受热膨胀,压强增大所致,所以此反应是放热反应,CuSO4和H2O的总能量大于CuSO4·5H2O的总能量。(2)Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O,反应吸热,导致具支试管内气体压强减小,U形管中右侧液面上升,左侧液面下降。
PAGE
1
【学习目标】
1、知道化学键的断裂与形成是化学反应中能量变化的主要原因
2、知道反应物与生成物总能量的相对高低是反应过程中能量变化的决定因素
3、熟悉常见的吸热反应和放热反应
【主干知识梳理】
一、化学反应过程中存在热量变化
1、实验探究
(1)镁和稀盐酸的反应
实验过程 在一支试管中加入2 mL 2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化
实验操作示意图
实验现象 有气泡产生;用手触摸反应后的试管,温热;用温度计测得反应后温度升高
离子反应 Mg+2H+===Mg2++H2↑
实验结论 活泼金属与酸反应是放热反应
(2)Ba(OH)2·8H2O和氯化铵反应
实验过程 将20 g Ba(OH)2·8H2O晶体研细后与NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸杯壁下部,试着用手拿起烧杯。观察现象
实验操作示意图
实验现象 混合物呈糊状;闻到刺激性气味;用手触摸杯壁下部,冰凉;用手拿起烧杯,木片与烧杯粘在一起
化学反应 Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
实验结论 该反应是吸热反应
(3)结论:化学反应中总会伴随着能量变化,通常主要表现为热能的变化,有的放出热量,有的吸收热量
2、吸热反应和放热反应
(1)概念
①放热反应:把释放热量的化学反应称为放热反应
②吸热反应:把吸收热量的化学反应称为吸热反应
(2)常见的放热反应和吸热反应
①常见的放热反应
a.所有的燃烧反应,如:木炭、CH4等在空气或氧气中的燃烧,Na、H2在Cl2中燃烧,镁条在CO2中燃烧
b.所有的酸碱中和反应,如:HCl+NaOH===NaCl+H2O
c.大多数的化合反应,如:CaO+H2O===Ca(OH)2 H2+F2===2HF
d.活泼金属与水、与酸的反应,如:2Na+2H2O===2NaOH+H2↑ Mg+2H+===Mg2++H2↑
e.铝热反应,如:2Al+Fe2O3 2Fe+Al2O3
f.生成沉淀的反应,如:SO42-+Ba2+===BaSO4↓
②常见的吸热反应
a.大多数分解反应,如:NH4ClNH3↑+HCl↑ CaCO3CaO+CO2↑
b.以碳、CO、H2为还原剂的氧化还原反应:如:H2+CuOH2O+Cu
c.Ba(OH)2·8H2O与NH4Cl的反应(固态铵盐与碱的反应)
d.C和CO2发生的化合反应及C和H2O(g)的反应
e.NaHCO3与盐酸的反应
【微点拨】
(1)吸热反应和放热反应的理解
①“四个不一定”
a.需加热才能发生的反应不一定是吸热反应,如:碳和氧气的反应
b.放热反应在常温下不一定容易发生,如:N2与H2合成NH3
c.高温条件下进行的反应不一定是吸热反应,如:铝热反应
d.吸热反应也不一定需要加热,如:Ba(OH)2·8H2O晶体和NH4Cl晶体的反应
②吸热反应和放热反应都是化学变化,如:NaOH固体溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应
③反应前需要加热的化学反应,停止加热后若反应还能继续进行,则该反应为放热反应
④一般情况下,持续加热或持续高温的化学反应,通常为吸热反应
(2)化学反应的能量变化,除转化为热能外,还转化为机械能、光、声、电等多种能量形式
(3)化学反应遵循的两条基本规律:质量守恒定律和能量守恒定律
(4)物质发生化学反应一定伴随着能量变化,但伴随能量变化的物质变化不一定都是化学变化
如:水蒸气变成液态水的过程放热,但该变化为物理变化
(5)能量越低越稳定。同一物质能量由高到低:气体(g)>液体(l)>固体(s);稳定性:气体(g)<液体(l)<固体(s)
(6)任何化学反应在发生物质变化的同时都伴随着能量的变化,通常表现为热量变化,即放出热量或吸收热量
【对点训练1】
1、下列反应是吸热反应的是( )
A.硫的燃烧 B.水的分解 C.食物的氧化变质 D.中和反应
2、下列说法正确的是( )
A.Fe与S在加热条件下才能发生反应,所以该反应属于吸热反应
B.HNO3、H2SO4分别与NaOH溶液反应都放出热量
C.分解反应都是吸热反应,化合反应都是放热反应
D.合成氨的反应是放热反应,所以N2与其他物质的反应也是放热反应
二、化学反应存在能量变化的原因
1、从化学键的变化理解——主要原因
(1)以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明
反应中能量变化
由图可知 1 mol H2分子中的化学键断裂吸收的能量是436 kJ 共吸收679 kJ
1 mol Cl2分子中的化学键断裂吸收的能量是243 kJ
1 mol HCl分子中的化学键形成释放的能量是431 kJ 共放出2×431=862 kJ
结论 H2(g)+Cl2(g)===2HCl(g)的反应放出的热量为183 kJ
(2)化学反应是旧键断裂,新键生成的反应,两者吸收和释放能量的差异表现为反应能量的变化。化学键的断裂与形成是化学反应中能量变化的主要原因
化学反应的过程
规律 新键生成释放的能量大于旧键断裂吸收的能量,则反应放热
新键生成释放的能量小于旧键断裂吸收的能量,则反应吸热
2、从物质储存化学能的角度理解——决定因素
宏观解释 放热反应示意图 吸热反应示意图
化学反应放出热量化学反应吸收热量
(1)放热反应可以看成是反应物所具有的化学能转化为热能释放出来
(2)吸热反应可以看成是热能转化为化学能被生成物所“储存”
(3)各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同
放热反应 吸热反应
反应物总能量大于生成物总能量,反应放热 反应物总能量小于生成物总能量,反应吸热
【微点拨】
①破坏反应物中的化学键吸收的能量越小,说明反应物越不稳定,本身的能量越高
②形成生成物的化学键放出的能量越多,说明生成物越稳定,本身的能量越低
3、放热反应与吸热反应的比较
类型比较 放热反应 吸热反应
定义 释放热量的化学反应 吸收热量的化学反应
形成原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
与化学键的关系 生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
反应过程图示
4、吸热反应和放热反应的判断方法
(1)根据反应物和生成物的总能量的相对大小判断——决定因素
若反应物的总能量大于生成物的总能量,属于放热反应,反之是吸热反应
(2)根据化学键断裂或形成时的能量变化判断——主要原因
若断裂反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量,属于放热反应,反之是吸热反应
(3)根据反应物和生成物的相对稳定性判断
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应
(4)根据反应条件判断
凡是持续加热才能进行的反应一般就是吸热反应
【对点训练2】
1、下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小
④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有③④ B.只有①② C.①②③④ D.②③④
2、已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对
H2(g)+I2(g)2HI(g)的反应类型判断错误的是( )
A.放出能量的反应 B.吸收能量的反应
C.氧化还原反应 D.可逆反应
3、下列反应中能量变化趋势与如图一致的是( )
A.氢氧化钡晶体与氯化铵晶体混合 B.中和反应
C.木炭在氧气中发生不完全燃烧 D.生石灰和水的反应
4、下图中,能表示灼热的炭与二氧化碳反应的能量变化的是( )
5、已知化学反应N2+3H22NH3的能量变化如图所示:
(1)1 mol N和3 mol H生成1 mol NH3(g)是________(填“吸收”或“释放”)能量的过程
(2)由 mol N2(g)和 mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量
三、化学能与热能相互转化的应用
1、化学能与热能的相互转化在生活、生产中的应用
化学物质中的化学能通过化学反应转化成热能,提供了人类生存和发展所需要的能量和动力,如:化石燃料的燃烧、炸药开山、发射火箭等;而热能转化为化学能是人们进行化工生产、研制新物质不可或缺的条件和途径,如:高温冶炼金属、分解化合物等
2、生物体中的能量转化及利用
能源物质在人体中氧化分解生成CO2和H2O,产生的能量一部分以热量的形式散失;另一部分作为可转移能量在人体内利用(如:合成代谢)
3、人类利用能源的三个阶段:柴草时期、化石能源时期和多能源结构时期。可再生能源和清洁能源是两类重要的新能源,主要有太阳能、氢能、核能、生物质能等。
4、现阶段人类获取热能的主要途径是:物质的燃烧,使用最多的常规能源是:化石燃料(煤、石油和天然气)。
5、化石燃料获取能量面临的问题
(1)储量有限,短期内不可再生
(2)影响环境:煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源
6、节能减排的措施
(1)燃料燃烧阶段提高燃料的燃烧效率——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率
(2)能量利用阶段提高能源的利用率——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率
(3)开发使用新能源,目前人们比较关注的新能源有太阳能、风能、地热能、海洋能和氢能等
①特点:资源丰富、可以再生、对环境无污染等
②人们比较关注的新能源:太阳能、风能、地热能、海洋能和氢能等
【对点训练3】
1、冰岛火山爆发再一次向人类敲响了警钟,必须发展“低碳经济”。氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车备受青睐。下列不是氢能优点的是( )
A.原料来源广 B.易燃烧,放出热量多 C.生成物无污染 D.制取H2简单易行
2、新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列能达到新能源标准的是( )
①地热能 ②煤 ②天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A.②⑤⑦⑧ B.①④⑤⑦⑧ C.④⑤⑦⑧ D.②③⑥⑦⑧
3、有专家指出,如果利用太阳能使燃烧产物如CO2、H2O、N2等重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。观察下面图示,判断在此构想的物质循环中,太阳能最终转化为( )
A.化学能 B.热能 C.生物质能 D.电能
4、“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是( )
A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
【课后作业】
1、将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是( )
A.NH4HCO3和盐酸的反应是放热反应 B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量 D.NH4HCO3的能量一定低于NH4Cl的能量
2、下列说法不正确的是( )
A.当今社会人们所需的能量绝大部分是由化学反应产生的
B.目前,全球仍处于化石能源时代
C.人体生命活动所需要的能量,是由氧化还原反应提供的
D.凡是放出热量的化学反应均可用来造福人类
3、下列关于能源和作为能源使用的物质的叙述中错误的是( )
A.化石能源物质内部蕴含着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在一定条件下转化为热能、电能,为人类所利用
D.吸热反应没有利用价值
4、下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
5、下列变化中属于吸热反应的是( )
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化
④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应
A.①④ B.②③ C.①④⑤ D.②④
6、化学反应的发生必然伴随能量的转化,其最根本的原因是( )
A.化学反应中一定有新物质生成
B.化学反应中旧化学键的断裂需要吸收能量,新化学键的形成需要放出能量
C.化学反应通常需要加热等条件才能发生
D.能量变化是化学反应的基本特征之一
7、下列有关化学反应能量变化的叙述中正确的是( )
①如果反应物的总能量低于生成物的总能量,该反应一定是吸热反应
②只要是在点燃条件下进行的反应就一定是吸热反应
③只要是在常温常压下进行的反应就一定是放热反应
④燃烧反应一定是放热反应
⑤化合反应都是放热反应,分解反应都是吸热反应
A.①④ B.①②③ C.③⑤ D.④⑤
8、已知反应A+B===C+D的能量变化如图所示,下列说法正确的是( )
A.该反应是放热反应
B.只有在加热条件下才能进行
C.反应物的总能量高于生成物的总能量
D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量
9、在25 ℃,101 kPa下,1 mol的白磷(化学式为P4)完全燃烧放出的热量比4 mol的红磷(化学式为P)完全燃烧放出的热量多。化学方程式分别为P4(s)+5O2(g)===P4O10(s);4P(s)+5O2(g)===P4O10(s)。由此判断,下列说法正确的是( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
10、北京奥运会开幕式在李宁点燃鸟巢主火炬时达到高潮。奥运火炬采用的是环保型燃料——丙烷,其燃烧时发生反应的化学方程式为C3H8+5O23CO2+4H2O。下列说法中不正确的是( )
A.火炬燃烧时化学能只转化为热能
B.所有的燃烧反应都会释放热量
C.1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
11、为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
12、已知2SO2+O22SO3为放热反应,下列关于该反应的说法正确的是( )
A.O2的能量一定高于SO2的能量 B.2 mol SO2和1 mol O2的总能量一定高于2 mol SO3的总能量
C.SO2的能量一定高于SO3的能量 D.因该反应放热,故不加热反应就可发生
13、化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应 B.断裂1 mol A—A键和1 mol B—B键放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量 D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
14、氢气燃烧生成水蒸气的能量变化如图所示。下列说法正确的是( )
A.燃烧时化学能全部转化为热能
B.断开1 mol氢氧键吸收930 kJ的能量
C.相同条件下,1 mol氢原子的能量为E1,1 mol氢分子的能量为E2,则2E1<E2
D.该反应生成1 mol水蒸气时放出能量245 kJ
15、肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N键为942、O===O键为500、N—N键为154,则断裂1 mol N—H键所需的能量(kJ)是( )
A.194 B.391 C.516 D.658
15、B。解析:利用图示可知1 mol肼和氧气变成原子时断键需要的能量为2 752 kJ-534 kJ=2 218 kJ。肼和氧气断键变为原子时要断裂1个N—N键、4个N—H键和1个O===O键,所以1×154 kJ+4×E(N—H)+1×500 kJ=2 218 kJ,解得断裂1 mol N—H键所需的能量为391 kJ。
16、化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图表示N2(g)与O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
A.1 mol N2(g)与1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)与O2(g)混合能直接生成NO(g)
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
17、液态储氢技术就是在常温常压下将氢气融入到一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是( )
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
18、下列有关新能源的说法不正确的是( )
A.绿色植物通过光合作用,将光能转化为化学能
B.风能、太阳能是清洁能源
C.氢能还未进入实用阶段的主要原因是其燃烧所放热量低于相同质量的矿物燃料
D.共享单车利用太阳能发电完成卫星定位,有利于节能环保
19、如图所示,在小试管里加入2 g新制备的无水硫酸铜,把小试管套在具支试管内。在U形管内加入少量红墨水。打开T形管螺旋夹,使U形管内两边的液面处于同一水平面。再夹紧螺旋夹,把水滴入小试管内,白色的无水硫酸铜完全变成蓝色的五水硫酸铜晶体,可观察到U形管右侧的液面立即下降,左侧的液面上升。
(1)①写出上述反应的化学方程式:_________________________________________________________
②该反应是________(填“吸热”或“放热”)反应
③反应中的硫酸铜和水具有的总能量________(填“大于”或“小于”)硫酸铜晶体的总能量
(2)如果U形管内两边的液面处于同一水平面后,在小试管内先加入Ba(OH)2·8H2O晶体,再加入NH4Cl固体,用玻璃棒不断搅拌,则可观察到U形管中的现象为__________________________________
【化学反应与热能】答案
【对点训练1】
1、B
2、B。解析:Fe与S虽然需加热才能发生反应,但反应开始后,停止加热,反应能继续进行,加热只是为了引发反应,所以该反应是放热反应,A错误;中和反应都是放热反应,B正确;分解反应不一定是吸热反应,如H2O2的分解反应就是放热反应,化合反应也不一定是放热反应,如CO2与C的反应就是吸热反应,C错误;与N2反应的物质不同,能量变化也不同,不能根据合成氨反应的能量变化来类推N2与其他物质反应的能量变化,如N2和O2在放电条件下生成NO就是吸热反应,D错误。
【对点训练2】
1、A。解析:加热才能发生的反应不一定是吸热反应,如铜在氯气中燃烧;放热反应在常温下不一定容易发生,如N2与H2合成NH3;反应是放热还是吸热取决于反应物、生成物所具有的总能量的相对大小;需要加热才能发生的放热反应,如果反应放出的热量达到反应所需要的热量,停止加热反应也能继续进行,如Fe+SFeS。
2、B。解析:依题意,断裂1 mol H—H键和1 mol I—I键吸收的能量为436 kJ+151 kJ=587 kJ,生成2 mol H—I键放出的能量为299 kJ×2=598 kJ,因为598 kJ>587 kJ,所以该反应是放出能量的反应;根据反应式可知该反应是可逆反应,也是氧化还原反应。
3、A。解析:生成物的总能量大于反应物的总能量,说明此反应为吸热反应。Ba(OH)2·8H2O和NH4Cl的反应为吸热反应,A项正确;中和反应、2C+O22CO、CaO+H2O===Ca(OH)2均为放热反应,B、C、D项错误。
4、C。解析:C和CO2反应生成CO是吸热反应,生成物总能量应大于反应物总能量。
5、(1)释放
(2)释放 (b-a)
解析:如果反应物具有的总能量大于生成物具有的总能量,整个反应就放出能量,反之就吸收能量。
(1)由图像可知1 mol N和3 mol H具有的总能量比1 mol NH3(g)的能量高b kJ,所以1 mol N和3 mol H生成1 mol NH3(g)是释放能量的过程。
(2)由图像可知 mol N2(g)和 mol H2(g)总能量比1 mol N 和3 mol H具有的总能量低a kJ,而1 mol NH3(g)具有的总能量比1 mol N和3 mol H具有的总能量低b kJ,b>a,所以由 mol N2(g)和 mol H2(g)生成1 mol NH3(g)的过程释放出(b-a)kJ能量。
【对点训练3】
1、D。解析:工业上制取H2的原料是H2O,来源广,A正确;H2易燃烧且等质量物质中放出的热量较多,产物为H2O,无污染,B、C正确;工业上利用水制取H2需消耗大量能量且效率低,D错。
2、B。解析:煤、石油、天然气是化石能源,不可再生,不属于新能源;新能源有:太阳能、地热能、海洋能、风能、氢能、生物质能等,这些新能源对环境污染小,属于环境友好型能源,即符合条件的是①④⑤⑦⑧,故选B。
3、B。解析:理解图示的转化关系便可顺利解题。关键信息是利用太阳能使CO2、H2O、N2等重新组合,根据图示可知燃料燃烧后转化为燃烧产物并放出热量,燃烧产物又结合太阳能转化为燃料,如此循环可知太阳能最终转化为热能。故选B。
4、C。解析:A项,煤炭、石油不是新能源,也不是可再生能源;B项,天然气不是新能源,也不是可再生能源;D项,地热能是来自地球内部的能源,核能不是可再生能源,也不是来自太阳的能源。
【课后作业】
1、B。解析:醋酸逐渐凝固,说明NH4HCO3与盐酸反应使醋酸的温度降低,因此该反应为吸热反应,A错误;吸热反应中反应物吸收能量,吸收的能量转化为生成物内部的能量储存在生成物中,B正确;由于NH4HCO3和盐酸的反应是吸热反应,故反应物的总能量低于生成物的总能量,C错误;NH4HCO3粉末与盐酸的反应是吸热反应,是各反应物的总能量低于各生成物的总能量,而NH4HCO3仅是两种反应物之一、NH4Cl仅是三种生成物之一,故无法得出NH4HCO3的能量一定低于NH4Cl的能量的结论,D错误。
2、D
3、D。解析:任何反应都有有利和不利的一面,如C+CO2高温,2CO是吸热反应,在钢铁冶炼中可以利用该反应获得更多的还原剂CO,故D项错误。
4、B。解析:锌粒与稀硫酸的反应、甲烷的燃烧反应均是放热反应,不合题意;Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是吸热反应,但元素的化合价无变化,是非氧化还原反应,D项不合题意。
5、D
6、B
7、A。解析:②燃烧反应和铝热反应虽需点燃,但属于放热反应。③NH4Cl和Ba(OH)2·8H2O的反应是吸热反应。⑤C和CO2生成CO的反应属于吸热反应,而分解反应通常是吸热反应。
8、D。解析:根据图像可知反应物的总能量低于生成物的总能量,则反应是吸热反应。A.该反应是吸热反应,错误;B.反应条件与反应是放热反应还是吸热反应无关系,错误;C.反应物的总能量低于生成物的总能量,错误;D.反应吸热,则反应中断开化学键吸收的总能量高于形成化学键放出的总能量,正确。
9、D。解析:白磷和红磷燃烧的生成物相同,但白磷释放的热量较多,说明等质量的白磷具有较高的能量,白磷转化为红磷要放热,反之要吸热。
10、A。解析:火炬燃烧时还有化学能与光能的转化,A错;燃烧都是放热反应,B对;因为丙烷燃烧为放热反应,所以据反应的化学方程式可知,C对;丙烷完全燃烧时产物为CO2与H2O,对环境无污染,D对。
11、D。解析:水的分解是吸热反应,A错误;氢能源由于受贮存和运输等因素的限制,还未普遍使用,但有巨大的开发利用价值,B、C错误;2 mol H2在1 mol O2中完全燃烧生成2 mol H2O,并放出大量的热,D正确。
12、B。解析:放热反应中反应物的总能量大于生成物的总能量,该反应为放热反应,故2 mol SO2和1 mol O2的总能量一定高于2 mol SO3的总能量,该反应需加热且有催化剂存在才能进行。
13、C。解析:从题图可以看出,反应物的总能量高于生成物的总能量,该反应是放热反应,A、D项错误;断键时需要吸收能量,B项错误,C项正确。
14、D。解析:燃烧时化学能可转化为热能、光能等,A项错误;由题图可知,断开2 mol氢氧键吸收930 kJ的能量,B项错误;氢分子变成氢原子要吸收能量,所以2E1>E2,C项错误;该反应生成1 mol水蒸气时放出的能量为930 kJ-436 kJ-249 kJ=245 kJ,D项正确。
16、B。解析:A.1 mol N2(g)与1 mol O2(g)反应吸收的能量为946 kJ+498 kJ-2×632 kJ=180 kJ,A错误;B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,B正确;C.在放电条件下,N2(g)与O2(g)混合能直接生成NO(g),C错误;D.NO不是酸性氧化物,与NaOH溶液不反应,D错误。
17、A。解析:“氢油”便于储存和运输,说明比较稳定,故A错误;氢气燃烧生成水,水分解又生成氢气,故属于可再生能源,故B正确;常温常压下可以将氢气融入到一种化合物“储油”中,故该技术实现了常温常压下储氢技术的新突破,故C正确;液态储氢解决了氢能储存难、运输难的问题,能实现氢能的广泛应用,故有利于发展氢能源电动机,从而带来新能源汽车的升级,故D正确。
18、C
19、(1)①CuSO4+5H2O===CuSO4·5H2O ②放热 ③大于
(2)U形管右侧液面上升,左侧液面下降
解析:(1)滴入水后,CuSO4+5H2O===CuSO4·5H2O,由现象U形管右侧液面下降,左侧液面上升,可知是具支试管内气体受热膨胀,压强增大所致,所以此反应是放热反应,CuSO4和H2O的总能量大于CuSO4·5H2O的总能量。(2)Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O,反应吸热,导致具支试管内气体压强减小,U形管中右侧液面上升,左侧液面下降。
PAGE
1
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
