2.3-1 键的极性与分子的极性课件(共19张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3-1 键的极性与分子的极性课件(共19张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-02 13:35:15 | ||
图片预览





文档简介
(共19张PPT)
【温故知新】
2.3 分子的性质
2.3-1 共价键的极性与分子的极性
学习目标
1、多角度理解认识极性共价键和非极性共价键
2、认识并学会判断共价分子的极性和非极性
1
键 的 极 性
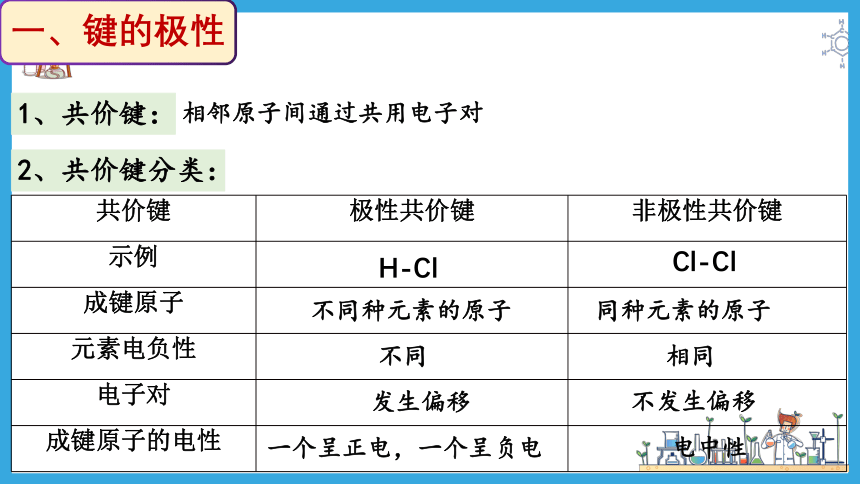
一、键的极性
1、共价键:
相邻原子间通过共用电子对
2、共价键分类:
共价键 极性共价键 非极性共价键
示例
成键原子
元素电负性
电子对
成键原子的电性
H-Cl
Cl-Cl
不同种元素的原子
同种元素的原子
不同
相同
发生偏移
不发生偏移
一个呈正电,一个呈负电
电中性
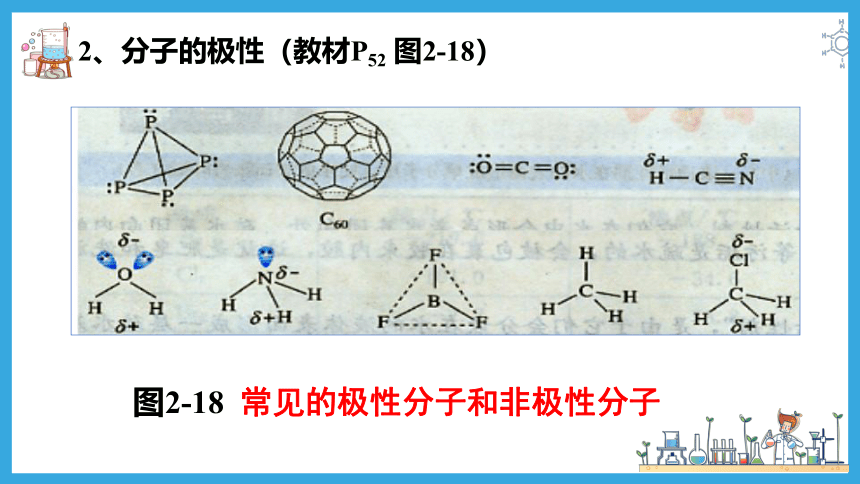
2、分子的极性(教材P52 图2-18)
图2-18 常见的极性分子和非极性分子
常见分子 键极性 键角 分子构型 分子类型
H2、Cl2
HCl
CO2
H2O
NH3
BF3
CH4
常见分子的构型及分子的极性
双原子分子
无 无 直线形 非极性
有 无 直线形 极性
有 105 V形 极性
有 180 直线形 非极性
三原子分子
四原子分子
有 107.3 三角锥形 极性
有 120 平面三角形 非极性
有 109.5 正四面体形 非极性
五原子分子
2
分子的极性
1、分子的极性
(1)极性分子
分子中的正电中心与负电中心不重合,使分子的某一个部分呈正电性(δ+ ),另一部分呈正电性(δ-),这样的分子是极性分子。
(2)非极性分子
分子中的正电中心与负电中心重合,使分子的某一个部分呈正电性(δ+ ),另一部分呈正电性(δ-),这样的分子是非极性分子。
2、多原子分子的极性
(1)双原子分子的极性
单质分子为非极性分子;(特例:O3)
双原子的化合物分子为极性分子
(2)多原子分子的极性
①三原子分子:对称的直线形
②四原子分子:平面正三角形
③五原子分子:空间正四面体
3
当堂训练
【解题模型】判断分子极性的一般思路
键有无极性
分子立体构型
非极性分子
极性分子
共价键形成的分子
共同决定
均匀对称
不均匀不对称
1. 下列叙述中正确的是( )
A.极性分子一定含有极性键。
B.含有极性键的分子一定是极性分子。
C.含有非极性键的分子一定是非极性分子。
D.非极性分子中一定含有非极性键。
极性分子HCl、H2O等,非极性分子CO2、CCl4等,均含极性键
极性分子CH3CH2OH等,含极性键和非极性键
非极性分子CO2、CCl4等,均含极性键
A
2. 由极性键结合的一组分子都为非极性分子的是( )
A.O2、H2、N2、P4、C60
B.HCl、HBr、CO、NO
C.H2O、H2S、NH3、PCl3
D.CO2、CS2、CH4、CCl4
D
【温故知新】
2.3 分子的性质
2.3-1 共价键的极性与分子的极性
学习目标
1、多角度理解认识极性共价键和非极性共价键
2、认识并学会判断共价分子的极性和非极性
1
键 的 极 性
一、键的极性
1、共价键:
相邻原子间通过共用电子对
2、共价键分类:
共价键 极性共价键 非极性共价键
示例
成键原子
元素电负性
电子对
成键原子的电性
H-Cl
Cl-Cl
不同种元素的原子
同种元素的原子
不同
相同
发生偏移
不发生偏移
一个呈正电,一个呈负电
电中性
2、分子的极性(教材P52 图2-18)
图2-18 常见的极性分子和非极性分子
常见分子 键极性 键角 分子构型 分子类型
H2、Cl2
HCl
CO2
H2O
NH3
BF3
CH4
常见分子的构型及分子的极性
双原子分子
无 无 直线形 非极性
有 无 直线形 极性
有 105 V形 极性
有 180 直线形 非极性
三原子分子
四原子分子
有 107.3 三角锥形 极性
有 120 平面三角形 非极性
有 109.5 正四面体形 非极性
五原子分子
2
分子的极性
1、分子的极性
(1)极性分子
分子中的正电中心与负电中心不重合,使分子的某一个部分呈正电性(δ+ ),另一部分呈正电性(δ-),这样的分子是极性分子。
(2)非极性分子
分子中的正电中心与负电中心重合,使分子的某一个部分呈正电性(δ+ ),另一部分呈正电性(δ-),这样的分子是非极性分子。
2、多原子分子的极性
(1)双原子分子的极性
单质分子为非极性分子;(特例:O3)
双原子的化合物分子为极性分子
(2)多原子分子的极性
①三原子分子:对称的直线形
②四原子分子:平面正三角形
③五原子分子:空间正四面体
3
当堂训练
【解题模型】判断分子极性的一般思路
键有无极性
分子立体构型
非极性分子
极性分子
共价键形成的分子
共同决定
均匀对称
不均匀不对称
1. 下列叙述中正确的是( )
A.极性分子一定含有极性键。
B.含有极性键的分子一定是极性分子。
C.含有非极性键的分子一定是非极性分子。
D.非极性分子中一定含有非极性键。
极性分子HCl、H2O等,非极性分子CO2、CCl4等,均含极性键
极性分子CH3CH2OH等,含极性键和非极性键
非极性分子CO2、CCl4等,均含极性键
A
2. 由极性键结合的一组分子都为非极性分子的是( )
A.O2、H2、N2、P4、C60
B.HCl、HBr、CO、NO
C.H2O、H2S、NH3、PCl3
D.CO2、CS2、CH4、CCl4
D
