第七章《有机化合物》测试题(含答案)2022-2023学年高一下学期人教版(2019)化学必修第二册
文档属性
| 名称 | 第七章《有机化合物》测试题(含答案)2022-2023学年高一下学期人教版(2019)化学必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 405.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-02 13:38:17 | ||
图片预览




文档简介
第七章《有机化合物》测试题
一、单选题(共12题)
1.某课外活动小组的同学通过进行乙醇的催化氧化实验来制取乙醛,其装置如图所示(部分夹持装置已略去)。下列有关说法错误的是
已知:乙醛的沸点为20.8℃,能与水互溶。
A.实验开始时,需要检查装置气密性
B.实验时,试管甲处需要用温水浴加热
C.实验中,可观察到铜丝出现红色和黑色交替的现象
D.实验结束后,装有铜丝的玻璃管的总质量减小
2.下列说法正确的是
A.葡萄糖能水解成乙醇和二氧化碳
B.氨基乙酸、甲醛、乙二醇均可发生聚合反应
C.苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强
D.实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯
3.某塑化剂的结构简式如图所示,下列说法正确的是
A.1mol该塑化剂最多能与5molH2发生加成反应
B.该塑化剂能与Br2发生加成反应使溴水褪色
C.该塑化剂与Cl2在光照条件下能发生取代反应
D.该塑化剂分子式为C16H22O4,是乙酸乙酯的一种同系物
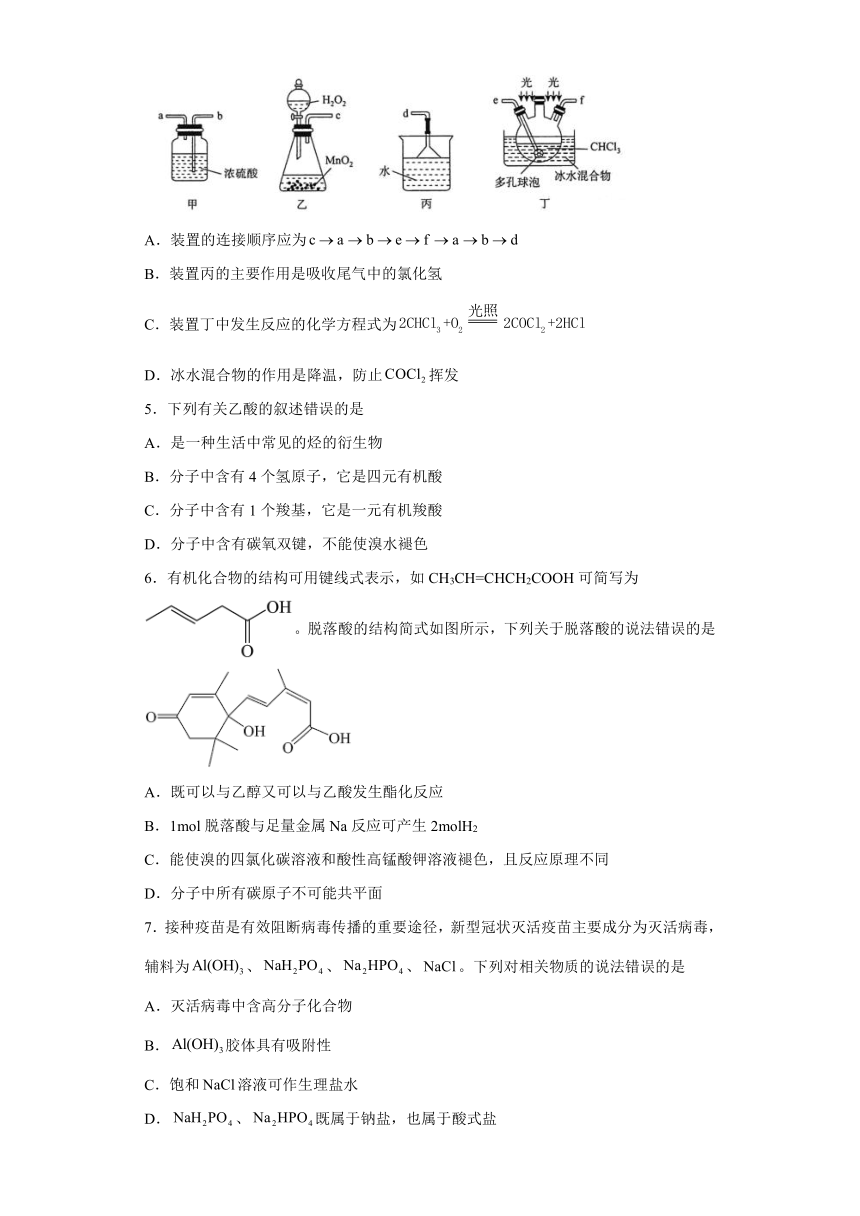
4.碳酰氯(COCl2)俗名光气,熔点为-118℃,沸点为8.2℃,遇水迅速水解,生成氯化氢。光气可由氯仿(CHCl3)和氧气在光照条件下合成。下列说法错误的是
A.装置的连接顺序应为
B.装置丙的主要作用是吸收尾气中的氯化氢
C.装置丁中发生反应的化学方程式为
D.冰水混合物的作用是降温,防止挥发
5.下列有关乙酸的叙述错误的是
A.是一种生活中常见的烃的衍生物
B.分子中含有4个氢原子,它是四元有机酸
C.分子中含有1个羧基,它是一元有机羧酸
D.分子中含有碳氧双键,不能使溴水褪色
6.有机化合物的结构可用键线式表示,如CH3CH=CHCH2COOH可简写为。脱落酸的结构简式如图所示,下列关于脱落酸的说法错误的是
A.既可以与乙醇又可以与乙酸发生酯化反应
B.1mol脱落酸与足量金属Na反应可产生2molH2
C.能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,且反应原理不同
D.分子中所有碳原子不可能共平面
7.接种疫苗是有效阻断病毒传播的重要途径,新型冠状灭活疫苗主要成分为灭活病毒,辅料为、、、。下列对相关物质的说法错误的是
A.灭活病毒中含高分子化合物
B.胶体具有吸附性
C.饱和溶液可作生理盐水
D.、既属于钠盐,也属于酸式盐
8.下列说法正确的是
A.苯和甲烷均不能发生氧化反应
B.葡萄糖在酒化酶的作用下水解产生乙醇
C.甲烷和Cl2的反应与乙烯和Br2的反应,属于同一类型的反应
D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团不相同
9.下列关于氨基酸、肽键与蛋白质的关系叙述中错误的是
A.氨基酸之间脱水可以形成肽键
B.蛋白质就是相对分子质量很大的多肽
C.肽键有二肽、三肽、四肽等多肽,三肽中含有三个肽键
D.多肽与蛋白质并没有一个严格的界限
10.下列各组物质中,互为同素异形体的一组是
A.麦芽糖和蔗糖 B.乙烷和丙烷 C.12C和14C D.氧气和臭氧
11.下列分子所有原子不可能处于同一平面的是 ( )
A.苯 B.乙烯 C.溴苯 D.甲苯
12.下列分子式表示的物质具有同分异构体的是
A.C2H4 B.C3H8 C.CH2Cl2 D.C4H10
二、非选择题(共10题)
13.下列过程中不一定释放能量的是 ______ 请填编号
A 形成化学键,燃料燃烧,化合反应,葡萄糖在体内的氧化分解,酸碱中和,炸药爆炸.
已知A和B是同种元素的两种单质,A转化为B时需放出能量,则A和B相比较而言,较稳定的是 ______ 请填A或.
在C、C、、几种核素中,互称为同位素的是 ______
下列五种有机物中: 淀粉,
水溶液显酸性的是 ______ 填编号.
14.下列物质中,属于同种原子的是___,属于同素异形体的是___,属于同位素的是__(填编号)。
①H和T;②C-12和C60;③H2和H;④14C和14N;⑤2H和D;⑥S和S2-;⑦H2O和D2O;⑧16O2和18O3
15.回答下列问题:
(1)脂肪、淀粉、蛋白质是三种重要的营养成分,其中____________不属于高分子化合物,但它们都能发生__________反应。
(2)食物的酸碱性和溶液的酸碱性___________(填“相同”或者“不同”);含有碳、氮、硫、磷等非金属元素的蛋白质,在人体内经过消化、吸收后,最终代谢成__________物质(填“酸性”或者“碱性”),因此,富含蛋白质的食物属于____________食物(填“酸性”或者“碱性”)。
(3)药品标签上都贴有OTC或R标记。平时我们到药店能自己买到的药如阿司匹林应贴有_________标记(填“OTC”或者“R”)。
(4)使用刀具时不小心割破了手指,在家庭小药箱里有风油精、速效感冒胶囊、板蓝根冲剂、胃舒平、碘酒等,可用于处理伤口的是______________。
16.计算:
(1)已知有机物A的相对分子质量为90。将9.0 g A在足量纯中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g,则有机物A的分子式为_______。
(2)将60 g由甲烷和乙烯组成的混合气体通入盛有足量溴水的容器,充分反应后容器的总质量增加28 g,则原混合气中甲烷和乙烯的物质的量之比为_______。
17.15克有机物A完全燃烧只生成22克CO2和9克H2O。试求:
(1)该有机物的最简式___。
(2)符合该最简式的A物质有多种,则它们之间的关系___(填序号)
A.一定互为同系物
B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同
D.等物质的量的它们完全燃烧耗氧量相同
(3)若A的相对质量为90,且两分子A能反应形成六元环状酯,则A的结构简式为___。
18.金属除了可以形成氧化物,氢化物之外,还能以碳化物、氮化物等形式存在,请根据题意完成下列计算:
(1)某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为_____________。
(2)已知2Mg3N2+3CO2 =3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加_________g。
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如下:
实验组号 ① ② ③ ④
碳化物(g) 6.2 9.3 15.5 21.7
水(mL) 18 18 18 18
气体(L,标准状况) 3.36 5.04 8.4左右 8.4左右
(3)求该混合物中Be2C与CaC2的物质的量之比__________。
(4)与18mL水恰好完全反应消耗该金属碳化物样品的质量是________克?(保留一位小数)
19.将浓度均为0.01mol/L的、、KI、溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应为。反应分两步进行,反应A为,反应B为……
(1)反应B的离子方程式是___________。对于总反应,I-的作用相当于___________。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的溶液中加入KI溶液和试剂X,溶液变为蓝色。
b.再向得到的蓝色溶液中加入溶液,溶液的蓝色褪去。
试剂X是___________。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ.(溶液浓度均为0.01mol/L)
用量/mL 实验序号 溶液 溶液 溶液 KI溶液(含淀粉)
实验Ⅱ 5 4 8 3 0
实验Ⅲ 5 2 x y z
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30min,实验Ⅲ是40min。
①实验Ⅲ中,x、y、z所对应的数值分别是___________。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是___________。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。(溶液浓度均为0.01mol/L)
用量/mL 实验序号 溶液 溶液 溶液 KI溶液(含淀粉)
实验Ⅳ 4 4 9 3 0
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:___________。
20.实验室制取乙烯:+CH2=CH2↑+H2O常因温度过高而使乙醇和浓H2SO4反应生成少量SO2。有人设计如图实验以确认上述混合气体中有乙烯和SO2。
(1)各装置盛放的试剂是:Ⅰ_______,Ⅱ_______,Ⅲ_______,Ⅳ_______(将有关试剂的序号填在横线上)。
A.品红溶液 B.NaOH溶液 C.浓H2SO4溶液 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是_______。
(3)使用装置Ⅱ的目的是_______,使用装置Ⅲ的目的是_______。
(4)确认含乙烯的现象是_______。
21.某化学兴趣小组用下图装置进行制取乙酸乙酯的实验。
请回答下列问题:
(1)反应物中含有的官能团有____(填写名称)。
(2)实验室加入反应物和浓硫酸的先后顺序是____。
(3)浓硫酸在该反应中的作用是________。
(4)右边试管中的溶液是____,其作用是________。
(5)用同位素180示踪法确定反应原理(18O在CH3CH2OH中),写出能表示18O位置的化学方程式_______ ,反应类型是____。
22.短周期元素A、B、C、D、E在周期表中相对位置如图所示。已知:D原子的原子序数等于其最外层电子数的3倍。
请回答下列问题:
(1)B在周期表中位于第___________周期___________族。
(2)E2B分子的电子式为___________,该分子所含化学键类型是___________。
(3)在B、D、E的气态氢化物中,热稳定性最弱的是___________(填化学式)。
(4)工业上,制备C单质的化学方程式为___________。
(5)在A的氢化物中,能与溴水、酸性KMnO4溶液发生化学反应的有___________(填一种物质的结构简式)。
(6)D的单质在氯气中燃烧生成两种产物X和Y,其中X分子中每个原子最外层都达到8电子结构。Y与足量的NaOH溶液反应生成两种盐和水,写出该反应的化学方程式:___________。
参考答案:
1.D
A.该实验中涉及气态反应为,开始时,需要检查装置气密性,A正确;
B.甲中乙醇为液态,为了能够进入硬质玻璃管反应,需要用温水浴加热使乙醇挥发,产生乙醇正确,B正确;
C.铜为该反应的催化剂,先于氧气反应生成黑色的氧化铜,氧化铜再氧化乙醇生成乙醛,而氧化铜则被还原为红色的铜,所以可观察到铜丝出现红色和黑色交替的现象,C正确;
D.铜丝为该反应的催化剂,所以实验结束后,装有铜丝的玻璃管的总质量不变,且有可能生成氧化铜而使质量增加,D错误;
综上所述答案为D。
2.B
A. 葡萄糖是单糖,不能水解,在一定条件下,葡萄糖能转化为乙醇和二氧化碳,故A错误;
B. 氨基乙酸中含有氨基和羧基,甲醛中含有醛基,乙二醇中含有羟基,均可发生聚合反应,故B正确;
C. 苯酚碳酸钠苯酚钠碳酸氢钠,说明苯酚的酸性比碳酸弱,但比碳酸氢根离子的酸性强,故C错误;
D. 溴乙烷在浓硫酸存在并加热条件下不能发生消去反应,应利用溴乙烷在醇溶液中加热制得乙烯,故D错误;
故选B。
3.C
A. 在该分子中,苯基能与H2发生加成反应,但酯基不能与H2反应,所以1mol该塑化剂最多能与3molH2发生加成反应,A错误;
B. 苯不能与溴水发生取代反应或加成反应,所以该塑化剂不能与Br2发生加成反应使溴水褪色,B错误;
C. 苯环侧链上的烃基能与氯气在光照条件下发生取代反应,所以该塑化剂与Cl2在光照条件下能发生取代反应,C正确;
D. 该塑化剂分子式为C16H22O4,正确,但它不是乙酸乙酯的一种同系物,D错误。
故答案为C。
4.A
A.洗气瓶按气流方向应该是b口进气,a口出气,A错误;
B.制备光气时有HCl气体产生,因此装置丙的主要作用是吸收尾气中的氯化氢,B正确;
C.装置丁中发生反应的化学方程式为,C正确;
D.冰水混合物的作用是降温,防止挥发,D正确;
故选A。
5.B
A.烃是只含C、H元素的有机化合物,乙酸除了含C、H元素还有O元素,属于烃的衍生物,故A正确;
B.只有羧基上的氢原子可以电离,是一元酸,故B错误;
C.分子中含有1个羧基,只有羧基上的氢原子可以电离,属于一元酸,故C正确;
D.分子中含有碳氧双键,但不能与溴水加成,所以不能使溴水褪色,故D正确;
故答案为B。
6.B
A.由脱落酸的结构简式可以看出,脱落酸中有羧基,可以跟乙醇发生酯化反应,脱落酸中也有羟基,可以与乙酸发生酯化反应,A正确;
B.1mol脱落酸有1mol羟基和1mol羧基,与Na反应能生成1molH2,B错误;
C.碳碳双键能使溴的四氯化碳溶液,属于加成反应,碳碳双键和羟基能使酸性高锰酸钾溶液褪色,属于氧化反应,两者反应原理不同,C正确;
D.图中箭头所指的六元环的3个C为烷烃的C,烷烃C与相连的C或H形成的是四面体形,故所有碳原子不可能共平面,D正确;
故选B。
7.C
A.灭活病毒中含蛋白质等高分子化合物,故A正确;
B.胶体有较大的表面积,所以胶体具有吸附性,故B正确;
C.医疗上常用0.9% NaCl溶液作生理盐水,故C错误;
D.、是磷酸中的氢部分被氢氧化钠中和的产物,既属于钠盐,也属于酸式盐,故D正确;
选C。
8.D
A.苯和甲烷燃烧生成二氧化碳和水,为氧化反应,故A错误;
B.葡萄糖是单糖不水解,葡萄糖在酒化酶作用下转化为乙醇和二氧化碳,属于氧化反应,故B错误;
C.甲烷与氯气发生取代反应,乙烯与溴发生加成反应,反应类型不同,故C错误;
D.乙醇、乙酸分别含有羟基、羧基,官能团不同,故D正确。
故选:D。
9.C
肽键是相邻氨基酸分子的氨基与羧基脱水而形成的,而肽的数值与氨基酸分子数目是对应的,即两个氨基酸分子脱水形成二肽,三个氨基酸分子脱水形成三肽,由此可见,肽键数目比肽的数目(即氨基酸分子的数目)少1。
A.相邻氨基酸分子的氨基与羧基脱水而形成肽键,A正确;
B.蛋白质就是无数个氨基酸分子通过形成肽键而连接起来的多肽,故B正确;
C.由上分析知肽键数目比肽的数目(即氨基酸分子的数目)少1,即三肽中只有两个肽键,C错误;
D.蛋白质就是无数个氨基酸分子通过形成肽键而连接起来的多肽,其概念上没有严格的界限,D正确;
故选C。
10.D
由同种元素组成的性质不同的单质互为同素异形体。
A.麦芽糖和蔗糖分子式均为C12H22O11,结构不同,二者互为同分异构体,A不符合题意;
B.乙烷和丙烷同属烷烃,结构相似,分子组成相差一个“CH2”,二者互为同系物,B不符合题意;
C.12C和14C属于质子数相同,中子数不同的碳的两种原子,二者互为同位素,C不符合题意;
D.氧气和臭氧均是由C元素组成的性质不同的两种单质,二者互为同素异形体,D符合题意。
答案选D。
11.D
在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面判断。
A.苯是平面结构,所有原子处于同一平面,故A不符合;
B.乙烯是平面结构,所有原子处于同一平面,故B不符合;
C.苯所有原子都在同一个平面上,溴苯可以看作是一个溴原子取代苯环上的一个氢原子,在同一个平面,故C不符合;
D.甲苯含有一个甲基,甲基具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故D符合;
故答案选D。
12.D
A.C2H4为乙烯,不存在同分异构体,故A不符合题意;
B.C3H8为丙烷,不存在同分异构体,故B不符合题意;
C.CH2Cl2是甲烷的二氯取代产物,甲烷正四面体结构,CH2Cl2不存在同分异构体,故C不符合题意;
D.C4H10有、两种结构,存在同分异构现象,故D符合题意;
故答案为:D。
13. C B C、 D
有些化合反应是吸热反应,如碳和二氧化碳反应制一氧化碳,其它反应都是放热反应;
物质含有的能量越高,物质的稳定性越差,根据A与B的转化过程中能量变化比较二者的稳定性;
具有相同的质子数,不同的中子数的原子之间互称为同位素;
有机物中显示酸性,分子中含有酚羟基或者羧基,据此进行判断。
形成化学键、燃料的燃烧、葡萄糖在体内的氧化分解、酸碱中和反应和炸药的爆炸过程都属于放热反应,而化合反应不一定为放热反应,如二氧化碳与C的反应属于吸热反应,所以不一定释放能量的为C;
故答案为:C;
和B是同种元素的两种单质,A转化为B时需放出能量,说明A的能量高于B,所以稳定性B的强于A;
故答案为:B;
同种元素的不同原子之间互称为同位素,满足条件的为:C、;
故答案为:C、;
种物质 淀粉中,甲烷、乙烯、乙醇和淀粉为中性溶液,只有乙酸为酸性溶液;
故答案为:D。
14. ⑤ ⑧ ①
质子数和中子数都相同的属于同种原子,所以和D属于同种原子;
同种元素的不同单质属于同素异形体,所以16O2和18O3互为同素异形体;
元素是具有相同质子数的一类原子的总称,则H和T互为同位素;
综上所述,答案分别为⑤;⑧;①。
15.(1) 脂肪 水解
(2) 不同 酸性 酸性
(3)OTC
(4)碘酒
(1)脂肪、淀粉、蛋白质是三种重要的营养成分,其中脂肪不属于高分子化合物,但它们都能发生水解反应;
(2)食物的酸碱性和溶液的酸碱性不同,含有碳、氮、硫、磷等非金属元素的蛋白质,在人体内经过消化、吸收后,最终代谢成酸性物质,因此,富含蛋白质的食物属于酸性食物;
(3)药品标签上都贴有OTC或R标记。平时我们到药店能自己买到的药如阿司匹林属于非处方药物,应贴有OTC;
(4)使用刀具时不小心割破了手指,可用于处理伤口的是碘酒。
16.(1)C3H6O3
(2)2:1
【解析】(1)浓硫酸增重5.4g,则生成水的质量是5.4g,生成n(H2O)==0.3mol,所含有H原子的物质的量n(H)=0.3mol×2=0.6mol,碱石灰增重13.2g,生成m(CO2)是13.2g,n(CO2)==0.3mol,则n(C)=0.3mol,9.0gA中m(O)=9g-0.6g-12g/mol×0.3mol=4.8g,n(O)==0.3mol,所以n(C):n(H):n(O)=0.3mol:0.6mol:0.3mol=1:2:1,即有机物A的实验式为CH2O,设其分子式为(CH2O)x,A相对分子质量为90,则30x=90,故x=3,则A的分子式为C3H6O3。
(2)将60 g由甲烷和乙烯组成的混合气体通入盛有足量溴水的容器,充分反应后容器的总质量增加28 g,这说明乙烯的质量是28g、物质的量是1mol,甲烷的质量是60g—28g=32g、物质的量是2mol,则原混合气体中甲烷和乙烯的物质的量之比为2:1。
17. CH2O C CH3CH(OH)COOH
(1)根据质量守恒可知,生成的22g 二氧化碳中C元素质量即为化合物中所含C元素质量、生成的9g水中H元素质量即为化合物中所含H元素质量,A的质量与C、H两种元素质量和的差为氧元素的质量,然后求出各自的物质的量,由碳、氢、氧元素的物质的量之比可推测实验式(最简式);
(2)A.结构相似,分子组成上相差1个或者若干个原子团的化合物互称为同系物;
B.有相同分子式而结构不同的化合物互为同分异构体;
C.最简式相同,质量相等,所含C、H、O质量相同,完全燃烧耗氧量相同;
D.最简式相同,分子式不一定相同,等物质的量,完全燃烧耗氧量不一定相同;
(3)若A的相对质量为90,结合最简式写出其分子式,再结合两分子A能反应形成六元环状酯,满足条件的A的结构简式。
(1)根据质量守恒定律得:15g A化合物中所含C元素质量为:22g×=6g,所含H元素质量为:9g×=1g,所含O元素质量为:15g-6g-1g=8g,n(C):n(H):n(O)=::=1:2:1,所以化合物的实验式(最简式)是CH2O;
(2)A.最简式相同,不一定是同系物,如甲醛与乙酸,故A错误;
B.最简式相同,不一定是同分异构体,如甲醛与乙酸,故B错误;
C.最简式相同,质量相等,所含C、H、O质量相同,则完全燃烧耗氧量相同,故C正确;
D.最简式相同,分子式不一定相同,则等物质的量,完全燃烧耗氧量不一定相同,如1mol的甲醛与1mol的乙酸,完全燃烧消耗氧气不等,故D错误;
故答案为C;
(3)若A的相对质量为90,最简式CH2O的式量为30,则A的分子式为C3H6O3,两分子A能反应形成六元环状酯,说明A中含有羧基和醇羟基,则满足条件的A的结构简式为CH3CH(OH)COOH。
18. 0.667或66.7% 3.8 2:1 12.4
(1)碳化钙样品中的含碳量为25%,CaC2中C的质量分数为,所以样品中碳化钙的质量分数为25%÷=66.7%;
(2)根据反应2Mg3N2+3CO2 =3C+6MgO+2N2,2mol氮化镁和3mol二氧化碳参加反应生成2mol氮气,固体质量增加3mol×44g/mol-2mol×28g/mol=76g,10.0g氮化镁的物质的量是10.0g÷100g/mol=0.1mol,标准状况下4.48L二氧化碳的物质的量是4.48L÷22.4L/mol=0.2mol,则二氧化碳过量,所以以0.1mol氮化镁计算,则固体增加的质量是×0.1mol=3.8g;
(3)根据表中数据,实验①中混合物完全反应,设实验①的混合物中Be2C与CaC2的物质的量分别为x、y,则Be2C与水反应的化学方程式是Be2C+4H2O=2Be(OH)2+CH4↑,生成甲烷气体的物质的量是x,CaC2与水反应的化学方程式是CaC2+ 2H2O=Ca(OH)2+C2H2↑,生成乙炔气体的物质的量是y,则30g/molx+64g/moly=6.2g,x+y=3.36L÷22.4L/mol,解得x=0.1mol,y=0.05mol,则该混合物中Be2C与CaC2的物质的量之比0.1mol:0.05mol=2:1;
(4)根据上题计算可知,6.2g固体混合物消耗水的物质的量是4x+2y=4×0.1mol+2×0.05mol=0.5mol,18mL水的质量是18g,物质的量是18g÷18g/mol=1mol,所以当恰好消耗18mL水时,需要固体的质量为6.2g的2倍,即12.4g。
19.(1) 催化剂
(2)淀粉
(3) 8、3、2 其他条件不变,增大氢离子浓度可以加快反应速率
(4)由于,,所以未出现溶液变蓝的现象
(1)该“碘钟实验”的总反应:①,反应分两步进行:反应A:②,反应B:①-②得到反应的离子方程式:,对于总反应,I-的作用相当于催化剂;
(2)过氧化氢具有氧化性会将KI氧化为碘单质,碘单质遇到淀粉变蓝色,碘单质具有氧化性,可以氧化Na2S2O3溶液,发生反应,则试剂X为淀粉溶液;
(3)①为了方便研究在反应中要采取控制变量方法进行研究,即只改变一个反应条件,其它条件相同,依据表格数据可知,实验Ⅲ跟实验Ⅱ比硫酸体积减少,所以其它条件都相同,而且混合后总体积也要相同,故实验Ⅲ中,x、y、z所对应的数值分别是:8、3、2;
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是:其它条件不变,溶液酸性越强,氢离子浓度越大,增大氢离子浓度可以加快反应速率;
(4)对比实验Ⅱ、实验Ⅳ,可知溶液总体积相同,该变量是过氧化氢、Na2S2O3溶液,过氧化氢减少,Na2S2O3增大,由于,,所以未出现溶液变蓝的现象。
20. A B A D Ⅰ中品红溶液褪色 除去SO2,以免干扰乙烯的实验 检验SO2是否除净 Ⅲ中溶液不褪色,Ⅳ中溶液褪色
二氧化硫的检验用品红溶液,乙烯的检验用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,据此回答问题。
(1)因装置Ⅰ用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置Ⅱ试管装有NaOH溶液除去SO2,装置Ⅲ通过品红溶液不褪色确认SO2已除干净,装置Ⅳ通过高锰酸钾酸性溶液褪色检验乙烯,即装置Ⅰ~Ⅳ中盛放的试剂依次是A、B、A、D;
(2)装置Ⅰ用来检验SO2,试管中品红溶液褪色,说明含有SO2;
(3)装置Ⅱ试管装有NaOH溶液除去SO2,以免干扰乙烯的检验;装置Ⅲ通过品红溶液不褪色确认SO2已除干净;
(4)装置Ⅳ通过高锰酸钾酸性溶液褪色检验乙烯,确认含乙烯的现象是:Ⅲ中溶液不褪色,Ⅳ中高锰酸钾酸性溶液褪色。
21. 羟基 羧基 先加乙醇,再加浓硫酸,再加乙酸 催化剂 吸水剂 饱和碳酸钠溶液 除去乙酸,溶解乙醇,降低乙酸乙酯的降低 CH3COOH+CH3CH2180HCH3CO180CH2CH3+H2O 酯化反应
(1)乙酸含羧基,乙醇含羟基;
(2) 试剂的加入顺序是先加乙醇,在缓慢加入浓硫酸,等温度降低后最后加入乙酸;
(3) 乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动;
(4) 乙酸与碳酸钠反应生成溶于水的醋酸钠,乙醇易溶于碳酸钠溶液,乙酸乙酯在饱和碳酸钠溶液中溶解度很小,易分层析出;
(5)根据酯化反应机理:酸脱羟基醇脱羟基氢,写出化学方程式;根据反应实质判断反应类型。
(1)该实验有机反应物乙酸和乙醇中含有的官能团有羟基、羧基,
因此,本题正确答案是:羟基、羧基;
(2) 实验室加入反应物和浓硫酸的先后顺序是先加乙醇,再加浓硫酸,再加乙酸;
因此,本题正确答案是:先加乙醇,再加浓硫酸,再加乙酸;
(3) 乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动提高乙醇、乙酸的转化率,故浓硫酸起催化剂和吸水剂作用;
因此,本题正确答案是:催化剂 吸水剂;
(4) 右边试管中的溶液是饱和碳酸钠溶液,其作用是除去乙酸,溶解乙醇,降低乙酸乙酯的降低。
因此,本题正确答案是:饱和碳酸钠溶液;除去乙酸,溶解乙醇,降低乙酸乙酯的降低;
(5)酯化反应机理:酸脱羟基醇脱羟基氢,化学方程式为CH3COOH+CH3CH2180HCH3CO180CH2CH3+H2O,反应类型是酯化反应。
因此,本题正确答案是:CH3COOH+CH3CH2180HCH3CO180CH2CH3+H2O;酯化反应。
22.(1) 二 ⅥA
(2) 共价键(或极性共价键)
(3)PH3
(4)2Al2O3(熔融)4Al+3O2↑
(5)CH2=CH2
(6)PCl5+8NaOH=Na3PO4+5NaCl+4H2O
D应处于第三周期,且D原子的原子序数等于其最外层电子数的3倍,则D为P,由元素在周期表中的位置,则A为C、B为O、C为Al、E为Cl;
(1)
B为O,在周期表中位于第二周期第VIA族;
(2)
E2B是Cl2O,由O和2个Cl原子各共用1对电子对,电子式为,化学键类型是共价键;
(3)
在B、D、E分别为O、P、S,非金属性越强,其气态氢化物越稳定,由非金属性:O>S>P,则热稳定性最弱的是PH3;
(4)
工业上,制备Al单质是电解熔融的氧化铝,反应的化学方程式为2Al2O3(熔融)4Al+3O2↑;
(5)
A是C,能与溴水、酸性KMnO4溶液发生化学反应的有乙烯,结构简式是CH2=CH2;
(6)
D的单质P在氯气中燃烧生成两种产物X和Y,其中X分子中每个原子最外层都达到8电子结构说明X为PCl3,则Y为PCl5,PCl5与足量的NaOH溶液反应生成两种盐为Na3PO4、NaCl和水,该反应的化学方程式:PCl5+8NaOH=Na3PO4+5NaCl+4H2O
一、单选题(共12题)
1.某课外活动小组的同学通过进行乙醇的催化氧化实验来制取乙醛,其装置如图所示(部分夹持装置已略去)。下列有关说法错误的是
已知:乙醛的沸点为20.8℃,能与水互溶。
A.实验开始时,需要检查装置气密性
B.实验时,试管甲处需要用温水浴加热
C.实验中,可观察到铜丝出现红色和黑色交替的现象
D.实验结束后,装有铜丝的玻璃管的总质量减小
2.下列说法正确的是
A.葡萄糖能水解成乙醇和二氧化碳
B.氨基乙酸、甲醛、乙二醇均可发生聚合反应
C.苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强
D.实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯
3.某塑化剂的结构简式如图所示,下列说法正确的是
A.1mol该塑化剂最多能与5molH2发生加成反应
B.该塑化剂能与Br2发生加成反应使溴水褪色
C.该塑化剂与Cl2在光照条件下能发生取代反应
D.该塑化剂分子式为C16H22O4,是乙酸乙酯的一种同系物
4.碳酰氯(COCl2)俗名光气,熔点为-118℃,沸点为8.2℃,遇水迅速水解,生成氯化氢。光气可由氯仿(CHCl3)和氧气在光照条件下合成。下列说法错误的是
A.装置的连接顺序应为
B.装置丙的主要作用是吸收尾气中的氯化氢
C.装置丁中发生反应的化学方程式为
D.冰水混合物的作用是降温,防止挥发
5.下列有关乙酸的叙述错误的是
A.是一种生活中常见的烃的衍生物
B.分子中含有4个氢原子,它是四元有机酸
C.分子中含有1个羧基,它是一元有机羧酸
D.分子中含有碳氧双键,不能使溴水褪色
6.有机化合物的结构可用键线式表示,如CH3CH=CHCH2COOH可简写为。脱落酸的结构简式如图所示,下列关于脱落酸的说法错误的是
A.既可以与乙醇又可以与乙酸发生酯化反应
B.1mol脱落酸与足量金属Na反应可产生2molH2
C.能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,且反应原理不同
D.分子中所有碳原子不可能共平面
7.接种疫苗是有效阻断病毒传播的重要途径,新型冠状灭活疫苗主要成分为灭活病毒,辅料为、、、。下列对相关物质的说法错误的是
A.灭活病毒中含高分子化合物
B.胶体具有吸附性
C.饱和溶液可作生理盐水
D.、既属于钠盐,也属于酸式盐
8.下列说法正确的是
A.苯和甲烷均不能发生氧化反应
B.葡萄糖在酒化酶的作用下水解产生乙醇
C.甲烷和Cl2的反应与乙烯和Br2的反应,属于同一类型的反应
D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团不相同
9.下列关于氨基酸、肽键与蛋白质的关系叙述中错误的是
A.氨基酸之间脱水可以形成肽键
B.蛋白质就是相对分子质量很大的多肽
C.肽键有二肽、三肽、四肽等多肽,三肽中含有三个肽键
D.多肽与蛋白质并没有一个严格的界限
10.下列各组物质中,互为同素异形体的一组是
A.麦芽糖和蔗糖 B.乙烷和丙烷 C.12C和14C D.氧气和臭氧
11.下列分子所有原子不可能处于同一平面的是 ( )
A.苯 B.乙烯 C.溴苯 D.甲苯
12.下列分子式表示的物质具有同分异构体的是
A.C2H4 B.C3H8 C.CH2Cl2 D.C4H10
二、非选择题(共10题)
13.下列过程中不一定释放能量的是 ______ 请填编号
A 形成化学键,燃料燃烧,化合反应,葡萄糖在体内的氧化分解,酸碱中和,炸药爆炸.
已知A和B是同种元素的两种单质,A转化为B时需放出能量,则A和B相比较而言,较稳定的是 ______ 请填A或.
在C、C、、几种核素中,互称为同位素的是 ______
下列五种有机物中: 淀粉,
水溶液显酸性的是 ______ 填编号.
14.下列物质中,属于同种原子的是___,属于同素异形体的是___,属于同位素的是__(填编号)。
①H和T;②C-12和C60;③H2和H;④14C和14N;⑤2H和D;⑥S和S2-;⑦H2O和D2O;⑧16O2和18O3
15.回答下列问题:
(1)脂肪、淀粉、蛋白质是三种重要的营养成分,其中____________不属于高分子化合物,但它们都能发生__________反应。
(2)食物的酸碱性和溶液的酸碱性___________(填“相同”或者“不同”);含有碳、氮、硫、磷等非金属元素的蛋白质,在人体内经过消化、吸收后,最终代谢成__________物质(填“酸性”或者“碱性”),因此,富含蛋白质的食物属于____________食物(填“酸性”或者“碱性”)。
(3)药品标签上都贴有OTC或R标记。平时我们到药店能自己买到的药如阿司匹林应贴有_________标记(填“OTC”或者“R”)。
(4)使用刀具时不小心割破了手指,在家庭小药箱里有风油精、速效感冒胶囊、板蓝根冲剂、胃舒平、碘酒等,可用于处理伤口的是______________。
16.计算:
(1)已知有机物A的相对分子质量为90。将9.0 g A在足量纯中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g,则有机物A的分子式为_______。
(2)将60 g由甲烷和乙烯组成的混合气体通入盛有足量溴水的容器,充分反应后容器的总质量增加28 g,则原混合气中甲烷和乙烯的物质的量之比为_______。
17.15克有机物A完全燃烧只生成22克CO2和9克H2O。试求:
(1)该有机物的最简式___。
(2)符合该最简式的A物质有多种,则它们之间的关系___(填序号)
A.一定互为同系物
B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同
D.等物质的量的它们完全燃烧耗氧量相同
(3)若A的相对质量为90,且两分子A能反应形成六元环状酯,则A的结构简式为___。
18.金属除了可以形成氧化物,氢化物之外,还能以碳化物、氮化物等形式存在,请根据题意完成下列计算:
(1)某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为_____________。
(2)已知2Mg3N2+3CO2 =3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加_________g。
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如下:
实验组号 ① ② ③ ④
碳化物(g) 6.2 9.3 15.5 21.7
水(mL) 18 18 18 18
气体(L,标准状况) 3.36 5.04 8.4左右 8.4左右
(3)求该混合物中Be2C与CaC2的物质的量之比__________。
(4)与18mL水恰好完全反应消耗该金属碳化物样品的质量是________克?(保留一位小数)
19.将浓度均为0.01mol/L的、、KI、溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应为。反应分两步进行,反应A为,反应B为……
(1)反应B的离子方程式是___________。对于总反应,I-的作用相当于___________。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的溶液中加入KI溶液和试剂X,溶液变为蓝色。
b.再向得到的蓝色溶液中加入溶液,溶液的蓝色褪去。
试剂X是___________。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ.(溶液浓度均为0.01mol/L)
用量/mL 实验序号 溶液 溶液 溶液 KI溶液(含淀粉)
实验Ⅱ 5 4 8 3 0
实验Ⅲ 5 2 x y z
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30min,实验Ⅲ是40min。
①实验Ⅲ中,x、y、z所对应的数值分别是___________。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是___________。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。(溶液浓度均为0.01mol/L)
用量/mL 实验序号 溶液 溶液 溶液 KI溶液(含淀粉)
实验Ⅳ 4 4 9 3 0
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:___________。
20.实验室制取乙烯:+CH2=CH2↑+H2O常因温度过高而使乙醇和浓H2SO4反应生成少量SO2。有人设计如图实验以确认上述混合气体中有乙烯和SO2。
(1)各装置盛放的试剂是:Ⅰ_______,Ⅱ_______,Ⅲ_______,Ⅳ_______(将有关试剂的序号填在横线上)。
A.品红溶液 B.NaOH溶液 C.浓H2SO4溶液 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是_______。
(3)使用装置Ⅱ的目的是_______,使用装置Ⅲ的目的是_______。
(4)确认含乙烯的现象是_______。
21.某化学兴趣小组用下图装置进行制取乙酸乙酯的实验。
请回答下列问题:
(1)反应物中含有的官能团有____(填写名称)。
(2)实验室加入反应物和浓硫酸的先后顺序是____。
(3)浓硫酸在该反应中的作用是________。
(4)右边试管中的溶液是____,其作用是________。
(5)用同位素180示踪法确定反应原理(18O在CH3CH2OH中),写出能表示18O位置的化学方程式_______ ,反应类型是____。
22.短周期元素A、B、C、D、E在周期表中相对位置如图所示。已知:D原子的原子序数等于其最外层电子数的3倍。
请回答下列问题:
(1)B在周期表中位于第___________周期___________族。
(2)E2B分子的电子式为___________,该分子所含化学键类型是___________。
(3)在B、D、E的气态氢化物中,热稳定性最弱的是___________(填化学式)。
(4)工业上,制备C单质的化学方程式为___________。
(5)在A的氢化物中,能与溴水、酸性KMnO4溶液发生化学反应的有___________(填一种物质的结构简式)。
(6)D的单质在氯气中燃烧生成两种产物X和Y,其中X分子中每个原子最外层都达到8电子结构。Y与足量的NaOH溶液反应生成两种盐和水,写出该反应的化学方程式:___________。
参考答案:
1.D
A.该实验中涉及气态反应为,开始时,需要检查装置气密性,A正确;
B.甲中乙醇为液态,为了能够进入硬质玻璃管反应,需要用温水浴加热使乙醇挥发,产生乙醇正确,B正确;
C.铜为该反应的催化剂,先于氧气反应生成黑色的氧化铜,氧化铜再氧化乙醇生成乙醛,而氧化铜则被还原为红色的铜,所以可观察到铜丝出现红色和黑色交替的现象,C正确;
D.铜丝为该反应的催化剂,所以实验结束后,装有铜丝的玻璃管的总质量不变,且有可能生成氧化铜而使质量增加,D错误;
综上所述答案为D。
2.B
A. 葡萄糖是单糖,不能水解,在一定条件下,葡萄糖能转化为乙醇和二氧化碳,故A错误;
B. 氨基乙酸中含有氨基和羧基,甲醛中含有醛基,乙二醇中含有羟基,均可发生聚合反应,故B正确;
C. 苯酚碳酸钠苯酚钠碳酸氢钠,说明苯酚的酸性比碳酸弱,但比碳酸氢根离子的酸性强,故C错误;
D. 溴乙烷在浓硫酸存在并加热条件下不能发生消去反应,应利用溴乙烷在醇溶液中加热制得乙烯,故D错误;
故选B。
3.C
A. 在该分子中,苯基能与H2发生加成反应,但酯基不能与H2反应,所以1mol该塑化剂最多能与3molH2发生加成反应,A错误;
B. 苯不能与溴水发生取代反应或加成反应,所以该塑化剂不能与Br2发生加成反应使溴水褪色,B错误;
C. 苯环侧链上的烃基能与氯气在光照条件下发生取代反应,所以该塑化剂与Cl2在光照条件下能发生取代反应,C正确;
D. 该塑化剂分子式为C16H22O4,正确,但它不是乙酸乙酯的一种同系物,D错误。
故答案为C。
4.A
A.洗气瓶按气流方向应该是b口进气,a口出气,A错误;
B.制备光气时有HCl气体产生,因此装置丙的主要作用是吸收尾气中的氯化氢,B正确;
C.装置丁中发生反应的化学方程式为,C正确;
D.冰水混合物的作用是降温,防止挥发,D正确;
故选A。
5.B
A.烃是只含C、H元素的有机化合物,乙酸除了含C、H元素还有O元素,属于烃的衍生物,故A正确;
B.只有羧基上的氢原子可以电离,是一元酸,故B错误;
C.分子中含有1个羧基,只有羧基上的氢原子可以电离,属于一元酸,故C正确;
D.分子中含有碳氧双键,但不能与溴水加成,所以不能使溴水褪色,故D正确;
故答案为B。
6.B
A.由脱落酸的结构简式可以看出,脱落酸中有羧基,可以跟乙醇发生酯化反应,脱落酸中也有羟基,可以与乙酸发生酯化反应,A正确;
B.1mol脱落酸有1mol羟基和1mol羧基,与Na反应能生成1molH2,B错误;
C.碳碳双键能使溴的四氯化碳溶液,属于加成反应,碳碳双键和羟基能使酸性高锰酸钾溶液褪色,属于氧化反应,两者反应原理不同,C正确;
D.图中箭头所指的六元环的3个C为烷烃的C,烷烃C与相连的C或H形成的是四面体形,故所有碳原子不可能共平面,D正确;
故选B。
7.C
A.灭活病毒中含蛋白质等高分子化合物,故A正确;
B.胶体有较大的表面积,所以胶体具有吸附性,故B正确;
C.医疗上常用0.9% NaCl溶液作生理盐水,故C错误;
D.、是磷酸中的氢部分被氢氧化钠中和的产物,既属于钠盐,也属于酸式盐,故D正确;
选C。
8.D
A.苯和甲烷燃烧生成二氧化碳和水,为氧化反应,故A错误;
B.葡萄糖是单糖不水解,葡萄糖在酒化酶作用下转化为乙醇和二氧化碳,属于氧化反应,故B错误;
C.甲烷与氯气发生取代反应,乙烯与溴发生加成反应,反应类型不同,故C错误;
D.乙醇、乙酸分别含有羟基、羧基,官能团不同,故D正确。
故选:D。
9.C
肽键是相邻氨基酸分子的氨基与羧基脱水而形成的,而肽的数值与氨基酸分子数目是对应的,即两个氨基酸分子脱水形成二肽,三个氨基酸分子脱水形成三肽,由此可见,肽键数目比肽的数目(即氨基酸分子的数目)少1。
A.相邻氨基酸分子的氨基与羧基脱水而形成肽键,A正确;
B.蛋白质就是无数个氨基酸分子通过形成肽键而连接起来的多肽,故B正确;
C.由上分析知肽键数目比肽的数目(即氨基酸分子的数目)少1,即三肽中只有两个肽键,C错误;
D.蛋白质就是无数个氨基酸分子通过形成肽键而连接起来的多肽,其概念上没有严格的界限,D正确;
故选C。
10.D
由同种元素组成的性质不同的单质互为同素异形体。
A.麦芽糖和蔗糖分子式均为C12H22O11,结构不同,二者互为同分异构体,A不符合题意;
B.乙烷和丙烷同属烷烃,结构相似,分子组成相差一个“CH2”,二者互为同系物,B不符合题意;
C.12C和14C属于质子数相同,中子数不同的碳的两种原子,二者互为同位素,C不符合题意;
D.氧气和臭氧均是由C元素组成的性质不同的两种单质,二者互为同素异形体,D符合题意。
答案选D。
11.D
在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面判断。
A.苯是平面结构,所有原子处于同一平面,故A不符合;
B.乙烯是平面结构,所有原子处于同一平面,故B不符合;
C.苯所有原子都在同一个平面上,溴苯可以看作是一个溴原子取代苯环上的一个氢原子,在同一个平面,故C不符合;
D.甲苯含有一个甲基,甲基具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故D符合;
故答案选D。
12.D
A.C2H4为乙烯,不存在同分异构体,故A不符合题意;
B.C3H8为丙烷,不存在同分异构体,故B不符合题意;
C.CH2Cl2是甲烷的二氯取代产物,甲烷正四面体结构,CH2Cl2不存在同分异构体,故C不符合题意;
D.C4H10有、两种结构,存在同分异构现象,故D符合题意;
故答案为:D。
13. C B C、 D
有些化合反应是吸热反应,如碳和二氧化碳反应制一氧化碳,其它反应都是放热反应;
物质含有的能量越高,物质的稳定性越差,根据A与B的转化过程中能量变化比较二者的稳定性;
具有相同的质子数,不同的中子数的原子之间互称为同位素;
有机物中显示酸性,分子中含有酚羟基或者羧基,据此进行判断。
形成化学键、燃料的燃烧、葡萄糖在体内的氧化分解、酸碱中和反应和炸药的爆炸过程都属于放热反应,而化合反应不一定为放热反应,如二氧化碳与C的反应属于吸热反应,所以不一定释放能量的为C;
故答案为:C;
和B是同种元素的两种单质,A转化为B时需放出能量,说明A的能量高于B,所以稳定性B的强于A;
故答案为:B;
同种元素的不同原子之间互称为同位素,满足条件的为:C、;
故答案为:C、;
种物质 淀粉中,甲烷、乙烯、乙醇和淀粉为中性溶液,只有乙酸为酸性溶液;
故答案为:D。
14. ⑤ ⑧ ①
质子数和中子数都相同的属于同种原子,所以和D属于同种原子;
同种元素的不同单质属于同素异形体,所以16O2和18O3互为同素异形体;
元素是具有相同质子数的一类原子的总称,则H和T互为同位素;
综上所述,答案分别为⑤;⑧;①。
15.(1) 脂肪 水解
(2) 不同 酸性 酸性
(3)OTC
(4)碘酒
(1)脂肪、淀粉、蛋白质是三种重要的营养成分,其中脂肪不属于高分子化合物,但它们都能发生水解反应;
(2)食物的酸碱性和溶液的酸碱性不同,含有碳、氮、硫、磷等非金属元素的蛋白质,在人体内经过消化、吸收后,最终代谢成酸性物质,因此,富含蛋白质的食物属于酸性食物;
(3)药品标签上都贴有OTC或R标记。平时我们到药店能自己买到的药如阿司匹林属于非处方药物,应贴有OTC;
(4)使用刀具时不小心割破了手指,可用于处理伤口的是碘酒。
16.(1)C3H6O3
(2)2:1
【解析】(1)浓硫酸增重5.4g,则生成水的质量是5.4g,生成n(H2O)==0.3mol,所含有H原子的物质的量n(H)=0.3mol×2=0.6mol,碱石灰增重13.2g,生成m(CO2)是13.2g,n(CO2)==0.3mol,则n(C)=0.3mol,9.0gA中m(O)=9g-0.6g-12g/mol×0.3mol=4.8g,n(O)==0.3mol,所以n(C):n(H):n(O)=0.3mol:0.6mol:0.3mol=1:2:1,即有机物A的实验式为CH2O,设其分子式为(CH2O)x,A相对分子质量为90,则30x=90,故x=3,则A的分子式为C3H6O3。
(2)将60 g由甲烷和乙烯组成的混合气体通入盛有足量溴水的容器,充分反应后容器的总质量增加28 g,这说明乙烯的质量是28g、物质的量是1mol,甲烷的质量是60g—28g=32g、物质的量是2mol,则原混合气体中甲烷和乙烯的物质的量之比为2:1。
17. CH2O C CH3CH(OH)COOH
(1)根据质量守恒可知,生成的22g 二氧化碳中C元素质量即为化合物中所含C元素质量、生成的9g水中H元素质量即为化合物中所含H元素质量,A的质量与C、H两种元素质量和的差为氧元素的质量,然后求出各自的物质的量,由碳、氢、氧元素的物质的量之比可推测实验式(最简式);
(2)A.结构相似,分子组成上相差1个或者若干个原子团的化合物互称为同系物;
B.有相同分子式而结构不同的化合物互为同分异构体;
C.最简式相同,质量相等,所含C、H、O质量相同,完全燃烧耗氧量相同;
D.最简式相同,分子式不一定相同,等物质的量,完全燃烧耗氧量不一定相同;
(3)若A的相对质量为90,结合最简式写出其分子式,再结合两分子A能反应形成六元环状酯,满足条件的A的结构简式。
(1)根据质量守恒定律得:15g A化合物中所含C元素质量为:22g×=6g,所含H元素质量为:9g×=1g,所含O元素质量为:15g-6g-1g=8g,n(C):n(H):n(O)=::=1:2:1,所以化合物的实验式(最简式)是CH2O;
(2)A.最简式相同,不一定是同系物,如甲醛与乙酸,故A错误;
B.最简式相同,不一定是同分异构体,如甲醛与乙酸,故B错误;
C.最简式相同,质量相等,所含C、H、O质量相同,则完全燃烧耗氧量相同,故C正确;
D.最简式相同,分子式不一定相同,则等物质的量,完全燃烧耗氧量不一定相同,如1mol的甲醛与1mol的乙酸,完全燃烧消耗氧气不等,故D错误;
故答案为C;
(3)若A的相对质量为90,最简式CH2O的式量为30,则A的分子式为C3H6O3,两分子A能反应形成六元环状酯,说明A中含有羧基和醇羟基,则满足条件的A的结构简式为CH3CH(OH)COOH。
18. 0.667或66.7% 3.8 2:1 12.4
(1)碳化钙样品中的含碳量为25%,CaC2中C的质量分数为,所以样品中碳化钙的质量分数为25%÷=66.7%;
(2)根据反应2Mg3N2+3CO2 =3C+6MgO+2N2,2mol氮化镁和3mol二氧化碳参加反应生成2mol氮气,固体质量增加3mol×44g/mol-2mol×28g/mol=76g,10.0g氮化镁的物质的量是10.0g÷100g/mol=0.1mol,标准状况下4.48L二氧化碳的物质的量是4.48L÷22.4L/mol=0.2mol,则二氧化碳过量,所以以0.1mol氮化镁计算,则固体增加的质量是×0.1mol=3.8g;
(3)根据表中数据,实验①中混合物完全反应,设实验①的混合物中Be2C与CaC2的物质的量分别为x、y,则Be2C与水反应的化学方程式是Be2C+4H2O=2Be(OH)2+CH4↑,生成甲烷气体的物质的量是x,CaC2与水反应的化学方程式是CaC2+ 2H2O=Ca(OH)2+C2H2↑,生成乙炔气体的物质的量是y,则30g/molx+64g/moly=6.2g,x+y=3.36L÷22.4L/mol,解得x=0.1mol,y=0.05mol,则该混合物中Be2C与CaC2的物质的量之比0.1mol:0.05mol=2:1;
(4)根据上题计算可知,6.2g固体混合物消耗水的物质的量是4x+2y=4×0.1mol+2×0.05mol=0.5mol,18mL水的质量是18g,物质的量是18g÷18g/mol=1mol,所以当恰好消耗18mL水时,需要固体的质量为6.2g的2倍,即12.4g。
19.(1) 催化剂
(2)淀粉
(3) 8、3、2 其他条件不变,增大氢离子浓度可以加快反应速率
(4)由于,,所以未出现溶液变蓝的现象
(1)该“碘钟实验”的总反应:①,反应分两步进行:反应A:②,反应B:①-②得到反应的离子方程式:,对于总反应,I-的作用相当于催化剂;
(2)过氧化氢具有氧化性会将KI氧化为碘单质,碘单质遇到淀粉变蓝色,碘单质具有氧化性,可以氧化Na2S2O3溶液,发生反应,则试剂X为淀粉溶液;
(3)①为了方便研究在反应中要采取控制变量方法进行研究,即只改变一个反应条件,其它条件相同,依据表格数据可知,实验Ⅲ跟实验Ⅱ比硫酸体积减少,所以其它条件都相同,而且混合后总体积也要相同,故实验Ⅲ中,x、y、z所对应的数值分别是:8、3、2;
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是:其它条件不变,溶液酸性越强,氢离子浓度越大,增大氢离子浓度可以加快反应速率;
(4)对比实验Ⅱ、实验Ⅳ,可知溶液总体积相同,该变量是过氧化氢、Na2S2O3溶液,过氧化氢减少,Na2S2O3增大,由于,,所以未出现溶液变蓝的现象。
20. A B A D Ⅰ中品红溶液褪色 除去SO2,以免干扰乙烯的实验 检验SO2是否除净 Ⅲ中溶液不褪色,Ⅳ中溶液褪色
二氧化硫的检验用品红溶液,乙烯的检验用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,据此回答问题。
(1)因装置Ⅰ用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置Ⅱ试管装有NaOH溶液除去SO2,装置Ⅲ通过品红溶液不褪色确认SO2已除干净,装置Ⅳ通过高锰酸钾酸性溶液褪色检验乙烯,即装置Ⅰ~Ⅳ中盛放的试剂依次是A、B、A、D;
(2)装置Ⅰ用来检验SO2,试管中品红溶液褪色,说明含有SO2;
(3)装置Ⅱ试管装有NaOH溶液除去SO2,以免干扰乙烯的检验;装置Ⅲ通过品红溶液不褪色确认SO2已除干净;
(4)装置Ⅳ通过高锰酸钾酸性溶液褪色检验乙烯,确认含乙烯的现象是:Ⅲ中溶液不褪色,Ⅳ中高锰酸钾酸性溶液褪色。
21. 羟基 羧基 先加乙醇,再加浓硫酸,再加乙酸 催化剂 吸水剂 饱和碳酸钠溶液 除去乙酸,溶解乙醇,降低乙酸乙酯的降低 CH3COOH+CH3CH2180HCH3CO180CH2CH3+H2O 酯化反应
(1)乙酸含羧基,乙醇含羟基;
(2) 试剂的加入顺序是先加乙醇,在缓慢加入浓硫酸,等温度降低后最后加入乙酸;
(3) 乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动;
(4) 乙酸与碳酸钠反应生成溶于水的醋酸钠,乙醇易溶于碳酸钠溶液,乙酸乙酯在饱和碳酸钠溶液中溶解度很小,易分层析出;
(5)根据酯化反应机理:酸脱羟基醇脱羟基氢,写出化学方程式;根据反应实质判断反应类型。
(1)该实验有机反应物乙酸和乙醇中含有的官能团有羟基、羧基,
因此,本题正确答案是:羟基、羧基;
(2) 实验室加入反应物和浓硫酸的先后顺序是先加乙醇,再加浓硫酸,再加乙酸;
因此,本题正确答案是:先加乙醇,再加浓硫酸,再加乙酸;
(3) 乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动提高乙醇、乙酸的转化率,故浓硫酸起催化剂和吸水剂作用;
因此,本题正确答案是:催化剂 吸水剂;
(4) 右边试管中的溶液是饱和碳酸钠溶液,其作用是除去乙酸,溶解乙醇,降低乙酸乙酯的降低。
因此,本题正确答案是:饱和碳酸钠溶液;除去乙酸,溶解乙醇,降低乙酸乙酯的降低;
(5)酯化反应机理:酸脱羟基醇脱羟基氢,化学方程式为CH3COOH+CH3CH2180HCH3CO180CH2CH3+H2O,反应类型是酯化反应。
因此,本题正确答案是:CH3COOH+CH3CH2180HCH3CO180CH2CH3+H2O;酯化反应。
22.(1) 二 ⅥA
(2) 共价键(或极性共价键)
(3)PH3
(4)2Al2O3(熔融)4Al+3O2↑
(5)CH2=CH2
(6)PCl5+8NaOH=Na3PO4+5NaCl+4H2O
D应处于第三周期,且D原子的原子序数等于其最外层电子数的3倍,则D为P,由元素在周期表中的位置,则A为C、B为O、C为Al、E为Cl;
(1)
B为O,在周期表中位于第二周期第VIA族;
(2)
E2B是Cl2O,由O和2个Cl原子各共用1对电子对,电子式为,化学键类型是共价键;
(3)
在B、D、E分别为O、P、S,非金属性越强,其气态氢化物越稳定,由非金属性:O>S>P,则热稳定性最弱的是PH3;
(4)
工业上,制备Al单质是电解熔融的氧化铝,反应的化学方程式为2Al2O3(熔融)4Al+3O2↑;
(5)
A是C,能与溴水、酸性KMnO4溶液发生化学反应的有乙烯,结构简式是CH2=CH2;
(6)
D的单质P在氯气中燃烧生成两种产物X和Y,其中X分子中每个原子最外层都达到8电子结构说明X为PCl3,则Y为PCl5,PCl5与足量的NaOH溶液反应生成两种盐为Na3PO4、NaCl和水,该反应的化学方程式:PCl5+8NaOH=Na3PO4+5NaCl+4H2O
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
