3.2弱电解质的电离盐类的水解课时培优练 高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 3.2弱电解质的电离盐类的水解课时培优练 高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-02 13:55:57 | ||
图片预览




文档简介
3.2弱电解质的电离 盐类的水解 课时培优练 高中化学选修一 鲁科版(2019)
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.向氨水滴入等物质的量浓度的盐酸,滴定过程中混合溶液的温度变化如图所示,下列有关说法正确的是
A.由水电离出的:c点>b点
B.的电离程度:a点>b点
C.从b点到c点存在的离子浓度关系一定是:
D.存在于a点到b点之间
2.常温下,向20.00mL 0.1000的溶液中逐滴加入0.1000的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。下列说法错误的是
A.a点所示溶液中:
B.b点所示溶液中:
C.c点所示溶液中:
D.d点所示溶液中:
3.下列实验事实不能证明醋酸是弱电解质的是
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D.相同浓度的盐酸和醋酸,醋酸溶液的导电性比盐酸的弱
4.水溶液呈碱性的盐是
A.KNO3 B.NaHCO3 C.NH4Cl D.NaHSO4
5.下列各溶液中,有关微粒的物质的量浓度关系正确的是
A.10mL的溶液与6mL的盐酸混合:
B.为4的NaHB溶液中:
C.硫酸氢铵溶液中滴加氢氧化钠溶液至溶液恰好呈中性:
D.pH相等的溶液、溶液及溶液中:
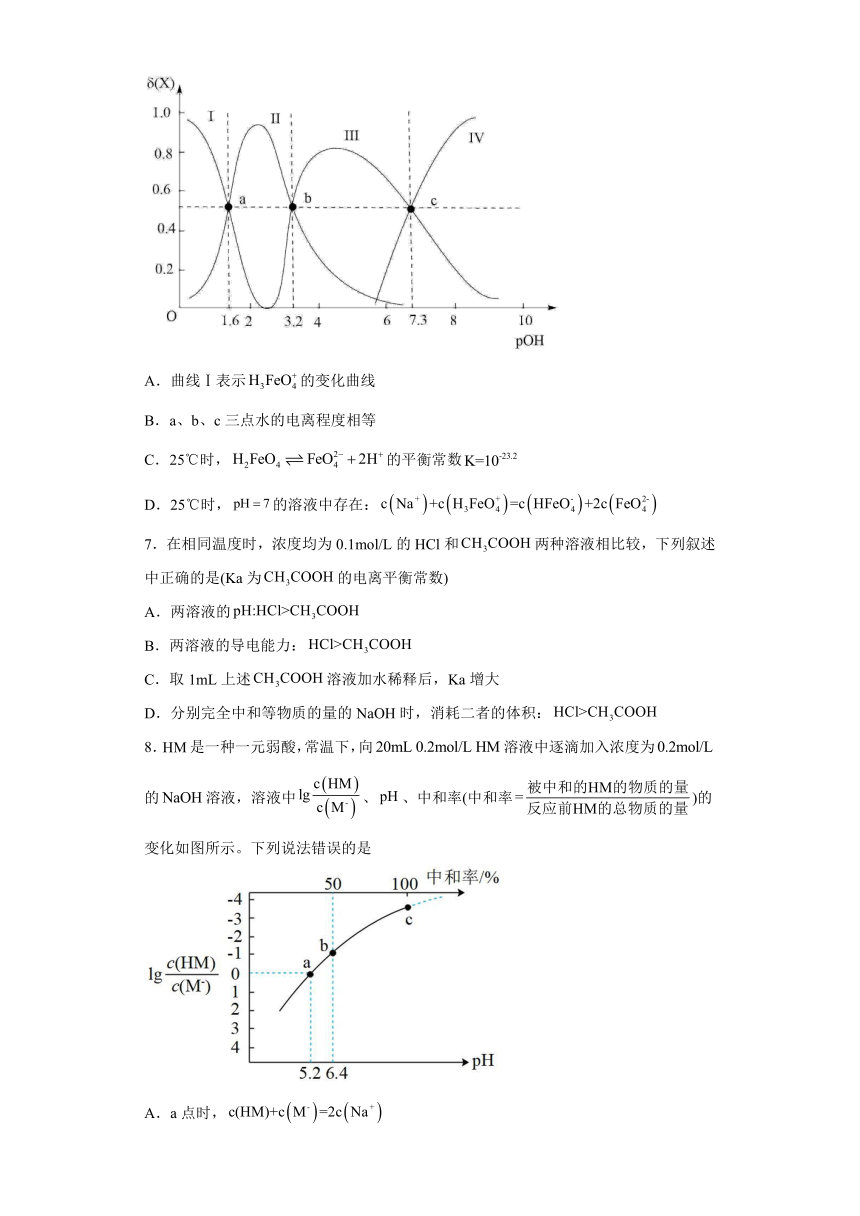
6.常温下,将一定量稀硫酸滴入高铁酸钠溶液中,溶液中含铁微粒、、、的物质的量分数随pOH的变化如图[,]。下列说法正确的是
A.曲线Ⅰ表示的变化曲线
B.a、b、c三点水的电离程度相等
C.25℃时,的平衡常数
D.25℃时,的溶液中存在:
7.在相同温度时,浓度均为0.1mol/L的HCl和两种溶液相比较,下列叙述中正确的是(Ka为的电离平衡常数)
A.两溶液的
B.两溶液的导电能力:
C.取1mL上述溶液加水稀释后,Ka增大
D.分别完全中和等物质的量的NaOH时,消耗二者的体积:
8.是一种一元弱酸,常温下,向溶液中逐滴加入浓度为的溶液,溶液中、、中和率(中和率)的变化如图所示。下列说法错误的是
A.a点时,
B.溶液中水的电离程度:c点点
C.b点时,
D.的电离常数为
9.室温下,向20mLNaHX溶液中逐滴滴入NaOH溶液,为由水电离产生的氢离子浓度的负对数,与所加NaOH溶液的体积关系如图所示,下列说法正确的是
A.A点溶液中存在:
B.B、D点溶液均为中性
C.C点溶液中存在:
D.D点溶液中存在:
10.一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是
A.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
B.工业上常用电解熔融MgCl2制备金属镁
C.“氯化”过程中发生的反应为
D.物质X常选用生石灰
二、多选题
11.25℃时,用HCl气体调节0.1mol·L-1碱BOH的pH,体系中粒子浓度的对数值(1gc)、反应物的物质的量之比的关系如图所示。若忽略通入气体后溶液体积的变化,下列说法正确的是
A.25℃时,BOH的电离平衡常数为10-9.25
B.t=0.5,2c(H+)+c(BOH)=2c(OH-)+c(B+)
C.P1所示溶液:c(C1-)<0.05mol·L-1
D.P2所示溶液:c(B+) >100c(BOH)
12.下列说法正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)= c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
D.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的ΔH<0
13.室温下,向20mL0.2mol L-1K2A(H2A:Ka1=1.64×10-3,Ka2=1.0×10-7)溶液中滴加0.2mol L-1的HCl溶液,混合溶液pH与所加HCl溶液体积的关系。下列叙述正确的是
A.a点溶液加水稀释后,促进A2-的水解,pH增大
B.b点溶液存在关系式:c(K+)<c(Cl-)+c(HA-)+2c(A2-)
C.c点溶液中pH最小,所以水的电离程度最大
D.a、b、c三点溶液存在关系式:c(H2A)+c(HA-)+c(A2-)=c(K+)
14.常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/LNaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
已知:常温常压下,
A.a点溶液中,
B.b点所示的溶液中:
C.a、b、c、d、四个点当中,水的电离程度:da=cb
D.d点所示溶液中:
15.痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,形成关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
①HUr(尿酸,aq)Ur-(尿酸根,aq)+H+(aq)
②NaUr(s)Ur-(aq)+Na+(aq)
室温下,将尿酸钠(NaUr)的悬浊液静置,取上层清液滴加盐酸,溶液中尿酸的浓度c(HUr)与pH的关系如图所示。已知Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法不正确的是
A.冬季为关节炎高发期,多在脚趾和手指的关节处,则生成尿酸钠晶体的反应是吸热反应
B.N点时,c(HUr)=c(Cl-)
C.M→N的变化过程中,逐渐减小
D.当某病人尿液中的c(HUr)=c(Ur-)时,该病人的尿液呈酸性
三、实验题
16.某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在___中,再加水稀释,这样操作的目的是___。
(2)通入足量SO2时,装置C中观察到的现象为___。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___。
②检验装置C中有Fe2+生成,可选择的试剂为___。
③该小组同学向装置C反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO,该做法___(填“合理”或“不合理”),理由是__。
(4)装置D中倒置漏斗的作用是___。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有___(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
四、有机推断题
17.甲、乙、丙是都含有同一种元素的不同物质,转化关系如下图:
(1)若甲是CO2。
①常用于泡沫灭火器的是_______(填“乙”或“丙”,下同)。
②浓度均为0.01 mol·L-1的乙溶液和丙溶液中,水的电离程度较大的是_________。
(2)若甲是Al。
①Al的原子结构示意图为__________。
②当n(Al)︰n(NaOH)︰n(H2SO4)=1︰1︰2时,丙的化学式是_________。
(3)若甲是Cl2。
①甲转化为乙的离子方程式是____________。
②已知:TiO2(s)+2Cl2 (g)+2C(s)=TiCl4(l)+2CO(g) △H=-81 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
写出TiO2和Cl2反应生成TiCl4和O2的热化学方程式:_________。
③常温下,将a mol·L-1乙溶液和0.01 mol·L-1H2SO4溶液等体积混合生成丙,溶液呈中性,则丙的电离平衡常数Ka=___________(用含a的代数式表示)。
五、工业流程题
18.天然铝土矿主要成分是Al2O3杂质主要为SiO2、Fe2O3、 MgO等,工业上用天然铝土矿生产铝的工艺流程如图:
已知部分氢氧化物沉淀的pH如下表:
沉淀物 Fe( OH)3 Al( OH)3 Mg(OH)2
开始沉淀时的pH (离子初始浓度为0. 01mol·L-1) 2.2 3.7 9. 6
完全沉淀时的pH (离子浓度<10-5mol·L-1) 3.2 4.7 11.1
请回答下列问题:
(1)为了加快铝土矿和盐酸的反应速率,可以采取的措施为_______(填一种即可);
(2)固体A的主要成分是_______(填化学式),溶液E中的金属离子主要为_______(填化学式);
(3)“溶液C”调节pH的范围为_______;
(4)为了验证“溶液C”中是否含有Fe3+,可取少量“溶液C”于试管中,向其中加入_______溶液(填试剂名称),溶液变成血红色,则证明“溶液C”中有Fe3+,其离子反应方程式为_______;
(5)操作⑤反应的化学方程式为_______。
六、原理综合题
19.利用化学反应原理研究碳、硫及其化合物的性质具有重要意义。
(1)工业上用炭还原辉铜矿(主要成分是Cu2S),可制取金属铜。
已知反应的热化学方程式如下:
C(s)+S2 (g) ═CS2 (g) △H1=150 KJ/mol
Cu2S(s)+H2 (g) ═2Cu(s)+H2S (g) △H2=59.5KJ/mol
2H2S (g) ═2H2 (g) +S2 (g) △H3=170KJ/mol
通过计算,可知用炭还原Cu2S 制取金属铜和CS2(g) 的热化学方程式为___________。
(2)为研究反应2H2S(g)2H2(g)+S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
①向三个体积均为1L的恒容密闭容器中分别加入1molH2S,进行H2S分解实验。不同温度下测得H2S 的转化率与时间的关系如图1所示:
T1温度下,0~5min S2(g)的平均反应速率v(S2)=____________mol.L-1.min-1,反应平衡常数K=_____mol L-1.温度T1、T2、T3由高到低的顺序是__________。
②T4温度时,向1L的恒容密闭容器中加入1.8molH2(g)、1.2molS2(g),达到平衡后测得S2(g)和H2S(g)的浓度相等,则T4_____ T1(填“<”、“=”或“>”)。
(3)T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH 溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42-的物质的量分数(δ) 与pH的关系如图2所示:
①草酸的电离常数分别为K1与K2,则=_____。
②按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,下列有关该溶液的叙述正确的是_____(填序号)。
A.该溶液的pH为4.2
B.3c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
C.3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
D.3c(OH-)+c(C2O42-)=3c(H+)+2c(HC2O4-)+5c(H2C2O4)
(4)含碳的甲醇(CH3OH)的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。
①写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________________。
②常温下,向100 mL0.1mol/L的NaOH溶液中通入一定量的CO2。为探究反应后混合溶液的成分,向其中逐滴加入0.1 mol/L的HCl溶液。溶液产生气体前,消耗V( HCl)=V1;溶液刚好不再产生气体时,消耗V( HCl) =V2。当V120.(1)某温度(t℃)时,测得0.01 mol L-1的NaOH溶液的pH=11,则该温度下水的kW=_______。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。若所得混合液的pH=10,且a=12,b=2,则:Va︰Vb=_______。
(2)室温时,向100mL0. 1 mol L-1NH4HSO4溶液中滴加0.1 mol L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是_______:在b点,溶液中阳离子浓度由大到小的排列顺序是_______。
(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为。反应10min后溶液中离子浓度的分析结果如下表。
离子 Cl-
c/(mol L-1)
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_______。
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是_______。
七、结构与性质
21.氮、磷、砷(As)、锑(Sb)、铋(B)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置是__。Mc的中子数为__。
已知:P(s,白磷)=P(s,黑磷)△H=-39.3kJ/mol;P(s,白磷)=P(s,红磷)△H=-17.6kJ/mol,由此推知,其中最稳定的磷单质是__。
(2)氮和磷氢化物性质的比较:
热稳定性:PH3__(填“>”或“<")NH3,沸点:P2H4__(填“>”或“<")N2H4,判断依据是__。
(3)PH3与卤化氢和N2H4与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是__(填序号)。
a.含离子键、共价键 b.能与水发生水解反应 c.不能与NaOH反应
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式__,因此,配制SbCl3溶液应__。
参考答案:
1.D
【详解】A.b点酸碱恰好完全反应生成氯化铵,c点盐酸过量,盐酸抑制水的电离,氯化铵促进水的电离,因此由水电离出的:c点B.为弱电解质,反应过程中不断电离,则电离程度:a点C.从b点到c点,盐酸过量,c(NH)逐渐减小,c(H+)逐渐增大,靠近c点时一定有,C错误;
D.a点是NH4Cl和的混合溶液,,b点是NH4Cl溶液,,随着盐酸加入,溶液中氯离子浓度逐渐增大,因此存在于a点到b点之间,D正确;
答案选D。
2.B
【详解】A.a点所示溶液即NH4Cl溶液中由于离子发生水解呈酸性,故离子浓度大小关系为:,A正确;
B.b点所示溶液为中性溶液即,又根据电荷守恒可知:,故离子浓度大小关系为:,B错误;
C.根据物料守恒可知,在滴定的整个过程中始终有:,故c点所示溶液中:,C正确;
D.d点所示溶液是NH4Cl和NaOH恰好完全反应,此时溶质等物质的量的为NaCl和NH3 H2O,故离子浓度大小关系为:,D正确;
故答案为:B。
3.A
【详解】A.醋酸溶液和盐酸pH相同,则溶液中c(H+)相同,因此分别与同样颗粒大小的锌反应时,产生H2的起始速率相等,这不能证明醋酸是弱电解质,A符合题意;
B.常温下,测得0.1 mol/L醋酸溶液的pH=4,c(H+)=10-4 mol/L<0.1 mol/L,因此可证明醋酸是弱酸,存在电离平衡,B不符合题意;
C.常温下,将pH=1的醋酸溶液稀释1000倍,若醋酸是强酸,则稀释后c(H+)=10-4 mol/L,pH=4,现在测得pH<4,c(H+)>10-4 mol/L,说明又有一部分醋酸分子发生电离产生H+,使溶液中c(H+)增大,故可以证明醋酸是弱酸,C不符合题意;
D.在相同条件下,相同浓度醋酸溶液的导电性比盐酸的弱,说明醋酸溶液中电离产生的自由移动的离子浓度比HCl小,因此可以说明醋酸是弱酸,D不符合题意;
故合理选项是A。
4.B
【详解】A. KNO3完全电离产生钾离子和硝酸根离子,二者均不水解,故溶液呈中性,故A不符合;
B. NaHCO3溶液中,的水解程度大于其电离程度,故溶液呈碱性,故B符合;
C. NH4Cl发生水解反应,使溶液呈酸性,故C不符合;
D. NaHSO4是强电解质,完全电离,,电离产生H+,使溶液呈酸性,故D不符合;
故选B。
5.C
【详解】A.10mL的溶液与6mL的盐酸混合,发生反应,所得溶液中、NaCl、HCl的物质的量之比为,所以,溶液呈酸性,,是弱酸,发生电离,但电离程度不大,所以,故有,A错误;
B.的NaHB溶液pH为4,说明的电离程度大于其水解程度,其电离生成,水解生成,所以,电离程度与水解程度均不大,故,B错误;
C.NH4HSO4溶液中滴加NaOH溶液至溶液恰好呈中性,则加入的氢氧化钠的物质的量大于硫酸氢铵,所以,由物料守恒可知,,所以,
故,C正确;
D.、、均是强酸弱碱盐,三种盐浓度相同时,、、水解得到的H+浓度依次减小,故pH相等的溶液、溶液和溶液中:,D错误;
正确答案选C。
6.C
【分析】稀硫酸逐滴滴入高铁酸钠溶液中,溶液pOH不断增大,OH-的浓度不断减小,H+的浓度不断增大,则的物质的量分数减小,之后的物质的量分数先增大后减小,然后的物质的量分数先增大后减小,最后的物质的量分数增大,故曲线I表示的变化曲线,曲线II表示的变化曲线,曲线III表示的变化曲线,曲线IV表示的变化曲线。
【详解】A.据分析知,曲线Ⅰ表示的变化曲线,A错误;
B.a、b、c三点溶液中微粒成分不同,溶液pOH不同,对水的电离影响程度不同,则水的电离程度不相等,B错误;
C.由a点可知,,所以的,同理可推知的,所以的平衡常数,C正确;
D.根据电荷守恒得,,的溶液中,所以,D错误;
故选C。
7.B
【详解】A.0.1mol/L的HCl溶液和0.1mol/L 溶液,氢离子浓度:,则溶液的,故A错误;
B.0.1mol/L的HCl溶液和0.1mol/L 溶液,离子浓度:,离子浓度越大,导电能力越强,则溶液的导电能力:,故B正确;
C.电离平衡常数Ka只与温度有关,温度不变,平衡常数不变,故C错误;
D.HCl和均为一元酸,分别完全中和等物质的量的NaOH时,消耗二者的物质的量相等,由于二者浓度也相等,则消耗二者的体积:,故D错误;
答案选B。
8.A
【详解】A.a点时lg=0,说明c(HM)=c(M-),又根据电荷守恒可知,c(H+)+c(Na+)=c(OH-)+c(M-),因为此时pH=5.2,则氢离子浓度大于氢氧根离子浓度,则c(Na+)B.b点时被中和的HM为50%,此时溶液中HM和NaM浓度基本相同,NaM水解促进水的电离但是HM的存在抑制水的电离,c点时被中和的HM为100%,溶液中全为NaM,NaM水解促进水的电离,因此c点水的电离程度大于b点,B正确;
C.根据电荷守恒可知,c(H+)+c(Na+)=c(OH-)+c(M-),b点时溶液呈酸性,则c(H+)>c(OH-),则c(Na+)c(Na+)>c(H+)>c(OH-),C正确;
D.a点时c(HM)=c(M-),pH=5.2,则HM电离常数=,D正确;
故答案选A。
9.C
【详解】A.A点溶质为NaHX,既发生电离又发生水解,,则,的电离受到抑制,故的电离大于水解,则溶液中存在,A项错误;
B.B点溶质为NaHX与,D点溶质为与,故D点溶液为碱性,B项错误;
C.C点溶质为,故存在质子守恒:,C项正确;
D.NaHX开始为,后加入溶液,故溶液体积变化,所有离子浓度均变化,故,D项错误;
答案选C。
10.A
【详解】A.煅烧后的产物主要是氧化镁,氧化镁中加稀盐酸后得到氯化镁溶液,但因氯化镁水解,将氯化镁溶液加热蒸发后的产物为氢氧化镁,A错误;
B.因钠镁铝性质活泼,采用电解熔融盐法进行冶炼,制备镁可选用电解熔融氯化镁的方法,B正确;
C.依据流程图,“氯化”过程是氧化镁、碳和氯气发生氧化还原反应生成氯化镁和一氧化碳,C正确;
D.苦卤水中加入物质X的目的是将溶液中的镁离子转化为氢氧化镁沉淀,因此物质X溶于水后应显碱性,生石灰价格便宜且溶于水显碱性,故物质X常选用生石灰,D正确;
答案选A。
11.CD
【分析】HCl是强酸,在调节pH的过程中,若BOH是强碱,则当时,pH应为7,但是当时,pH小于7,溶液显酸性,对应图中点P3,是因为存在水解平衡,故BOH是一元弱碱。
【详解】A.由图可知,当pH=9.25,即c(OH-),lgc(BOH)=lgc(B+),BOH的电离平衡常数为,故A项错误;
B.t=0.5时,溶液中电荷守恒:c(H+)+c(B+)=c(OH-)+c(Cl-),且c(H+)与c(OH-)不相等,所以2c(H+)+c(BOH)不等于2c(OH-)+c(B+),故B项错误;
C.P1所示的溶液中电荷守恒:c(H+)+c(B+)=c(OH-)+c(Cl-),c(H+)=10-9.25 mol·L-1,c(OH-) mol·L-1,,得到c(C1-)<0.05mol·L-1,故C项正确;
D.P2所示溶液,pH=7,溶液呈中性,c(H+)=c(OH-)=10-7,根据,,故D项正确。
故答案选CD。
12.AB
【详解】A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+) + c(M+)= c(OH-) + c(A-),A正确;
B.酸越弱,盐的水解程度越大,相同浓度时pH的关系为NaOH>Na2CO3>CH3COONa,则pH相同时的浓度关系为c(NaOH)<c(Na2CO3)<c(CH3COONa),B正确;
C.1 mol Cl2通入水中,溶液中存在物料守恒,C错误;
D.该反应的ΔS>0,常温下不能自发进行,说明ΔG=ΔH-TΔS>0的,则ΔH>0,D错误;
故选AB。
13.BD
【详解】A.a点溶液中的溶质是,溶液水解呈碱性,加水稀释后水解程度增大,溶液中增大,但是溶液体积增大,所以减小,pH减小,A项错误;
B.b点溶液中的溶质为KHA和KCl,存在的电离和水解,,电离程度大于水解程度,溶液呈酸性,即,根据电荷守恒,B项正确;
C.c点的溶液溶质为KCl和,电离出的抑制了水的电离,溶液中水的电离程度最小,C项错误;
D.根据物料守恒K元素是A元素的两倍,,D项正确;
答案选BD。
14.AB
【分析】将Cl2缓慢通入水中发生反应Cl2+H2OH++Cl-+HClO,向右进行的过程,故a点是HCl和HClO的混合溶液,两种酸都会抑制水的电离,从b点开始滴加氢氧化钠,c点时随着NaOH溶液的加入,反应生成了NaCl和NaClO,其中次氯酸根离子会水解,从而促进水的电离,以此解题。
【详解】A.a点溶液中,氯水没有饱和,没有达到平衡状态,,故A正确;
B.b点所示溶液中发生反应:Cl2+H2OH++Cl-+HClO,HClO为弱电解质,部分电离,故溶液中存在:,故B正确;
C.由分析可知,a点时水的电离被抑制,但是在c点却存在次氯酸根离子,次氯酸根的水解促进了水的电离,故C错误;
D.d点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),根据物料守恒得,c(Cl-)=c(ClO-)+ c(HClO),所以,故D错误;
故选B。
15.AC
【详解】A.关节炎是因为形成了尿酸钠晶体,说明降低温度反应②的平衡向逆反应方向移动,Ksp减小,温度降低平衡逆向移动,说明生成尿酸钠晶体的反应是放热反应,A错误;
B. N点溶液呈中性,溶液中存在c(Na+ )+c(H+ )=c(Cl-)+c(OH- )+c(Ur- ),根据物料守恒:c(Na+ )=c(Ur- ) +c(HUr),则有c(HUr) +c(H+ )= c(Cl- )+c(OH- ),可知c(Cl- )=c(HUr),故 B正确;
C. M→N的变化过程中,溶液中c(HUr)增大,溶液中c(Ur- )减小,c(Na+ )= 增大,则逐渐增大,故C错误;
D.当c(HUr)=c(Ur -)时,Ka(HUr)=c(H+ )=2.0× 10-6 mol/L>=c(OH- ),尿液呈酸性,故D正确;
答案选AC。
16.(1) 浓盐酸 抑制氯化铁水解
(2)溶液由棕黄色变为浅绿色
(3) 2Fe3++SO2+2H2O=SO+4H++2Fe2+ K3[Fe(CN)6] 不合理 硝酸可以将溶解的SO2氧化为H2SO4,干扰实验
(4)使气体充分吸收;防止溶液倒吸
(5)bc
【分析】本题为用题给图示装置进行SO2 与FeCl3溶液反应的相关实验,A装置为SO2发生装置,B装置为安全装置,C装置用于进行SO2 与FeCl3溶液反应,D装置则是SO2尾气处理。SO2 与FeCl3溶液反应可以通过溶液颜色的变化证明,装置C中观察到溶液由棕黄色变为浅绿色。检验Fe3+中存在的Fe2+,可以用K3[Fe(CN)6]溶液,若生成蓝色沉淀,说明有亚铁离子;若将FeCl3溶液改用酸性KMnO4溶液则溶液紫红色逐渐变浅,若该用碘水,则黄色逐渐褪去;D装置采用防倒吸的装置,以此分析解答。
【详解】(1)配制氯化铁溶液时,为了抑制Fe3+的水解,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,故答案为:浓盐酸;抑制氯化铁水解;
(2)SO2时通入FeCl3溶液中时,SO2表现出还原性,能将Fe3+还原为Fe2+,则装置C中观察到的现象为溶液由棕黄色变为浅绿色,故答案为:溶液由棕黄色变为浅绿色;
(3)①根据以上分析可知,装置C中发生SO2与FeCl3溶液反应的离子方程式2Fe3+ + SO2 +2H2O=+4H++2Fe2+;②检验装置C中有Fe2+ 生成的方法为:取少量C中反应后的溶液于试管中,向其中滴入铁氰化钾溶液,若生成蓝色沉淀,说明有亚铁离子;③加入的硝酸可以将溶解的SO2氧化为 H2SO4,会干扰实验,故该做法不合理,故答案为:2Fe3+ + SO2 +2H2O=+4H++2Fe2+ ;K3[Fe(CN)6];不合理; 硝酸可以将溶解的SO2氧化为 H2SO4,干扰实验;
(4)装置D中倒置漏斗能将SO2尾气充分吸收,且能防止溶液倒吸,故答案为:使气体充分吸收;防止溶液倒吸;
(5)要验证SO2具有还原性,应选择具有强氧化性的试剂,且实验过程有明显的实验现象,b、c项试剂均可代替FeCl3溶液。故答案为b、c。
17. 乙 乙 Al2(SO4)3 Cl2+2OH-=Cl-+ClO-+H2O TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H=+140 kJ·mol-1 ()×10-5
【详解】(1)二氧化碳与氢氧化钠反应生成碳酸钠(碳酸氢钠),再与硫酸反应生成硫酸钠,①常用作泡沫灭火器的是NaHCO3,故为乙;②浓度相同的碳酸氢钠溶液和硫酸钠溶液中,HCO3-水解,故乙溶液中水的电离程度大;
(2)金属铝是13号元素,核外电子排布为2、8、3②n(Al)=n(NaOH)时,生成偏铝酸钠,根据方程式:2NaAlO2 + 4H2SO4 =Na2SO4 + Al2(SO4)3 + 4H2O可知,NaAlO2与H2SO4的物质的量之比为1:2,符合题意,故丙的化学式是Al2(SO4)3;
(3)若甲是氯气,与氢氧化钠生成氯化钠和次氯酸钠,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;用方程式①-②,得TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H=-81-(-221)=+140 kJ·mol-1 ;③根据电荷守恒可得到:c(Na+)+c(H+)=c(OH-)+c(ClO-)+2c(SO42-);其中,溶液显中性即c(H+)=c(OH-),故c(Na+)=c(ClO-)+2c(SO42-);又根据物料守恒可得到:c(Na+)=c(ClO-)+c(HClO),即c(ClO-)=c(Na+)-2c(SO42-)、c(HClO)=c(Na+)-c(ClO-)=c(Na+)-[c(Na+)-2c(SO42-)]=2c(SO42-);Ka=
=()×10-5 ;
18.(1))粉碎铝土矿或加热或搅拌
(2) SiO2 Mg2+
(3)4.7≤pH<9.6
(4) 硫氰化钾 Fe3+ + 3SCN- Fe(SCN)3
(5)2Al2O3 4Al + 3O2↑
【分析】铝土矿中含有MgO、Fe2O3、Al2O3、SiO2,铝土矿加过量盐酸溶解后,MgO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解,沉淀B为SiO2;向滤液中加入过量NaOH溶液,氯化铁、氯化镁和NaOH发生复分解反应生成Fe(OH)3、Mg(OH)2,则沉淀C为Fe(OH)3、Mg(OH)2,滤液D中含有的阴离子是、Cl-、OH-,向滤液D中通入过量二氧化碳,生成沉淀F为Al(OH)3,滤液E中含有碳酸氢钠,氢氧化铝加热分解生成M为氧化铝,电解熔融氧化铝得到Al。
(1)
粉碎铝土矿或加热或搅拌都可以加快反应速率;
(2)
SiO2难溶于酸,故酸溶后的杂质主要成分为SiO2,溶液C用碱液调pH为4.7≤pH<9.6,使Al3+沉淀而Mg2+不沉淀,故溶液E中的金属离子主要为Mg2+;
(3)
溶液C用碱液调pH的目的是为了使Al3+沉淀而Mg2+不沉淀,所以调pH的范围是4.7≤pH<9.6;
(4)
用硫氰化钾溶液可以检验Fe3+,其反应为Fe3+ + 3SCN- Fe(SCN)3;
(5)
操作⑤是电解制铝,其反应方程式为2Al2O3 4Al + 3O2↑。
19. C(s)+2Cu2S(s)=4Cu(s)+CS2(g)△H=439KJ mol-l 0.02 6.25×10-3 T3>T2>T1 > 103 CD 5CH3OH+6ClO2=6Cl-+5CO2+6H++7H2O NaOH、Na2CO3
【详解】(1) ①C(s)+S2 (g) ═CS2 (g) △H1=150 kJ/mol
②Cu2S(s)+H2 (g) ═2Cu(s)+H2S (g) △H2=59.5 kJ/mol
③2H2S (g) ═2H2 (g) +S2 (g) △H3=170 kJ/mol
由①+②2+③可得:C(s)+2 Cu2S(s)=4 Cu(s)+ CS2 (g) 的△H=150 kJ/mol+(59.5 kJ/mol)2+170 kJ/mol=439 kJ/mol,
因此,本题正确答案是:C(s)+2 Cu2S(s)=4 Cu(s)+ CS2 (g) △H=439KJ mol-l ;
(2)① 2H2S(g)2H2(g)+S2(g),
起始浓度(mol/L) 1 0 0
变化浓度(mol/L) 0.2 0.2 0.1
平衡浓度(mol/L) 0.8 0.2 0.1
T1温度下,0~5min S2(g)的平均反应速率
v(S2)====0.02 mol.L-1.min-1,
反应平衡常数K===6.2510-3,反应是吸热反应,温度越高,反应物的转化率越大,所以温度T1、T2、T3 由高到低的顺序是T1、T2、T3;
因此,本题正确答案是:0.02 ;6.25×10-3 ;T3>T2>T1 ;
②T4温度时,向1L的恒容密闭容器中加入1.8molH2(g)、1.2molS2(g),达到平衡后测得S2(g)和H2S(g)的浓度相等,说明反应正向进行,所以T4高于T1。
因此,本题正确答案是:>;
(3)①坐标(1.2,0.5)时H2C2O4和HC2O4-的含量相同,则K1=c(H+)=10-1.2,坐标(4.2,0.5)时HC2O4-和C2O42-的浓度相等,K2=c(H+)=10-4..2,则==1000,
因此,本题正确答案是:103;
②A、按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,此时三种微粒H2C2O4、HC2O4-、C2O42- 的物质的量分数不是0.5,所以该溶液的pH不是4.2,故A错误;
B、按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故B错误;
C、n(Na2C2O4):n(NaHC2O4)=2:1的溶液中存在物料守恒:3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],所以C选项是正确的;
D. 3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],的溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),存在物料守恒:3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],整理得到:3c(OH-)+c(C2O42-)=3c(H+)+2c(HC2O4-)+5c(H2C2O4),所以D选项是正确的。
因此,本题正确答案是:CD;
(4)①根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水,所以反应方程式为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O,
因此,本题正确答案是:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O;
②若混合溶液中成分为NaOH、Na2CO3时,逐滴加入盐酸,依次发生反应:H++OH-=H2O、CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑,假设NaOH有amol,Na2CO3有bmol,则刚产生气体时,消耗盐酸的物质的量为(a+b)mol,溶液中不再产生气体时,消耗的盐酸的物质的量为(a+2b)mol,因为a+b若混合溶液中成分为NaOH、NaHCO3时,溶液不能大量共存,故不可能;
若混合溶液中成分为NaHCO3、Na2CO3时,逐滴加入盐酸,依次发生反应:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,假设NaHCO3有amol,Na2CO3有bmol,则刚产生气体时,消耗盐酸的物质的量为bmol,溶液中不再产生气体时,消耗的盐酸的物质的量为(a+2b)mol,对应的溶液体积为V2 >2Vl,,故不符合题意;
综上所述,本题正确答案为NaOH、Na2CO3。
因此,本题正确答案是:NaOH、Na2CO3。
20. 10-13 1︰9 a 生成的硫酸钙微溶,降低硫酸根离子的浓度,使平衡向正反应方向移动
【详解】(1) 0.01mol/ L的NaOH溶液的pH为11,则c(H+) = 1×10-11 mol/L,c(OH- ) = 0.01mol/L,Kw=c(H+)×c(OH-)=1x10-13,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液Vb L混合,若所得混合溶液的pH = 10,混合液中碱过量,该温度下氢氧根离子浓度为0.001mo/L,a= 12,氢氧根离子浓度为0.1mol/L, b= 2溶液中氢离子浓度为0.01mol/L,则c(OH- ) = =0.001mo/L,解得:Va︰Vb=1︰9,故答案为:10-13;1︰9;
(2) a、b、c、d四个点,根据反应量的关系,a点恰好消耗H+ ,溶液中只有(NH4)2SO4与Na2SO4,b、c、d三点溶液均含有NH3·H2O, (NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,所以的电离程度最大的是a点, b点溶液呈中性,溶液含有(NH4)2SO4、Na2SO4、NH3·H2O三种成分,a点时c(Na+) =c(SO ),b点时c(Na+) >c(SO ),根据N元素与S元素的关系,可以得出c(SO )>c(NH),故, 故答案为:a,;
(3) ①亚氯酸钠具有氧化性,且溶液呈碱性,所以NaClO2溶液脱硝过程中主要反应的离子方程式为:,②如果采用Ca(ClO)2替代NaClO2,生成硫酸钙微溶物,降低硫酸根离子浓度,促使平衡向正反应方向进行,SO2转化率提高,所以Ca(ClO)2效果好,故答案为:;生成的硫酸钙微溶,降低硫酸根离子的浓度,使平衡向正反应方向移动;
21. 第四周期VA族 173 黑鳞 < < N2H4分子间可以形成氢键,P2H4分子间不能形成氢键 ab 加入盐酸,抑制SbCl3的水解
【详解】(1) 砷在元素周期表中的位置是第四周期VA族,中子数=质量数-质子数=288-115=173,能量越低越稳定,由白磷转化为黑鳞比转化为红磷放热更多,因此黑鳞更稳定;
(2)元素的非金属性越强,其简单氢化物的稳定性越强,氮元素的非金属性强于磷元素,则热稳定性PH3< NH3,N2H4分子间可以形成氢键,P2H4分子间不能形成氢键,则沸点P2H4(3)由题意可知,PH3与卤化氢和N2H4与卤化氢的反应相似,产物的结构和性质也相似,PH3与HI反应产物是 ,含有离子键和共价键,可以发生水解反应,能与氢氧化钠溶液反应,
故答案为:ab;
(4) SbCl3能发生较强烈的水解,生成难溶的SbOCl,发生水解反应的离子方程式为 ,因此配制SbCl3溶液应加入盐酸,抑制SbCl3的水解。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.向氨水滴入等物质的量浓度的盐酸,滴定过程中混合溶液的温度变化如图所示,下列有关说法正确的是
A.由水电离出的:c点>b点
B.的电离程度:a点>b点
C.从b点到c点存在的离子浓度关系一定是:
D.存在于a点到b点之间
2.常温下,向20.00mL 0.1000的溶液中逐滴加入0.1000的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。下列说法错误的是
A.a点所示溶液中:
B.b点所示溶液中:
C.c点所示溶液中:
D.d点所示溶液中:
3.下列实验事实不能证明醋酸是弱电解质的是
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D.相同浓度的盐酸和醋酸,醋酸溶液的导电性比盐酸的弱
4.水溶液呈碱性的盐是
A.KNO3 B.NaHCO3 C.NH4Cl D.NaHSO4
5.下列各溶液中,有关微粒的物质的量浓度关系正确的是
A.10mL的溶液与6mL的盐酸混合:
B.为4的NaHB溶液中:
C.硫酸氢铵溶液中滴加氢氧化钠溶液至溶液恰好呈中性:
D.pH相等的溶液、溶液及溶液中:
6.常温下,将一定量稀硫酸滴入高铁酸钠溶液中,溶液中含铁微粒、、、的物质的量分数随pOH的变化如图[,]。下列说法正确的是
A.曲线Ⅰ表示的变化曲线
B.a、b、c三点水的电离程度相等
C.25℃时,的平衡常数
D.25℃时,的溶液中存在:
7.在相同温度时,浓度均为0.1mol/L的HCl和两种溶液相比较,下列叙述中正确的是(Ka为的电离平衡常数)
A.两溶液的
B.两溶液的导电能力:
C.取1mL上述溶液加水稀释后,Ka增大
D.分别完全中和等物质的量的NaOH时,消耗二者的体积:
8.是一种一元弱酸,常温下,向溶液中逐滴加入浓度为的溶液,溶液中、、中和率(中和率)的变化如图所示。下列说法错误的是
A.a点时,
B.溶液中水的电离程度:c点点
C.b点时,
D.的电离常数为
9.室温下,向20mLNaHX溶液中逐滴滴入NaOH溶液,为由水电离产生的氢离子浓度的负对数,与所加NaOH溶液的体积关系如图所示,下列说法正确的是
A.A点溶液中存在:
B.B、D点溶液均为中性
C.C点溶液中存在:
D.D点溶液中存在:
10.一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是
A.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
B.工业上常用电解熔融MgCl2制备金属镁
C.“氯化”过程中发生的反应为
D.物质X常选用生石灰
二、多选题
11.25℃时,用HCl气体调节0.1mol·L-1碱BOH的pH,体系中粒子浓度的对数值(1gc)、反应物的物质的量之比的关系如图所示。若忽略通入气体后溶液体积的变化,下列说法正确的是
A.25℃时,BOH的电离平衡常数为10-9.25
B.t=0.5,2c(H+)+c(BOH)=2c(OH-)+c(B+)
C.P1所示溶液:c(C1-)<0.05mol·L-1
D.P2所示溶液:c(B+) >100c(BOH)
12.下列说法正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)= c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
D.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的ΔH<0
13.室温下,向20mL0.2mol L-1K2A(H2A:Ka1=1.64×10-3,Ka2=1.0×10-7)溶液中滴加0.2mol L-1的HCl溶液,混合溶液pH与所加HCl溶液体积的关系。下列叙述正确的是
A.a点溶液加水稀释后,促进A2-的水解,pH增大
B.b点溶液存在关系式:c(K+)<c(Cl-)+c(HA-)+2c(A2-)
C.c点溶液中pH最小,所以水的电离程度最大
D.a、b、c三点溶液存在关系式:c(H2A)+c(HA-)+c(A2-)=c(K+)
14.常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/LNaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
已知:常温常压下,
A.a点溶液中,
B.b点所示的溶液中:
C.a、b、c、d、四个点当中,水的电离程度:da=cb
D.d点所示溶液中:
15.痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,形成关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
①HUr(尿酸,aq)Ur-(尿酸根,aq)+H+(aq)
②NaUr(s)Ur-(aq)+Na+(aq)
室温下,将尿酸钠(NaUr)的悬浊液静置,取上层清液滴加盐酸,溶液中尿酸的浓度c(HUr)与pH的关系如图所示。已知Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法不正确的是
A.冬季为关节炎高发期,多在脚趾和手指的关节处,则生成尿酸钠晶体的反应是吸热反应
B.N点时,c(HUr)=c(Cl-)
C.M→N的变化过程中,逐渐减小
D.当某病人尿液中的c(HUr)=c(Ur-)时,该病人的尿液呈酸性
三、实验题
16.某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在___中,再加水稀释,这样操作的目的是___。
(2)通入足量SO2时,装置C中观察到的现象为___。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___。
②检验装置C中有Fe2+生成,可选择的试剂为___。
③该小组同学向装置C反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO,该做法___(填“合理”或“不合理”),理由是__。
(4)装置D中倒置漏斗的作用是___。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有___(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
四、有机推断题
17.甲、乙、丙是都含有同一种元素的不同物质,转化关系如下图:
(1)若甲是CO2。
①常用于泡沫灭火器的是_______(填“乙”或“丙”,下同)。
②浓度均为0.01 mol·L-1的乙溶液和丙溶液中,水的电离程度较大的是_________。
(2)若甲是Al。
①Al的原子结构示意图为__________。
②当n(Al)︰n(NaOH)︰n(H2SO4)=1︰1︰2时,丙的化学式是_________。
(3)若甲是Cl2。
①甲转化为乙的离子方程式是____________。
②已知:TiO2(s)+2Cl2 (g)+2C(s)=TiCl4(l)+2CO(g) △H=-81 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
写出TiO2和Cl2反应生成TiCl4和O2的热化学方程式:_________。
③常温下,将a mol·L-1乙溶液和0.01 mol·L-1H2SO4溶液等体积混合生成丙,溶液呈中性,则丙的电离平衡常数Ka=___________(用含a的代数式表示)。
五、工业流程题
18.天然铝土矿主要成分是Al2O3杂质主要为SiO2、Fe2O3、 MgO等,工业上用天然铝土矿生产铝的工艺流程如图:
已知部分氢氧化物沉淀的pH如下表:
沉淀物 Fe( OH)3 Al( OH)3 Mg(OH)2
开始沉淀时的pH (离子初始浓度为0. 01mol·L-1) 2.2 3.7 9. 6
完全沉淀时的pH (离子浓度<10-5mol·L-1) 3.2 4.7 11.1
请回答下列问题:
(1)为了加快铝土矿和盐酸的反应速率,可以采取的措施为_______(填一种即可);
(2)固体A的主要成分是_______(填化学式),溶液E中的金属离子主要为_______(填化学式);
(3)“溶液C”调节pH的范围为_______;
(4)为了验证“溶液C”中是否含有Fe3+,可取少量“溶液C”于试管中,向其中加入_______溶液(填试剂名称),溶液变成血红色,则证明“溶液C”中有Fe3+,其离子反应方程式为_______;
(5)操作⑤反应的化学方程式为_______。
六、原理综合题
19.利用化学反应原理研究碳、硫及其化合物的性质具有重要意义。
(1)工业上用炭还原辉铜矿(主要成分是Cu2S),可制取金属铜。
已知反应的热化学方程式如下:
C(s)+S2 (g) ═CS2 (g) △H1=150 KJ/mol
Cu2S(s)+H2 (g) ═2Cu(s)+H2S (g) △H2=59.5KJ/mol
2H2S (g) ═2H2 (g) +S2 (g) △H3=170KJ/mol
通过计算,可知用炭还原Cu2S 制取金属铜和CS2(g) 的热化学方程式为___________。
(2)为研究反应2H2S(g)2H2(g)+S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
①向三个体积均为1L的恒容密闭容器中分别加入1molH2S,进行H2S分解实验。不同温度下测得H2S 的转化率与时间的关系如图1所示:
T1温度下,0~5min S2(g)的平均反应速率v(S2)=____________mol.L-1.min-1,反应平衡常数K=_____mol L-1.温度T1、T2、T3由高到低的顺序是__________。
②T4温度时,向1L的恒容密闭容器中加入1.8molH2(g)、1.2molS2(g),达到平衡后测得S2(g)和H2S(g)的浓度相等,则T4_____ T1(填“<”、“=”或“>”)。
(3)T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH 溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42-的物质的量分数(δ) 与pH的关系如图2所示:
①草酸的电离常数分别为K1与K2,则=_____。
②按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,下列有关该溶液的叙述正确的是_____(填序号)。
A.该溶液的pH为4.2
B.3c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
C.3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
D.3c(OH-)+c(C2O42-)=3c(H+)+2c(HC2O4-)+5c(H2C2O4)
(4)含碳的甲醇(CH3OH)的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。
①写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________________。
②常温下,向100 mL0.1mol/L的NaOH溶液中通入一定量的CO2。为探究反应后混合溶液的成分,向其中逐滴加入0.1 mol/L的HCl溶液。溶液产生气体前,消耗V( HCl)=V1;溶液刚好不再产生气体时,消耗V( HCl) =V2。当V1
(2)室温时,向100mL0. 1 mol L-1NH4HSO4溶液中滴加0.1 mol L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是_______:在b点,溶液中阳离子浓度由大到小的排列顺序是_______。
(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为。反应10min后溶液中离子浓度的分析结果如下表。
离子 Cl-
c/(mol L-1)
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_______。
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是_______。
七、结构与性质
21.氮、磷、砷(As)、锑(Sb)、铋(B)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置是__。Mc的中子数为__。
已知:P(s,白磷)=P(s,黑磷)△H=-39.3kJ/mol;P(s,白磷)=P(s,红磷)△H=-17.6kJ/mol,由此推知,其中最稳定的磷单质是__。
(2)氮和磷氢化物性质的比较:
热稳定性:PH3__(填“>”或“<")NH3,沸点:P2H4__(填“>”或“<")N2H4,判断依据是__。
(3)PH3与卤化氢和N2H4与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是__(填序号)。
a.含离子键、共价键 b.能与水发生水解反应 c.不能与NaOH反应
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式__,因此,配制SbCl3溶液应__。
参考答案:
1.D
【详解】A.b点酸碱恰好完全反应生成氯化铵,c点盐酸过量,盐酸抑制水的电离,氯化铵促进水的电离,因此由水电离出的:c点
D.a点是NH4Cl和的混合溶液,,b点是NH4Cl溶液,,随着盐酸加入,溶液中氯离子浓度逐渐增大,因此存在于a点到b点之间,D正确;
答案选D。
2.B
【详解】A.a点所示溶液即NH4Cl溶液中由于离子发生水解呈酸性,故离子浓度大小关系为:,A正确;
B.b点所示溶液为中性溶液即,又根据电荷守恒可知:,故离子浓度大小关系为:,B错误;
C.根据物料守恒可知,在滴定的整个过程中始终有:,故c点所示溶液中:,C正确;
D.d点所示溶液是NH4Cl和NaOH恰好完全反应,此时溶质等物质的量的为NaCl和NH3 H2O,故离子浓度大小关系为:,D正确;
故答案为:B。
3.A
【详解】A.醋酸溶液和盐酸pH相同,则溶液中c(H+)相同,因此分别与同样颗粒大小的锌反应时,产生H2的起始速率相等,这不能证明醋酸是弱电解质,A符合题意;
B.常温下,测得0.1 mol/L醋酸溶液的pH=4,c(H+)=10-4 mol/L<0.1 mol/L,因此可证明醋酸是弱酸,存在电离平衡,B不符合题意;
C.常温下,将pH=1的醋酸溶液稀释1000倍,若醋酸是强酸,则稀释后c(H+)=10-4 mol/L,pH=4,现在测得pH<4,c(H+)>10-4 mol/L,说明又有一部分醋酸分子发生电离产生H+,使溶液中c(H+)增大,故可以证明醋酸是弱酸,C不符合题意;
D.在相同条件下,相同浓度醋酸溶液的导电性比盐酸的弱,说明醋酸溶液中电离产生的自由移动的离子浓度比HCl小,因此可以说明醋酸是弱酸,D不符合题意;
故合理选项是A。
4.B
【详解】A. KNO3完全电离产生钾离子和硝酸根离子,二者均不水解,故溶液呈中性,故A不符合;
B. NaHCO3溶液中,的水解程度大于其电离程度,故溶液呈碱性,故B符合;
C. NH4Cl发生水解反应,使溶液呈酸性,故C不符合;
D. NaHSO4是强电解质,完全电离,,电离产生H+,使溶液呈酸性,故D不符合;
故选B。
5.C
【详解】A.10mL的溶液与6mL的盐酸混合,发生反应,所得溶液中、NaCl、HCl的物质的量之比为,所以,溶液呈酸性,,是弱酸,发生电离,但电离程度不大,所以,故有,A错误;
B.的NaHB溶液pH为4,说明的电离程度大于其水解程度,其电离生成,水解生成,所以,电离程度与水解程度均不大,故,B错误;
C.NH4HSO4溶液中滴加NaOH溶液至溶液恰好呈中性,则加入的氢氧化钠的物质的量大于硫酸氢铵,所以,由物料守恒可知,,所以,
故,C正确;
D.、、均是强酸弱碱盐,三种盐浓度相同时,、、水解得到的H+浓度依次减小,故pH相等的溶液、溶液和溶液中:,D错误;
正确答案选C。
6.C
【分析】稀硫酸逐滴滴入高铁酸钠溶液中,溶液pOH不断增大,OH-的浓度不断减小,H+的浓度不断增大,则的物质的量分数减小,之后的物质的量分数先增大后减小,然后的物质的量分数先增大后减小,最后的物质的量分数增大,故曲线I表示的变化曲线,曲线II表示的变化曲线,曲线III表示的变化曲线,曲线IV表示的变化曲线。
【详解】A.据分析知,曲线Ⅰ表示的变化曲线,A错误;
B.a、b、c三点溶液中微粒成分不同,溶液pOH不同,对水的电离影响程度不同,则水的电离程度不相等,B错误;
C.由a点可知,,所以的,同理可推知的,所以的平衡常数,C正确;
D.根据电荷守恒得,,的溶液中,所以,D错误;
故选C。
7.B
【详解】A.0.1mol/L的HCl溶液和0.1mol/L 溶液,氢离子浓度:,则溶液的,故A错误;
B.0.1mol/L的HCl溶液和0.1mol/L 溶液,离子浓度:,离子浓度越大,导电能力越强,则溶液的导电能力:,故B正确;
C.电离平衡常数Ka只与温度有关,温度不变,平衡常数不变,故C错误;
D.HCl和均为一元酸,分别完全中和等物质的量的NaOH时,消耗二者的物质的量相等,由于二者浓度也相等,则消耗二者的体积:,故D错误;
答案选B。
8.A
【详解】A.a点时lg=0,说明c(HM)=c(M-),又根据电荷守恒可知,c(H+)+c(Na+)=c(OH-)+c(M-),因为此时pH=5.2,则氢离子浓度大于氢氧根离子浓度,则c(Na+)
C.根据电荷守恒可知,c(H+)+c(Na+)=c(OH-)+c(M-),b点时溶液呈酸性,则c(H+)>c(OH-),则c(Na+)
D.a点时c(HM)=c(M-),pH=5.2,则HM电离常数=,D正确;
故答案选A。
9.C
【详解】A.A点溶质为NaHX,既发生电离又发生水解,,则,的电离受到抑制,故的电离大于水解,则溶液中存在,A项错误;
B.B点溶质为NaHX与,D点溶质为与,故D点溶液为碱性,B项错误;
C.C点溶质为,故存在质子守恒:,C项正确;
D.NaHX开始为,后加入溶液,故溶液体积变化,所有离子浓度均变化,故,D项错误;
答案选C。
10.A
【详解】A.煅烧后的产物主要是氧化镁,氧化镁中加稀盐酸后得到氯化镁溶液,但因氯化镁水解,将氯化镁溶液加热蒸发后的产物为氢氧化镁,A错误;
B.因钠镁铝性质活泼,采用电解熔融盐法进行冶炼,制备镁可选用电解熔融氯化镁的方法,B正确;
C.依据流程图,“氯化”过程是氧化镁、碳和氯气发生氧化还原反应生成氯化镁和一氧化碳,C正确;
D.苦卤水中加入物质X的目的是将溶液中的镁离子转化为氢氧化镁沉淀,因此物质X溶于水后应显碱性,生石灰价格便宜且溶于水显碱性,故物质X常选用生石灰,D正确;
答案选A。
11.CD
【分析】HCl是强酸,在调节pH的过程中,若BOH是强碱,则当时,pH应为7,但是当时,pH小于7,溶液显酸性,对应图中点P3,是因为存在水解平衡,故BOH是一元弱碱。
【详解】A.由图可知,当pH=9.25,即c(OH-),lgc(BOH)=lgc(B+),BOH的电离平衡常数为,故A项错误;
B.t=0.5时,溶液中电荷守恒:c(H+)+c(B+)=c(OH-)+c(Cl-),且c(H+)与c(OH-)不相等,所以2c(H+)+c(BOH)不等于2c(OH-)+c(B+),故B项错误;
C.P1所示的溶液中电荷守恒:c(H+)+c(B+)=c(OH-)+c(Cl-),c(H+)=10-9.25 mol·L-1,c(OH-) mol·L-1,,得到c(C1-)<0.05mol·L-1,故C项正确;
D.P2所示溶液,pH=7,溶液呈中性,c(H+)=c(OH-)=10-7,根据,,故D项正确。
故答案选CD。
12.AB
【详解】A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+) + c(M+)= c(OH-) + c(A-),A正确;
B.酸越弱,盐的水解程度越大,相同浓度时pH的关系为NaOH>Na2CO3>CH3COONa,则pH相同时的浓度关系为c(NaOH)<c(Na2CO3)<c(CH3COONa),B正确;
C.1 mol Cl2通入水中,溶液中存在物料守恒,C错误;
D.该反应的ΔS>0,常温下不能自发进行,说明ΔG=ΔH-TΔS>0的,则ΔH>0,D错误;
故选AB。
13.BD
【详解】A.a点溶液中的溶质是,溶液水解呈碱性,加水稀释后水解程度增大,溶液中增大,但是溶液体积增大,所以减小,pH减小,A项错误;
B.b点溶液中的溶质为KHA和KCl,存在的电离和水解,,电离程度大于水解程度,溶液呈酸性,即,根据电荷守恒,B项正确;
C.c点的溶液溶质为KCl和,电离出的抑制了水的电离,溶液中水的电离程度最小,C项错误;
D.根据物料守恒K元素是A元素的两倍,,D项正确;
答案选BD。
14.AB
【分析】将Cl2缓慢通入水中发生反应Cl2+H2OH++Cl-+HClO,向右进行的过程,故a点是HCl和HClO的混合溶液,两种酸都会抑制水的电离,从b点开始滴加氢氧化钠,c点时随着NaOH溶液的加入,反应生成了NaCl和NaClO,其中次氯酸根离子会水解,从而促进水的电离,以此解题。
【详解】A.a点溶液中,氯水没有饱和,没有达到平衡状态,,故A正确;
B.b点所示溶液中发生反应:Cl2+H2OH++Cl-+HClO,HClO为弱电解质,部分电离,故溶液中存在:,故B正确;
C.由分析可知,a点时水的电离被抑制,但是在c点却存在次氯酸根离子,次氯酸根的水解促进了水的电离,故C错误;
D.d点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),根据物料守恒得,c(Cl-)=c(ClO-)+ c(HClO),所以,故D错误;
故选B。
15.AC
【详解】A.关节炎是因为形成了尿酸钠晶体,说明降低温度反应②的平衡向逆反应方向移动,Ksp减小,温度降低平衡逆向移动,说明生成尿酸钠晶体的反应是放热反应,A错误;
B. N点溶液呈中性,溶液中存在c(Na+ )+c(H+ )=c(Cl-)+c(OH- )+c(Ur- ),根据物料守恒:c(Na+ )=c(Ur- ) +c(HUr),则有c(HUr) +c(H+ )= c(Cl- )+c(OH- ),可知c(Cl- )=c(HUr),故 B正确;
C. M→N的变化过程中,溶液中c(HUr)增大,溶液中c(Ur- )减小,c(Na+ )= 增大,则逐渐增大,故C错误;
D.当c(HUr)=c(Ur -)时,Ka(HUr)=c(H+ )=2.0× 10-6 mol/L>=c(OH- ),尿液呈酸性,故D正确;
答案选AC。
16.(1) 浓盐酸 抑制氯化铁水解
(2)溶液由棕黄色变为浅绿色
(3) 2Fe3++SO2+2H2O=SO+4H++2Fe2+ K3[Fe(CN)6] 不合理 硝酸可以将溶解的SO2氧化为H2SO4,干扰实验
(4)使气体充分吸收;防止溶液倒吸
(5)bc
【分析】本题为用题给图示装置进行SO2 与FeCl3溶液反应的相关实验,A装置为SO2发生装置,B装置为安全装置,C装置用于进行SO2 与FeCl3溶液反应,D装置则是SO2尾气处理。SO2 与FeCl3溶液反应可以通过溶液颜色的变化证明,装置C中观察到溶液由棕黄色变为浅绿色。检验Fe3+中存在的Fe2+,可以用K3[Fe(CN)6]溶液,若生成蓝色沉淀,说明有亚铁离子;若将FeCl3溶液改用酸性KMnO4溶液则溶液紫红色逐渐变浅,若该用碘水,则黄色逐渐褪去;D装置采用防倒吸的装置,以此分析解答。
【详解】(1)配制氯化铁溶液时,为了抑制Fe3+的水解,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,故答案为:浓盐酸;抑制氯化铁水解;
(2)SO2时通入FeCl3溶液中时,SO2表现出还原性,能将Fe3+还原为Fe2+,则装置C中观察到的现象为溶液由棕黄色变为浅绿色,故答案为:溶液由棕黄色变为浅绿色;
(3)①根据以上分析可知,装置C中发生SO2与FeCl3溶液反应的离子方程式2Fe3+ + SO2 +2H2O=+4H++2Fe2+;②检验装置C中有Fe2+ 生成的方法为:取少量C中反应后的溶液于试管中,向其中滴入铁氰化钾溶液,若生成蓝色沉淀,说明有亚铁离子;③加入的硝酸可以将溶解的SO2氧化为 H2SO4,会干扰实验,故该做法不合理,故答案为:2Fe3+ + SO2 +2H2O=+4H++2Fe2+ ;K3[Fe(CN)6];不合理; 硝酸可以将溶解的SO2氧化为 H2SO4,干扰实验;
(4)装置D中倒置漏斗能将SO2尾气充分吸收,且能防止溶液倒吸,故答案为:使气体充分吸收;防止溶液倒吸;
(5)要验证SO2具有还原性,应选择具有强氧化性的试剂,且实验过程有明显的实验现象,b、c项试剂均可代替FeCl3溶液。故答案为b、c。
17. 乙 乙 Al2(SO4)3 Cl2+2OH-=Cl-+ClO-+H2O TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H=+140 kJ·mol-1 ()×10-5
【详解】(1)二氧化碳与氢氧化钠反应生成碳酸钠(碳酸氢钠),再与硫酸反应生成硫酸钠,①常用作泡沫灭火器的是NaHCO3,故为乙;②浓度相同的碳酸氢钠溶液和硫酸钠溶液中,HCO3-水解,故乙溶液中水的电离程度大;
(2)金属铝是13号元素,核外电子排布为2、8、3②n(Al)=n(NaOH)时,生成偏铝酸钠,根据方程式:2NaAlO2 + 4H2SO4 =Na2SO4 + Al2(SO4)3 + 4H2O可知,NaAlO2与H2SO4的物质的量之比为1:2,符合题意,故丙的化学式是Al2(SO4)3;
(3)若甲是氯气,与氢氧化钠生成氯化钠和次氯酸钠,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;用方程式①-②,得TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H=-81-(-221)=+140 kJ·mol-1 ;③根据电荷守恒可得到:c(Na+)+c(H+)=c(OH-)+c(ClO-)+2c(SO42-);其中,溶液显中性即c(H+)=c(OH-),故c(Na+)=c(ClO-)+2c(SO42-);又根据物料守恒可得到:c(Na+)=c(ClO-)+c(HClO),即c(ClO-)=c(Na+)-2c(SO42-)、c(HClO)=c(Na+)-c(ClO-)=c(Na+)-[c(Na+)-2c(SO42-)]=2c(SO42-);Ka=
=()×10-5 ;
18.(1))粉碎铝土矿或加热或搅拌
(2) SiO2 Mg2+
(3)4.7≤pH<9.6
(4) 硫氰化钾 Fe3+ + 3SCN- Fe(SCN)3
(5)2Al2O3 4Al + 3O2↑
【分析】铝土矿中含有MgO、Fe2O3、Al2O3、SiO2,铝土矿加过量盐酸溶解后,MgO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解,沉淀B为SiO2;向滤液中加入过量NaOH溶液,氯化铁、氯化镁和NaOH发生复分解反应生成Fe(OH)3、Mg(OH)2,则沉淀C为Fe(OH)3、Mg(OH)2,滤液D中含有的阴离子是、Cl-、OH-,向滤液D中通入过量二氧化碳,生成沉淀F为Al(OH)3,滤液E中含有碳酸氢钠,氢氧化铝加热分解生成M为氧化铝,电解熔融氧化铝得到Al。
(1)
粉碎铝土矿或加热或搅拌都可以加快反应速率;
(2)
SiO2难溶于酸,故酸溶后的杂质主要成分为SiO2,溶液C用碱液调pH为4.7≤pH<9.6,使Al3+沉淀而Mg2+不沉淀,故溶液E中的金属离子主要为Mg2+;
(3)
溶液C用碱液调pH的目的是为了使Al3+沉淀而Mg2+不沉淀,所以调pH的范围是4.7≤pH<9.6;
(4)
用硫氰化钾溶液可以检验Fe3+,其反应为Fe3+ + 3SCN- Fe(SCN)3;
(5)
操作⑤是电解制铝,其反应方程式为2Al2O3 4Al + 3O2↑。
19. C(s)+2Cu2S(s)=4Cu(s)+CS2(g)△H=439KJ mol-l 0.02 6.25×10-3 T3>T2>T1 > 103 CD 5CH3OH+6ClO2=6Cl-+5CO2+6H++7H2O NaOH、Na2CO3
【详解】(1) ①C(s)+S2 (g) ═CS2 (g) △H1=150 kJ/mol
②Cu2S(s)+H2 (g) ═2Cu(s)+H2S (g) △H2=59.5 kJ/mol
③2H2S (g) ═2H2 (g) +S2 (g) △H3=170 kJ/mol
由①+②2+③可得:C(s)+2 Cu2S(s)=4 Cu(s)+ CS2 (g) 的△H=150 kJ/mol+(59.5 kJ/mol)2+170 kJ/mol=439 kJ/mol,
因此,本题正确答案是:C(s)+2 Cu2S(s)=4 Cu(s)+ CS2 (g) △H=439KJ mol-l ;
(2)① 2H2S(g)2H2(g)+S2(g),
起始浓度(mol/L) 1 0 0
变化浓度(mol/L) 0.2 0.2 0.1
平衡浓度(mol/L) 0.8 0.2 0.1
T1温度下,0~5min S2(g)的平均反应速率
v(S2)====0.02 mol.L-1.min-1,
反应平衡常数K===6.2510-3,反应是吸热反应,温度越高,反应物的转化率越大,所以温度T1、T2、T3 由高到低的顺序是T1、T2、T3;
因此,本题正确答案是:0.02 ;6.25×10-3 ;T3>T2>T1 ;
②T4温度时,向1L的恒容密闭容器中加入1.8molH2(g)、1.2molS2(g),达到平衡后测得S2(g)和H2S(g)的浓度相等,说明反应正向进行,所以T4高于T1。
因此,本题正确答案是:>;
(3)①坐标(1.2,0.5)时H2C2O4和HC2O4-的含量相同,则K1=c(H+)=10-1.2,坐标(4.2,0.5)时HC2O4-和C2O42-的浓度相等,K2=c(H+)=10-4..2,则==1000,
因此,本题正确答案是:103;
②A、按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,此时三种微粒H2C2O4、HC2O4-、C2O42- 的物质的量分数不是0.5,所以该溶液的pH不是4.2,故A错误;
B、按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故B错误;
C、n(Na2C2O4):n(NaHC2O4)=2:1的溶液中存在物料守恒:3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],所以C选项是正确的;
D. 3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],的溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),存在物料守恒:3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],整理得到:3c(OH-)+c(C2O42-)=3c(H+)+2c(HC2O4-)+5c(H2C2O4),所以D选项是正确的。
因此,本题正确答案是:CD;
(4)①根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水,所以反应方程式为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O,
因此,本题正确答案是:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O;
②若混合溶液中成分为NaOH、Na2CO3时,逐滴加入盐酸,依次发生反应:H++OH-=H2O、CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑,假设NaOH有amol,Na2CO3有bmol,则刚产生气体时,消耗盐酸的物质的量为(a+b)mol,溶液中不再产生气体时,消耗的盐酸的物质的量为(a+2b)mol,因为a+b
若混合溶液中成分为NaHCO3、Na2CO3时,逐滴加入盐酸,依次发生反应:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,假设NaHCO3有amol,Na2CO3有bmol,则刚产生气体时,消耗盐酸的物质的量为bmol,溶液中不再产生气体时,消耗的盐酸的物质的量为(a+2b)mol,对应的溶液体积为V2 >2Vl,,故不符合题意;
综上所述,本题正确答案为NaOH、Na2CO3。
因此,本题正确答案是:NaOH、Na2CO3。
20. 10-13 1︰9 a 生成的硫酸钙微溶,降低硫酸根离子的浓度,使平衡向正反应方向移动
【详解】(1) 0.01mol/ L的NaOH溶液的pH为11,则c(H+) = 1×10-11 mol/L,c(OH- ) = 0.01mol/L,Kw=c(H+)×c(OH-)=1x10-13,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液Vb L混合,若所得混合溶液的pH = 10,混合液中碱过量,该温度下氢氧根离子浓度为0.001mo/L,a= 12,氢氧根离子浓度为0.1mol/L, b= 2溶液中氢离子浓度为0.01mol/L,则c(OH- ) = =0.001mo/L,解得:Va︰Vb=1︰9,故答案为:10-13;1︰9;
(2) a、b、c、d四个点,根据反应量的关系,a点恰好消耗H+ ,溶液中只有(NH4)2SO4与Na2SO4,b、c、d三点溶液均含有NH3·H2O, (NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,所以的电离程度最大的是a点, b点溶液呈中性,溶液含有(NH4)2SO4、Na2SO4、NH3·H2O三种成分,a点时c(Na+) =c(SO ),b点时c(Na+) >c(SO ),根据N元素与S元素的关系,可以得出c(SO )>c(NH),故, 故答案为:a,;
(3) ①亚氯酸钠具有氧化性,且溶液呈碱性,所以NaClO2溶液脱硝过程中主要反应的离子方程式为:,②如果采用Ca(ClO)2替代NaClO2,生成硫酸钙微溶物,降低硫酸根离子浓度,促使平衡向正反应方向进行,SO2转化率提高,所以Ca(ClO)2效果好,故答案为:;生成的硫酸钙微溶,降低硫酸根离子的浓度,使平衡向正反应方向移动;
21. 第四周期VA族 173 黑鳞 < < N2H4分子间可以形成氢键,P2H4分子间不能形成氢键 ab 加入盐酸,抑制SbCl3的水解
【详解】(1) 砷在元素周期表中的位置是第四周期VA族,中子数=质量数-质子数=288-115=173,能量越低越稳定,由白磷转化为黑鳞比转化为红磷放热更多,因此黑鳞更稳定;
(2)元素的非金属性越强,其简单氢化物的稳定性越强,氮元素的非金属性强于磷元素,则热稳定性PH3< NH3,N2H4分子间可以形成氢键,P2H4分子间不能形成氢键,则沸点P2H4
故答案为:ab;
(4) SbCl3能发生较强烈的水解,生成难溶的SbOCl,发生水解反应的离子方程式为 ,因此配制SbCl3溶液应加入盐酸,抑制SbCl3的水解。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
