6.1.2 化学反应与能量变化 教案(第二课时,表格式) 高中化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.2 化学反应与能量变化 教案(第二课时,表格式) 高中化学人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 665.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-02 18:59:32 | ||
图片预览



文档简介
教 案
教学基本信息
课题 化学反应与能量变化(2)
学科 化学 学段: 高中 年级 高一
教材 书名:普通高中教科书化学必修第二册 出版社:人民教育出版社 出版日期: 2019 年 7 月
教学目标及教学重点、难点
教学目标: 通过实验探究和搭建模型,了解可直接使化学能变为电能的装置——原电池,理解原电池的工作原理。并且结合社会背景,了解原电池的社会价值。 教学重点:原电池的工作原理,原电池的构成条件 教学难点:原电池的工作原理
教学过程(表格描述)
教学环节 主要教学活动 设置意图
环节一: 课程引入 展示电器、能源、电能等相关图片,结合文字叙说电能在当今社会下不可替代的意义。 讲解一次能源与二次能源的定义,让学生了解电能是一种二次能源,需要通过其他形式的能量转化而来,并不能直接获得。 激发学生的兴趣,快速进入课堂,并让学生了解本节课的主题就是电能,并且电能不能直接获得需要转化。为后面引出化学能与电能的关系作出铺垫。
环节二 化学能与电能 给出资料,讲述火力发电是目前社会中,最主要的发电形式,并简单讲解火力发电的原理,和其中的能量转化关系。化学能通常直接转化为热能,燃料中的化学能在火力发电中,经多次转化为电能。 化学能→热能→机械能→电能 2.讲解能量转化过程中是有损失的,并且转化次数越多能量损失越严重。所以提出寻找将化学能直接转化为电能的方法。根据课本,这种方法已经找到,叫做化学电源。 了解火力发电的工作原理,知道化学能与电能的间接转化关系。并且在目前社会中,主要依靠火力发电来获得电能。 讲解能量在转化中的损失,转化次数越多,能量损失越严重。让学生了解火力发电在能量转化中的局限性。引出将化学能直接转化为电能的化学电源。
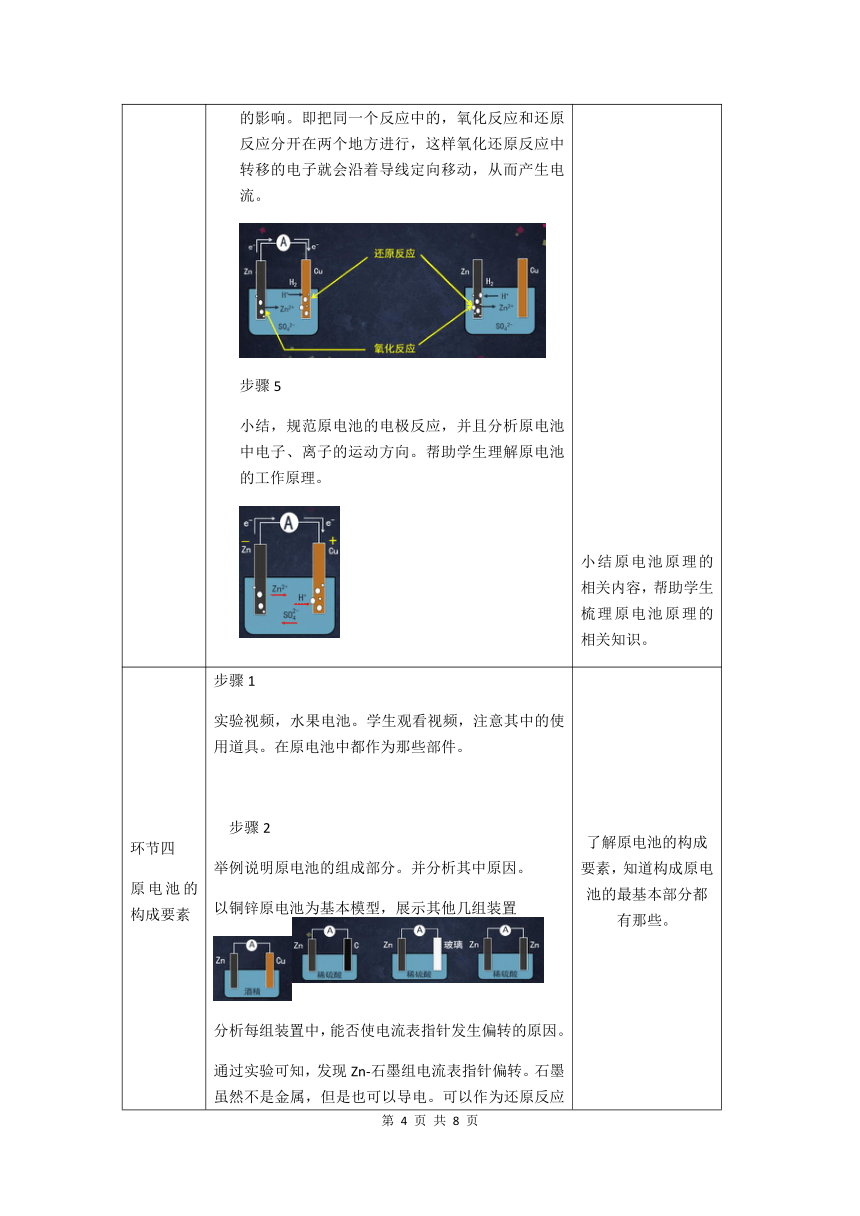
环节三 原电池 世界上第一个电池,伏特电池。并举例说明,伏特电池出现后,其在化学科学上体现的巨大意义。 例如:电解水,电解法制取活泼金属。并提出本节课的主题,这样的装置是如何将化学能直接转化为电能的? 仿照伏特电池,利用铜、锌和稀硫酸,通过视频展示,最基本的铜锌原电池模型。通过观察到对学生来说非常“异常”的现象,对装置中化学反应进行微观分析。 步骤1, 锌直接放入稀硫酸的分析过程。发生氧化还原反应。得失电子均在稀硫酸和锌片的接触面上进行。此时化学能转为热能。将氧化还原反应的得电子部分和失电子部分分开表示为: 氧化反应:Zn – 2e- ==Zn2+ 还原反应:2H+ + 2e- ==H2 步骤2 在锌片旁边放入一个铜片,发现无异常现象,发生的反应一切和上一步骤相同。此步骤主要为下面步骤的对比项。 步骤3(重点) 将放入稀硫酸的锌片和铜片,利用导线和电流计连接起来。 发现铜片会产生气泡这一“异常”现象。结合示意图帮助学生分析铜片上会产生气泡的原因。 气泡是氢气,所以氢气必然由溶液中的氢离子得电子生成,是还原反应:2H+ + 2e- ==H2,此过程除了溶液中的氢离子外还需要电子。但是由于铜并不能和稀硫酸反正反应而给出电子。所以上述还原反应还需要其他电子来源,即锌片。结合第二组的例子说明。锌失去的电子是沿着导线,移动到铜上,与溶液中的氢离子结合生成氢气。 步骤4 结合图例对比,原电池装置对氧化还原反应产生的影响。即把同一个反应中的,氧化反应和还原反应分开在两个地方进行,这样氧化还原反应中转移的电子就会沿着导线定向移动,从而产生电流。 步骤5 小结,规范原电池的电极反应,并且分析原电池中电子、离子的运动方向。帮助学生理解原电池的工作原理。 让学生体会原电池的出现对化学学科所带来的意义。并由此引出接下来的工作原理分析。 通过实验视频所观察到的现象和示意图,分析原电池的工作原理。利用建模的思想帮助学生建立基本的原电池模型。并且帮助学生理解氧化反应和还原反应分开进行的含义。 小结原电池原理的相关内容,帮助学生梳理原电池原理的相关知识。
环节四 原电池的构成要素 步骤1 实验视频,水果电池。学生观看视频,注意其中的使用道具。在原电池中都作为那些部件。 步骤2 举例说明原电池的组成部分。并分析其中原因。 以铜锌原电池为基本模型,展示其他几组装置 分析每组装置中,能否使电流表指针发生偏转的原因。 通过实验可知,发现Zn-石墨组电流表指针偏转。石墨虽然不是金属,但是也可以导电。可以作为还原反应的发生场所。Zn-玻璃组电流表指针不偏转,这是因为,玻璃不能导电,不能作为电子导体,自然也就无法在玻璃电极上发生还原反应。而使用相同材料作为电极的Zn—Zn组,电流表同样指针不偏转。此时并没有电极反应发生。而是锌与硫酸直接发生氧化还原反应。 帮助学生理解电子导体和离子导体在原电池的作用。以及电极材料和电极反应。 步骤3 小结:构成原电池的基本要素 1.合适的电极材料 2.自发进行的电极反应,只有发生电极反应,才会有电子沿着电子导体进行定向移动。 3.电子导体和离子导体,比如整体装置中的导线和电解质溶液。 了解原电池的构成要素,知道构成原电池的最基本部分都有那些。
环节五 化学电源 简单介绍一下日常生活中常见的化学电源。 一次电池——干电池
根据原电池原理,人们研制出了很多结构和性能各异的化学电池,以满足不同的用电需要。 这是常见的锌锰干电池构造图。其中,石墨棒做正极,氯化铵糊作为电解质溶液,锌筒做负极。在使用过程中,电子由锌筒(负极)流向石墨棒(正极),锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。 这种电池放电后不能充电(内部氧化还原反应无法逆向进行),属于一次电池。 随着电池的使用,锌筒不断消耗变薄,可能发生漏液现象,对电器危害极大。所以请及时将经久不用电器中的干电池取出。 二次电池——铅蓄电池,锂离子电池。 有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,是电池恢复到放电前的状态,从而实现放电(此时化学能转化为电能)与充电(此时电能转化为化学能)的循环。 这种充电电池属于二次电池。常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等,目前汽车上使用的多是铅酸蓄电池。 并且从能量角度简述,电池发展对环境和社会的重要意义。化学电池是新能源和可再生能源的重要组成部分。科学技术的进步加速了电池技术的发展、锰锌电池、铅蓄电池等传统电池的性能有了明显提高; 各种高效、安全、环保的新型化学电池不断涌现,其中锂离子电池和燃料电池发展较快。手机、笔记本计算机、照相机和摄像机等电器的电池大多为锂离子电池。 通过身边的实际例子,感受电池出现的巨大意义,帮助学生理解电池,学有所用。
环节6 经典例题解读 例1 判断下列原电池的正极和负极 此题的目的在于帮助学生了解如何快速判断电池的正负极,即根据在体系中更容易失去的电子的一极。 例2 下列关于右图所示装置的叙述,错误的是( ) A.锌是负极,其质量逐渐减小 B.氢离子在铜表面被还原,产生气泡 C.电流从锌片经过导线流向铜片 D.电子从锌片经过导线流向铜片 此题的目的在于,帮助学生熟悉原电池的工作原理,一极简单介绍原电池在微观的工作原理之后,所导致的宏观表现如何分析 例3 把a、b、c、d4种金属浸入到稀硫酸中,用导线两两相连可以组成各种原电池,请根据下列信息,判断四种金属的活动性顺序。 1.若a、b相连,a为负极; 2.若c、d相连,d上有气泡逸出; 3.若a、c相连时,a的质量减少; 4.若b、d相连,b为正极 原电池原理的基本应用之一,帮助学生熟悉原电池原理,将判断正负极,微观上工作原理,宏观上的表象,结合在一起的综合题目。 利用课后习题,帮助学生回顾今天所学的知识,加深印象,学以致用。
教学基本信息
课题 化学反应与能量变化(2)
学科 化学 学段: 高中 年级 高一
教材 书名:普通高中教科书化学必修第二册 出版社:人民教育出版社 出版日期: 2019 年 7 月
教学目标及教学重点、难点
教学目标: 通过实验探究和搭建模型,了解可直接使化学能变为电能的装置——原电池,理解原电池的工作原理。并且结合社会背景,了解原电池的社会价值。 教学重点:原电池的工作原理,原电池的构成条件 教学难点:原电池的工作原理
教学过程(表格描述)
教学环节 主要教学活动 设置意图
环节一: 课程引入 展示电器、能源、电能等相关图片,结合文字叙说电能在当今社会下不可替代的意义。 讲解一次能源与二次能源的定义,让学生了解电能是一种二次能源,需要通过其他形式的能量转化而来,并不能直接获得。 激发学生的兴趣,快速进入课堂,并让学生了解本节课的主题就是电能,并且电能不能直接获得需要转化。为后面引出化学能与电能的关系作出铺垫。
环节二 化学能与电能 给出资料,讲述火力发电是目前社会中,最主要的发电形式,并简单讲解火力发电的原理,和其中的能量转化关系。化学能通常直接转化为热能,燃料中的化学能在火力发电中,经多次转化为电能。 化学能→热能→机械能→电能 2.讲解能量转化过程中是有损失的,并且转化次数越多能量损失越严重。所以提出寻找将化学能直接转化为电能的方法。根据课本,这种方法已经找到,叫做化学电源。 了解火力发电的工作原理,知道化学能与电能的间接转化关系。并且在目前社会中,主要依靠火力发电来获得电能。 讲解能量在转化中的损失,转化次数越多,能量损失越严重。让学生了解火力发电在能量转化中的局限性。引出将化学能直接转化为电能的化学电源。
环节三 原电池 世界上第一个电池,伏特电池。并举例说明,伏特电池出现后,其在化学科学上体现的巨大意义。 例如:电解水,电解法制取活泼金属。并提出本节课的主题,这样的装置是如何将化学能直接转化为电能的? 仿照伏特电池,利用铜、锌和稀硫酸,通过视频展示,最基本的铜锌原电池模型。通过观察到对学生来说非常“异常”的现象,对装置中化学反应进行微观分析。 步骤1, 锌直接放入稀硫酸的分析过程。发生氧化还原反应。得失电子均在稀硫酸和锌片的接触面上进行。此时化学能转为热能。将氧化还原反应的得电子部分和失电子部分分开表示为: 氧化反应:Zn – 2e- ==Zn2+ 还原反应:2H+ + 2e- ==H2 步骤2 在锌片旁边放入一个铜片,发现无异常现象,发生的反应一切和上一步骤相同。此步骤主要为下面步骤的对比项。 步骤3(重点) 将放入稀硫酸的锌片和铜片,利用导线和电流计连接起来。 发现铜片会产生气泡这一“异常”现象。结合示意图帮助学生分析铜片上会产生气泡的原因。 气泡是氢气,所以氢气必然由溶液中的氢离子得电子生成,是还原反应:2H+ + 2e- ==H2,此过程除了溶液中的氢离子外还需要电子。但是由于铜并不能和稀硫酸反正反应而给出电子。所以上述还原反应还需要其他电子来源,即锌片。结合第二组的例子说明。锌失去的电子是沿着导线,移动到铜上,与溶液中的氢离子结合生成氢气。 步骤4 结合图例对比,原电池装置对氧化还原反应产生的影响。即把同一个反应中的,氧化反应和还原反应分开在两个地方进行,这样氧化还原反应中转移的电子就会沿着导线定向移动,从而产生电流。 步骤5 小结,规范原电池的电极反应,并且分析原电池中电子、离子的运动方向。帮助学生理解原电池的工作原理。 让学生体会原电池的出现对化学学科所带来的意义。并由此引出接下来的工作原理分析。 通过实验视频所观察到的现象和示意图,分析原电池的工作原理。利用建模的思想帮助学生建立基本的原电池模型。并且帮助学生理解氧化反应和还原反应分开进行的含义。 小结原电池原理的相关内容,帮助学生梳理原电池原理的相关知识。
环节四 原电池的构成要素 步骤1 实验视频,水果电池。学生观看视频,注意其中的使用道具。在原电池中都作为那些部件。 步骤2 举例说明原电池的组成部分。并分析其中原因。 以铜锌原电池为基本模型,展示其他几组装置 分析每组装置中,能否使电流表指针发生偏转的原因。 通过实验可知,发现Zn-石墨组电流表指针偏转。石墨虽然不是金属,但是也可以导电。可以作为还原反应的发生场所。Zn-玻璃组电流表指针不偏转,这是因为,玻璃不能导电,不能作为电子导体,自然也就无法在玻璃电极上发生还原反应。而使用相同材料作为电极的Zn—Zn组,电流表同样指针不偏转。此时并没有电极反应发生。而是锌与硫酸直接发生氧化还原反应。 帮助学生理解电子导体和离子导体在原电池的作用。以及电极材料和电极反应。 步骤3 小结:构成原电池的基本要素 1.合适的电极材料 2.自发进行的电极反应,只有发生电极反应,才会有电子沿着电子导体进行定向移动。 3.电子导体和离子导体,比如整体装置中的导线和电解质溶液。 了解原电池的构成要素,知道构成原电池的最基本部分都有那些。
环节五 化学电源 简单介绍一下日常生活中常见的化学电源。 一次电池——干电池
根据原电池原理,人们研制出了很多结构和性能各异的化学电池,以满足不同的用电需要。 这是常见的锌锰干电池构造图。其中,石墨棒做正极,氯化铵糊作为电解质溶液,锌筒做负极。在使用过程中,电子由锌筒(负极)流向石墨棒(正极),锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。 这种电池放电后不能充电(内部氧化还原反应无法逆向进行),属于一次电池。 随着电池的使用,锌筒不断消耗变薄,可能发生漏液现象,对电器危害极大。所以请及时将经久不用电器中的干电池取出。 二次电池——铅蓄电池,锂离子电池。 有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,是电池恢复到放电前的状态,从而实现放电(此时化学能转化为电能)与充电(此时电能转化为化学能)的循环。 这种充电电池属于二次电池。常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等,目前汽车上使用的多是铅酸蓄电池。 并且从能量角度简述,电池发展对环境和社会的重要意义。化学电池是新能源和可再生能源的重要组成部分。科学技术的进步加速了电池技术的发展、锰锌电池、铅蓄电池等传统电池的性能有了明显提高; 各种高效、安全、环保的新型化学电池不断涌现,其中锂离子电池和燃料电池发展较快。手机、笔记本计算机、照相机和摄像机等电器的电池大多为锂离子电池。 通过身边的实际例子,感受电池出现的巨大意义,帮助学生理解电池,学有所用。
环节6 经典例题解读 例1 判断下列原电池的正极和负极 此题的目的在于帮助学生了解如何快速判断电池的正负极,即根据在体系中更容易失去的电子的一极。 例2 下列关于右图所示装置的叙述,错误的是( ) A.锌是负极,其质量逐渐减小 B.氢离子在铜表面被还原,产生气泡 C.电流从锌片经过导线流向铜片 D.电子从锌片经过导线流向铜片 此题的目的在于,帮助学生熟悉原电池的工作原理,一极简单介绍原电池在微观的工作原理之后,所导致的宏观表现如何分析 例3 把a、b、c、d4种金属浸入到稀硫酸中,用导线两两相连可以组成各种原电池,请根据下列信息,判断四种金属的活动性顺序。 1.若a、b相连,a为负极; 2.若c、d相连,d上有气泡逸出; 3.若a、c相连时,a的质量减少; 4.若b、d相连,b为正极 原电池原理的基本应用之一,帮助学生熟悉原电池原理,将判断正负极,微观上工作原理,宏观上的表象,结合在一起的综合题目。 利用课后习题,帮助学生回顾今天所学的知识,加深印象,学以致用。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
