2.2.2价层电子对互斥模型 课件(共17张PPT) 2022-2023学年高中化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2.2价层电子对互斥模型 课件(共17张PPT) 2022-2023学年高中化学人教版(2019)选择性必修2 |

|
|
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-31 19:50:16 | ||
图片预览






文档简介
(共17张PPT)
新课程背景下,
基于化学核心素养培养
第二章第2节《分子的空间结构 》
第2课时 价层电子对互斥模型
1.结合实例了解共价分子都有特定的空间构型。
2.能用价层电子对互斥模型预测简单分子或离子的空间构型。
3.发展对理论模型的认知能力, 培养微观空间想象能力和科学态度。
学习目标
第一关:动手关
分别把2个、3个、4个相同大小的气球扎在一起,气球们如何分布,整体更稳定呢?
由于空间拥挤排斥,气球会尽量均匀分散,远离,以达稳定!
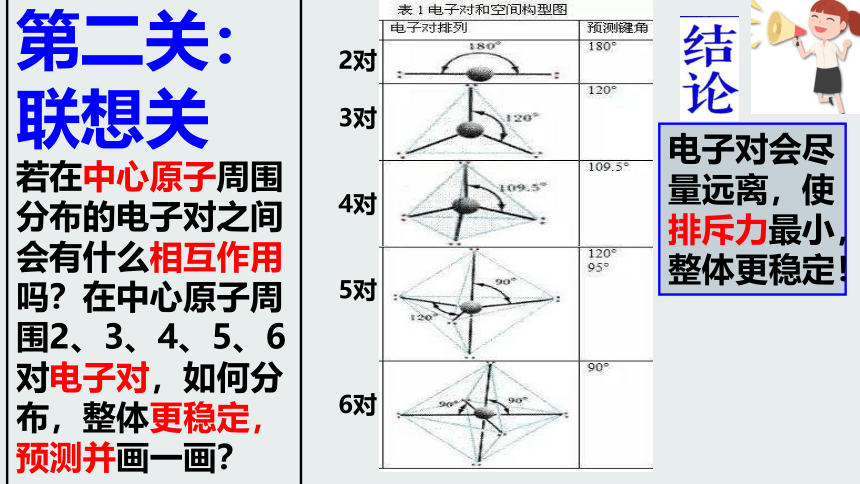
第二关:联想关
若在中心原子周围分布的电子对之间会有什么相互作用吗?在中心原子周围2、3、4、5、6对电子对,如何分布,整体更稳定,预测并画一画?
电子对会尽量远离,使排斥力最小,整体更稳定!
2对
3对
4对
5对
6对
第三关:迁移应用关
①写出CH4 BCl3 BeCl2的电子式,价层电子对?
②根据上节所学,用彩泥牙签分别拼插分子模型,并解释拼插依据,如键角?分子空间构型?
③ “分子的空间构型”如何确定?与什么因素密切相关?
中心原子周围价层电子对间的排斥,决定分子的空间构型。
第四关:变通完善关
①写出NH3 H2O的电子式
②根据上节所学,拼插分子模型,并解释二者构型为何不是“平面三角形”“直线形”?键角?
①参与排斥的价层电子对有两类:
σ键电子对+未成键的孤电子对
②排斥力:孤-孤>孤-σ键>σ键-σ键
抽象
形象直观
联想、类比、分析推理等
领悟学习方法
1.用途:预测和解释分子或离子的空间构型
2.内容:分子的立体构型是中心原子的“价层电子对”相互排斥的结果。使分子立体构型采取电子对排斥最小的那种,即键角最大。以保证分子或离子体系能量最低,最稳定。
σ键电子对和未成键的孤电子对。(不计π键电子对)
中心原子所连原子数(分子式)
电子式或计算公式
第五关:系统认知 VSEPR模型理论
a=中心原子的价电子数=主族序数
(阳离子:a=中心原子的价电子数-电荷数;
阴离子: a=中心原子的价电子数+电荷数)
x = 中心原子所连原子数
b =中心所连原子最多能接受的电子数(如H为1,O为2,N为3,C为4等)
中心原子上的孤电子对数 = (a-xb)
2
1
分子或离子 中心原子 a 中心原子价电子 x 所连原子数 b 中心原子上的孤电子对数
SO2
NH4+
CO32-
S
4
C
N
6
6
2
4
3
2
1
2
1
0
0
【巩固练习1】中心原子上的孤电子对数求算?
2.推理:价层电子对的空间占位 即VSEPR模型
去“孤电子对”
3.推理:外围原子的空间占位 即分子空间构型
确定分子或离子的立体构型的3步骤?
1.计算:价层电子对数
σ键
分子空间构型
VSEPR模型
ABx
孤电子对
相互排斥
V形
三角锥形
平面三角形
2
3
4
四面体形
V形
直线形
?
分子 σ键电子对 孤对电子对 价层电子对数 VSERR模型 分子空间构型
H3O+
ClO3-
CO2
3 1 4 四面体形 三角锥形
2 0 2 直线形 直线形
3 1 4 四面体形 三角锥形
【巩固练习2】分子空间构型的判断?
第六关:应用升级
①甲醛是什么空间构型?
为何∠HCO> ∠HCH?
②NH3和PH3是什么空间构型?
为何∠HNH(107 °)> ∠HPH(93.5 °)?
排斥力:①孤-孤>孤-σ键>σ键-σ键
②三键>双键 > σ单键
③成键电子离核越近,相互间斥力越大
知识要点
一个原理
一个公式
一个理论
一个数据
能量最低原理
价层电子对数
价层电子对互斥模型理论
孤对电子数= (a-xb)
化学学科素养提升
建模
用模
完善模
再用模
互斥
模型
分析常见
分子
应用
推广
通用VSEPR模型
应用
普遍性 变通提升
形象化
直观化
概括化
1.【化学史】早在1940年,希吉维克和坡威尔在总结实验事实的基础上提出了一种简单的理论模型,用以预测简单分子的立体构型。这一理论模型后经吉列思比和尼霍尔姆在20世纪50年代加以发展,定名为价层电子对互斥模型。
2.该理论模型不能用于预测以过渡金属为中心原子的分子。
晶体X射线衍射仪、红外光谱仪等现代仪器可弥补该理论的不足。
寄语
科学精神:批判、探索、求真!
历史的进步需要全人类各尽其力!
加油!
新课程背景下,
基于化学核心素养培养
第二章第2节《分子的空间结构 》
第2课时 价层电子对互斥模型
1.结合实例了解共价分子都有特定的空间构型。
2.能用价层电子对互斥模型预测简单分子或离子的空间构型。
3.发展对理论模型的认知能力, 培养微观空间想象能力和科学态度。
学习目标
第一关:动手关
分别把2个、3个、4个相同大小的气球扎在一起,气球们如何分布,整体更稳定呢?
由于空间拥挤排斥,气球会尽量均匀分散,远离,以达稳定!
第二关:联想关
若在中心原子周围分布的电子对之间会有什么相互作用吗?在中心原子周围2、3、4、5、6对电子对,如何分布,整体更稳定,预测并画一画?
电子对会尽量远离,使排斥力最小,整体更稳定!
2对
3对
4对
5对
6对
第三关:迁移应用关
①写出CH4 BCl3 BeCl2的电子式,价层电子对?
②根据上节所学,用彩泥牙签分别拼插分子模型,并解释拼插依据,如键角?分子空间构型?
③ “分子的空间构型”如何确定?与什么因素密切相关?
中心原子周围价层电子对间的排斥,决定分子的空间构型。
第四关:变通完善关
①写出NH3 H2O的电子式
②根据上节所学,拼插分子模型,并解释二者构型为何不是“平面三角形”“直线形”?键角?
①参与排斥的价层电子对有两类:
σ键电子对+未成键的孤电子对
②排斥力:孤-孤>孤-σ键>σ键-σ键
抽象
形象直观
联想、类比、分析推理等
领悟学习方法
1.用途:预测和解释分子或离子的空间构型
2.内容:分子的立体构型是中心原子的“价层电子对”相互排斥的结果。使分子立体构型采取电子对排斥最小的那种,即键角最大。以保证分子或离子体系能量最低,最稳定。
σ键电子对和未成键的孤电子对。(不计π键电子对)
中心原子所连原子数(分子式)
电子式或计算公式
第五关:系统认知 VSEPR模型理论
a=中心原子的价电子数=主族序数
(阳离子:a=中心原子的价电子数-电荷数;
阴离子: a=中心原子的价电子数+电荷数)
x = 中心原子所连原子数
b =中心所连原子最多能接受的电子数(如H为1,O为2,N为3,C为4等)
中心原子上的孤电子对数 = (a-xb)
2
1
分子或离子 中心原子 a 中心原子价电子 x 所连原子数 b 中心原子上的孤电子对数
SO2
NH4+
CO32-
S
4
C
N
6
6
2
4
3
2
1
2
1
0
0
【巩固练习1】中心原子上的孤电子对数求算?
2.推理:价层电子对的空间占位 即VSEPR模型
去“孤电子对”
3.推理:外围原子的空间占位 即分子空间构型
确定分子或离子的立体构型的3步骤?
1.计算:价层电子对数
σ键
分子空间构型
VSEPR模型
ABx
孤电子对
相互排斥
V形
三角锥形
平面三角形
2
3
4
四面体形
V形
直线形
?
分子 σ键电子对 孤对电子对 价层电子对数 VSERR模型 分子空间构型
H3O+
ClO3-
CO2
3 1 4 四面体形 三角锥形
2 0 2 直线形 直线形
3 1 4 四面体形 三角锥形
【巩固练习2】分子空间构型的判断?
第六关:应用升级
①甲醛是什么空间构型?
为何∠HCO> ∠HCH?
②NH3和PH3是什么空间构型?
为何∠HNH(107 °)> ∠HPH(93.5 °)?
排斥力:①孤-孤>孤-σ键>σ键-σ键
②三键>双键 > σ单键
③成键电子离核越近,相互间斥力越大
知识要点
一个原理
一个公式
一个理论
一个数据
能量最低原理
价层电子对数
价层电子对互斥模型理论
孤对电子数= (a-xb)
化学学科素养提升
建模
用模
完善模
再用模
互斥
模型
分析常见
分子
应用
推广
通用VSEPR模型
应用
普遍性 变通提升
形象化
直观化
概括化
1.【化学史】早在1940年,希吉维克和坡威尔在总结实验事实的基础上提出了一种简单的理论模型,用以预测简单分子的立体构型。这一理论模型后经吉列思比和尼霍尔姆在20世纪50年代加以发展,定名为价层电子对互斥模型。
2.该理论模型不能用于预测以过渡金属为中心原子的分子。
晶体X射线衍射仪、红外光谱仪等现代仪器可弥补该理论的不足。
寄语
科学精神:批判、探索、求真!
历史的进步需要全人类各尽其力!
加油!
