化学人教版九下课前预习练:9.3 溶液的浓度(含答案)
文档属性
| 名称 | 化学人教版九下课前预习练:9.3 溶液的浓度(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 1008.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-31 00:00:00 | ||
图片预览

文档简介
课前预习记录: 月 日 星期
溶液浓度
1.计算式:溶质的质量分数=______
注意(1)上下单位要一致。(2)溶质是指溶液中的溶质,没有溶解的固体或析出的固体不包括在内。(3)溶液是指溶剂与溶解在溶剂中的所有溶质的质量之和。(4)溶质质量分数没有单位。
2.在一定温度下,某物质不饱和溶液的质量分数为a%,饱和溶液的质量分数为b%,溶解度为cg,则a、b、c由大到小的顺序是______________;
3.请根据溶液中有关量的关系完成下表:
溶质质量 溶剂质量 溶液质量 溶质质量分数
______
______
______
4.根据图1、图2中三种固体物质的溶解度曲线回答问题。
(1)分析图1,P点处A、B两种物质的溶解度关系是A__________B(填“>”、“<”或“=”);取一定质量的A的饱和溶液,将溶液温度从t℃降低到10℃,溶液中溶质的质量分数_______(填“增大”、“减小”或“不变”)。
(2)分析图2,要使C的饱和溶液变成不饱和溶液,可采用的方法是:
①_____________________________;②______________________________。
(3)10℃时,A、B、C的饱和溶液中溶质的质量分数由大到小的顺序是_________。
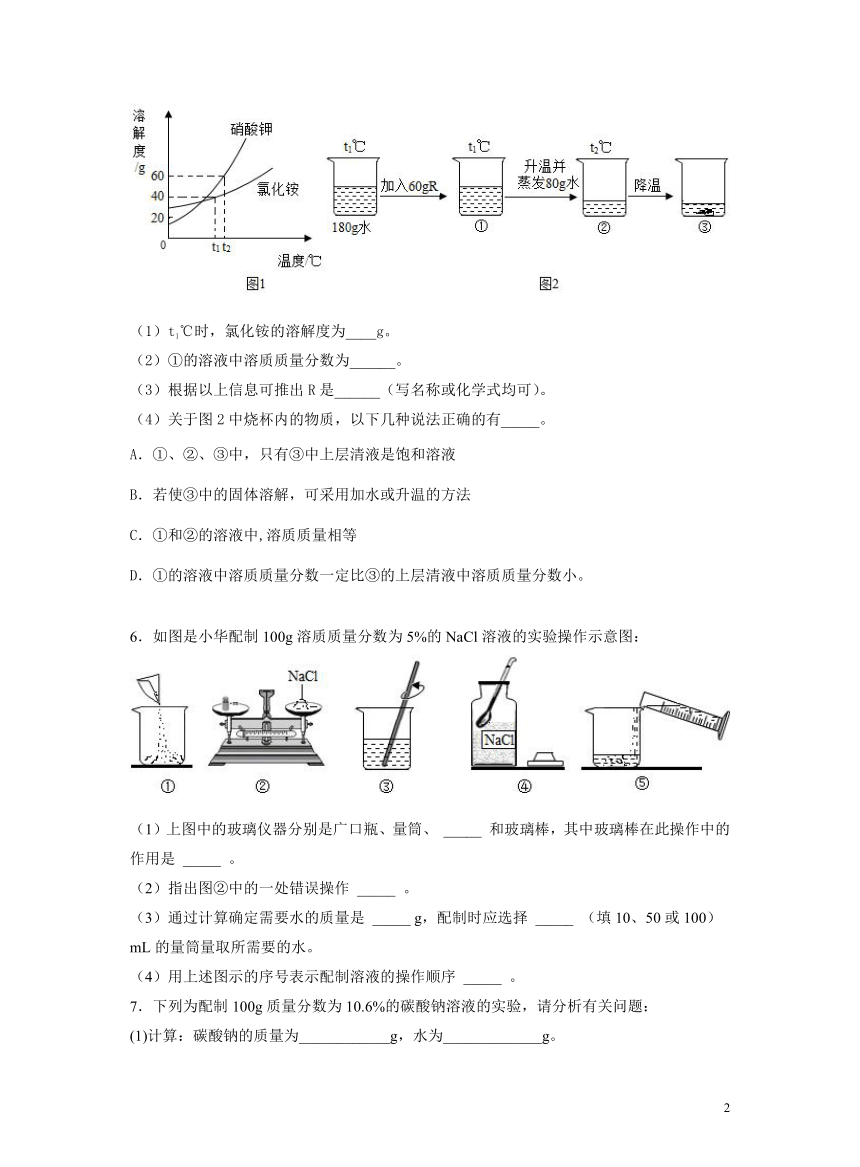
5.R是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示.某化学兴趣小组的同学进行了如图2所示实验。
(1)t1℃时,氯化铵的溶解度为____g。
(2)①的溶液中溶质质量分数为______。
(3)根据以上信息可推出R是______(写名称或化学式均可)。
(4)关于图2中烧杯内的物质,以下几种说法正确的有_____。
A.①、②、③中,只有③中上层清液是饱和溶液
B.若使③中的固体溶解,可采用加水或升温的方法
C.①和②的溶液中,溶质质量相等
D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小。
6.如图是小华配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
(1)上图中的玻璃仪器分别是广口瓶、量筒、 _____ 和玻璃棒,其中玻璃棒在此操作中的作用是 _____ 。
(2)指出图②中的一处错误操作 _____ 。
(3)通过计算确定需要水的质量是 _____ g,配制时应选择 _____ (填10、50或100)mL的量筒量取所需要的水。
(4)用上述图示的序号表示配制溶液的操作顺序 _____ 。
7.下列为配制100g质量分数为10.6%的碳酸钠溶液的实验,请分析有关问题:
(1)计算:碳酸钠的质量为____________g,水为_____________g。
(2)称量:用托盘天平称量, 碳酸钠应放在_____________(填“左盘”或“右盘”)。
(3)溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是________(从下列中选用:10mL、25 mL、50 mL、100 mL);溶解碳酸钠要用到玻璃棒,其作用是_____________。
(4)反思:若称取的碳酸钠中含有水分,则所配制的溶液的质量分数会_____________(填“偏大”、“偏小”或“无影响”)。
参考答案
1. ×100%
【详解】溶液由溶质和溶剂组成,溶质的质量分数是指溶质占溶液的质量百分含量,计算式:溶质的质量分数= ×100%。
2.c>b>a
【详解】试题分析:在一定温度下,某物质不饱和溶液的溶质质量分数<饱和溶液的溶质质量分数,=b%,,故c>b,由于b>a,故c>b>a。
考点:饱和溶液中溶质质量分数与溶解度之间的关系。
3.20% 33.3% 16%
【解析】根据:或:计算即可。
(1);
(2);
(3)。
4.= 减少 降低温度 加溶剂 B>A>C
【详解】(1)P点处A、B两种物质相交于一点,故其溶解度关系是A=B;A的溶解度随温度的降低而减小,将溶液温度从t℃降低到10℃,要析出溶质,仍为饱和溶液;饱和溶液中溶质的质量分数的计算式:×100%,即溶解度越大质量分数也就越大,所以降温后溶液中溶质的质量分数减小;
(2)观察图2可知:C物质的溶解度随温度的升高而减小,所以,要使C的饱和溶液变成不饱和溶液,可采用的方法是增加溶剂、降低温度;
(3)10℃时,A、B、C的溶解度大小顺序是B>A>C,由(1)所得结论:溶解度越大质量分数也就越大,所以10℃时,A、B、C的饱和溶液中溶质的质量分数由大到小的顺序是B>A>C。
5.40 25% 硝酸钾 BC
【详解】根据所学知识和题中信息知,(1)t1℃时,氯化铵的济解度为40g。(2)①的溶液为不饱和溶液,溶质质量分数为∶×100%=25%。(3)根据以上信息可推出R是硝酸钾,蒸发80g水没有晶体析出。A.①、②,③中,②、③中上层清液是饱和溶液。故A错误。B.若使③中的固体溶解,可采用加水或升温的方法。故B正确。C.①和②的溶液中,溶质质量相等。故C正确。D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小,③没有具体温度,无法比较。故D错误。
6.烧杯 搅拌,加速溶解 药品与砝码放错位置 95 100 ④②①⑤③
【详解】(1)图中使用的仪器中,属于玻璃仪器的有:广口瓶、量筒、烧杯、玻璃棒;在溶解过程中用到玻璃棒,玻璃棒的作用是:搅拌,加速溶解;
(2)图中所示的操作中,在称取固体氯化钠时,药品与砝码放反了,属于错误操作;
(3)配制100g溶质质量分数为5%的NaCl溶液需要氯化钠的质量=100g×5%=5g,需要溶剂水的质量=100g-5g=95g(合95mL),因此为了保证量取水的精确度,配制时应选择100 mL的量筒量取所需要的水。
(4)使用固体药品配制溶液步骤:计算、称量、量取、溶解,用上述图示的序号表示配制溶液的操作顺序是:④②①⑤③。
7.10.6 89.4 左盘 100mL 加快溶解 偏小
【详解】(1)∵溶质质量分数=×100%
∴溶质质量=溶液质量×溶质质量分数=100×10.6%=10.6g
溶剂质量=溶液质量-溶质质量=100-10.6=89.4g,故答案为10.6; 89.4
(2)用托盘天平称量固体时应遵循“左物右码“的原则,故答案为左盘
(3)因为需要溶剂的体积为89.4ml,所选量筒的量程要稍大于所需水的体积,所以选100ml的量筒,
溶解碳酸钠时,用玻璃棒搅拌可以加速其溶解.
故答案为100mL; 加快溶解
(4)因为溶质质量分数=×100%,所以若称取的碳酸钠中含有水分,即溶质质量减小,故溶质质量分数偏小,故答案为偏小
1
溶液浓度
1.计算式:溶质的质量分数=______
注意(1)上下单位要一致。(2)溶质是指溶液中的溶质,没有溶解的固体或析出的固体不包括在内。(3)溶液是指溶剂与溶解在溶剂中的所有溶质的质量之和。(4)溶质质量分数没有单位。
2.在一定温度下,某物质不饱和溶液的质量分数为a%,饱和溶液的质量分数为b%,溶解度为cg,则a、b、c由大到小的顺序是______________;
3.请根据溶液中有关量的关系完成下表:
溶质质量 溶剂质量 溶液质量 溶质质量分数
______
______
______
4.根据图1、图2中三种固体物质的溶解度曲线回答问题。
(1)分析图1,P点处A、B两种物质的溶解度关系是A__________B(填“>”、“<”或“=”);取一定质量的A的饱和溶液,将溶液温度从t℃降低到10℃,溶液中溶质的质量分数_______(填“增大”、“减小”或“不变”)。
(2)分析图2,要使C的饱和溶液变成不饱和溶液,可采用的方法是:
①_____________________________;②______________________________。
(3)10℃时,A、B、C的饱和溶液中溶质的质量分数由大到小的顺序是_________。
5.R是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示.某化学兴趣小组的同学进行了如图2所示实验。
(1)t1℃时,氯化铵的溶解度为____g。
(2)①的溶液中溶质质量分数为______。
(3)根据以上信息可推出R是______(写名称或化学式均可)。
(4)关于图2中烧杯内的物质,以下几种说法正确的有_____。
A.①、②、③中,只有③中上层清液是饱和溶液
B.若使③中的固体溶解,可采用加水或升温的方法
C.①和②的溶液中,溶质质量相等
D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小。
6.如图是小华配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
(1)上图中的玻璃仪器分别是广口瓶、量筒、 _____ 和玻璃棒,其中玻璃棒在此操作中的作用是 _____ 。
(2)指出图②中的一处错误操作 _____ 。
(3)通过计算确定需要水的质量是 _____ g,配制时应选择 _____ (填10、50或100)mL的量筒量取所需要的水。
(4)用上述图示的序号表示配制溶液的操作顺序 _____ 。
7.下列为配制100g质量分数为10.6%的碳酸钠溶液的实验,请分析有关问题:
(1)计算:碳酸钠的质量为____________g,水为_____________g。
(2)称量:用托盘天平称量, 碳酸钠应放在_____________(填“左盘”或“右盘”)。
(3)溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是________(从下列中选用:10mL、25 mL、50 mL、100 mL);溶解碳酸钠要用到玻璃棒,其作用是_____________。
(4)反思:若称取的碳酸钠中含有水分,则所配制的溶液的质量分数会_____________(填“偏大”、“偏小”或“无影响”)。
参考答案
1. ×100%
【详解】溶液由溶质和溶剂组成,溶质的质量分数是指溶质占溶液的质量百分含量,计算式:溶质的质量分数= ×100%。
2.c>b>a
【详解】试题分析:在一定温度下,某物质不饱和溶液的溶质质量分数<饱和溶液的溶质质量分数,=b%,,故c>b,由于b>a,故c>b>a。
考点:饱和溶液中溶质质量分数与溶解度之间的关系。
3.20% 33.3% 16%
【解析】根据:或:计算即可。
(1);
(2);
(3)。
4.= 减少 降低温度 加溶剂 B>A>C
【详解】(1)P点处A、B两种物质相交于一点,故其溶解度关系是A=B;A的溶解度随温度的降低而减小,将溶液温度从t℃降低到10℃,要析出溶质,仍为饱和溶液;饱和溶液中溶质的质量分数的计算式:×100%,即溶解度越大质量分数也就越大,所以降温后溶液中溶质的质量分数减小;
(2)观察图2可知:C物质的溶解度随温度的升高而减小,所以,要使C的饱和溶液变成不饱和溶液,可采用的方法是增加溶剂、降低温度;
(3)10℃时,A、B、C的溶解度大小顺序是B>A>C,由(1)所得结论:溶解度越大质量分数也就越大,所以10℃时,A、B、C的饱和溶液中溶质的质量分数由大到小的顺序是B>A>C。
5.40 25% 硝酸钾 BC
【详解】根据所学知识和题中信息知,(1)t1℃时,氯化铵的济解度为40g。(2)①的溶液为不饱和溶液,溶质质量分数为∶×100%=25%。(3)根据以上信息可推出R是硝酸钾,蒸发80g水没有晶体析出。A.①、②,③中,②、③中上层清液是饱和溶液。故A错误。B.若使③中的固体溶解,可采用加水或升温的方法。故B正确。C.①和②的溶液中,溶质质量相等。故C正确。D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小,③没有具体温度,无法比较。故D错误。
6.烧杯 搅拌,加速溶解 药品与砝码放错位置 95 100 ④②①⑤③
【详解】(1)图中使用的仪器中,属于玻璃仪器的有:广口瓶、量筒、烧杯、玻璃棒;在溶解过程中用到玻璃棒,玻璃棒的作用是:搅拌,加速溶解;
(2)图中所示的操作中,在称取固体氯化钠时,药品与砝码放反了,属于错误操作;
(3)配制100g溶质质量分数为5%的NaCl溶液需要氯化钠的质量=100g×5%=5g,需要溶剂水的质量=100g-5g=95g(合95mL),因此为了保证量取水的精确度,配制时应选择100 mL的量筒量取所需要的水。
(4)使用固体药品配制溶液步骤:计算、称量、量取、溶解,用上述图示的序号表示配制溶液的操作顺序是:④②①⑤③。
7.10.6 89.4 左盘 100mL 加快溶解 偏小
【详解】(1)∵溶质质量分数=×100%
∴溶质质量=溶液质量×溶质质量分数=100×10.6%=10.6g
溶剂质量=溶液质量-溶质质量=100-10.6=89.4g,故答案为10.6; 89.4
(2)用托盘天平称量固体时应遵循“左物右码“的原则,故答案为左盘
(3)因为需要溶剂的体积为89.4ml,所选量筒的量程要稍大于所需水的体积,所以选100ml的量筒,
溶解碳酸钠时,用玻璃棒搅拌可以加速其溶解.
故答案为100mL; 加快溶解
(4)因为溶质质量分数=×100%,所以若称取的碳酸钠中含有水分,即溶质质量减小,故溶质质量分数偏小,故答案为偏小
1
同课章节目录
