6.1 化学反应速率与反应限度 综合练习(含答案) 2022-2023学年高一下学期化学苏教版(2019)必修第二册
文档属性
| 名称 | 6.1 化学反应速率与反应限度 综合练习(含答案) 2022-2023学年高一下学期化学苏教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 184.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-02 18:24:07 | ||
图片预览



文档简介
6.1 化学反应速率与反应限度 综合练习
2022-2023学年高一下学期化学苏教版(2019)必修第二册
一、单选题
1.在一定温度下的恒容密闭容器中发生反应:2SO2(g) + O2(g) 2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( )
A.c(SO2):c(O2):c(SO3) = 2:1:2
B.容器内的压强不再改变
C.SO2 的转化率不再改变
D.SO3 的生成速率与 SO3 的消耗速率相等
2.下列现象或做法与化学反应速率无关的是( )
A.“冰墩墩”制作材料生产过程中添加抗老化助剂
B.水果箱中放置乙烯利
C.馒头制作过程中用酵头发酵
D.新冠病毒可能通过气溶胶加速传播
3.如图为反应N2+3H2 2NH3的速率v(N2)变化的图像,则横坐标不可能是( )
A.反应时间 B.温度 C.压强 D.N2的浓度
4.下列有关可逆反应的说法不正确的是( )
A.可逆反应是指在同一条件下能同时向正逆两个方向进行的反应
B.2HI H2+I2是可逆反应
C.CaCO3 CaO+CO2↑是可逆反应
D.存在平衡的不一定是化学反应
5.决定化学反应速率的主要因素是( )
A.反应物的浓度 B.反应体系内的压强
C.反应物的性质 D.反应物的状态
6.把镁条放入有过量稀盐酸的试管中,下列变化不影响氢气产生速率的是( )
A.加少量Na2SO4固体 B.改变盐酸的浓度
C.改变溶液的温度 D.镁条换成镁粉
7.对于100mL 0.5mol/LH2SO4溶液与铁片的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 1.0mol/LH2SO4溶液;③改用300mL 0.5mol/LH2SO4溶液;④用等量铁粉代替铁片;⑤改用质量分数为98%的H2SO4溶液( )
A.①③④ B.①②④ C.①②③④ D.①②③⑤
8.对于在一密闭容器中进行的下列反应:C(s)+ O2(g) CO2(g)下列说法中错误的是 ( )
A.将木炭粉碎成粉末状可以加快化学反应速
B.升高温度可以加快化学反应速率
C.增加压强可以加快化学反应速率
D.增加木炭的量可以加快化学反应速率
9.用锌片与稀硫酸反应制取氢气,下列措施不能使氢气的生成速率增大的是( )
A.加热 B.将锌片改成锌粉
C.滴加少量CuSO4溶液 D.加入适量Na2CO3粉末
10.一定条件下,容积可变的密闭容器中反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是( )
A.υ(正、A2) =2υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.混合气体密度不变
11.用锌粒与2mol·L-1的稀硫酸混合制备氢气时,若向其中分别再加入少量等体积的下列物质:①KCl溶液、②4mol·L-1盐酸、③CuCl2溶液、④4mol·L-1CH3COONa溶液,则加入后反应生成氢气速率的大小顺序是( )
A.③>④>① B.①>②>④ C.②>①>④ D.④>③>②
12.要增大锌与盐酸反应的速率,所采取的下列措施无效的是( )
A.增大盐酸的浓度 B.提高反应的温度
C.用锌粉代替锌片 D.用纯锌代替粗锌
13.用过量铁块与稀硫酸反应制取氢气,采取下列措施:
①将铁块换为等质量的铁粉;
②加入少量NaNO3固体;
③加入少量CuSO4固体;
④加入少量CH3COONa固体;
⑤加热;
⑥将稀硫酸换成98%硫酸,
其中可增大单位时间内氢气收集量的措施有( )
A.①③④ B.①③⑤ C.②④⑤ D.②⑤⑥
14.一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g),一定达到化学平衡状态的是( )
①X,Y,Z的物质的量之比为1:2:2
②X,Y,Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y.
A.①② B.①④ C.②③ D.③④
15.一定温度下,在容积恒定的密闭容器中发生可逆反应A(g)+3B(g) 2C(g),下列叙述一定是达到平衡的标志的是( )
①2υ(B)正=3υ(C)逆;②单位时间内生成a mol A,同时消耗2a mol C;③A、
B、C的浓度不再变化;④混合气体的总压强不再变化;⑤C的质量分数不再改变;⑥用A、
B、C的物质的量浓度变化表示的反应速率之比为1:3:2的状态;⑦A、
B、C的浓度彼此相等;⑧混合气体的密度不再改变的状态
A.①③④⑤ B.①④⑤⑦ C.④⑤⑥⑧ D.③⑤⑥⑦
二、综合题
16.一定温度下,在密闭容器中发生反应 ,正反应速率表达式为(k是正反应速率常数,只与温度有关)。测得正反应速率常数与浓度关系如表所示:
序号
Ⅰ 0.10 0.10 0.15
Ⅱ 0.20 0.20 2.40
Ⅲ 0.20 0.10 1.20
(1)m= ,n= 。
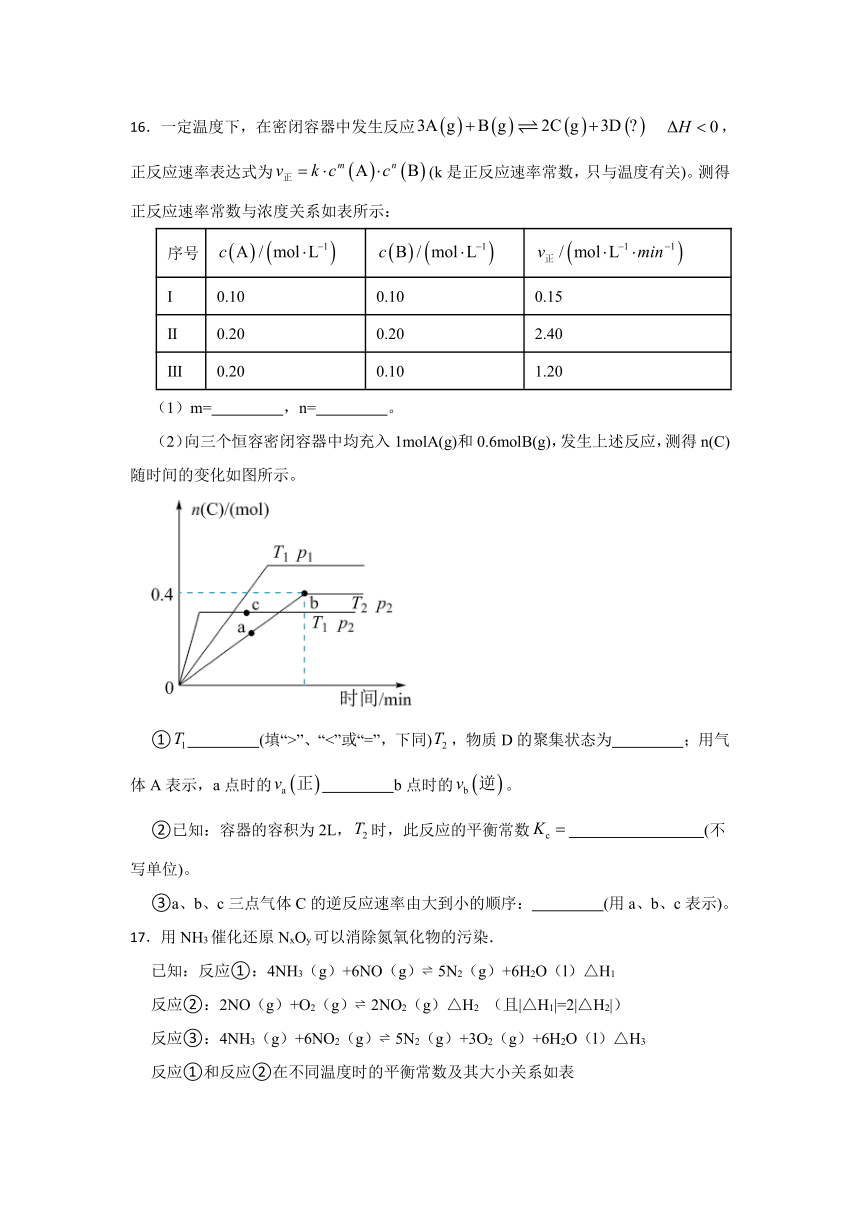
(2)向三个恒容密闭容器中均充入1molA(g)和0.6molB(g),发生上述反应,测得n(C)随时间的变化如图所示。
① (填“>”、“<”或“=”,下同),物质D的聚集状态为 ;用气体A表示,a点时的 b点时的。
②已知:容器的容积为2L,时,此反应的平衡常数 (不写单位)。
③a、b、c三点气体C的逆反应速率由大到小的顺序: (用a、b、c表示)。
17.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(l)△H1
反应②:2NO(g)+O2(g) 2NO2(g)△H2 (且|△H1|=2|△H2|)
反应③:4NH3(g)+6NO2(g) 5N2(g)+3O2(g)+6H2O(l)△H3
反应①和反应②在不同温度时的平衡常数及其大小关系如表
温度/K 反应① 反应② 已知: K2>K1>K2′>K1′
298 K1 K2
398 K1′ K2′
(1)推测反应③是 反应(填“吸热”或“放热”)
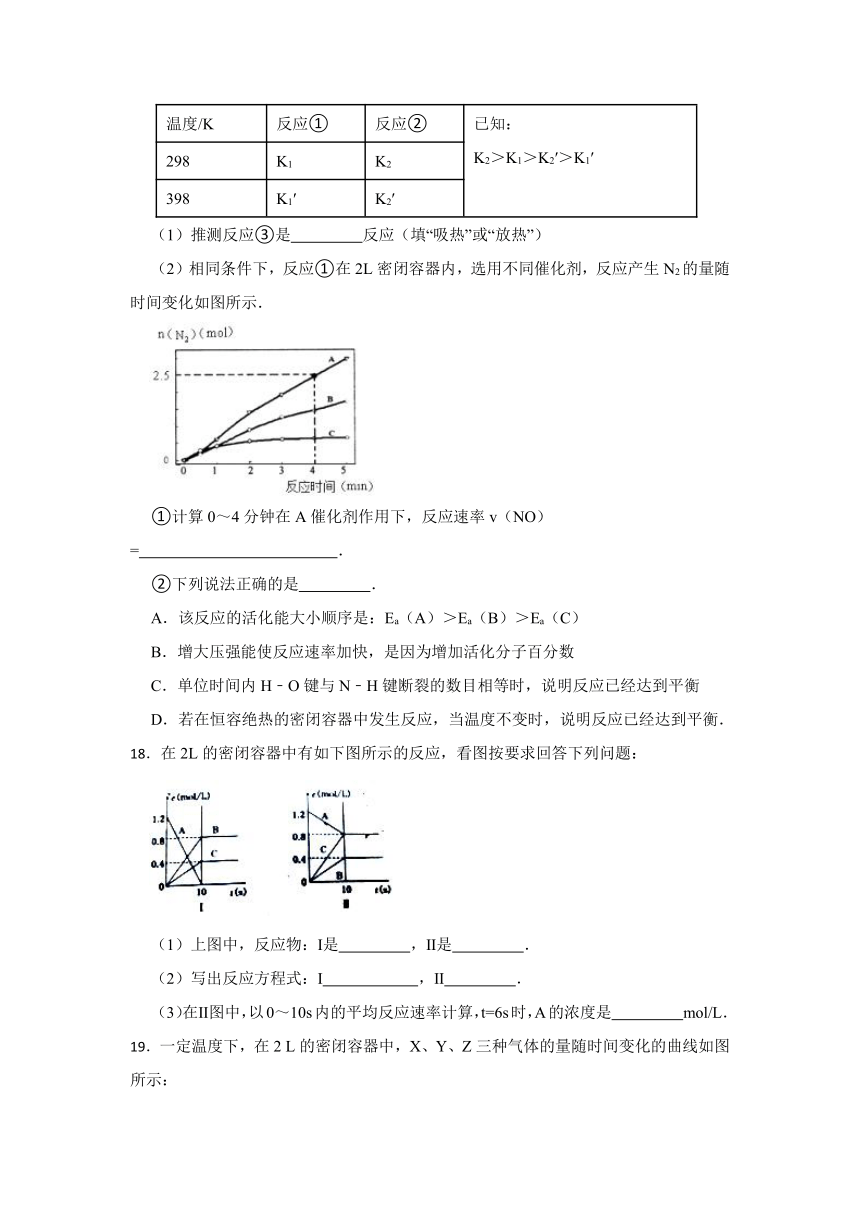
(2)相同条件下,反应①在2L密闭容器内,选用不同催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= .
②下列说法正确的是 .
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加活化分子百分数
C.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当温度不变时,说明反应已经达到平衡.
18.在2L的密闭容器中有如下图所示的反应,看图按要求回答下列问题:
(1)上图中,反应物:Ⅰ是 ,Ⅱ是 .
(2)写出反应方程式:Ⅰ ,Ⅱ .
(3)在Ⅱ图中,以0~10s内的平均反应速率计算,t=6s时,A的浓度是 mol/L.
19.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:
则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
三、实验探究题
20.Na2S2O3用于照相业定影剂、鞣革时重铬酸盐的还原剂等.
(1)Na2S2O3溶液与稀硫酸的反应可探究外界条件对化学反应速率的影响.Na2S2O3溶液与稀硫酸反应的离子方程式为 ;表格中H2O的体积x= ,其中探究温度对化学反应速率的影响的实验是 (填序号).
实验 反应温度/℃ Na2S2O溶液 稀H2SO4 H2O
V/mL c/mol·L-1 V/mL c/mol·L-1 V/mL
Ⅰ 20 10 0.1 10 0.1 0
Ⅱ 20 5 0.2 10 0.2 x
Ⅲ 40 10 0.1 10 0.1 0
(2)工业上可用反应制取Na2S2O3.实验室模拟该工业过程制取Na2S2O3的装置如图所示.
①试管a中的化学方程式为 .
②反应结束后,将试管b中溶液水浴加热浓缩, ,经过滤、乙醇洗涤晶体、干燥,得到。用乙醇而不用水洗涤晶体的原因 .
③测定产品纯度:准确称取mg晶体,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol·L-1碘的标准溶液滴定,反应原理为:。若消耗碘的标准液体积为20.00mL,产品的质量分数为(设相对分子质量为M) (写出计算表达式)
21.草酸与高锰酸钾在酸性条件下能够发生如下反应:
2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别 10%硫酸体积/mL 温度/℃ 其它物质
Ⅰ 2mL 20 /
Ⅱ 2mL 20 10滴饱和MnSO4溶液
Ⅲ 2mL 30 /
Ⅳ 1mL 20 1mL蒸馏水
(1)该反应中氧化剂是 .(填化学式)
(2)对比实验 和 (用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验 和 .
(3)对比实验Ⅰ和Ⅳ,可以研究 对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是 .
答案解析部分
1.【答案】A
【解析】【解答】A. c(SO2):c (O2):c(SO3 ) =2:1:2,只能说明某一时刻各物质的浓度之间的关系,不能说明各物质的物质的量浓度不变,A符合题意;
B. 该反应为反应前后气体的总量发生变化的反应,容器内的压强不再改变时,说明气体的物质的量也不再发生变化,反应达平衡状态, B 不符合题意;
C. SO2的转化率不再改变,说明各物质的量不变,反应达平衡状态,C不符合题意;
D. SO3的生成速率与SO3的消耗速率相等,说明正、逆反应的速率相等,反应达平衡状态, D不符合题意;
故答案为:A。
【分析】当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变。
2.【答案】D
【解析】【解答】A.材料老化过程是化学反应过程,材料生产过程中添加抗老化助剂是为了减缓材料老化速率,故A不符合体题意;
B.水果成熟过程是化学反应过程,水果箱中放置乙烯利是为了加速水果成熟,故B不符合题意;
C.发酵是化学反应过程,馒头制作过程中用酵头发酵,是为了加速发酵速率,故D不符合题意;
D.新冠病毒通过气溶胶传播不是化学反应过程,与化学反应速率无关,故D符合题意;
故答案为:D。
【分析】A.抗老化剂就是减慢反应速率;
B.乙烯是水果催熟剂,加快反应速率;
C.酵头可以加快反应速率;
D.分子在不断的运动。
3.【答案】A
【解析】【解答】由图像可知,氮气的反应速率逐渐增大,升高温度、增大压强、增大N2的浓度都可以增大反应速率,而氮气的反应速率与反应时间无关。
故答案为:A
【分析】本题考查了影响反应速率变化的因素
4.【答案】C
【解析】【解答】A项说法符合可逆反应的概念,正确;
2HI H2+I2在加热条件下可以正逆两个方向进行,B项正确;
CaCO3分解与CaO与CO2反应的条件不同,二者不互为可逆反应,C项错误;
存在平衡的不一定是化学反应,如溶解平衡,D正确。
故答案为:C
【分析】根据可逆反应的定义进行判断,注意需要在相同条件下的两个反应。
5.【答案】C
【解析】【解答】决定化学反应速率的是反应物的性质,温度、浓度、压强、催化剂是外界的影响因素,故C正确。
故答案为:C
【分析】本题考查了化学反应速率的影响因素。解此题的关键是理解影响化学反应速率的内在因素和外在因素。
6.【答案】A
【解析】【解答】A.向试管中加入少量硫酸钠固体,溶液中参加反应的各物质的浓度没有变化,体系温度没有发生变化,氢气产生速率不变,A符合题意;
B.改变盐酸的浓度,改变了单位体积内H+的活化分子数,反应速率改变,氢气产生速率改变,B不符合题意;
C.改变溶液温度,改变了单位体积内反应物的活化分子百分数,反应速率改变,氢气产生速率改变,C不符合题意;
D将镁条改成镁粉,增大了酸与Mg的接触面积,反应速率改变,氢气产生速率改变,D不符合题意;
故答案为:A。
【分析】影响化学反应速率因素有:浓度、温度、固体表面积,是否形成原电池等,从这些方面判断即可
7.【答案】B
【解析】【解答】解:①适当升高温度,增大活化分子百分数,反应速率加快,故正确;
②改用100mL 1.0mol/LH2SO4溶酸,酸的浓度增大,反应速率加快,故正确;
③改用300mL 0.5mol/LH2SO4溶液,酸的浓度不变,反应速率不变,故错误;
④用等量铁粉代替铁片,增大固体接触面积,使反应速率加快,故正确;
⑤改用98%的硫酸,浓硫酸与铁不生成氢气,则不能加快反应速率,故错误;
综上所述,①②④正确;
故选B.
【分析】若要加快产生氢气的速率,可增大反应的浓度、增大固体的表面积、升高温度以及形成原电池反应,注意加入浓硫酸的性质,以此解答该题.
8.【答案】D
【解析】【解答】A.将木炭粉碎成粉末状,接触面积增大,可以加快化学反应速率,A项不符合题意;
B.升高温度,活化分子百分数增大,反应速率加快,B项不符合题意;
C.压强增大,气体的浓度增大,化学反应速率加快,C项不符合题意;
D.木炭为纯固体,增加木炭的量,化学反应速率不变,D项符合题意;
故答案为:D。
【分析】A.增大表面积加快反应速率;
B.升高温度可以增大活化分子百分数;
C.增大压强相等于增大浓度;
D.改变固体、纯液体的用量不能改变反应速率。
9.【答案】D
【解析】【解答】A.加热,温度升高,反应速率加快,A不符合题意;
B.将锌片改成锌粉,固体与液体的接触面积增大,反应速率加快,B不符合题意;
C.滴加少量CuSO4溶液,Zn与CuSO4发生置换反应,形成微型锌铜原电池,反应速率加快,C不符合题意;
D.加入适量Na2CO3粉末,与H2SO4反应,使得溶液中c(H+)减小,反应速率减小,D符合题意;
故答案为:D
【分析】根据反应速率的影响进行分析。
10.【答案】C
【解析】【解答】A.υ(正、A2)不是正反应速率,υ(逆、AB)表示逆反应速率,但不满足速率之比是相应的化学计量数之比,应为2υ(正、A2)=υ(逆、AB),所以不能用来判断是否达到平衡状态,故A不符合题意;
B.因为反应前后气体的体积是不变的,所以压强始终是不变的,不能用压强来判断是否达到平衡状态,故B不符合题意;
C.单位时间内生成2n mol AB的同时,生成n mol的B2,反应速率方向是相反,满足速率之比是相应的化学计量数之比,说明正逆反应速率相等,所以能用来判断是否达到平衡状态,故C符合题意;
D.密度是混合气的质量和容器容积的比值,根据质量守恒,在化学反应前后混合物的质量不变,容器的体积不变,所以密度始终是不变的,所以不能用来判断是否达到平衡状态,故D不符合题意。
故答案为:C。
【分析】化学平衡状态的标志可概括为“一等五不变”:“一等”即正反应速率等于逆反应速率;“五不变”即反应混合物中各组分的浓度保持不变,其意义是指各组分的物质的量不变;各组分的浓度不变;各组分的百分含量不变;反应物的转化率不变。
11.【答案】C
【解析】【解答】①加入KCl溶液,使得溶液中c(H+)减小,反应速率减慢;
②加入4mol/L盐酸,使得溶液中c(H+)增大,反应速率加快;
③加入CuCl2溶液,Zn与CuCl2发生置换反应,产生Cu,形成Zn-Cu原电池,反应速率加快;
④加入4mol/LCH3COONa,CH3COO-与H+反应生成CH3COOH弱酸,溶液中c(H+)减小,反应速率减慢;
因此,加入上述溶液后,反应生成氢气的速率大小关系为:③>②>①>④,C符合题意;
故答案为:C
【分析】此题是对反应速率影响因素探究的考查,结合浓度、原电池反应对反应速率的影响分析。
12.【答案】D
【解析】【解答】解:A.增大盐酸浓度,单位体积活化分子数目增多,反应速率增大,故A不选;
B.提高反应的温度,增大活化分子的百分数,反应的速率加快,故B不选;
C.用锌粉代替锌片,增大固体表面积,反应速率增大,故C不选;
D.用纯锌代替粗锌,反应速率减小,故D选,
故选D.
【分析】用锌粒与稀盐酸反应制取氢气时,增大氢离子的浓度、升高温度、增大接触面积等可加快反应速率,以此来解答.
13.【答案】B
【解析】【解答】解:①将铁块换为等质量的铁粉,固体表面积增大,反应速率增大,故正确;②加入NaNO3固体,因硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气,故错误; ③滴加几滴硫酸铜溶液,生成铜,形成原电池反应,加快反应速率,故正确; ④加CH3COONa固体,生成弱酸,氢离子浓度降低,反应速率减小,故错误;⑤升高温度,反应速率增大,故正确;⑥将稀硫酸换成98.3%硫酸,与铁反应不发生氢气,故错误; 故选B.
【分析】为加快铁与盐酸的反应速率,可增大浓度,升高温度,形成原电池反应或增大固体的表面积,不改变生成氢气的总量,则铁的物质的量应不变,以此解答.
14.【答案】C
【解析】【解答】解:①平衡时各物质的物质的量取决于起始配料比以及转化的程度,不能作为判断是否达到平衡状态的依据,故①错误;
②X、Y、Z的浓度不再发生变化,说明达到化学平衡状态,故②正确;
③反应物和生成物的物质的量不相等,当压强不变时,说明各物质的量不再发生变化,反应达到平衡状态,故③正确;
④单位时间内生成nmolZ,同时生成2nmolY,正逆反应速率不相等,没有达到平衡状态,故④错误.
故选C.
【分析】当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,注意反应物与生成物的化学计量数关系.
15.【答案】A
【解析】【解答】①达到平衡时正逆反应速率比等于系数比,所以2υ(B)正=3υ(C)逆时一定平衡,故①是标志;
②生成A与消耗C都是逆反应速率,单位时间内生成a mol A,同时消耗2a mol C不一定平衡,故②不是标志;
③达到平衡时各物质的浓度保持不变,所以A、B、C的浓度不再变化一定平衡,故③是标志;
④反应前后气体系数和不同,压强是变量,所以混合气体的总压强不再变化一定平衡,故④是标志;
⑤C的质量分数不再改变,说明C的浓度保持不变,一定达到平衡状态,故⑤是标志;
⑥任意时刻用不同物质表示的速率比等于系数比,所以用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2的状态不一定平衡,故⑥不是标志;
⑦浓度保持不变是平衡状态,A、B、C的浓度彼此相等时不一定保持不变,所以A、B、C的浓度彼此相等不一定平衡,故⑦不是标志;
⑧根据 ,该反应中密度是恒量,所以密度不变不一定平衡,故⑧不是标志;
综上所述,一定是达到平衡的标志的是①③④⑤,
故答案为:A。
【分析】可以代表反应达到平衡的标志是正逆反应的速率相等。
16.【答案】(1)3;1
(2)>;气体;>;0.675或;c>b>a
【解析】【解答】(1)将Ⅰ和Ⅲ数据代入正反应速率表达式可得:解得m=3;将Ⅱ和Ⅲ数据代入正反应速率表达式可得:解得n=1。
(2)①比较T1、p2和T2、p2:压强相同,由T1到T2,n(C)增大,平衡正移,由于反应放热,故此过程温度降低,故T1>T2;
比较T1、p1和T1、p2:温度相同,p2时反应速率大于p1,故p2>p1,从p1到p2,n(C)减小,平衡逆移,即压强增大,平衡逆移,故该反应正方向气体系数增大,则D为气体;
a点到b点过程中,n(C)继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故a点的v(正)大于b点的v(正),又b点v(正)=v(逆),所以a点时的v(正)>b点时的v(逆)。
②
=0.675
③b点和c点都处于平衡状态,逆反应速率达到最大值,但c点的温度比b点高,故c>b,又a点到b点过程中,n(C)继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故b大于a,综上a、b、c三点气体C的逆反应速率由大到小的顺序:c>b>a。
【分析】(1)将表中数据代入 计算;
(2)①温度越高反应速率越快,达到平衡的时间越短;温度相同,p2时反应速率大于p1,故p2>p1;
②列出反应的三段式计算;
③温度越高反应速率越大。
17.【答案】(1)吸热
(2)0.375mol L﹣1 min﹣1;CD
【解析】【解答】解:(1)已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I﹣反应II×3得到反应III,则△H3=△H1﹣3△H2,已知|△H1|=2|△H2|,所以△H3=△H1﹣3△H2=|△H2|>0,即反应III为吸热反应,故答案为:吸热;(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,所以v(NO)= = =0.375mol L﹣1 min﹣1,故答案为:0.375mol L﹣1 min﹣1;②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故B错误;
C.单位时间内H﹣O键断裂表示逆速率,N﹣H键断裂表示正速率,单位时间内H﹣O键与N﹣H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,当温度不变时,说明反应已经达到平衡,故D正确;
故答案为:CD.
【分析】(1)已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I﹣反应II×3得到反应III,则△H3=△H1﹣3△H2,据此分析;(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,根据v(NO)= 计算;②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低;
B.改变压强,活化分子百分数不变;
C.单位时间内H﹣O键断裂表示逆速率,N﹣H键断裂表示正速率,正逆速率相同则反应已经达到平衡;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小;
18.【答案】(1)A;A
(2)3A=B+2C;A=B+2C
(3)0.96
【解析】【解答】解:(1)图Ⅰ、Ⅱ分析图象变化可知,都是A的浓度随反应进行不断减小至不变,BC浓度随反应进行二不断增加至不变化,所以A为反应物,BC为生成物;
故答案为:A,A;(2)上述分析和图象变化可知,Ⅰ反应中,10s末,A浓度变化为1.2mol/L,B、C的浓度从0变化为0.4mol/L,0.8mol/L,说明该反应不是可逆反应,c(A):c(B):c(C)=1.2:0.4:0.8=3:1:2,反应的化学方程式为:3A=B+2C;Ⅱ反应中,10s末,A浓度变化为1.2mol/L﹣0.8mol/L=0.4mol/L,B、C的浓度从0变化为0.4mol/L,0.8mol/L,说明该反应不是可逆反应,c(A):c(B):c(C)=0.4:0.4:0.8=1:1:2,反应的化学方程式为:A=B+2C;
故答案为:3A=B+2C,A=B+2C;(3)在Ⅱ图中图象分析可知反应的速率匀速进行,计算10s时A的反应速率V(A)= {#mathmL#}{#/mathmL#} =0.04mol/L s,6s时变化的A的浓度c(A)=6s×V(A)=0.04mol/L s×6s=0.24mol/L,最后得到A的浓度=1.2mol/L﹣变化的A的浓度c(A)=1.2mol/L﹣0.24mol/L=0.96mol/L;
故答案为:0.96mol/L;
【分析】(1)图象分析可知随时间变化,Ⅰ中B、C从0变化为0.4mol/L,0.8mol/L为生成物,A变化为1.2mol/L,Ⅱ中BC增大为生成物,A减小为反应物;(2)依据图象计算得到ABC变化的浓度,变化量等于化学方程式计量数之比,据此书写化学方程式;(3)图象分析可知反应的速率匀速进行,计算10s时A的反应速率V(A),6s时变化的A的浓度c(A)=6s×V(A),最后得到A的浓度=1.2mol/L﹣变化的A的浓度c(A);
19.【答案】(1)0.079 mol·L-1·s-1;0.395 mol·L-1;79.0%
(2)X(g)+Y(g) 2Z(g)
(3)C;D
【解析】【解答】(1)根据化学反应速率数学表达式,v(Z)=1.58/(2×10)mol/(L·s)=0.079mol/(L·s);X减少的浓度为(1.2-0.41)/2mol·L-1=0.395mol·L-1,Y的转化率为(1-0.21)/1×100%=79.0%;(2)X、Y、Z的系数之比为:(1.2-0.41):(1-0.21):1.58=1:1:2,因此化学反应方程式为:X(g)+Y(g) 2Z(g);(3)根据图像,t1时刻化学反应速率增大,但化学平衡不移动,A、增大X浓度,平衡向正反应方向移动,故A错误;
B、升高温度,化学平衡必然改变,故B错误;
C、缩小容器的体积,相当于增大压强,因为反应前后气体系数之和相等,因此增大压强,平衡不移动,但正逆反应速率增大,故C正确;
D、使用催化剂加快反应速率,但平衡不移动,故D正确。
【分析】本题考查化学反应速率的计算以及影响化学平衡移动的因素。
(1)根据化学反应速率的公式计算,再结合图像计算即可得出答案;
(2)同一容器中,化学反应速率之比等于化学计量数之比等于物质的量变化之比;
(3)根据化学反应速率的影响因素分析解答。
20.【答案】(1);5;I和Ⅲ
(2);冷却结晶;降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水份;
【解析】【解答】(1)Na2S2O3溶液与稀硫酸反应生成硫酸钠、硫单质、二氧化硫和水,其离子方程式为;Ⅰ和Ⅱ探究稀硫酸浓度对反应速率的影响,因此其他量相同即溶液的总体积相同,因此表格中H2O的体积x=5,I和Ⅲ只有温度不相同,其他量相同,因此探究温度对化学反应速率的影响的实验是I和Ⅲ;故答案为:;5;I和Ⅲ。
(2)①试管a中是铜和浓硫酸加热条件下反应生成二氧化硫、硫酸铜和水,其化学方程式为;故答案为:。
②反应结束后,从溶液到晶体,因此要将试管b中溶液水浴加热浓缩,冷却结晶,经过滤、乙醇洗涤晶体、干燥,得到。水会溶解少量硫代硫酸钠,为了减少硫代硫酸钠溶解损失,因此用乙醇而不用水洗涤晶体的原因降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水份;故答案为:冷却结晶;降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水份。
③根据题意得到关系式,因此产品中物质的量为0.1000mol·L-1×0.02L×2=0.004mol,其质量分数为;故答案为:。
【分析】(1)探究外界条件对化学反应速率的影响,采用控制变量法进行探究,保持唯一变量原则,所以要保持溶液体积不变
(2)①根据制备硫代硫酸钠的反应,不难判断装置a是制备二氧化硫,b是反应装置,c是尾气吸收
②利用溶解度的差异进行分离物质方法一般是:加热浓缩、冷却结晶、过滤、洗涤,用乙醇洗涤往往考虑到物质易溶于水
③根据反应关系,进行计算即可
21.【答案】(1)MnO4﹣
(2)Ⅰ;Ⅱ;Ⅰ;Ⅲ
(3)浓度;确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同
【解析】【解答】解:(1)2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高,MnO4﹣为氧化剂,H2C2O4为还原剂,故答案为:MnO4﹣;(2)研究催化剂对化学反应速率的影响,应保证温度、浓度相同,则选实验Ⅰ、Ⅱ;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ、Ⅲ,故答案为:Ⅰ;Ⅱ;Ⅰ;Ⅲ;(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,可研究浓度对反应速率的影响,加少量蒸馏水确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同,故答案为:浓度;确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同.
【分析】(1)2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高;(2)研究催化剂对化学反应速率的影响,应保证温度、浓度相同;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同;(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,少量蒸馏水,溶液的体积相同
2022-2023学年高一下学期化学苏教版(2019)必修第二册
一、单选题
1.在一定温度下的恒容密闭容器中发生反应:2SO2(g) + O2(g) 2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( )
A.c(SO2):c(O2):c(SO3) = 2:1:2
B.容器内的压强不再改变
C.SO2 的转化率不再改变
D.SO3 的生成速率与 SO3 的消耗速率相等
2.下列现象或做法与化学反应速率无关的是( )
A.“冰墩墩”制作材料生产过程中添加抗老化助剂
B.水果箱中放置乙烯利
C.馒头制作过程中用酵头发酵
D.新冠病毒可能通过气溶胶加速传播
3.如图为反应N2+3H2 2NH3的速率v(N2)变化的图像,则横坐标不可能是( )
A.反应时间 B.温度 C.压强 D.N2的浓度
4.下列有关可逆反应的说法不正确的是( )
A.可逆反应是指在同一条件下能同时向正逆两个方向进行的反应
B.2HI H2+I2是可逆反应
C.CaCO3 CaO+CO2↑是可逆反应
D.存在平衡的不一定是化学反应
5.决定化学反应速率的主要因素是( )
A.反应物的浓度 B.反应体系内的压强
C.反应物的性质 D.反应物的状态
6.把镁条放入有过量稀盐酸的试管中,下列变化不影响氢气产生速率的是( )
A.加少量Na2SO4固体 B.改变盐酸的浓度
C.改变溶液的温度 D.镁条换成镁粉
7.对于100mL 0.5mol/LH2SO4溶液与铁片的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 1.0mol/LH2SO4溶液;③改用300mL 0.5mol/LH2SO4溶液;④用等量铁粉代替铁片;⑤改用质量分数为98%的H2SO4溶液( )
A.①③④ B.①②④ C.①②③④ D.①②③⑤
8.对于在一密闭容器中进行的下列反应:C(s)+ O2(g) CO2(g)下列说法中错误的是 ( )
A.将木炭粉碎成粉末状可以加快化学反应速
B.升高温度可以加快化学反应速率
C.增加压强可以加快化学反应速率
D.增加木炭的量可以加快化学反应速率
9.用锌片与稀硫酸反应制取氢气,下列措施不能使氢气的生成速率增大的是( )
A.加热 B.将锌片改成锌粉
C.滴加少量CuSO4溶液 D.加入适量Na2CO3粉末
10.一定条件下,容积可变的密闭容器中反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是( )
A.υ(正、A2) =2υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.混合气体密度不变
11.用锌粒与2mol·L-1的稀硫酸混合制备氢气时,若向其中分别再加入少量等体积的下列物质:①KCl溶液、②4mol·L-1盐酸、③CuCl2溶液、④4mol·L-1CH3COONa溶液,则加入后反应生成氢气速率的大小顺序是( )
A.③>④>① B.①>②>④ C.②>①>④ D.④>③>②
12.要增大锌与盐酸反应的速率,所采取的下列措施无效的是( )
A.增大盐酸的浓度 B.提高反应的温度
C.用锌粉代替锌片 D.用纯锌代替粗锌
13.用过量铁块与稀硫酸反应制取氢气,采取下列措施:
①将铁块换为等质量的铁粉;
②加入少量NaNO3固体;
③加入少量CuSO4固体;
④加入少量CH3COONa固体;
⑤加热;
⑥将稀硫酸换成98%硫酸,
其中可增大单位时间内氢气收集量的措施有( )
A.①③④ B.①③⑤ C.②④⑤ D.②⑤⑥
14.一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g),一定达到化学平衡状态的是( )
①X,Y,Z的物质的量之比为1:2:2
②X,Y,Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y.
A.①② B.①④ C.②③ D.③④
15.一定温度下,在容积恒定的密闭容器中发生可逆反应A(g)+3B(g) 2C(g),下列叙述一定是达到平衡的标志的是( )
①2υ(B)正=3υ(C)逆;②单位时间内生成a mol A,同时消耗2a mol C;③A、
B、C的浓度不再变化;④混合气体的总压强不再变化;⑤C的质量分数不再改变;⑥用A、
B、C的物质的量浓度变化表示的反应速率之比为1:3:2的状态;⑦A、
B、C的浓度彼此相等;⑧混合气体的密度不再改变的状态
A.①③④⑤ B.①④⑤⑦ C.④⑤⑥⑧ D.③⑤⑥⑦
二、综合题
16.一定温度下,在密闭容器中发生反应 ,正反应速率表达式为(k是正反应速率常数,只与温度有关)。测得正反应速率常数与浓度关系如表所示:
序号
Ⅰ 0.10 0.10 0.15
Ⅱ 0.20 0.20 2.40
Ⅲ 0.20 0.10 1.20
(1)m= ,n= 。
(2)向三个恒容密闭容器中均充入1molA(g)和0.6molB(g),发生上述反应,测得n(C)随时间的变化如图所示。
① (填“>”、“<”或“=”,下同),物质D的聚集状态为 ;用气体A表示,a点时的 b点时的。
②已知:容器的容积为2L,时,此反应的平衡常数 (不写单位)。
③a、b、c三点气体C的逆反应速率由大到小的顺序: (用a、b、c表示)。
17.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(l)△H1
反应②:2NO(g)+O2(g) 2NO2(g)△H2 (且|△H1|=2|△H2|)
反应③:4NH3(g)+6NO2(g) 5N2(g)+3O2(g)+6H2O(l)△H3
反应①和反应②在不同温度时的平衡常数及其大小关系如表
温度/K 反应① 反应② 已知: K2>K1>K2′>K1′
298 K1 K2
398 K1′ K2′
(1)推测反应③是 反应(填“吸热”或“放热”)
(2)相同条件下,反应①在2L密闭容器内,选用不同催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= .
②下列说法正确的是 .
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加活化分子百分数
C.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当温度不变时,说明反应已经达到平衡.
18.在2L的密闭容器中有如下图所示的反应,看图按要求回答下列问题:
(1)上图中,反应物:Ⅰ是 ,Ⅱ是 .
(2)写出反应方程式:Ⅰ ,Ⅱ .
(3)在Ⅱ图中,以0~10s内的平均反应速率计算,t=6s时,A的浓度是 mol/L.
19.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:
则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
三、实验探究题
20.Na2S2O3用于照相业定影剂、鞣革时重铬酸盐的还原剂等.
(1)Na2S2O3溶液与稀硫酸的反应可探究外界条件对化学反应速率的影响.Na2S2O3溶液与稀硫酸反应的离子方程式为 ;表格中H2O的体积x= ,其中探究温度对化学反应速率的影响的实验是 (填序号).
实验 反应温度/℃ Na2S2O溶液 稀H2SO4 H2O
V/mL c/mol·L-1 V/mL c/mol·L-1 V/mL
Ⅰ 20 10 0.1 10 0.1 0
Ⅱ 20 5 0.2 10 0.2 x
Ⅲ 40 10 0.1 10 0.1 0
(2)工业上可用反应制取Na2S2O3.实验室模拟该工业过程制取Na2S2O3的装置如图所示.
①试管a中的化学方程式为 .
②反应结束后,将试管b中溶液水浴加热浓缩, ,经过滤、乙醇洗涤晶体、干燥,得到。用乙醇而不用水洗涤晶体的原因 .
③测定产品纯度:准确称取mg晶体,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol·L-1碘的标准溶液滴定,反应原理为:。若消耗碘的标准液体积为20.00mL,产品的质量分数为(设相对分子质量为M) (写出计算表达式)
21.草酸与高锰酸钾在酸性条件下能够发生如下反应:
2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别 10%硫酸体积/mL 温度/℃ 其它物质
Ⅰ 2mL 20 /
Ⅱ 2mL 20 10滴饱和MnSO4溶液
Ⅲ 2mL 30 /
Ⅳ 1mL 20 1mL蒸馏水
(1)该反应中氧化剂是 .(填化学式)
(2)对比实验 和 (用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验 和 .
(3)对比实验Ⅰ和Ⅳ,可以研究 对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是 .
答案解析部分
1.【答案】A
【解析】【解答】A. c(SO2):c (O2):c(SO3 ) =2:1:2,只能说明某一时刻各物质的浓度之间的关系,不能说明各物质的物质的量浓度不变,A符合题意;
B. 该反应为反应前后气体的总量发生变化的反应,容器内的压强不再改变时,说明气体的物质的量也不再发生变化,反应达平衡状态, B 不符合题意;
C. SO2的转化率不再改变,说明各物质的量不变,反应达平衡状态,C不符合题意;
D. SO3的生成速率与SO3的消耗速率相等,说明正、逆反应的速率相等,反应达平衡状态, D不符合题意;
故答案为:A。
【分析】当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变。
2.【答案】D
【解析】【解答】A.材料老化过程是化学反应过程,材料生产过程中添加抗老化助剂是为了减缓材料老化速率,故A不符合体题意;
B.水果成熟过程是化学反应过程,水果箱中放置乙烯利是为了加速水果成熟,故B不符合题意;
C.发酵是化学反应过程,馒头制作过程中用酵头发酵,是为了加速发酵速率,故D不符合题意;
D.新冠病毒通过气溶胶传播不是化学反应过程,与化学反应速率无关,故D符合题意;
故答案为:D。
【分析】A.抗老化剂就是减慢反应速率;
B.乙烯是水果催熟剂,加快反应速率;
C.酵头可以加快反应速率;
D.分子在不断的运动。
3.【答案】A
【解析】【解答】由图像可知,氮气的反应速率逐渐增大,升高温度、增大压强、增大N2的浓度都可以增大反应速率,而氮气的反应速率与反应时间无关。
故答案为:A
【分析】本题考查了影响反应速率变化的因素
4.【答案】C
【解析】【解答】A项说法符合可逆反应的概念,正确;
2HI H2+I2在加热条件下可以正逆两个方向进行,B项正确;
CaCO3分解与CaO与CO2反应的条件不同,二者不互为可逆反应,C项错误;
存在平衡的不一定是化学反应,如溶解平衡,D正确。
故答案为:C
【分析】根据可逆反应的定义进行判断,注意需要在相同条件下的两个反应。
5.【答案】C
【解析】【解答】决定化学反应速率的是反应物的性质,温度、浓度、压强、催化剂是外界的影响因素,故C正确。
故答案为:C
【分析】本题考查了化学反应速率的影响因素。解此题的关键是理解影响化学反应速率的内在因素和外在因素。
6.【答案】A
【解析】【解答】A.向试管中加入少量硫酸钠固体,溶液中参加反应的各物质的浓度没有变化,体系温度没有发生变化,氢气产生速率不变,A符合题意;
B.改变盐酸的浓度,改变了单位体积内H+的活化分子数,反应速率改变,氢气产生速率改变,B不符合题意;
C.改变溶液温度,改变了单位体积内反应物的活化分子百分数,反应速率改变,氢气产生速率改变,C不符合题意;
D将镁条改成镁粉,增大了酸与Mg的接触面积,反应速率改变,氢气产生速率改变,D不符合题意;
故答案为:A。
【分析】影响化学反应速率因素有:浓度、温度、固体表面积,是否形成原电池等,从这些方面判断即可
7.【答案】B
【解析】【解答】解:①适当升高温度,增大活化分子百分数,反应速率加快,故正确;
②改用100mL 1.0mol/LH2SO4溶酸,酸的浓度增大,反应速率加快,故正确;
③改用300mL 0.5mol/LH2SO4溶液,酸的浓度不变,反应速率不变,故错误;
④用等量铁粉代替铁片,增大固体接触面积,使反应速率加快,故正确;
⑤改用98%的硫酸,浓硫酸与铁不生成氢气,则不能加快反应速率,故错误;
综上所述,①②④正确;
故选B.
【分析】若要加快产生氢气的速率,可增大反应的浓度、增大固体的表面积、升高温度以及形成原电池反应,注意加入浓硫酸的性质,以此解答该题.
8.【答案】D
【解析】【解答】A.将木炭粉碎成粉末状,接触面积增大,可以加快化学反应速率,A项不符合题意;
B.升高温度,活化分子百分数增大,反应速率加快,B项不符合题意;
C.压强增大,气体的浓度增大,化学反应速率加快,C项不符合题意;
D.木炭为纯固体,增加木炭的量,化学反应速率不变,D项符合题意;
故答案为:D。
【分析】A.增大表面积加快反应速率;
B.升高温度可以增大活化分子百分数;
C.增大压强相等于增大浓度;
D.改变固体、纯液体的用量不能改变反应速率。
9.【答案】D
【解析】【解答】A.加热,温度升高,反应速率加快,A不符合题意;
B.将锌片改成锌粉,固体与液体的接触面积增大,反应速率加快,B不符合题意;
C.滴加少量CuSO4溶液,Zn与CuSO4发生置换反应,形成微型锌铜原电池,反应速率加快,C不符合题意;
D.加入适量Na2CO3粉末,与H2SO4反应,使得溶液中c(H+)减小,反应速率减小,D符合题意;
故答案为:D
【分析】根据反应速率的影响进行分析。
10.【答案】C
【解析】【解答】A.υ(正、A2)不是正反应速率,υ(逆、AB)表示逆反应速率,但不满足速率之比是相应的化学计量数之比,应为2υ(正、A2)=υ(逆、AB),所以不能用来判断是否达到平衡状态,故A不符合题意;
B.因为反应前后气体的体积是不变的,所以压强始终是不变的,不能用压强来判断是否达到平衡状态,故B不符合题意;
C.单位时间内生成2n mol AB的同时,生成n mol的B2,反应速率方向是相反,满足速率之比是相应的化学计量数之比,说明正逆反应速率相等,所以能用来判断是否达到平衡状态,故C符合题意;
D.密度是混合气的质量和容器容积的比值,根据质量守恒,在化学反应前后混合物的质量不变,容器的体积不变,所以密度始终是不变的,所以不能用来判断是否达到平衡状态,故D不符合题意。
故答案为:C。
【分析】化学平衡状态的标志可概括为“一等五不变”:“一等”即正反应速率等于逆反应速率;“五不变”即反应混合物中各组分的浓度保持不变,其意义是指各组分的物质的量不变;各组分的浓度不变;各组分的百分含量不变;反应物的转化率不变。
11.【答案】C
【解析】【解答】①加入KCl溶液,使得溶液中c(H+)减小,反应速率减慢;
②加入4mol/L盐酸,使得溶液中c(H+)增大,反应速率加快;
③加入CuCl2溶液,Zn与CuCl2发生置换反应,产生Cu,形成Zn-Cu原电池,反应速率加快;
④加入4mol/LCH3COONa,CH3COO-与H+反应生成CH3COOH弱酸,溶液中c(H+)减小,反应速率减慢;
因此,加入上述溶液后,反应生成氢气的速率大小关系为:③>②>①>④,C符合题意;
故答案为:C
【分析】此题是对反应速率影响因素探究的考查,结合浓度、原电池反应对反应速率的影响分析。
12.【答案】D
【解析】【解答】解:A.增大盐酸浓度,单位体积活化分子数目增多,反应速率增大,故A不选;
B.提高反应的温度,增大活化分子的百分数,反应的速率加快,故B不选;
C.用锌粉代替锌片,增大固体表面积,反应速率增大,故C不选;
D.用纯锌代替粗锌,反应速率减小,故D选,
故选D.
【分析】用锌粒与稀盐酸反应制取氢气时,增大氢离子的浓度、升高温度、增大接触面积等可加快反应速率,以此来解答.
13.【答案】B
【解析】【解答】解:①将铁块换为等质量的铁粉,固体表面积增大,反应速率增大,故正确;②加入NaNO3固体,因硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气,故错误; ③滴加几滴硫酸铜溶液,生成铜,形成原电池反应,加快反应速率,故正确; ④加CH3COONa固体,生成弱酸,氢离子浓度降低,反应速率减小,故错误;⑤升高温度,反应速率增大,故正确;⑥将稀硫酸换成98.3%硫酸,与铁反应不发生氢气,故错误; 故选B.
【分析】为加快铁与盐酸的反应速率,可增大浓度,升高温度,形成原电池反应或增大固体的表面积,不改变生成氢气的总量,则铁的物质的量应不变,以此解答.
14.【答案】C
【解析】【解答】解:①平衡时各物质的物质的量取决于起始配料比以及转化的程度,不能作为判断是否达到平衡状态的依据,故①错误;
②X、Y、Z的浓度不再发生变化,说明达到化学平衡状态,故②正确;
③反应物和生成物的物质的量不相等,当压强不变时,说明各物质的量不再发生变化,反应达到平衡状态,故③正确;
④单位时间内生成nmolZ,同时生成2nmolY,正逆反应速率不相等,没有达到平衡状态,故④错误.
故选C.
【分析】当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,注意反应物与生成物的化学计量数关系.
15.【答案】A
【解析】【解答】①达到平衡时正逆反应速率比等于系数比,所以2υ(B)正=3υ(C)逆时一定平衡,故①是标志;
②生成A与消耗C都是逆反应速率,单位时间内生成a mol A,同时消耗2a mol C不一定平衡,故②不是标志;
③达到平衡时各物质的浓度保持不变,所以A、B、C的浓度不再变化一定平衡,故③是标志;
④反应前后气体系数和不同,压强是变量,所以混合气体的总压强不再变化一定平衡,故④是标志;
⑤C的质量分数不再改变,说明C的浓度保持不变,一定达到平衡状态,故⑤是标志;
⑥任意时刻用不同物质表示的速率比等于系数比,所以用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2的状态不一定平衡,故⑥不是标志;
⑦浓度保持不变是平衡状态,A、B、C的浓度彼此相等时不一定保持不变,所以A、B、C的浓度彼此相等不一定平衡,故⑦不是标志;
⑧根据 ,该反应中密度是恒量,所以密度不变不一定平衡,故⑧不是标志;
综上所述,一定是达到平衡的标志的是①③④⑤,
故答案为:A。
【分析】可以代表反应达到平衡的标志是正逆反应的速率相等。
16.【答案】(1)3;1
(2)>;气体;>;0.675或;c>b>a
【解析】【解答】(1)将Ⅰ和Ⅲ数据代入正反应速率表达式可得:解得m=3;将Ⅱ和Ⅲ数据代入正反应速率表达式可得:解得n=1。
(2)①比较T1、p2和T2、p2:压强相同,由T1到T2,n(C)增大,平衡正移,由于反应放热,故此过程温度降低,故T1>T2;
比较T1、p1和T1、p2:温度相同,p2时反应速率大于p1,故p2>p1,从p1到p2,n(C)减小,平衡逆移,即压强增大,平衡逆移,故该反应正方向气体系数增大,则D为气体;
a点到b点过程中,n(C)继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故a点的v(正)大于b点的v(正),又b点v(正)=v(逆),所以a点时的v(正)>b点时的v(逆)。
②
=0.675
③b点和c点都处于平衡状态,逆反应速率达到最大值,但c点的温度比b点高,故c>b,又a点到b点过程中,n(C)继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故b大于a,综上a、b、c三点气体C的逆反应速率由大到小的顺序:c>b>a。
【分析】(1)将表中数据代入 计算;
(2)①温度越高反应速率越快,达到平衡的时间越短;温度相同,p2时反应速率大于p1,故p2>p1;
②列出反应的三段式计算;
③温度越高反应速率越大。
17.【答案】(1)吸热
(2)0.375mol L﹣1 min﹣1;CD
【解析】【解答】解:(1)已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I﹣反应II×3得到反应III,则△H3=△H1﹣3△H2,已知|△H1|=2|△H2|,所以△H3=△H1﹣3△H2=|△H2|>0,即反应III为吸热反应,故答案为:吸热;(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,所以v(NO)= = =0.375mol L﹣1 min﹣1,故答案为:0.375mol L﹣1 min﹣1;②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故B错误;
C.单位时间内H﹣O键断裂表示逆速率,N﹣H键断裂表示正速率,单位时间内H﹣O键与N﹣H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,当温度不变时,说明反应已经达到平衡,故D正确;
故答案为:CD.
【分析】(1)已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I﹣反应II×3得到反应III,则△H3=△H1﹣3△H2,据此分析;(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,根据v(NO)= 计算;②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低;
B.改变压强,活化分子百分数不变;
C.单位时间内H﹣O键断裂表示逆速率,N﹣H键断裂表示正速率,正逆速率相同则反应已经达到平衡;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小;
18.【答案】(1)A;A
(2)3A=B+2C;A=B+2C
(3)0.96
【解析】【解答】解:(1)图Ⅰ、Ⅱ分析图象变化可知,都是A的浓度随反应进行不断减小至不变,BC浓度随反应进行二不断增加至不变化,所以A为反应物,BC为生成物;
故答案为:A,A;(2)上述分析和图象变化可知,Ⅰ反应中,10s末,A浓度变化为1.2mol/L,B、C的浓度从0变化为0.4mol/L,0.8mol/L,说明该反应不是可逆反应,c(A):c(B):c(C)=1.2:0.4:0.8=3:1:2,反应的化学方程式为:3A=B+2C;Ⅱ反应中,10s末,A浓度变化为1.2mol/L﹣0.8mol/L=0.4mol/L,B、C的浓度从0变化为0.4mol/L,0.8mol/L,说明该反应不是可逆反应,c(A):c(B):c(C)=0.4:0.4:0.8=1:1:2,反应的化学方程式为:A=B+2C;
故答案为:3A=B+2C,A=B+2C;(3)在Ⅱ图中图象分析可知反应的速率匀速进行,计算10s时A的反应速率V(A)= {#mathmL#}{#/mathmL#} =0.04mol/L s,6s时变化的A的浓度c(A)=6s×V(A)=0.04mol/L s×6s=0.24mol/L,最后得到A的浓度=1.2mol/L﹣变化的A的浓度c(A)=1.2mol/L﹣0.24mol/L=0.96mol/L;
故答案为:0.96mol/L;
【分析】(1)图象分析可知随时间变化,Ⅰ中B、C从0变化为0.4mol/L,0.8mol/L为生成物,A变化为1.2mol/L,Ⅱ中BC增大为生成物,A减小为反应物;(2)依据图象计算得到ABC变化的浓度,变化量等于化学方程式计量数之比,据此书写化学方程式;(3)图象分析可知反应的速率匀速进行,计算10s时A的反应速率V(A),6s时变化的A的浓度c(A)=6s×V(A),最后得到A的浓度=1.2mol/L﹣变化的A的浓度c(A);
19.【答案】(1)0.079 mol·L-1·s-1;0.395 mol·L-1;79.0%
(2)X(g)+Y(g) 2Z(g)
(3)C;D
【解析】【解答】(1)根据化学反应速率数学表达式,v(Z)=1.58/(2×10)mol/(L·s)=0.079mol/(L·s);X减少的浓度为(1.2-0.41)/2mol·L-1=0.395mol·L-1,Y的转化率为(1-0.21)/1×100%=79.0%;(2)X、Y、Z的系数之比为:(1.2-0.41):(1-0.21):1.58=1:1:2,因此化学反应方程式为:X(g)+Y(g) 2Z(g);(3)根据图像,t1时刻化学反应速率增大,但化学平衡不移动,A、增大X浓度,平衡向正反应方向移动,故A错误;
B、升高温度,化学平衡必然改变,故B错误;
C、缩小容器的体积,相当于增大压强,因为反应前后气体系数之和相等,因此增大压强,平衡不移动,但正逆反应速率增大,故C正确;
D、使用催化剂加快反应速率,但平衡不移动,故D正确。
【分析】本题考查化学反应速率的计算以及影响化学平衡移动的因素。
(1)根据化学反应速率的公式计算,再结合图像计算即可得出答案;
(2)同一容器中,化学反应速率之比等于化学计量数之比等于物质的量变化之比;
(3)根据化学反应速率的影响因素分析解答。
20.【答案】(1);5;I和Ⅲ
(2);冷却结晶;降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水份;
【解析】【解答】(1)Na2S2O3溶液与稀硫酸反应生成硫酸钠、硫单质、二氧化硫和水,其离子方程式为;Ⅰ和Ⅱ探究稀硫酸浓度对反应速率的影响,因此其他量相同即溶液的总体积相同,因此表格中H2O的体积x=5,I和Ⅲ只有温度不相同,其他量相同,因此探究温度对化学反应速率的影响的实验是I和Ⅲ;故答案为:;5;I和Ⅲ。
(2)①试管a中是铜和浓硫酸加热条件下反应生成二氧化硫、硫酸铜和水,其化学方程式为;故答案为:。
②反应结束后,从溶液到晶体,因此要将试管b中溶液水浴加热浓缩,冷却结晶,经过滤、乙醇洗涤晶体、干燥,得到。水会溶解少量硫代硫酸钠,为了减少硫代硫酸钠溶解损失,因此用乙醇而不用水洗涤晶体的原因降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水份;故答案为:冷却结晶;降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水份。
③根据题意得到关系式,因此产品中物质的量为0.1000mol·L-1×0.02L×2=0.004mol,其质量分数为;故答案为:。
【分析】(1)探究外界条件对化学反应速率的影响,采用控制变量法进行探究,保持唯一变量原则,所以要保持溶液体积不变
(2)①根据制备硫代硫酸钠的反应,不难判断装置a是制备二氧化硫,b是反应装置,c是尾气吸收
②利用溶解度的差异进行分离物质方法一般是:加热浓缩、冷却结晶、过滤、洗涤,用乙醇洗涤往往考虑到物质易溶于水
③根据反应关系,进行计算即可
21.【答案】(1)MnO4﹣
(2)Ⅰ;Ⅱ;Ⅰ;Ⅲ
(3)浓度;确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同
【解析】【解答】解:(1)2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高,MnO4﹣为氧化剂,H2C2O4为还原剂,故答案为:MnO4﹣;(2)研究催化剂对化学反应速率的影响,应保证温度、浓度相同,则选实验Ⅰ、Ⅱ;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ、Ⅲ,故答案为:Ⅰ;Ⅱ;Ⅰ;Ⅲ;(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,可研究浓度对反应速率的影响,加少量蒸馏水确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同,故答案为:浓度;确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同.
【分析】(1)2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高;(2)研究催化剂对化学反应速率的影响,应保证温度、浓度相同;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同;(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,少量蒸馏水,溶液的体积相同
