1.2反应热的计算 基础练习(含答案)-2022-2023学年高二上学期化学人教版(2019)选择性必修一
文档属性
| 名称 | 1.2反应热的计算 基础练习(含答案)-2022-2023学年高二上学期化学人教版(2019)选择性必修一 |  | |
| 格式 | zip | ||
| 文件大小 | 301.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-04 07:54:22 | ||
图片预览




文档简介
1.2反应热的计算
一、单选题(本大题共14小题)
1. 下列关于两个反应的的判断,正确的是( )
;
A. , B.
C. , D.
2. 已知:;,、和键的键能分别为、和,则为( )
A. B. C. D.
3. 通过以下反应均可获取。下列有关说法不正确的是 ( )
光催化分解水制氧气:
过氧化氢分解制氧气:
一氧化氮分解制氧气:
A. 反应是人们获取的途径之一
B. 反应、都是化学能转化为热能
C. 反应的
D. 反应的
4. 用生产某些含氯有机物时会产生副产物。利用反应可实现氯的循环利用:反应 。
已知:.
下列说法不正确的是 ( )
A. 反应中反应物的总能量高于生成物的总能量
B. 反应中涉及极性键、非极性键的断裂和生成
C.
D. 断开键与断开键所需能量相差约为
5. 用和的混合溶液可溶出废旧印刷电路板上的铜。已知:
在溶液中,与反应生成和的反应热等于( )
A. B.
C. D.
6. 四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
下列说法中正确的是( )
A. 的燃烧热为
B. 反应若使用催化剂,会变小
C. 反应中的能量变化如图所示
D. 反应
7. 已知下列热化学方程式:
则下列叙述正确的是 ( )
A. 由上述热化学方程式可知
B. 甲烷的燃烧热为
C.
D. 甲醇和甲烷物质的量之比为的混合物完全燃烧生成和时,放出的热量为,则该混合物中甲醇的物质的量为
8. 、、都是重要的能源物质,它们的燃烧热依次为、、。已知:一定条件下,和可合成甲醇:。则与反应合成甲醇的热化学方程式为( )
A.
B.
C.
D.
9. 已知下列热化学方程式:
下列说法正确的是( )
A. 的燃烧热
B. 燃烧生成液态水,放出的热量为
C.
D.
10. 下列有关热化学方程式的叙述正确的是( )
A. ,则氢气的燃烧热为
B. 已知石墨,金刚石,的,则金刚石比石墨稳定
C. 含的稀溶液与稀盐酸完全中和,放出的热量,则中和热的热化学方程式为
D. 已知 , ,则
11. 已知、下,水蒸发为水蒸气需要吸热。
则反应的反应热为( )
A. B.
C. D.
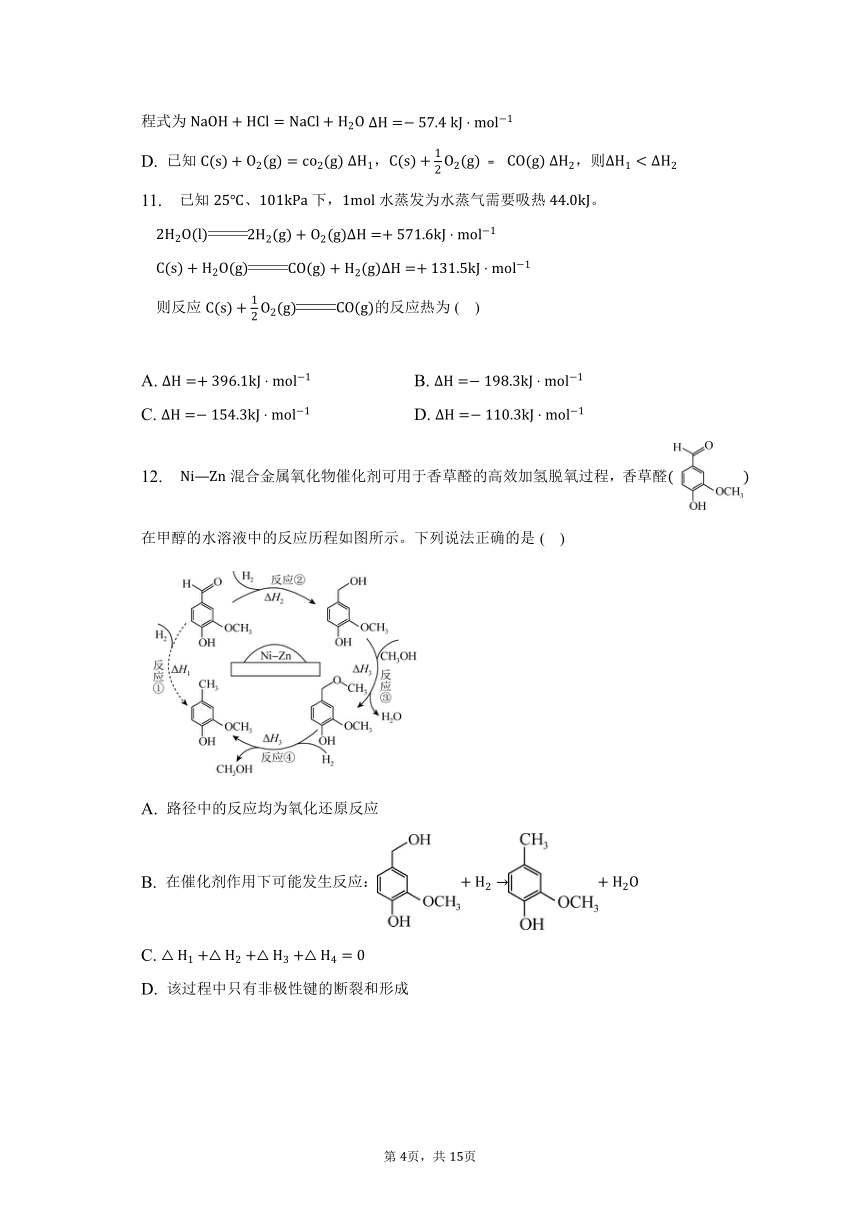
12. 混合金属氧化物催化剂可用于香草醛的高效加氢脱氧过程,香草醛在甲醇的水溶液中的反应历程如图所示。下列说法正确的是( )
A. 路径中的反应均为氧化还原反应
B. 在催化剂作用下可能发生反应:
C.
D. 该过程中只有非极性键的断裂和形成
13. 相同温度和压强下,关于反应的,下列判断正确的是( )
A. , B.
C. , D.
14. 已知转化为和分步进行: ,其反应过程能量如图所示,下列说法正确的是( )
A. 的能量低于的能量
B.
C. 断裂化学键吸收的热量小于形成和化学键所放出的热量
D. 反应过程中,由于,反应速率大于反应,气体很难大量积累
二、填空题(本大题共3小题)
15. 利用加氢制甲醇等清洁燃料,是实现减排较为可行的方法。一定温度下,和在催化剂作用下可发生以下两个反应:
反应Ⅰ:
反应Ⅱ:
相同温度下,反应的_______。
在催化、恒压条件下,向密闭容器中投入一定量和。其他条件相同,升高温度,判断甲醇选择性以及的平衡转化率的变化,并说明理由:_______。已知:。
氢气可通过水煤气法获得,原理为。在进气比不同时,测得平衡时转化率如图,和两点对应的温度关系:_______填“”、“”、或“”,判断的理由是_______。
如图装置可将和甲醇转化为甲酸。阳极的电极反应式为_______。
加氢制甲醇的部分反应机理如图所示。
“”表示物质在催化剂表面被吸附,“”表示自由基中未成对电子。已知在催化剂表面会形成两种吸附态的,一种显正电性,一种显负电性。
根据元素的电负性变化规律分析,过程中参与反应的显正电性与显负电性氢原子的数目比为_______;
结合化学键的断裂和形成,过程可描述为_______。
16. 判断下列说法是否正确正确的打“”,错误的打“”
已知 , ,则
甲烷的标准燃烧热,则甲烷燃烧的热化学方程式为
已知 , ,则
、下, ;将和过量的在此条件下充分反应,放出热量
,则相同条件下,气体的总能量小于氢气和氟气的能量之和
已知反应 ,、分子中化学键断裂时分别需要吸收、的能量,则分子中化学键断裂时需吸收的能量为
已知 ,则含的稀溶液与稀醋酸完全中和,放出的热量小于
17. 利用如图所示装置测定中和热的实验步骤如下:
用量筒量取盐酸倒入小烧杯中,测出盐酸温度;
用另一量筒量取溶液,并用同一温度计测出其温度;
将溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和的稀盐酸恰好完全反应,其反应热分别为、、,则、、的大小关系为__________________。
假设盐酸和氢氧化钠溶液的密度都是,又知中和反应后生成溶液的比热容
。为了计算中和热,某学生实验记录数据如下:
实验序号 起始温度 终止温度
盐酸 氢氧化钠溶液 混合溶液
依据该学生的实验数据计算,该实验测得的中和热______________________结果保留一位小数。
是一种无色气体,遇到空气能发生爆炸性自燃,生成和液态。已知室温下自燃放出热量。自燃的热化学方程式为____________________________________。
标准摩尔生成焓是指在和时,最稳定的单质生成化合物的焓变。已知和时下列反应:
石墨,
写出乙烷标准摩尔生成焓的热化学方程式:_________________________________________。
三、计算题(本大题共1小题)
18. 已知碳酸钙分解的热化学方程式为:
欲使完全分解,需要提供多少热?若通过煤炭燃烧来提供热,则至少需要燃烧多少千克煤炭?已知煤炭的热值为
答案和解析
1.【答案】
2.【答案】
【解析】已知:;,根据盖斯定律可得到,反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则,解得。
3.【答案】
【解答】反应是制取氢气的途径之一,A正确;
B.过氧化氢分解制氧气: ;一氧化氮分解制氧气: 都是放热反应,故反应、都是化学能转化为热能,B正确;
C.根据可知反应 ,题中是气态,故 ,C错误;
D.根据盖斯定律,由可得反应: ,D正确。
4.【答案】
【解答】
A.反应是放热反应,放热反应中反应物的总能量高于生成物的总能量,A正确;
B.反应中,极性键和非极性键断裂,生成非极性键和极性键,B正确;
C.根据盖斯定律,,C错误;
D.设键的键能为 、键的键能为 ,有,可得,则,即断开键与断开键所需能量相差约为,D正确。
5.【答案】
【解析】根据盖斯定律,将,整理可得: ,故A项正确。
6.【答案】
【解答】
A. 燃烧热指物质在氧气中完全燃烧并生成稳定化合物时放出的热量,完全燃烧的产物是二氧化碳,故A错误;
B.催化剂能降低反应所需的活化能,但不能改变,故B错误;
C.反应为吸热反应,反应物的总能量小于生成物的总能量,故C错误;
D.由可得,,根据盖斯定律可得,,故D正确。
故选D。
7.【答案】
【解答】
A.由气态水转化为液态水会放热,所以,A错误;
B.根据燃烧热的定义,该反应生成的稳定氧化物不能是水蒸气,应该是液态水,B错误;
C.根据盖斯定律,得到,C正确;
D.由得,设甲醇和甲烷的物质的量分别为和,则有,解得,D错误。
8.【答案】
【解答】
由题意可知, ; ; ,根据盖斯定律,得, 。故选A项。
9.【答案】
【解答】
A.燃烧热是可燃物完全燃烧生成稳定的氧化物放出的热量,氢气燃烧生成气态水放出热量,所以氢气的燃烧热不是,故A错误;
B.方程方程得,,,是氢气,放出的热量为,故B错误;
C.得,,故C错误;
D.,: ,得,故D正确。
10.【答案】
【解析】A.表示氢气燃烧热时产物中的水应该为液态,故A错误;
B.已知石墨,金刚石,的,则石墨能量较低,更稳定,故B错误;
C.含即的稀溶液与稀盐酸完全中和,放出的热量,则中和热的热化学方程式为 ,故C错误;
D.已知 , ,完全燃烧时放出的热量多,故,故D正确。
11.【答案】
【解析】已知、下,水蒸发为水蒸气需要吸热,则有:
Ⅰ
Ⅱ
Ⅲ
根据盖斯定律,ⅢⅡⅠ得,则反应的反应热,故D正确。
12.【答案】
【解答】
A.反应中没有元素的化合价发生变化,不是氧化还原反应,A错误;
B.根据反应和中甲醇的作用原理及这两步反应的总结果,在催化剂作用下可能直接发生反应,B正确;
C.由盖斯定律可知,,,C错误;
D.反应的过程中有极性键的断裂和形成,D错误;
故选:。
13.【答案】
【解析】环己烯、,环已二烯分别与氢气发生的加成反应均为放热反应,因此,,,不正确;
苯分子中没有碳碳双键,其中的碳碳键是介于单键和双键之间的特殊的共价键,因此,其与氢气完全加成的反应热不等于环已烯,,环己二烯分别与氢气发生的加成反应的反应热之和,即,不正确;
由于,环己二烯与氢气完全加成后消耗的氢气是等量环已烯的倍,故其放出的热量更多,其;苯与氢气发生加成反应生成,环已二烯的反应为吸热反应,根据盖斯定律可知,苯与氢气完全加成的反应热:,因此,,C正确、不正确。
14.【答案】
【解析】从图中可知的能量低于和的总能量,不能比较的能量和的能量大小,A错误;
从图中反应前后能量变化可知,反应物总能量低于生成物总能量,为吸热反应,,故,B错误;
从图中可知,转化为和为吸热反应,断裂化学键吸收的热量应大于形成和化学键所放出的热量,C错误;
从反应过程的图像中可知,,活化能越低,反应速率越快,故反应速率大于反应,气体很难大量积累,D正确。
15.【答案】
温度升高,甲醇选择性降低,的平衡转化率无法判断。温度升高,反应Ⅰ平衡逆向移动,反应Ⅱ平衡正向移动。故甲醇选择性降低。若反应Ⅰ移动程度大于反应Ⅱ,则的平衡转化率降低;反之,则的平衡转化率升高
由图中数据计算得等于,同一反应只与温度有关,相等温度相等
被吸附的与被吸附的作用,中断裂,形成了中,生成被吸附的与
【解析】反应Ⅰ:
反应Ⅱ:
反应Ⅰ反应Ⅱ得反应,其;
反应Ⅰ放热,反应Ⅱ吸热,温度升高,反应Ⅰ平衡逆向移动,反应Ⅱ平衡正向移动。故甲醇选择性降低。若反应Ⅰ移动程度大于反应Ⅱ,则的平衡转化率降低;反之,则的平衡转化率升高。即温度升高,甲醇选择性降低,的平衡转化率无法判断。温度升高,反应Ⅰ平衡逆向移动,反应Ⅱ平衡正向移动。故甲醇选择性降低。若反应Ⅰ移动程度大于反应Ⅱ,则的平衡转化率降低;反之,则的平衡转化率升高;
设点起始,,列三段式:,;
设点起始,,列三段式:,;
即,故;判断的理由是由图中数据计算得等于,同一反应只与温度有关,相等温度相等;
由图可知二氧化碳转化为甲酸的电极的价态降低,为阴极,则阳极甲醇失电子转化为甲酸,电极反应式为;
过程可表示为表示吸附态,反应后多了个形成,个形成,电负性:,则形成的显负电性,形成的显正电性,即过程中参与反应的显正电性与显负电性氢原子的数目比;
结合图可知过程为被吸附的与被吸附的作用,中断裂,形成了中,生成被吸附的与。
16.【答案】
17.【答案】
石墨,
【解答】
中和热是强酸强碱稀溶液完全反应生成水放出的热量,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和的稀盐酸恰好完全反应放热;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和的稀盐酸恰好完全反应放热小于,反应焓变是负值,所以
次初始温度分别为:、、,三次温差分别是、、,三次温度差平均值,盐酸与溶液进行中和反应生成水的物质的量为,溶液的质量为:,温度变化的值为,则生成水放出的热量为,即,所以实验测得的中和热。
根据自燃放出热量,则自燃放出热量,故自燃的热化学方程式为 。
根据盖斯定律,由,可得:石墨, 。
18.【答案】根据,碳酸钙完全分解成氧化钙和二氧化碳气体时,需要吸收的热量,完全分解,需提供的热量为;需要煤炭的质量为,
答:欲使完全分解,至少需要提供热量;若通过煤炭燃烧提供热量,则至少需要燃烧煤炭。
【解析】根据,碳酸钙完全分解成氧化钙和二氧化碳气体时,需要吸收的热量,完全分解,需提供的热量为;需要煤炭的质量为。
第1页,共1页
一、单选题(本大题共14小题)
1. 下列关于两个反应的的判断,正确的是( )
;
A. , B.
C. , D.
2. 已知:;,、和键的键能分别为、和,则为( )
A. B. C. D.
3. 通过以下反应均可获取。下列有关说法不正确的是 ( )
光催化分解水制氧气:
过氧化氢分解制氧气:
一氧化氮分解制氧气:
A. 反应是人们获取的途径之一
B. 反应、都是化学能转化为热能
C. 反应的
D. 反应的
4. 用生产某些含氯有机物时会产生副产物。利用反应可实现氯的循环利用:反应 。
已知:.
下列说法不正确的是 ( )
A. 反应中反应物的总能量高于生成物的总能量
B. 反应中涉及极性键、非极性键的断裂和生成
C.
D. 断开键与断开键所需能量相差约为
5. 用和的混合溶液可溶出废旧印刷电路板上的铜。已知:
在溶液中,与反应生成和的反应热等于( )
A. B.
C. D.
6. 四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
下列说法中正确的是( )
A. 的燃烧热为
B. 反应若使用催化剂,会变小
C. 反应中的能量变化如图所示
D. 反应
7. 已知下列热化学方程式:
则下列叙述正确的是 ( )
A. 由上述热化学方程式可知
B. 甲烷的燃烧热为
C.
D. 甲醇和甲烷物质的量之比为的混合物完全燃烧生成和时,放出的热量为,则该混合物中甲醇的物质的量为
8. 、、都是重要的能源物质,它们的燃烧热依次为、、。已知:一定条件下,和可合成甲醇:。则与反应合成甲醇的热化学方程式为( )
A.
B.
C.
D.
9. 已知下列热化学方程式:
下列说法正确的是( )
A. 的燃烧热
B. 燃烧生成液态水,放出的热量为
C.
D.
10. 下列有关热化学方程式的叙述正确的是( )
A. ,则氢气的燃烧热为
B. 已知石墨,金刚石,的,则金刚石比石墨稳定
C. 含的稀溶液与稀盐酸完全中和,放出的热量,则中和热的热化学方程式为
D. 已知 , ,则
11. 已知、下,水蒸发为水蒸气需要吸热。
则反应的反应热为( )
A. B.
C. D.
12. 混合金属氧化物催化剂可用于香草醛的高效加氢脱氧过程,香草醛在甲醇的水溶液中的反应历程如图所示。下列说法正确的是( )
A. 路径中的反应均为氧化还原反应
B. 在催化剂作用下可能发生反应:
C.
D. 该过程中只有非极性键的断裂和形成
13. 相同温度和压强下,关于反应的,下列判断正确的是( )
A. , B.
C. , D.
14. 已知转化为和分步进行: ,其反应过程能量如图所示,下列说法正确的是( )
A. 的能量低于的能量
B.
C. 断裂化学键吸收的热量小于形成和化学键所放出的热量
D. 反应过程中,由于,反应速率大于反应,气体很难大量积累
二、填空题(本大题共3小题)
15. 利用加氢制甲醇等清洁燃料,是实现减排较为可行的方法。一定温度下,和在催化剂作用下可发生以下两个反应:
反应Ⅰ:
反应Ⅱ:
相同温度下,反应的_______。
在催化、恒压条件下,向密闭容器中投入一定量和。其他条件相同,升高温度,判断甲醇选择性以及的平衡转化率的变化,并说明理由:_______。已知:。
氢气可通过水煤气法获得,原理为。在进气比不同时,测得平衡时转化率如图,和两点对应的温度关系:_______填“”、“”、或“”,判断的理由是_______。
如图装置可将和甲醇转化为甲酸。阳极的电极反应式为_______。
加氢制甲醇的部分反应机理如图所示。
“”表示物质在催化剂表面被吸附,“”表示自由基中未成对电子。已知在催化剂表面会形成两种吸附态的,一种显正电性,一种显负电性。
根据元素的电负性变化规律分析,过程中参与反应的显正电性与显负电性氢原子的数目比为_______;
结合化学键的断裂和形成,过程可描述为_______。
16. 判断下列说法是否正确正确的打“”,错误的打“”
已知 , ,则
甲烷的标准燃烧热,则甲烷燃烧的热化学方程式为
已知 , ,则
、下, ;将和过量的在此条件下充分反应,放出热量
,则相同条件下,气体的总能量小于氢气和氟气的能量之和
已知反应 ,、分子中化学键断裂时分别需要吸收、的能量,则分子中化学键断裂时需吸收的能量为
已知 ,则含的稀溶液与稀醋酸完全中和,放出的热量小于
17. 利用如图所示装置测定中和热的实验步骤如下:
用量筒量取盐酸倒入小烧杯中,测出盐酸温度;
用另一量筒量取溶液,并用同一温度计测出其温度;
将溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和的稀盐酸恰好完全反应,其反应热分别为、、,则、、的大小关系为__________________。
假设盐酸和氢氧化钠溶液的密度都是,又知中和反应后生成溶液的比热容
。为了计算中和热,某学生实验记录数据如下:
实验序号 起始温度 终止温度
盐酸 氢氧化钠溶液 混合溶液
依据该学生的实验数据计算,该实验测得的中和热______________________结果保留一位小数。
是一种无色气体,遇到空气能发生爆炸性自燃,生成和液态。已知室温下自燃放出热量。自燃的热化学方程式为____________________________________。
标准摩尔生成焓是指在和时,最稳定的单质生成化合物的焓变。已知和时下列反应:
石墨,
写出乙烷标准摩尔生成焓的热化学方程式:_________________________________________。
三、计算题(本大题共1小题)
18. 已知碳酸钙分解的热化学方程式为:
欲使完全分解,需要提供多少热?若通过煤炭燃烧来提供热,则至少需要燃烧多少千克煤炭?已知煤炭的热值为
答案和解析
1.【答案】
2.【答案】
【解析】已知:;,根据盖斯定律可得到,反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则,解得。
3.【答案】
【解答】反应是制取氢气的途径之一,A正确;
B.过氧化氢分解制氧气: ;一氧化氮分解制氧气: 都是放热反应,故反应、都是化学能转化为热能,B正确;
C.根据可知反应 ,题中是气态,故 ,C错误;
D.根据盖斯定律,由可得反应: ,D正确。
4.【答案】
【解答】
A.反应是放热反应,放热反应中反应物的总能量高于生成物的总能量,A正确;
B.反应中,极性键和非极性键断裂,生成非极性键和极性键,B正确;
C.根据盖斯定律,,C错误;
D.设键的键能为 、键的键能为 ,有,可得,则,即断开键与断开键所需能量相差约为,D正确。
5.【答案】
【解析】根据盖斯定律,将,整理可得: ,故A项正确。
6.【答案】
【解答】
A. 燃烧热指物质在氧气中完全燃烧并生成稳定化合物时放出的热量,完全燃烧的产物是二氧化碳,故A错误;
B.催化剂能降低反应所需的活化能,但不能改变,故B错误;
C.反应为吸热反应,反应物的总能量小于生成物的总能量,故C错误;
D.由可得,,根据盖斯定律可得,,故D正确。
故选D。
7.【答案】
【解答】
A.由气态水转化为液态水会放热,所以,A错误;
B.根据燃烧热的定义,该反应生成的稳定氧化物不能是水蒸气,应该是液态水,B错误;
C.根据盖斯定律,得到,C正确;
D.由得,设甲醇和甲烷的物质的量分别为和,则有,解得,D错误。
8.【答案】
【解答】
由题意可知, ; ; ,根据盖斯定律,得, 。故选A项。
9.【答案】
【解答】
A.燃烧热是可燃物完全燃烧生成稳定的氧化物放出的热量,氢气燃烧生成气态水放出热量,所以氢气的燃烧热不是,故A错误;
B.方程方程得,,,是氢气,放出的热量为,故B错误;
C.得,,故C错误;
D.,: ,得,故D正确。
10.【答案】
【解析】A.表示氢气燃烧热时产物中的水应该为液态,故A错误;
B.已知石墨,金刚石,的,则石墨能量较低,更稳定,故B错误;
C.含即的稀溶液与稀盐酸完全中和,放出的热量,则中和热的热化学方程式为 ,故C错误;
D.已知 , ,完全燃烧时放出的热量多,故,故D正确。
11.【答案】
【解析】已知、下,水蒸发为水蒸气需要吸热,则有:
Ⅰ
Ⅱ
Ⅲ
根据盖斯定律,ⅢⅡⅠ得,则反应的反应热,故D正确。
12.【答案】
【解答】
A.反应中没有元素的化合价发生变化,不是氧化还原反应,A错误;
B.根据反应和中甲醇的作用原理及这两步反应的总结果,在催化剂作用下可能直接发生反应,B正确;
C.由盖斯定律可知,,,C错误;
D.反应的过程中有极性键的断裂和形成,D错误;
故选:。
13.【答案】
【解析】环己烯、,环已二烯分别与氢气发生的加成反应均为放热反应,因此,,,不正确;
苯分子中没有碳碳双键,其中的碳碳键是介于单键和双键之间的特殊的共价键,因此,其与氢气完全加成的反应热不等于环已烯,,环己二烯分别与氢气发生的加成反应的反应热之和,即,不正确;
由于,环己二烯与氢气完全加成后消耗的氢气是等量环已烯的倍,故其放出的热量更多,其;苯与氢气发生加成反应生成,环已二烯的反应为吸热反应,根据盖斯定律可知,苯与氢气完全加成的反应热:,因此,,C正确、不正确。
14.【答案】
【解析】从图中可知的能量低于和的总能量,不能比较的能量和的能量大小,A错误;
从图中反应前后能量变化可知,反应物总能量低于生成物总能量,为吸热反应,,故,B错误;
从图中可知,转化为和为吸热反应,断裂化学键吸收的热量应大于形成和化学键所放出的热量,C错误;
从反应过程的图像中可知,,活化能越低,反应速率越快,故反应速率大于反应,气体很难大量积累,D正确。
15.【答案】
温度升高,甲醇选择性降低,的平衡转化率无法判断。温度升高,反应Ⅰ平衡逆向移动,反应Ⅱ平衡正向移动。故甲醇选择性降低。若反应Ⅰ移动程度大于反应Ⅱ,则的平衡转化率降低;反之,则的平衡转化率升高
由图中数据计算得等于,同一反应只与温度有关,相等温度相等
被吸附的与被吸附的作用,中断裂,形成了中,生成被吸附的与
【解析】反应Ⅰ:
反应Ⅱ:
反应Ⅰ反应Ⅱ得反应,其;
反应Ⅰ放热,反应Ⅱ吸热,温度升高,反应Ⅰ平衡逆向移动,反应Ⅱ平衡正向移动。故甲醇选择性降低。若反应Ⅰ移动程度大于反应Ⅱ,则的平衡转化率降低;反之,则的平衡转化率升高。即温度升高,甲醇选择性降低,的平衡转化率无法判断。温度升高,反应Ⅰ平衡逆向移动,反应Ⅱ平衡正向移动。故甲醇选择性降低。若反应Ⅰ移动程度大于反应Ⅱ,则的平衡转化率降低;反之,则的平衡转化率升高;
设点起始,,列三段式:,;
设点起始,,列三段式:,;
即,故;判断的理由是由图中数据计算得等于,同一反应只与温度有关,相等温度相等;
由图可知二氧化碳转化为甲酸的电极的价态降低,为阴极,则阳极甲醇失电子转化为甲酸,电极反应式为;
过程可表示为表示吸附态,反应后多了个形成,个形成,电负性:,则形成的显负电性,形成的显正电性,即过程中参与反应的显正电性与显负电性氢原子的数目比;
结合图可知过程为被吸附的与被吸附的作用,中断裂,形成了中,生成被吸附的与。
16.【答案】
17.【答案】
石墨,
【解答】
中和热是强酸强碱稀溶液完全反应生成水放出的热量,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和的稀盐酸恰好完全反应放热;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和的稀盐酸恰好完全反应放热小于,反应焓变是负值,所以
次初始温度分别为:、、,三次温差分别是、、,三次温度差平均值,盐酸与溶液进行中和反应生成水的物质的量为,溶液的质量为:,温度变化的值为,则生成水放出的热量为,即,所以实验测得的中和热。
根据自燃放出热量,则自燃放出热量,故自燃的热化学方程式为 。
根据盖斯定律,由,可得:石墨, 。
18.【答案】根据,碳酸钙完全分解成氧化钙和二氧化碳气体时,需要吸收的热量,完全分解,需提供的热量为;需要煤炭的质量为,
答:欲使完全分解,至少需要提供热量;若通过煤炭燃烧提供热量,则至少需要燃烧煤炭。
【解析】根据,碳酸钙完全分解成氧化钙和二氧化碳气体时,需要吸收的热量,完全分解,需提供的热量为;需要煤炭的质量为。
第1页,共1页
