2.2化学平衡 基础练习(含解析) 2022-2023学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2化学平衡 基础练习(含解析) 2022-2023学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | zip | ||
| 文件大小 | 286.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-03 15:13:46 | ||
图片预览




文档简介
2.2化学平衡
一、单选题(本大题共15小题)
1. 一定温度下,某气态平衡体系的平衡常数表达式为,有关该平衡体系的说法正确的是( )
A. 升高温度,平衡常数一定增大
B. 增大浓度,平衡向正反应方向移动
C. 增大压强,体积分数增加
D. 升高温度,若的百分含量减少,则正反应是放热反应
2. 下列说法不正确的是( )
A. 对于有气体参加的可逆反应,加压化学平衡不一定发生移动
B. 外界条件的改变引起,则平衡一定发生移动
C. 平衡移动,反应物的浓度一定减小
D. 外界条件发生变化,化学平衡不一定移动
3. 反应,在不同温度下的平衡体系中物质的体积分数随压强变化的曲线如图所示。下列说法错误的是( )
A. B. 该反应的
C. B、两点化学平衡常数: D. A、两点的反应速率
4. 痛风病与关节滑液中形成的尿酸钠有关增多,病情加重,其化学原理为:,下列说法不正确的是( )
A. 寒冷季节更易诱发关节疼痛
B. 大量饮水会增大痛风病发作的可能性
C. 饮食中摄入过多食盐,会加重痛风病病情
D. 患痛风病的人应少吃能代谢产生更多尿酸的食物
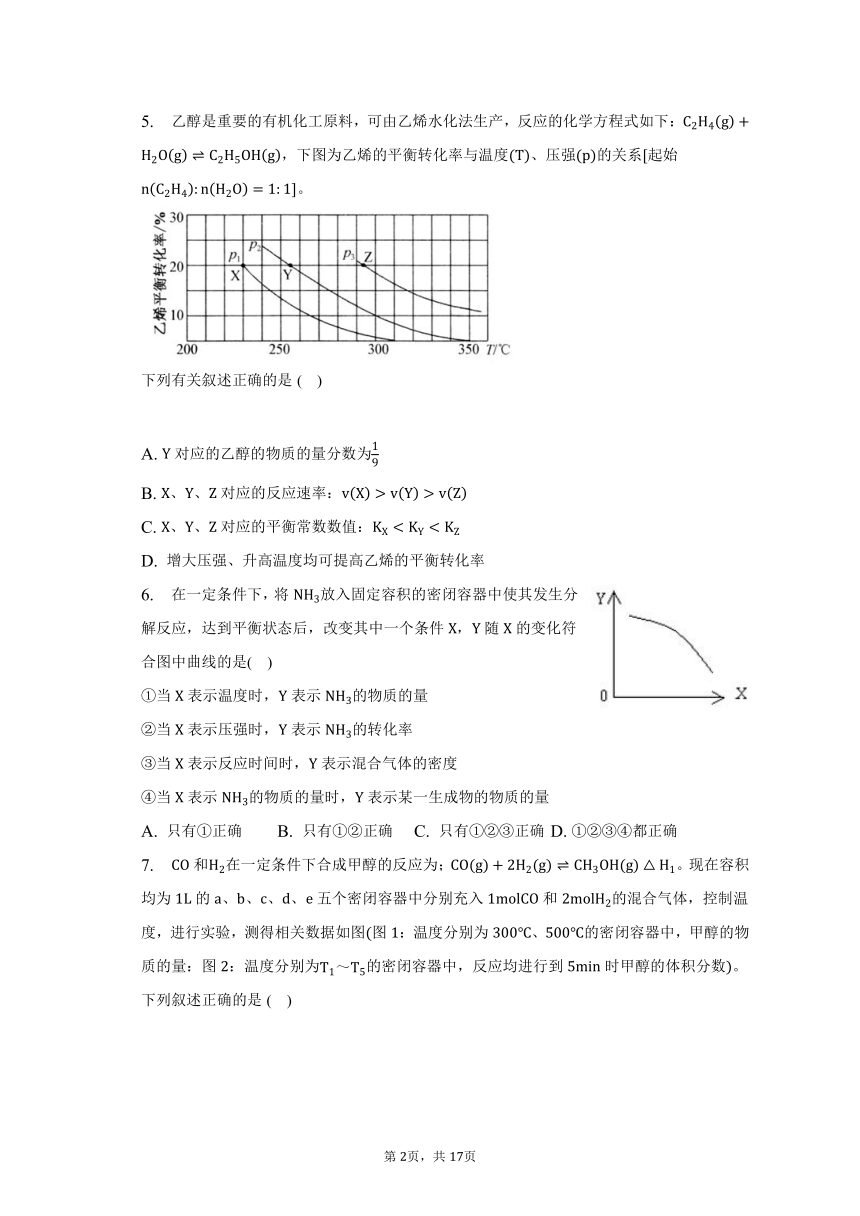
5. 乙醇是重要的有机化工原料,可由乙烯水化法生产,反应的化学方程式如下:,下图为乙烯的平衡转化率与温度、压强的关系起始。
下列有关叙述正确的是( )
A. 对应的乙醇的物质的量分数为
B. 、、对应的反应速率:
C. 、、对应的平衡常数数值:
D. 增大压强、升高温度均可提高乙烯的平衡转化率
6. 在一定条件下,将放入固定容积的密闭容器中使其发生分解反应,达到平衡状态后,改变其中一个条件,随的变化符合图中曲线的是( )
当表示温度时,表示的物质的量
当表示压强时,表示的转化率
当表示反应时间时,表示混合气体的密度
当表示的物质的量时,表示某一生成物的物质的量
A. 只有正确 B. 只有正确 C. 只有正确 D. 都正确
7. 和在一定条件下合成甲醇的反应为;。现在容积均为的、、、、五个密闭容器中分别充入和的混合气体,控制温度,进行实验,测得相关数据如图图:温度分别为、的密闭容器中,甲醇的物质的量:图:温度分别为的密闭容器中,反应均进行到时甲醇的体积分数。下列叙述正确的是( )
A. 该反应的,且
B. 将容器中的平衡状态转变到容器中的平衡状态,可采取的措施有升温或加压
C. 时,向平衡后的容器中再充入,,,平衡正向移动
D. 时,向平衡后的容器中再充入,重新平衡后,的百分含量增大
8. ,当反应达到平衡时,下列措施:升温,恒容通入惰性气体,增加浓度,减压,加催化剂,恒压通入惰性气体。其中能提高转化率的是( )
A. B. C. D.
9. 下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应,升高温度,该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. 平衡常数为的反应,化学方程式为
10. 某温度下,在一个的密闭容器中,加入和进行如下反应:,反应一段时间后达到平衡,测得生成,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是
B. 增加的量,平衡向右移动,的平衡转化率增大
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 此时的平衡转化率是
11. 已知某化学反应的平衡常数表达式为,在不同的温度下该反应的平衡常数如下表。下列有关叙述正确的是( )
A. 若平衡浓度符合下列关系式:,则此时的温度为
B. 上述反应的逆反应是放热反应
C. 该反应的化学方程式为
D. 若在一定容积的密闭容器中通入和各,后温度升高到,此时测得为时,该反应达到平衡状态
12. 在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
向恒压、密闭容器中通入和,平衡时、、的物质的量随温度的变化如图所示。下列说法正确的是( )
A. 反应的平衡常数可表示为
B. 图中曲线表示的物质的量随温度的变化
C. 提高转化为的转化率,需要研发在低温区高效的催化剂
D. 的
13. 在催化剂作用下,向刚性容器中按物质的量之比为:充入甲醇和异丁烯用表示,分别在和两个温度下发生反应生成有机物:。异丁烯的转化率随时间的变化关系如图所示。下列说法正确的是( )
A. ,
B.
C. 维持不变,再向容器中充入,新平衡时的百分含量减小
D. 时,容器内起始总压为,则用分压表示的该反应的平衡常数
14. 已知反应:,。在恒容密闭容器中反应达到平衡时,若升高体系温度,下列说法正确的是( )
A. 反应正向移动 B. ::
C. 平衡常数增大 D. 混合气体的平均相对分子质量变大
15. 反应在容积为的密闭容器中进行。起始时和均为。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
A. 实验,从反应开始至达到平衡时
B. 实验,用浓度表示的平衡常数为
C. 该反应的
D. 比较实验、可得出升高温度反应速率加快
二、填空题(本大题共3小题)
16. 环戊二烯是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。已知: 。
某温度下,等物质的量的碘和环戊烯在刚性容器内发生上述反应,起始总压为,平衡时总压增加了,环戊烯的转化率为 ,该反应的平衡常数 。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有 填标号。
A.通入惰性气体 提高温度 增加环戊烯浓度 增加碘浓度
17. 治理汽车尾气中和污染的一种方法是将其转化为无害的和,反应原理为。某研究小组在三个容积均为的恒容密闭容器中,分别充入和,在三种不同实验条件下进行上述反应,体系各自保持温度不变,反应体系总压强随时间的变化如图所示。
与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件为实验Ⅰ: ,实验Ⅲ: 。
三组实验中的平衡转化率、和的大小关系为 。
实验Ⅲ的平衡常数 。
18. 合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
据此回答以下问题:
该反应的化学平衡常数表达式为__________________。
根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值_______。填“越大”、“越小”或“不变”
某温度下,若把与置于体积为的密闭容器内,反应达到平衡状态时,测得混合气体总物质的量变为开始时的,则平衡时氢气的转化率_______用百分数表示。能说明该反应达到化学平衡状态的是_______ 填字母。
容器内的密度保持不变 容器内压强保持不变
混合气体中不变
对于合成氨反应而言,下列有关图像一定正确的是选填序号_______。
三、计算题(本大题共1小题)
19. ,时,在体积为固定体积的密闭容器中加入和的,的物质的量随时间的变化如下表:
时间
物质的量
根据表中数据回答:
氢气平衡转化率为________。
时该反应的平衡常数为________。
保持其他条件不变,向平衡体系中充入、、;此时________填“”“”或“”。
答案和解析
1.【答案】
【解答】
根据平衡常数表达式可知反应方程式为,
A.升高温度,化学平衡向吸热反应方向移动,如果正反应是放热反应,则化学平衡常数减小,故A错误;
B.增大浓度,平衡向逆反应方向移动,故B错误;
C.该反应正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,所以的体积分数减少,故C错误;
D.升高温度,平衡向吸热反应方向移动,若的百分含量减少,说明平衡向逆反应方向移动,所以逆反应为吸热反应,正反应是放热反应,故D正确。
故选D。
2.【答案】
【解析】错,平衡移动分正向移动和逆向移动,所以反应物的浓度不一定减小。故选:。
3.【答案】
【解答】
A.由图可知,增大压强,的体积分数减小,说明平衡逆向移动,则,故A正确;
B.由图可知温度升高,的体积分数增大,说明平衡正向移动,则正向为吸热反应,故B正确;
C.对吸热反应来说,温度升高,增大,,故C错误;
D.、温度相同,点压强大,则点的速率大于点,故D正确。
故选C。
4.【答案】
【解答】
A.该反应是放热反应,降低温度,平衡正向移动,生成更多的尿酸钠,更易诱发关节疼痛,故A正确;
B.假设该反应中,,即,若饮水将各物质浓度稀释为,则浓度商,则平衡逆向移动,人体中含量会减少,降低痛风病发作的可能性,故B错误;
C.饮食中摄入过多食盐,增加钠离子浓度,平衡正向移动,生成更多尿酸钠会加重痛风病病情,故C正确;
D.若患痛风病的人多吃能代谢产生更多尿酸的食物,会增大尿酸的浓度,使得平衡正向移动,人体中含量增多,病情加重,故患痛风病的人应少吃能代谢产生更多尿酸的食物,故D正确,
5.【答案】
【解析】解:图中分析可知,点乙烯转化率为,起始::,
起始量
变化量
平衡量
对应的乙醇的物质的量分数,故A正确;
B.温度越高,压强越大,反应速率越大,增大压强平衡正向移动,乙烯转化率增大,故,、、对应的反应速率:,故B错误;
C.温度升高乙烯转化率减小,说明升温平衡逆向移动,正反应为放热反应,温度越高平衡常数越小,、、对应的平衡常数数值:,故C错误;
D.该反应是气体体积减小的放热反应,增大压强平衡正向移动,乙烯转化率增大,升温平衡逆向移动,乙烯转化率减小,故D错误;
故选:。
6.【答案】
【解析】放入固定容积的密闭容器中使其发生分解为气体分子数增加的吸热反应,由图象可知,随着的增大,的值减小。
反应吸热,升高温度,平衡向正反应方向移动,的物质的量减小,故正确;
该反应气体分子数增加,则增大压强,平衡向逆反应方向移动,的转化率减小,故正确;
达到平衡后,因混合气体的质量和体积不变,混合气体的密度将不变,故错误;
增加的物质的量时,平衡向正方向移动,某一生成物的物质的量增加,故错误。
故选:。
7.【答案】
【解答】
A.图可以看出,甲醇的物质的量为的曲线温度大,说明升高温度,甲醇的物质的量减少,即平衡逆向移动,说明正反应是放热反应,所以;因正反应是放热反应,温度降低,平衡正向移动,平衡常数增大,所以说低温时平衡常数大,,故A错误;
B.从平衡状态转到,甲醇含量下降,说明平衡逆向移动,可以采用减小压强的措施,或升温平衡逆向进行的措施,故B错误;
C.利用三段式进行计算;根据平衡常数的定义计算,平衡状态下甲醇物质的量为,
起始量
变化量
平衡量
时,向平衡后的容器中再充入,,,浓度商,平衡正向移动,故C正确;
D.时,向平衡后的容器中再充入,相当于增大容器中压强,平衡正向进行,重新平衡后,的百分含量减小,故D错误;
故选:。
8.【答案】
【解析】 该反应为气体体积增大的吸热反应,所以升温和减压均可以促使反应正向移动,转化率增大。恒压通入惰性气体,相当于减压,平衡正向移动,转化率增大;恒容通入惰性气体与加催化剂均对平衡无影响,转化率不变;增加的浓度,将导致平衡逆向移动,转化率减小。
9.【答案】
【解答】
A.若是压强的改变,使反应物的转化率增大,平衡常数不变,平衡常数只随温度变化,故A错误;
B.对,升高温度,平衡逆向移动,平衡常数减小,故B错误;
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数互为倒数,故C错误;
D.平衡常数为的反应,化学方程式为,故D正确。
故选D。
10.【答案】
【解答】
A.依据平衡常数的概念分析列式得到,为固体不写入平衡常数的表达式, ,故A错误;
B.两种反应物,增加一种物质的量,会提高另一种物质的转化率,本身转化率降低,增加,的平衡转化率减小,故B错误;
C.反应前后气体体积减小,增大压强平衡正向进行,但平衡常数随温度变化,压强变化,平衡常数不变,故C错误;
D.依据平衡三段式列式计算;加入和进行反应,反应一段时间后达到平衡,测得生成,
起始量
变化量
平衡量
的转化率为 ,故D正确。
故选D。
11.【答案】
【解析】若平衡浓度符合关系式:,则平衡常数,对照平衡常数可知温度是,故A正确;
由表中数据可知,温度升高平衡常数减小,说明升高温度平衡逆向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,故B错误;
化学反应的平衡常数表达式为,而平衡常数是生成物浓度的化学计量数次幂的乘积与反应物浓度的化学计量数次幂的乘积的比值,故反应物是一氧化碳和水,生成物是二氧化碳和氢气,该反应的化学方程式为,故C错误;
起始量
变化量
的量
反应前后气体的体积不变,用物质的量代替浓度计算,故,,时不等于,说明反应未达到平衡,反应向逆反应方向进行,故D错误。
12.【答案】
【解析】化学平衡常数是生成物浓度幂之积与反应物浓度幂之积的比值,反应Ⅰ的平衡常数,A错误;
反应物的量逐渐减小,故图中曲线表示的物质的量变化曲线,由反应Ⅱ和Ⅲ可知,温度升高反应Ⅱ正向移动,反应Ⅲ逆向移动,的物质的量增大,故曲线为的物质的量变化曲线,则曲线为的物质的量变化曲线,B错误;
反应Ⅰ为放热反应,反应Ⅱ为吸热反应,降低温度有利于反应Ⅰ正向移动、反应Ⅱ逆向移动,即可提高转化为的转化率,所以需要研发在低温区高效的催化剂,C正确;
反应Ⅱ反应Ⅲ得到目标反应,则的,D错误。
13.【答案】
【解析】先达平衡,所以,由到,温度升高,异丁烯的转化率降低,即平衡逆向移动,正反应为放热反应,则,项错误;点和点异丁烯的转化率相同,即异丁烯的浓度相同,但是点对应的温度高,所以,项错误;维持不变,再向容器中充入,相当于增大压强,平衡正向移动,新平衡时的百分含量增大,项错误;假设甲醇和异丁烯的初始物质的量都是,时异丁烯的平衡转化率为,则消耗的异丁烯为,列出三段式:
初始
消耗
平衡
平衡时总物质的量为,因为是刚性容器,所以容器体积不变,则压强改变,初始压强为,平衡时压强为,则,项符合题意。
14.【答案】
【解析】升高温度,反应逆向进行,A错误;
用不同物质表示同一反应的反应速率时,速率之比等于化学计量数之比,因此有::,B正确;
反应放热,升高温度,平衡逆向移动,平衡常数减小,C错误;
恒容密闭容器中,气体总质量不变,升高温度,平衡逆向移动,,气体的物质的量变大,因此混合气体的平均相对分子质量减小,D错误。
15.【答案】
【解析】实验,设达到平衡时转化的物质的量为 ,根据“三段式”法进行计算:
起始量
转化量
平衡量
则,解得,,项正确。
实验,设平衡时转化的,的物质的量为 ,运用“三段式法进行计算:
起始量
转化量
平衡量
则,解得,则平衡时,故用浓度表示的平衡常数,项正确;
实验相对于实验,容器容积和起始投料量均相同,但起始总压强增大,因此实验的温度高于实验,由于实验达到平衡时转化,实验达到平衡时转化,因此升高温度,平衡向逆反应方向移动,该反应的逆反应为吸热反应,正反应为放热反应,,项错误;
实验相对于实验改变的条件为升高温度,根据题图可知实验比实验先达到平衡,故比较实验、可以得出升高温度反应速率加快,项正确。
16.【答案】
【解析】设起始时碘的物质的量为,至平衡时转化,则
起始
转化
平衡
,解得,环戊烯的转化率为。平衡时总压为,平衡时总物质的量为。
。
该反应是在恒容条件下进行的,通入惰性气体,平衡不移动,项不符合题意;该反应为吸热反应,提高温度,平衡正向移动,环戊烯的转化率增加,项符合题意;增加环戊烯的浓度,环戊烯的转化率降低,项不符合题意;增加碘浓度,平衡正向移动,环戊烯的转化率增加,项符合题意。
17.【答案】升高温度
加催化剂
【解答】
对比Ⅱ、Ⅰ可知,Ⅰ到达平衡时间缩短且起始压强增大,应是升高温度;对比Ⅱ、Ⅲ可知,平衡时压强不变,Ⅲ到达平衡时间缩短,改变条件,反应速率加快且不影响平衡移动,应是使用催化剂;
根据中分析可知,Ⅱ、Ⅲ相比,平衡不移动,故C转化率不变,即,Ⅰ与Ⅱ相比,Ⅰ中温度较高,正反应为放热反应,平衡向逆反应方向移动,的转化率减小,即,故转化率;
利用三段式计算,可知相关数据,假设转化:
恒温恒容下,,根据图中数据推出,得,可知平衡时的浓度为,的浓度为,的浓度为,的浓度为,故平衡常数。
18.【答案】
越小
;
【解答】
为生成物浓度幂之积与反应物浓度幂之积的比,则,故答案为:;
该反应为放热反应,升高温度,平衡逆向移动,则平衡常数减小,温度越高,越小,故答案为:越小;
设氮气消耗物质的量为
开始
转化
平衡
反应达到平衡状态时,测得混合气体总物质的量变为开始时的,
,
解得,则平衡时氢气的转化率;
由平衡的特征“等”、“定”可判定平衡,则
容器的体积、气体的质量始终不变,则容器内的密度保持不变,不能判断平衡,故错误;
该反应为反应前后体积不等的反应,则容器内压强保持不变,达到平衡,故正确;
,正逆反应速率不等,反应没有达到平衡,故错误;
混合气体中 不变,为平衡的特征,达到平衡,故正确;
故答案为:;;
先出现拐点的先达到平衡,则大,温度高,平衡逆向移动,与图象一致,故正确;
平衡时浓度不一定相等,平衡浓度取决于起始浓度和转化率,图象表示错误,故错误;
使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故正确;
故答案为:;
19.【答案】
【解答】
,的物质的量随时间的变化可知反应达到平衡状态时,物质的量为,变化了,则变化的氢气物质的量,氢气转化率为;
时,,平衡状态下物质的量,物质的量浓度为,
起始量
变化量
平衡量
该反应的平衡常数;
保持其他条件不变,向平衡体系中充入、、,此时的浓度熵,平衡正向进行,则。
第1页,共1页
一、单选题(本大题共15小题)
1. 一定温度下,某气态平衡体系的平衡常数表达式为,有关该平衡体系的说法正确的是( )
A. 升高温度,平衡常数一定增大
B. 增大浓度,平衡向正反应方向移动
C. 增大压强,体积分数增加
D. 升高温度,若的百分含量减少,则正反应是放热反应
2. 下列说法不正确的是( )
A. 对于有气体参加的可逆反应,加压化学平衡不一定发生移动
B. 外界条件的改变引起,则平衡一定发生移动
C. 平衡移动,反应物的浓度一定减小
D. 外界条件发生变化,化学平衡不一定移动
3. 反应,在不同温度下的平衡体系中物质的体积分数随压强变化的曲线如图所示。下列说法错误的是( )
A. B. 该反应的
C. B、两点化学平衡常数: D. A、两点的反应速率
4. 痛风病与关节滑液中形成的尿酸钠有关增多,病情加重,其化学原理为:,下列说法不正确的是( )
A. 寒冷季节更易诱发关节疼痛
B. 大量饮水会增大痛风病发作的可能性
C. 饮食中摄入过多食盐,会加重痛风病病情
D. 患痛风病的人应少吃能代谢产生更多尿酸的食物
5. 乙醇是重要的有机化工原料,可由乙烯水化法生产,反应的化学方程式如下:,下图为乙烯的平衡转化率与温度、压强的关系起始。
下列有关叙述正确的是( )
A. 对应的乙醇的物质的量分数为
B. 、、对应的反应速率:
C. 、、对应的平衡常数数值:
D. 增大压强、升高温度均可提高乙烯的平衡转化率
6. 在一定条件下,将放入固定容积的密闭容器中使其发生分解反应,达到平衡状态后,改变其中一个条件,随的变化符合图中曲线的是( )
当表示温度时,表示的物质的量
当表示压强时,表示的转化率
当表示反应时间时,表示混合气体的密度
当表示的物质的量时,表示某一生成物的物质的量
A. 只有正确 B. 只有正确 C. 只有正确 D. 都正确
7. 和在一定条件下合成甲醇的反应为;。现在容积均为的、、、、五个密闭容器中分别充入和的混合气体,控制温度,进行实验,测得相关数据如图图:温度分别为、的密闭容器中,甲醇的物质的量:图:温度分别为的密闭容器中,反应均进行到时甲醇的体积分数。下列叙述正确的是( )
A. 该反应的,且
B. 将容器中的平衡状态转变到容器中的平衡状态,可采取的措施有升温或加压
C. 时,向平衡后的容器中再充入,,,平衡正向移动
D. 时,向平衡后的容器中再充入,重新平衡后,的百分含量增大
8. ,当反应达到平衡时,下列措施:升温,恒容通入惰性气体,增加浓度,减压,加催化剂,恒压通入惰性气体。其中能提高转化率的是( )
A. B. C. D.
9. 下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应,升高温度,该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. 平衡常数为的反应,化学方程式为
10. 某温度下,在一个的密闭容器中,加入和进行如下反应:,反应一段时间后达到平衡,测得生成,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是
B. 增加的量,平衡向右移动,的平衡转化率增大
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 此时的平衡转化率是
11. 已知某化学反应的平衡常数表达式为,在不同的温度下该反应的平衡常数如下表。下列有关叙述正确的是( )
A. 若平衡浓度符合下列关系式:,则此时的温度为
B. 上述反应的逆反应是放热反应
C. 该反应的化学方程式为
D. 若在一定容积的密闭容器中通入和各,后温度升高到,此时测得为时,该反应达到平衡状态
12. 在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
向恒压、密闭容器中通入和,平衡时、、的物质的量随温度的变化如图所示。下列说法正确的是( )
A. 反应的平衡常数可表示为
B. 图中曲线表示的物质的量随温度的变化
C. 提高转化为的转化率,需要研发在低温区高效的催化剂
D. 的
13. 在催化剂作用下,向刚性容器中按物质的量之比为:充入甲醇和异丁烯用表示,分别在和两个温度下发生反应生成有机物:。异丁烯的转化率随时间的变化关系如图所示。下列说法正确的是( )
A. ,
B.
C. 维持不变,再向容器中充入,新平衡时的百分含量减小
D. 时,容器内起始总压为,则用分压表示的该反应的平衡常数
14. 已知反应:,。在恒容密闭容器中反应达到平衡时,若升高体系温度,下列说法正确的是( )
A. 反应正向移动 B. ::
C. 平衡常数增大 D. 混合气体的平均相对分子质量变大
15. 反应在容积为的密闭容器中进行。起始时和均为。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
A. 实验,从反应开始至达到平衡时
B. 实验,用浓度表示的平衡常数为
C. 该反应的
D. 比较实验、可得出升高温度反应速率加快
二、填空题(本大题共3小题)
16. 环戊二烯是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。已知: 。
某温度下,等物质的量的碘和环戊烯在刚性容器内发生上述反应,起始总压为,平衡时总压增加了,环戊烯的转化率为 ,该反应的平衡常数 。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有 填标号。
A.通入惰性气体 提高温度 增加环戊烯浓度 增加碘浓度
17. 治理汽车尾气中和污染的一种方法是将其转化为无害的和,反应原理为。某研究小组在三个容积均为的恒容密闭容器中,分别充入和,在三种不同实验条件下进行上述反应,体系各自保持温度不变,反应体系总压强随时间的变化如图所示。
与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件为实验Ⅰ: ,实验Ⅲ: 。
三组实验中的平衡转化率、和的大小关系为 。
实验Ⅲ的平衡常数 。
18. 合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
据此回答以下问题:
该反应的化学平衡常数表达式为__________________。
根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值_______。填“越大”、“越小”或“不变”
某温度下,若把与置于体积为的密闭容器内,反应达到平衡状态时,测得混合气体总物质的量变为开始时的,则平衡时氢气的转化率_______用百分数表示。能说明该反应达到化学平衡状态的是_______ 填字母。
容器内的密度保持不变 容器内压强保持不变
混合气体中不变
对于合成氨反应而言,下列有关图像一定正确的是选填序号_______。
三、计算题(本大题共1小题)
19. ,时,在体积为固定体积的密闭容器中加入和的,的物质的量随时间的变化如下表:
时间
物质的量
根据表中数据回答:
氢气平衡转化率为________。
时该反应的平衡常数为________。
保持其他条件不变,向平衡体系中充入、、;此时________填“”“”或“”。
答案和解析
1.【答案】
【解答】
根据平衡常数表达式可知反应方程式为,
A.升高温度,化学平衡向吸热反应方向移动,如果正反应是放热反应,则化学平衡常数减小,故A错误;
B.增大浓度,平衡向逆反应方向移动,故B错误;
C.该反应正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,所以的体积分数减少,故C错误;
D.升高温度,平衡向吸热反应方向移动,若的百分含量减少,说明平衡向逆反应方向移动,所以逆反应为吸热反应,正反应是放热反应,故D正确。
故选D。
2.【答案】
【解析】错,平衡移动分正向移动和逆向移动,所以反应物的浓度不一定减小。故选:。
3.【答案】
【解答】
A.由图可知,增大压强,的体积分数减小,说明平衡逆向移动,则,故A正确;
B.由图可知温度升高,的体积分数增大,说明平衡正向移动,则正向为吸热反应,故B正确;
C.对吸热反应来说,温度升高,增大,,故C错误;
D.、温度相同,点压强大,则点的速率大于点,故D正确。
故选C。
4.【答案】
【解答】
A.该反应是放热反应,降低温度,平衡正向移动,生成更多的尿酸钠,更易诱发关节疼痛,故A正确;
B.假设该反应中,,即,若饮水将各物质浓度稀释为,则浓度商,则平衡逆向移动,人体中含量会减少,降低痛风病发作的可能性,故B错误;
C.饮食中摄入过多食盐,增加钠离子浓度,平衡正向移动,生成更多尿酸钠会加重痛风病病情,故C正确;
D.若患痛风病的人多吃能代谢产生更多尿酸的食物,会增大尿酸的浓度,使得平衡正向移动,人体中含量增多,病情加重,故患痛风病的人应少吃能代谢产生更多尿酸的食物,故D正确,
5.【答案】
【解析】解:图中分析可知,点乙烯转化率为,起始::,
起始量
变化量
平衡量
对应的乙醇的物质的量分数,故A正确;
B.温度越高,压强越大,反应速率越大,增大压强平衡正向移动,乙烯转化率增大,故,、、对应的反应速率:,故B错误;
C.温度升高乙烯转化率减小,说明升温平衡逆向移动,正反应为放热反应,温度越高平衡常数越小,、、对应的平衡常数数值:,故C错误;
D.该反应是气体体积减小的放热反应,增大压强平衡正向移动,乙烯转化率增大,升温平衡逆向移动,乙烯转化率减小,故D错误;
故选:。
6.【答案】
【解析】放入固定容积的密闭容器中使其发生分解为气体分子数增加的吸热反应,由图象可知,随着的增大,的值减小。
反应吸热,升高温度,平衡向正反应方向移动,的物质的量减小,故正确;
该反应气体分子数增加,则增大压强,平衡向逆反应方向移动,的转化率减小,故正确;
达到平衡后,因混合气体的质量和体积不变,混合气体的密度将不变,故错误;
增加的物质的量时,平衡向正方向移动,某一生成物的物质的量增加,故错误。
故选:。
7.【答案】
【解答】
A.图可以看出,甲醇的物质的量为的曲线温度大,说明升高温度,甲醇的物质的量减少,即平衡逆向移动,说明正反应是放热反应,所以;因正反应是放热反应,温度降低,平衡正向移动,平衡常数增大,所以说低温时平衡常数大,,故A错误;
B.从平衡状态转到,甲醇含量下降,说明平衡逆向移动,可以采用减小压强的措施,或升温平衡逆向进行的措施,故B错误;
C.利用三段式进行计算;根据平衡常数的定义计算,平衡状态下甲醇物质的量为,
起始量
变化量
平衡量
时,向平衡后的容器中再充入,,,浓度商,平衡正向移动,故C正确;
D.时,向平衡后的容器中再充入,相当于增大容器中压强,平衡正向进行,重新平衡后,的百分含量减小,故D错误;
故选:。
8.【答案】
【解析】 该反应为气体体积增大的吸热反应,所以升温和减压均可以促使反应正向移动,转化率增大。恒压通入惰性气体,相当于减压,平衡正向移动,转化率增大;恒容通入惰性气体与加催化剂均对平衡无影响,转化率不变;增加的浓度,将导致平衡逆向移动,转化率减小。
9.【答案】
【解答】
A.若是压强的改变,使反应物的转化率增大,平衡常数不变,平衡常数只随温度变化,故A错误;
B.对,升高温度,平衡逆向移动,平衡常数减小,故B错误;
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数互为倒数,故C错误;
D.平衡常数为的反应,化学方程式为,故D正确。
故选D。
10.【答案】
【解答】
A.依据平衡常数的概念分析列式得到,为固体不写入平衡常数的表达式, ,故A错误;
B.两种反应物,增加一种物质的量,会提高另一种物质的转化率,本身转化率降低,增加,的平衡转化率减小,故B错误;
C.反应前后气体体积减小,增大压强平衡正向进行,但平衡常数随温度变化,压强变化,平衡常数不变,故C错误;
D.依据平衡三段式列式计算;加入和进行反应,反应一段时间后达到平衡,测得生成,
起始量
变化量
平衡量
的转化率为 ,故D正确。
故选D。
11.【答案】
【解析】若平衡浓度符合关系式:,则平衡常数,对照平衡常数可知温度是,故A正确;
由表中数据可知,温度升高平衡常数减小,说明升高温度平衡逆向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,故B错误;
化学反应的平衡常数表达式为,而平衡常数是生成物浓度的化学计量数次幂的乘积与反应物浓度的化学计量数次幂的乘积的比值,故反应物是一氧化碳和水,生成物是二氧化碳和氢气,该反应的化学方程式为,故C错误;
起始量
变化量
的量
反应前后气体的体积不变,用物质的量代替浓度计算,故,,时不等于,说明反应未达到平衡,反应向逆反应方向进行,故D错误。
12.【答案】
【解析】化学平衡常数是生成物浓度幂之积与反应物浓度幂之积的比值,反应Ⅰ的平衡常数,A错误;
反应物的量逐渐减小,故图中曲线表示的物质的量变化曲线,由反应Ⅱ和Ⅲ可知,温度升高反应Ⅱ正向移动,反应Ⅲ逆向移动,的物质的量增大,故曲线为的物质的量变化曲线,则曲线为的物质的量变化曲线,B错误;
反应Ⅰ为放热反应,反应Ⅱ为吸热反应,降低温度有利于反应Ⅰ正向移动、反应Ⅱ逆向移动,即可提高转化为的转化率,所以需要研发在低温区高效的催化剂,C正确;
反应Ⅱ反应Ⅲ得到目标反应,则的,D错误。
13.【答案】
【解析】先达平衡,所以,由到,温度升高,异丁烯的转化率降低,即平衡逆向移动,正反应为放热反应,则,项错误;点和点异丁烯的转化率相同,即异丁烯的浓度相同,但是点对应的温度高,所以,项错误;维持不变,再向容器中充入,相当于增大压强,平衡正向移动,新平衡时的百分含量增大,项错误;假设甲醇和异丁烯的初始物质的量都是,时异丁烯的平衡转化率为,则消耗的异丁烯为,列出三段式:
初始
消耗
平衡
平衡时总物质的量为,因为是刚性容器,所以容器体积不变,则压强改变,初始压强为,平衡时压强为,则,项符合题意。
14.【答案】
【解析】升高温度,反应逆向进行,A错误;
用不同物质表示同一反应的反应速率时,速率之比等于化学计量数之比,因此有::,B正确;
反应放热,升高温度,平衡逆向移动,平衡常数减小,C错误;
恒容密闭容器中,气体总质量不变,升高温度,平衡逆向移动,,气体的物质的量变大,因此混合气体的平均相对分子质量减小,D错误。
15.【答案】
【解析】实验,设达到平衡时转化的物质的量为 ,根据“三段式”法进行计算:
起始量
转化量
平衡量
则,解得,,项正确。
实验,设平衡时转化的,的物质的量为 ,运用“三段式法进行计算:
起始量
转化量
平衡量
则,解得,则平衡时,故用浓度表示的平衡常数,项正确;
实验相对于实验,容器容积和起始投料量均相同,但起始总压强增大,因此实验的温度高于实验,由于实验达到平衡时转化,实验达到平衡时转化,因此升高温度,平衡向逆反应方向移动,该反应的逆反应为吸热反应,正反应为放热反应,,项错误;
实验相对于实验改变的条件为升高温度,根据题图可知实验比实验先达到平衡,故比较实验、可以得出升高温度反应速率加快,项正确。
16.【答案】
【解析】设起始时碘的物质的量为,至平衡时转化,则
起始
转化
平衡
,解得,环戊烯的转化率为。平衡时总压为,平衡时总物质的量为。
。
该反应是在恒容条件下进行的,通入惰性气体,平衡不移动,项不符合题意;该反应为吸热反应,提高温度,平衡正向移动,环戊烯的转化率增加,项符合题意;增加环戊烯的浓度,环戊烯的转化率降低,项不符合题意;增加碘浓度,平衡正向移动,环戊烯的转化率增加,项符合题意。
17.【答案】升高温度
加催化剂
【解答】
对比Ⅱ、Ⅰ可知,Ⅰ到达平衡时间缩短且起始压强增大,应是升高温度;对比Ⅱ、Ⅲ可知,平衡时压强不变,Ⅲ到达平衡时间缩短,改变条件,反应速率加快且不影响平衡移动,应是使用催化剂;
根据中分析可知,Ⅱ、Ⅲ相比,平衡不移动,故C转化率不变,即,Ⅰ与Ⅱ相比,Ⅰ中温度较高,正反应为放热反应,平衡向逆反应方向移动,的转化率减小,即,故转化率;
利用三段式计算,可知相关数据,假设转化:
恒温恒容下,,根据图中数据推出,得,可知平衡时的浓度为,的浓度为,的浓度为,的浓度为,故平衡常数。
18.【答案】
越小
;
【解答】
为生成物浓度幂之积与反应物浓度幂之积的比,则,故答案为:;
该反应为放热反应,升高温度,平衡逆向移动,则平衡常数减小,温度越高,越小,故答案为:越小;
设氮气消耗物质的量为
开始
转化
平衡
反应达到平衡状态时,测得混合气体总物质的量变为开始时的,
,
解得,则平衡时氢气的转化率;
由平衡的特征“等”、“定”可判定平衡,则
容器的体积、气体的质量始终不变,则容器内的密度保持不变,不能判断平衡,故错误;
该反应为反应前后体积不等的反应,则容器内压强保持不变,达到平衡,故正确;
,正逆反应速率不等,反应没有达到平衡,故错误;
混合气体中 不变,为平衡的特征,达到平衡,故正确;
故答案为:;;
先出现拐点的先达到平衡,则大,温度高,平衡逆向移动,与图象一致,故正确;
平衡时浓度不一定相等,平衡浓度取决于起始浓度和转化率,图象表示错误,故错误;
使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故正确;
故答案为:;
19.【答案】
【解答】
,的物质的量随时间的变化可知反应达到平衡状态时,物质的量为,变化了,则变化的氢气物质的量,氢气转化率为;
时,,平衡状态下物质的量,物质的量浓度为,
起始量
变化量
平衡量
该反应的平衡常数;
保持其他条件不变,向平衡体系中充入、、,此时的浓度熵,平衡正向进行,则。
第1页,共1页
