3.4沉淀溶解平衡 基础练习(含解析) 2022-2023学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.4沉淀溶解平衡 基础练习(含解析) 2022-2023学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | zip | ||
| 文件大小 | 441.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-03 15:22:27 | ||
图片预览



文档简介
3.4沉淀溶解平衡
一、单选题(本大题共14小题)
1. 时,已知下列三种金属硫化物的溶度积常数分别为,,。下列有关叙述正确的是( )
A. 硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B. 将足量的晶体加入到的溶液中,的浓度最大只能达到
C. 除去工业废水中的,可用固体作为沉淀剂
D. 向饱和溶液中加入溶液后,混合液中变大、变小,变大
2. 化工生产中常用作沉淀剂除去工业废水中的:下列有关叙述中正确的是( )
的大于的达到平衡时溶液中加入少量固体后,溶液中、保持不变 该反应平衡常数
A. B. C. D.
3. 某温度时,在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A. 含有大量的溶液中肯定不存在
B. 该温度下,的溶度积常数的数量级是
C. 可以通过改变温度或加入硫酸银固体使点移动到点
D. 该温度下,的溶液与的溶液等体积混合,不会生成沉淀
4. 时,已知下列三种金属硫化物的溶度积常数分别为;;。下列关于常温时的有关叙述正确的是( )
A. 硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B. 将足量的晶体加入的溶液中,的浓度最大只能达到
C. 除去工业废水中含有的,可采用固体作为沉淀剂
D. 向饱和的溶液中加入溶液后,混合液中变大、变小,但变大
5. 常温下,,。和在水中的沉淀溶解平衡曲线如图所示表示或,下列说法错误的是( )
A. 曲线Ⅰ表示的沉淀溶解平衡曲线
B. 升高温度,曲线Ⅱ上的点可沿虚线平移至点
C. 常温下,反应的平衡常数
D. 向点溶液中加入少量固体,溶液组成由点沿Ⅰ线向点方向移动
6. 在悬浊液中存在平衡:。已知常温下, 。下列叙述正确的是( )
A. 常温下, 悬浊液中
B. 温度不变时,向悬浊液中加入少量粉末,平衡向左移动,减小
C. 向悬浊液中加入溶液,白色沉淀转化为淡黄色,说明
D. 常温下,将 溶液与 的 溶液等体积混合,无沉淀析出
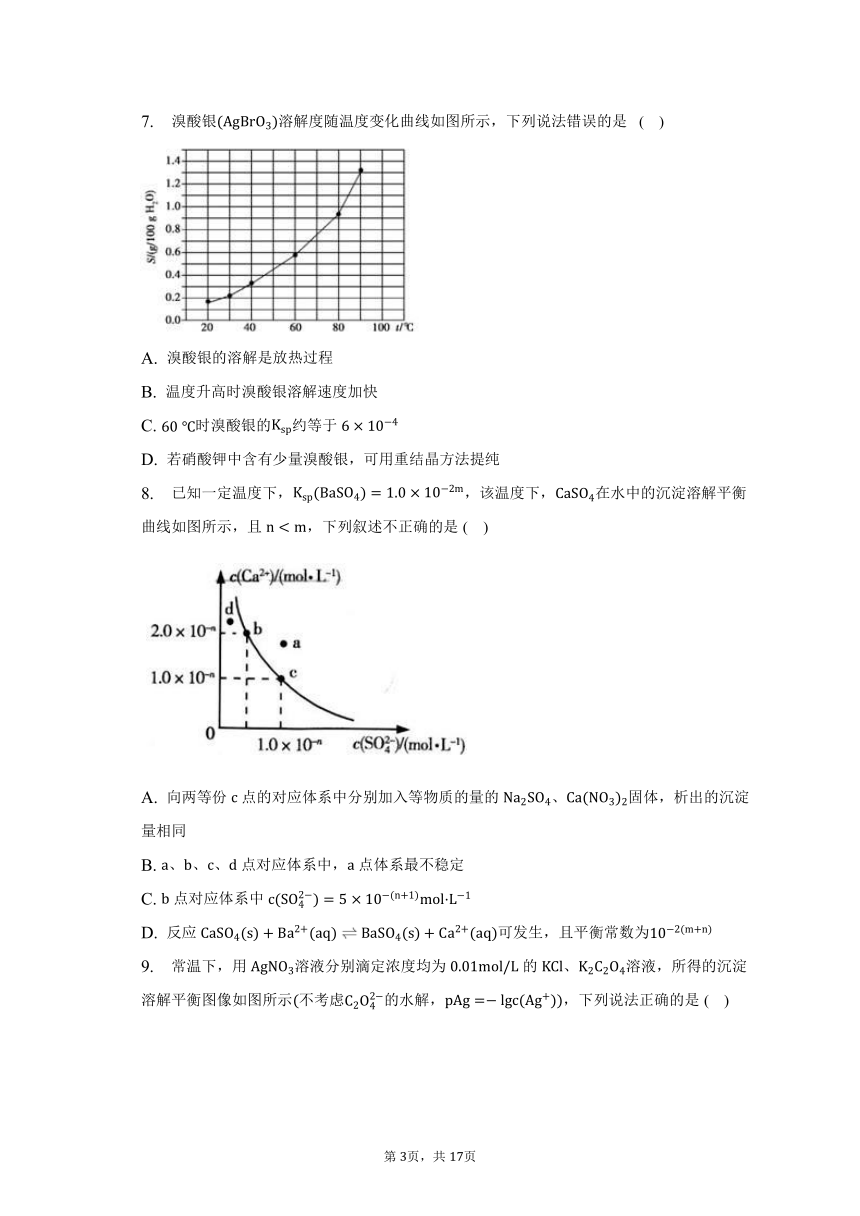
7. 溴酸银溶解度随温度变化曲线如图所示,下列说法错误的是 ( )
A. 溴酸银的溶解是放热过程
B. 温度升高时溴酸银溶解速度加快
C. 时溴酸银的约等于
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
8. 已知一定温度下,,该温度下,在水中的沉淀溶解平衡曲线如图所示,且,下列叙述不正确的是( )
A. 向两等份点的对应体系中分别加入等物质的量的、固体,析出的沉淀量相同
B. 、、、点对应体系中,点体系最不稳定
C. 点对应体系中
D. 反应可发生,且平衡常数为
9. 常温下,用溶液分别滴定浓度均为的、溶液,所得的沉淀溶解平衡图像如图所示不考虑的水解,,下列说法正确的是( )
A. 的数量级等于
B. 点表示的不饱和溶液
C. 向的混合液中滴入溶液时,先生成沉淀
D. 的平衡常数为
10. 由于铬酸银是红棕色且溶解度大于卤化银的难溶物,因此铬酸银常用于卤化物莫氏法滴定确定终点的指示剂。在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A. 图中和分别为、温度下在水中的溶解度
B. 图中各点对应的
C. 向点的悬浊液中加入固体,溶液组成可能会由向方向移动
D. 根据曲线数据计算可知,温度下,
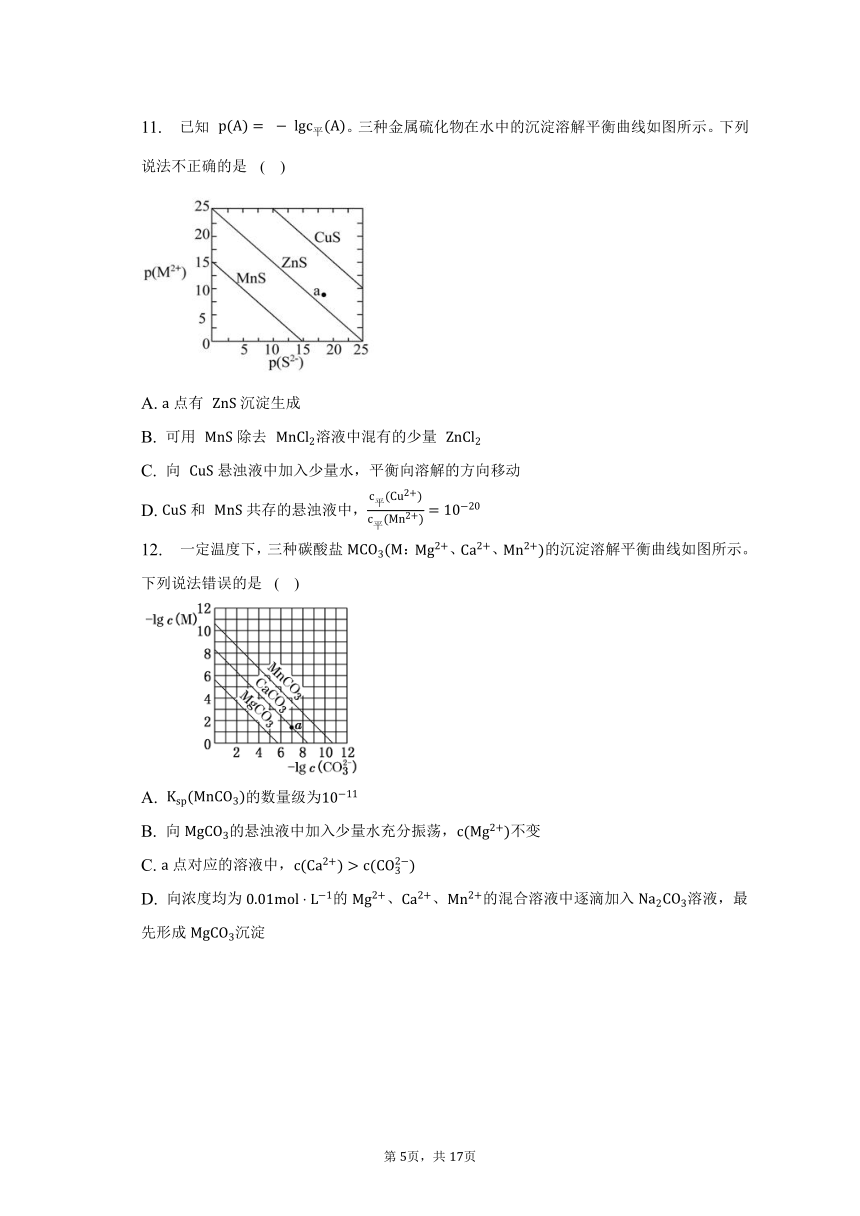
11. 已知 。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是 ( )
A. 点有 沉淀生成
B. 可用 除去 溶液中混有的少量
C. 向 悬浊液中加入少量水,平衡向溶解的方向移动
D. 和 共存的悬浊液中,
12. 一定温度下,三种碳酸盐:、、的沉淀溶解平衡曲线如图所示。下列说法错误的是 ( )
A. 的数量级为
B. 向的悬浊液中加入少量水充分振荡,不变
C. 点对应的溶液中,
D. 向浓度均为的、、的混合溶液中逐滴加入溶液,最先形成沉淀
13. 下,三种硫酸盐:、、的沉淀溶解平衡曲线如下图所示。已知,。下列说法正确的是( )
A. 溶度积:
B. 点对是不饱和溶液,能继续溶解
C. 点对应的溶液中,二者的浓度积等于
D. 不可能转化成
14. 已知:,。时几种物质的如下表:
化学式
颜色 白 浅黄 红
、、的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是 ( )
A. 图中代表曲线,代表曲线
B. 时,在和的物质的量浓度均为的溶液中,滴入少量 的溶液,首先产生的是红色沉淀
C. 时若增大点的阴离子浓度,则上的点沿曲线向上移动
D. 时的平衡常数
二、填空题(本大题共4小题)
15. 、两种温度下在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:
________填“”、“”或“”,时____________。
图中点对应的是的:__________________填“饱和溶液”或“不饱和溶液”。
根据温度时的沉淀溶解平衡曲线,判断下列说法正确的是________填序号。
A.加入可由点变为点
B.在曲线上方区域不含曲线的任意一点时,均有沉淀生成
C.蒸发溶剂可能由点变为曲线上、之间的某一点不含、
D.升温可由点变为点
16. 已知:,,时开始沉淀。室温下,除溶液中的、使其浓度均小于,需调节溶液范围为________。
已知常温下,在溶液中加入氨水充分搅拌,有沉淀生成,当溶液的时,________。
已知:。室温下,除去被还原所得溶液中的使其浓度小于,需调节溶液________。
已知,,。某溶液中含有、和的浓度均为,向该溶液中逐滴加入的溶液时,三种阴离子产生沉淀的先后顺序为_____________________________________________________________________。
大量的碘富集在海藻中,用水浸取后浓缩,该浓缩液中主要含有、等离子。取一定量的浓缩液,向其中滴加溶液,当开始沉淀时,溶液中为________已知,。
17. 某溶液中含和,且,加入双氧水和磷酸设溶液体积增加倍,使恰好沉淀完全即溶液中,此时是否有沉淀生成 列式计算。、的分别为,。
18. 实验室利用某印刷电路厂的废腐蚀液含大量、、、、按下述流程来制备氯化铜晶体。
已知:金属阳离子开始沉淀及沉淀完全时的如下表所示:
开始沉淀
完全沉淀
时,。
回答下列问题:
上述流程中废腐蚀液所加物质的目的是__________,所加物质为______________填选项字母。
酸性
加入的物质的化学式是____________,加入物质的目的是调整溶液的。
溶度积的表达式______________;常温下,某溶液中
,如果生成沉淀,应调整溶液的,使之大于_____________;要使溶液中浓度降至原来的千分之一,则应向溶液里加入溶液,使溶液的为___________。
某温度下,、分别在溶液中达到沉淀溶解平衡后,改变溶液,金属阳离子浓度的变化如图所示。据图分析,下列判断 错误的是_________________填选项字母。
加适量固体可使溶液由点变到点
、两点代表的溶液中与的乘积相等
、分别在、两点代表的溶液中达到饱和
答案和解析
1.【答案】
【解答】
A.这三种硫化物的溶度积常数表达式相同,则溶度积常数越大其溶解度越大,根据溶度积常数知,这几种物质的溶解度,故A错误;
B.将足量晶体加入到的溶液中,生成沉淀,溶液中小于,锌离子浓度,故B错误;
C.溶解度大的物质能转化为溶解度小的物质,溶解度,所以某工业废水中含有,欲除去可采用固体作为沉淀剂,故C正确;
D.溶度积常数只与温度有关,向饱和的溶液中加入溶液后,混合液中变大而抑制溶解,则变小,温度不变,则不变,故D错误。
故选C。
2.【答案】
【解析】化学式相似的物质,溶度积大的物质容易转化为溶度积小的物质,所以的比的大,正确;该反应达到平衡时各离子的浓度保持不变,但不相等,错误;溶液中加入少量固体后,溶液中增大,由于温度不变,溶度积不变,故、均减小,错误;反应的平衡常数,正确。
3.【答案】
【解答】
A.在水溶液中存在溶解平衡,含有大量的溶液抑制溶解,但是也有少量的溶解,所以存在,故A错误;
B.,故B错误;
C.如果改变温度,溶液中、都改变,点为不饱和溶液,如果加入,、都增大,所以不能通过升高温度或加入硫酸银固体使点移动到点,故C错误;
D.,溶液混合后体积增大一倍则浓度降为原来的一半,则该混合溶液中浓度积,所以没有沉淀生成,故D正确;
故选:。
4.【答案】
【解答】
A.化学式所表示的组成中阴、阳离子个数比相同时,数值越大的难溶电解质在水中的溶解能力越强,由可知,常温下,的溶解度最小,故A错误;
B.将足量的晶体加入的溶液中,将减至非常小,而的浓度远远大于 ,故B错误;
C.因比更难溶,沉淀可转化为沉淀,故C正确;
D.温度不变,不变,故D错误。
5.【答案】
【解答】
A.,结合图象可知,曲线Ⅰ表示的沉淀溶解平衡曲线,曲线Ⅱ表示的沉淀溶解平衡曲线,故A正确;
B.升高温度,增大,曲线Ⅱ上的点可沿虚线向点方向平移,故B错误;
C.常温下,反应的平衡常数,故C正确;
D.温度不变,不变,向点溶液中加入少量固体,增大,减小,溶液组成可由点沿Ⅰ线向点方向移动,故D正确。
6.【答案】
【解析】解:常温下, 悬浊液中达到沉淀溶解平衡,则溶液中 ,故A正确;
B.温度不变,溶度积常数不变,所以向 悬浊液中加入少量 粉末,平衡向左移动,不变,故B错误;
C.向悬浊液中加入溶液,白色沉淀转化为淡黄色,说明转化为,与是同类型沉淀,可以说明,故C错误;
D.常温下,将 溶液与 的 溶液等体积混合,则溶液中,,所以,所以有沉淀析出,故D错误,
故选:。
7.【答案】
【解答】
A.由图可知,升高温度,溴酸银的溶解度增大,说明溴酸银的溶解过程为吸热过程,故A错误;
B.升高温度,溴酸银的溶解度增大,所以温度升高时溴酸银溶解速度加快,故B正确;
C.时溴酸银的溶解度为,溴酸银的物质的量为,溴酸银溶液的体积约为,溶液中银离子、溴酸根离子浓度约为,所以时溴酸银的,故C正确;
D.由于硝酸钾的溶解度比较大,而溴酸银的溶解度较小,所以若硝酸钾中含有少量溴酸银,可用重结晶方法提纯,故 D正确。
故选A。
8.【答案】
【解答】
A.点对应饱和溶液,且,又加入的、相等,故析出的沉淀量相同,故A正确;
B.点对应过饱和溶液,、点对应饱和溶液,点对应不饱和溶液,点对应体系最不稳定,故B正确;
C.根据图示可知,,点对应体系中,故C正确;
D.由于,故C可转化为:,,故D错误。
故选D。
9.【答案】
【解答】
A.由图像可得到,数量级等于,故A错误;
B.点对应的大于具有相同的的饱和溶液,故点表示的过饱和溶液,故B错误;
C.根据图象可知,当阴离子浓度相同时,生成沉淀所需的小,故向的混合液中滴入溶液时,先析出氯化银沉淀,故C错误;
D.的平衡常数,此时溶液中的相同,故有:,故D正确;
故选D。
10.【答案】
【解答】
A.饱和溶液中,,因此和不代表、温度下在水中的溶解度,故A错误;
B.沉淀溶解吸收热量,温度升高增大,则,图中各点对应的,故B错误;
C.向点的悬浊液中加入固体,溶液中减小,故C错误;
D.温度下,,故D正确;
故选D。
11.【答案】
【解答】
当横坐标相同时,纵坐标数值越大,金属阳离子浓度越小,其溶度积常数越小,根据图知,溶度积常数:;
A.在曲线下方表示过饱和溶液,曲线上表示饱和溶液,曲线上方表示不饱和溶液,对于,点为不饱和溶液,所以点无沉淀生成,故A错误;
B.难溶物类型相同时,溶度积常数大的难溶物能转化为溶度积常数小的难溶物,,所以可用除去溶液中混有的少量,故B正确;
C.向悬浊液中加入少量水,平衡向溶解的方向移动,故C正确;
D.和共存的悬浊液中,,故D正确。
12.【答案】
【解答】
A. 由图像中的沉淀溶解平衡曲线可知,当 时, ,而,项正确;
B. 一定温度时,向的悬浊液中加入少量水充分振荡,仍为悬浊液,故不变,项正确;
C. 点对应溶液为饱和溶液, ,所以,项正确;
D. 由图像可知,,故向浓度均为的、、的混合溶液中逐滴加入溶液,最先形成沉淀,项错误。
13.【答案】
【解析】越大,、、浓度越小,越大,越小,所以溶度积,A错误;点对应的溶液,所以是不饱和溶液,能继续溶解,B正确;点对应的溶液中,二者的浓度积等于,C错误;增大的浓度,能转化成,D错误。
14.【答案】
【解答】
当相等时,如时,溶液中,溶液中,溶液中,可知为,为,为的浓度曲线,以此解答该题。
A.由以上分析可知图中代表曲线,代表曲线,故A错误;
B.向、均为的混合溶液中逐滴加入稀硝酸银溶液,形成沉淀需要的浓度为;形成沉淀需要的浓度为,形成沉淀需要的浓度较小,因此先析出沉淀,故B错误;
C. 时若增大点的阴离子浓度,则银离子浓度减小,上的点沿曲线向下移动,故C错误;
D. 时的平衡常数,故D正确。
故选:。
15.【答案】; ;
不饱和溶液;
【解答】
温度升高,在水中的溶解度增大,平衡时溶液中的离子浓度更大,因此温度大小关系为;根据曲线上的点对应的和的浓度分别为,,则在温度时的溶度积常数为
点对应的钡离子浓度与硫酸根离子的浓度的乘积小于,则为不饱和溶液。
在水中存在沉淀溶解平衡,加入固体可使溶液中浓度增加,导致沉淀溶解平衡逆向移动,溶液中浓度减小,因此加入可由点变为点,故A正确;
B.在曲线上方区域不含曲线的任意一点时,相对于曲线上的点来说,其浓度商,沉淀溶解平衡向生成沉淀方向移动,因此均有沉淀生成,故B正确;
C.蒸发溶剂,则溶液中溶质的物质的量浓度增加,但若形成饱和溶液则随着蒸发溶剂析出晶体,溶液仍为饱和溶液,溶液中浓度商,因此蒸发溶剂可能由点变为曲线上、之间的某一点不含、,故C正确;
D.温度升高,则的溶解度增加,此时溶液中离子浓度都会增加,原本饱和溶液也会变成不饱和溶液导致沉淀溶解平衡正向移动,不可能由点变为点,故D错误。
16.【答案】;
;
;
、、;
。
【解析】由氢氧化铝和氢氧化铁的可知,使完全沉淀时,肯定已经完全沉淀,,,,,为了不使沉淀,所以要小于,
故答案为:;
溶液,则,有氢氧化铝沉淀生成,可知溶液为氢氧化铝饱和溶液,,
故答案为:;
由,则,,
,
故答案为:;
根据沉淀的溶解平衡原理,当时,有沉淀生成,溶液中的、、的浓度均为,当向该溶液中逐滴加入的溶液时,氯化银和溴化银结构相似,小的先生成沉淀,即溴化银首先生成沉淀,再比较氯化银和铬酸银,生成沉淀需,生成沉淀需要,故三种阴离子产生沉淀的先后顺序为、、,
故答案为:、、;
当开始沉淀时,早已沉淀完全,已达沉淀平衡,溶液中,
故答案为:。
17.【答案】恰好沉淀完全时,,,因此不会生成沉淀
18.【答案】将氧化成;
或或或
;;
【解答】
腐蚀液回收铜离子,根据物质的性质去除和,首先要将转化为,根据流程图可知既不引入杂质又可氧化,故答案为:将氧化成;;
该步骤为沉淀铁离子,加入氢氧根可达到目的,按不引人杂质原则选择或或或可达到沉淀目的,故答案为:或或或溶度积的表达式;
按照溶度积的表达式书写原则可知溶度积的表达式
;溶液里,如果生成沉淀,则应有,则
所以要使 溶液中浓度降至原来的千分之一,的浓度为,又因为,则的浓度为,时,,则的浓度为,即,故答案为:
;;;
向溶液中加入固体,不会导致溶液中的增大,故不能使溶液由点变到点,故错误;
只要温度不发生改变,溶液中与的乘积即就不变.该题中温度条件不变,故、两点代表的溶液中与的乘积相等,故
正确;
由、两点对应数据可比较出与的大小,,
,
因,故K,故正确;
、两点分别处在两条的沉淀溶解平衡曲线上,故两点均代表溶液达到饱和,故正确。
故答案为:。
第1页,共1页
一、单选题(本大题共14小题)
1. 时,已知下列三种金属硫化物的溶度积常数分别为,,。下列有关叙述正确的是( )
A. 硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B. 将足量的晶体加入到的溶液中,的浓度最大只能达到
C. 除去工业废水中的,可用固体作为沉淀剂
D. 向饱和溶液中加入溶液后,混合液中变大、变小,变大
2. 化工生产中常用作沉淀剂除去工业废水中的:下列有关叙述中正确的是( )
的大于的达到平衡时溶液中加入少量固体后,溶液中、保持不变 该反应平衡常数
A. B. C. D.
3. 某温度时,在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A. 含有大量的溶液中肯定不存在
B. 该温度下,的溶度积常数的数量级是
C. 可以通过改变温度或加入硫酸银固体使点移动到点
D. 该温度下,的溶液与的溶液等体积混合,不会生成沉淀
4. 时,已知下列三种金属硫化物的溶度积常数分别为;;。下列关于常温时的有关叙述正确的是( )
A. 硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B. 将足量的晶体加入的溶液中,的浓度最大只能达到
C. 除去工业废水中含有的,可采用固体作为沉淀剂
D. 向饱和的溶液中加入溶液后,混合液中变大、变小,但变大
5. 常温下,,。和在水中的沉淀溶解平衡曲线如图所示表示或,下列说法错误的是( )
A. 曲线Ⅰ表示的沉淀溶解平衡曲线
B. 升高温度,曲线Ⅱ上的点可沿虚线平移至点
C. 常温下,反应的平衡常数
D. 向点溶液中加入少量固体,溶液组成由点沿Ⅰ线向点方向移动
6. 在悬浊液中存在平衡:。已知常温下, 。下列叙述正确的是( )
A. 常温下, 悬浊液中
B. 温度不变时,向悬浊液中加入少量粉末,平衡向左移动,减小
C. 向悬浊液中加入溶液,白色沉淀转化为淡黄色,说明
D. 常温下,将 溶液与 的 溶液等体积混合,无沉淀析出
7. 溴酸银溶解度随温度变化曲线如图所示,下列说法错误的是 ( )
A. 溴酸银的溶解是放热过程
B. 温度升高时溴酸银溶解速度加快
C. 时溴酸银的约等于
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
8. 已知一定温度下,,该温度下,在水中的沉淀溶解平衡曲线如图所示,且,下列叙述不正确的是( )
A. 向两等份点的对应体系中分别加入等物质的量的、固体,析出的沉淀量相同
B. 、、、点对应体系中,点体系最不稳定
C. 点对应体系中
D. 反应可发生,且平衡常数为
9. 常温下,用溶液分别滴定浓度均为的、溶液,所得的沉淀溶解平衡图像如图所示不考虑的水解,,下列说法正确的是( )
A. 的数量级等于
B. 点表示的不饱和溶液
C. 向的混合液中滴入溶液时,先生成沉淀
D. 的平衡常数为
10. 由于铬酸银是红棕色且溶解度大于卤化银的难溶物,因此铬酸银常用于卤化物莫氏法滴定确定终点的指示剂。在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A. 图中和分别为、温度下在水中的溶解度
B. 图中各点对应的
C. 向点的悬浊液中加入固体,溶液组成可能会由向方向移动
D. 根据曲线数据计算可知,温度下,
11. 已知 。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是 ( )
A. 点有 沉淀生成
B. 可用 除去 溶液中混有的少量
C. 向 悬浊液中加入少量水,平衡向溶解的方向移动
D. 和 共存的悬浊液中,
12. 一定温度下,三种碳酸盐:、、的沉淀溶解平衡曲线如图所示。下列说法错误的是 ( )
A. 的数量级为
B. 向的悬浊液中加入少量水充分振荡,不变
C. 点对应的溶液中,
D. 向浓度均为的、、的混合溶液中逐滴加入溶液,最先形成沉淀
13. 下,三种硫酸盐:、、的沉淀溶解平衡曲线如下图所示。已知,。下列说法正确的是( )
A. 溶度积:
B. 点对是不饱和溶液,能继续溶解
C. 点对应的溶液中,二者的浓度积等于
D. 不可能转化成
14. 已知:,。时几种物质的如下表:
化学式
颜色 白 浅黄 红
、、的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是 ( )
A. 图中代表曲线,代表曲线
B. 时,在和的物质的量浓度均为的溶液中,滴入少量 的溶液,首先产生的是红色沉淀
C. 时若增大点的阴离子浓度,则上的点沿曲线向上移动
D. 时的平衡常数
二、填空题(本大题共4小题)
15. 、两种温度下在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:
________填“”、“”或“”,时____________。
图中点对应的是的:__________________填“饱和溶液”或“不饱和溶液”。
根据温度时的沉淀溶解平衡曲线,判断下列说法正确的是________填序号。
A.加入可由点变为点
B.在曲线上方区域不含曲线的任意一点时,均有沉淀生成
C.蒸发溶剂可能由点变为曲线上、之间的某一点不含、
D.升温可由点变为点
16. 已知:,,时开始沉淀。室温下,除溶液中的、使其浓度均小于,需调节溶液范围为________。
已知常温下,在溶液中加入氨水充分搅拌,有沉淀生成,当溶液的时,________。
已知:。室温下,除去被还原所得溶液中的使其浓度小于,需调节溶液________。
已知,,。某溶液中含有、和的浓度均为,向该溶液中逐滴加入的溶液时,三种阴离子产生沉淀的先后顺序为_____________________________________________________________________。
大量的碘富集在海藻中,用水浸取后浓缩,该浓缩液中主要含有、等离子。取一定量的浓缩液,向其中滴加溶液,当开始沉淀时,溶液中为________已知,。
17. 某溶液中含和,且,加入双氧水和磷酸设溶液体积增加倍,使恰好沉淀完全即溶液中,此时是否有沉淀生成 列式计算。、的分别为,。
18. 实验室利用某印刷电路厂的废腐蚀液含大量、、、、按下述流程来制备氯化铜晶体。
已知:金属阳离子开始沉淀及沉淀完全时的如下表所示:
开始沉淀
完全沉淀
时,。
回答下列问题:
上述流程中废腐蚀液所加物质的目的是__________,所加物质为______________填选项字母。
酸性
加入的物质的化学式是____________,加入物质的目的是调整溶液的。
溶度积的表达式______________;常温下,某溶液中
,如果生成沉淀,应调整溶液的,使之大于_____________;要使溶液中浓度降至原来的千分之一,则应向溶液里加入溶液,使溶液的为___________。
某温度下,、分别在溶液中达到沉淀溶解平衡后,改变溶液,金属阳离子浓度的变化如图所示。据图分析,下列判断 错误的是_________________填选项字母。
加适量固体可使溶液由点变到点
、两点代表的溶液中与的乘积相等
、分别在、两点代表的溶液中达到饱和
答案和解析
1.【答案】
【解答】
A.这三种硫化物的溶度积常数表达式相同,则溶度积常数越大其溶解度越大,根据溶度积常数知,这几种物质的溶解度,故A错误;
B.将足量晶体加入到的溶液中,生成沉淀,溶液中小于,锌离子浓度,故B错误;
C.溶解度大的物质能转化为溶解度小的物质,溶解度,所以某工业废水中含有,欲除去可采用固体作为沉淀剂,故C正确;
D.溶度积常数只与温度有关,向饱和的溶液中加入溶液后,混合液中变大而抑制溶解,则变小,温度不变,则不变,故D错误。
故选C。
2.【答案】
【解析】化学式相似的物质,溶度积大的物质容易转化为溶度积小的物质,所以的比的大,正确;该反应达到平衡时各离子的浓度保持不变,但不相等,错误;溶液中加入少量固体后,溶液中增大,由于温度不变,溶度积不变,故、均减小,错误;反应的平衡常数,正确。
3.【答案】
【解答】
A.在水溶液中存在溶解平衡,含有大量的溶液抑制溶解,但是也有少量的溶解,所以存在,故A错误;
B.,故B错误;
C.如果改变温度,溶液中、都改变,点为不饱和溶液,如果加入,、都增大,所以不能通过升高温度或加入硫酸银固体使点移动到点,故C错误;
D.,溶液混合后体积增大一倍则浓度降为原来的一半,则该混合溶液中浓度积,所以没有沉淀生成,故D正确;
故选:。
4.【答案】
【解答】
A.化学式所表示的组成中阴、阳离子个数比相同时,数值越大的难溶电解质在水中的溶解能力越强,由可知,常温下,的溶解度最小,故A错误;
B.将足量的晶体加入的溶液中,将减至非常小,而的浓度远远大于 ,故B错误;
C.因比更难溶,沉淀可转化为沉淀,故C正确;
D.温度不变,不变,故D错误。
5.【答案】
【解答】
A.,结合图象可知,曲线Ⅰ表示的沉淀溶解平衡曲线,曲线Ⅱ表示的沉淀溶解平衡曲线,故A正确;
B.升高温度,增大,曲线Ⅱ上的点可沿虚线向点方向平移,故B错误;
C.常温下,反应的平衡常数,故C正确;
D.温度不变,不变,向点溶液中加入少量固体,增大,减小,溶液组成可由点沿Ⅰ线向点方向移动,故D正确。
6.【答案】
【解析】解:常温下, 悬浊液中达到沉淀溶解平衡,则溶液中 ,故A正确;
B.温度不变,溶度积常数不变,所以向 悬浊液中加入少量 粉末,平衡向左移动,不变,故B错误;
C.向悬浊液中加入溶液,白色沉淀转化为淡黄色,说明转化为,与是同类型沉淀,可以说明,故C错误;
D.常温下,将 溶液与 的 溶液等体积混合,则溶液中,,所以,所以有沉淀析出,故D错误,
故选:。
7.【答案】
【解答】
A.由图可知,升高温度,溴酸银的溶解度增大,说明溴酸银的溶解过程为吸热过程,故A错误;
B.升高温度,溴酸银的溶解度增大,所以温度升高时溴酸银溶解速度加快,故B正确;
C.时溴酸银的溶解度为,溴酸银的物质的量为,溴酸银溶液的体积约为,溶液中银离子、溴酸根离子浓度约为,所以时溴酸银的,故C正确;
D.由于硝酸钾的溶解度比较大,而溴酸银的溶解度较小,所以若硝酸钾中含有少量溴酸银,可用重结晶方法提纯,故 D正确。
故选A。
8.【答案】
【解答】
A.点对应饱和溶液,且,又加入的、相等,故析出的沉淀量相同,故A正确;
B.点对应过饱和溶液,、点对应饱和溶液,点对应不饱和溶液,点对应体系最不稳定,故B正确;
C.根据图示可知,,点对应体系中,故C正确;
D.由于,故C可转化为:,,故D错误。
故选D。
9.【答案】
【解答】
A.由图像可得到,数量级等于,故A错误;
B.点对应的大于具有相同的的饱和溶液,故点表示的过饱和溶液,故B错误;
C.根据图象可知,当阴离子浓度相同时,生成沉淀所需的小,故向的混合液中滴入溶液时,先析出氯化银沉淀,故C错误;
D.的平衡常数,此时溶液中的相同,故有:,故D正确;
故选D。
10.【答案】
【解答】
A.饱和溶液中,,因此和不代表、温度下在水中的溶解度,故A错误;
B.沉淀溶解吸收热量,温度升高增大,则,图中各点对应的,故B错误;
C.向点的悬浊液中加入固体,溶液中减小,故C错误;
D.温度下,,故D正确;
故选D。
11.【答案】
【解答】
当横坐标相同时,纵坐标数值越大,金属阳离子浓度越小,其溶度积常数越小,根据图知,溶度积常数:;
A.在曲线下方表示过饱和溶液,曲线上表示饱和溶液,曲线上方表示不饱和溶液,对于,点为不饱和溶液,所以点无沉淀生成,故A错误;
B.难溶物类型相同时,溶度积常数大的难溶物能转化为溶度积常数小的难溶物,,所以可用除去溶液中混有的少量,故B正确;
C.向悬浊液中加入少量水,平衡向溶解的方向移动,故C正确;
D.和共存的悬浊液中,,故D正确。
12.【答案】
【解答】
A. 由图像中的沉淀溶解平衡曲线可知,当 时, ,而,项正确;
B. 一定温度时,向的悬浊液中加入少量水充分振荡,仍为悬浊液,故不变,项正确;
C. 点对应溶液为饱和溶液, ,所以,项正确;
D. 由图像可知,,故向浓度均为的、、的混合溶液中逐滴加入溶液,最先形成沉淀,项错误。
13.【答案】
【解析】越大,、、浓度越小,越大,越小,所以溶度积,A错误;点对应的溶液,所以是不饱和溶液,能继续溶解,B正确;点对应的溶液中,二者的浓度积等于,C错误;增大的浓度,能转化成,D错误。
14.【答案】
【解答】
当相等时,如时,溶液中,溶液中,溶液中,可知为,为,为的浓度曲线,以此解答该题。
A.由以上分析可知图中代表曲线,代表曲线,故A错误;
B.向、均为的混合溶液中逐滴加入稀硝酸银溶液,形成沉淀需要的浓度为;形成沉淀需要的浓度为,形成沉淀需要的浓度较小,因此先析出沉淀,故B错误;
C. 时若增大点的阴离子浓度,则银离子浓度减小,上的点沿曲线向下移动,故C错误;
D. 时的平衡常数,故D正确。
故选:。
15.【答案】; ;
不饱和溶液;
【解答】
温度升高,在水中的溶解度增大,平衡时溶液中的离子浓度更大,因此温度大小关系为;根据曲线上的点对应的和的浓度分别为,,则在温度时的溶度积常数为
点对应的钡离子浓度与硫酸根离子的浓度的乘积小于,则为不饱和溶液。
在水中存在沉淀溶解平衡,加入固体可使溶液中浓度增加,导致沉淀溶解平衡逆向移动,溶液中浓度减小,因此加入可由点变为点,故A正确;
B.在曲线上方区域不含曲线的任意一点时,相对于曲线上的点来说,其浓度商,沉淀溶解平衡向生成沉淀方向移动,因此均有沉淀生成,故B正确;
C.蒸发溶剂,则溶液中溶质的物质的量浓度增加,但若形成饱和溶液则随着蒸发溶剂析出晶体,溶液仍为饱和溶液,溶液中浓度商,因此蒸发溶剂可能由点变为曲线上、之间的某一点不含、,故C正确;
D.温度升高,则的溶解度增加,此时溶液中离子浓度都会增加,原本饱和溶液也会变成不饱和溶液导致沉淀溶解平衡正向移动,不可能由点变为点,故D错误。
16.【答案】;
;
;
、、;
。
【解析】由氢氧化铝和氢氧化铁的可知,使完全沉淀时,肯定已经完全沉淀,,,,,为了不使沉淀,所以要小于,
故答案为:;
溶液,则,有氢氧化铝沉淀生成,可知溶液为氢氧化铝饱和溶液,,
故答案为:;
由,则,,
,
故答案为:;
根据沉淀的溶解平衡原理,当时,有沉淀生成,溶液中的、、的浓度均为,当向该溶液中逐滴加入的溶液时,氯化银和溴化银结构相似,小的先生成沉淀,即溴化银首先生成沉淀,再比较氯化银和铬酸银,生成沉淀需,生成沉淀需要,故三种阴离子产生沉淀的先后顺序为、、,
故答案为:、、;
当开始沉淀时,早已沉淀完全,已达沉淀平衡,溶液中,
故答案为:。
17.【答案】恰好沉淀完全时,,,因此不会生成沉淀
18.【答案】将氧化成;
或或或
;;
【解答】
腐蚀液回收铜离子,根据物质的性质去除和,首先要将转化为,根据流程图可知既不引入杂质又可氧化,故答案为:将氧化成;;
该步骤为沉淀铁离子,加入氢氧根可达到目的,按不引人杂质原则选择或或或可达到沉淀目的,故答案为:或或或溶度积的表达式;
按照溶度积的表达式书写原则可知溶度积的表达式
;溶液里,如果生成沉淀,则应有,则
所以要使 溶液中浓度降至原来的千分之一,的浓度为,又因为,则的浓度为,时,,则的浓度为,即,故答案为:
;;;
向溶液中加入固体,不会导致溶液中的增大,故不能使溶液由点变到点,故错误;
只要温度不发生改变,溶液中与的乘积即就不变.该题中温度条件不变,故、两点代表的溶液中与的乘积相等,故
正确;
由、两点对应数据可比较出与的大小,,
,
因,故K,故正确;
、两点分别处在两条的沉淀溶解平衡曲线上,故两点均代表溶液达到饱和,故正确。
故答案为:。
第1页,共1页
