4.3金属的腐蚀与防护 基础练习(含解析) 2022-2023学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3金属的腐蚀与防护 基础练习(含解析) 2022-2023学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | zip | ||
| 文件大小 | 445.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-03 15:25:54 | ||
图片预览

文档简介
4.3金属的腐蚀与防护
一、单选题(本大题共14小题)
1. 对金属腐蚀及防护的表述正确的是( )
A. 金属腐蚀的本质:金属失电子发生还原反应
B. 牺牲阳极的阴极保护法:被保护的金属应做负极
C. 外加电流阴极保护法:被保护的金属应与电源正极相连
D. 金属表面涂油漆:可避免金属与电解质溶液接触
2. 下列叙述正确的是( )
锌跟稀硫酸反应制,加入少量硫酸铜溶液能加快反应速率
镀层破损后,白口铁镀锌的铁比马口铁镀锡的铁更易腐蚀
电镀时,应把镀件置于电解槽的阴极
电解精炼铜时,纯铜连接电源负极,发生还原反应
钢铁表面常易腐蚀生成
酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀
为了降低水库铁闸门被腐蚀的速率,在铁闸门上焊接金属铜
A. 全部 B. C. D.
3. 下列叙述中正确的是( )
A. 电子工业中,用三氯化铁溶液腐蚀铜箔印刷线路板,发生的反应属于电化学腐蚀
B. 钢铁表面发生吸氧腐蚀时,钢铁表面水膜的增大
C. 如图所示的装置可防止铁钉生锈
D. 电解精炼铜时,阳极和阴极的质量变化相等
4. 家用暖气片大多用低碳钢材料制成,一旦生锈不仅影响美观,也会造成安全隐患。下列防止生锈的方法中,存在安全隐患的是( )
A. 在暖气片表面镀锡 B. 在暖气片表面涂漆
C. 在暖气片表面涂铝粉 D. 非供暖期在暖气内充满弱碱性的无氧水
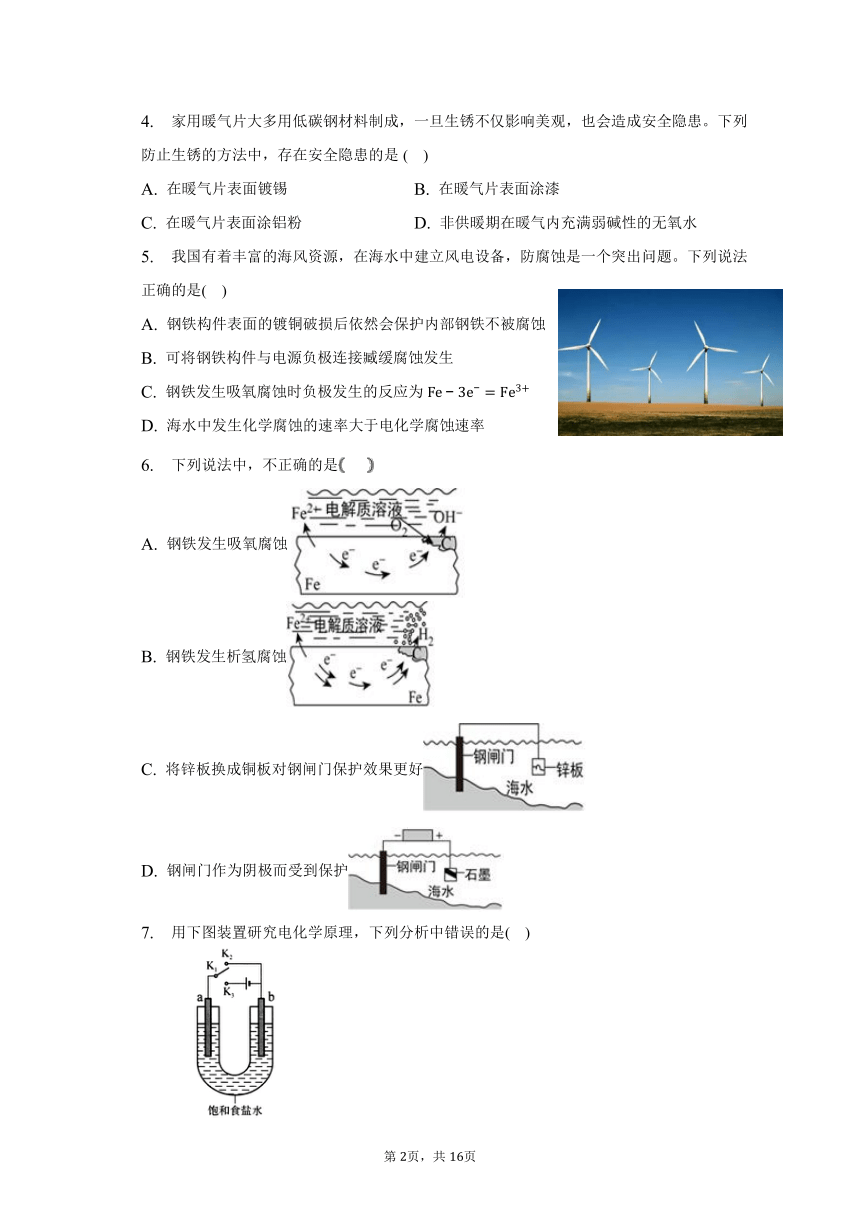
5. 我国有着丰富的海风资源,在海水中建立风电设备,防腐蚀是一个突出问题。下列说法正确的是( )
A. 钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀
B. 可将钢铁构件与电源负极连接臧缓腐蚀发生
C. 钢铁发生吸氧腐蚀时负极发生的反应为
D. 海水中发生化学腐蚀的速率大于电化学腐蚀速率
6. 下列说法中,不正确的是
A. 钢铁发生吸氧腐蚀
B. 钢铁发生析氢腐蚀
C. 将锌板换成铜板对钢闸门保护效果更好
D. 钢闸门作为阴极而受到保护
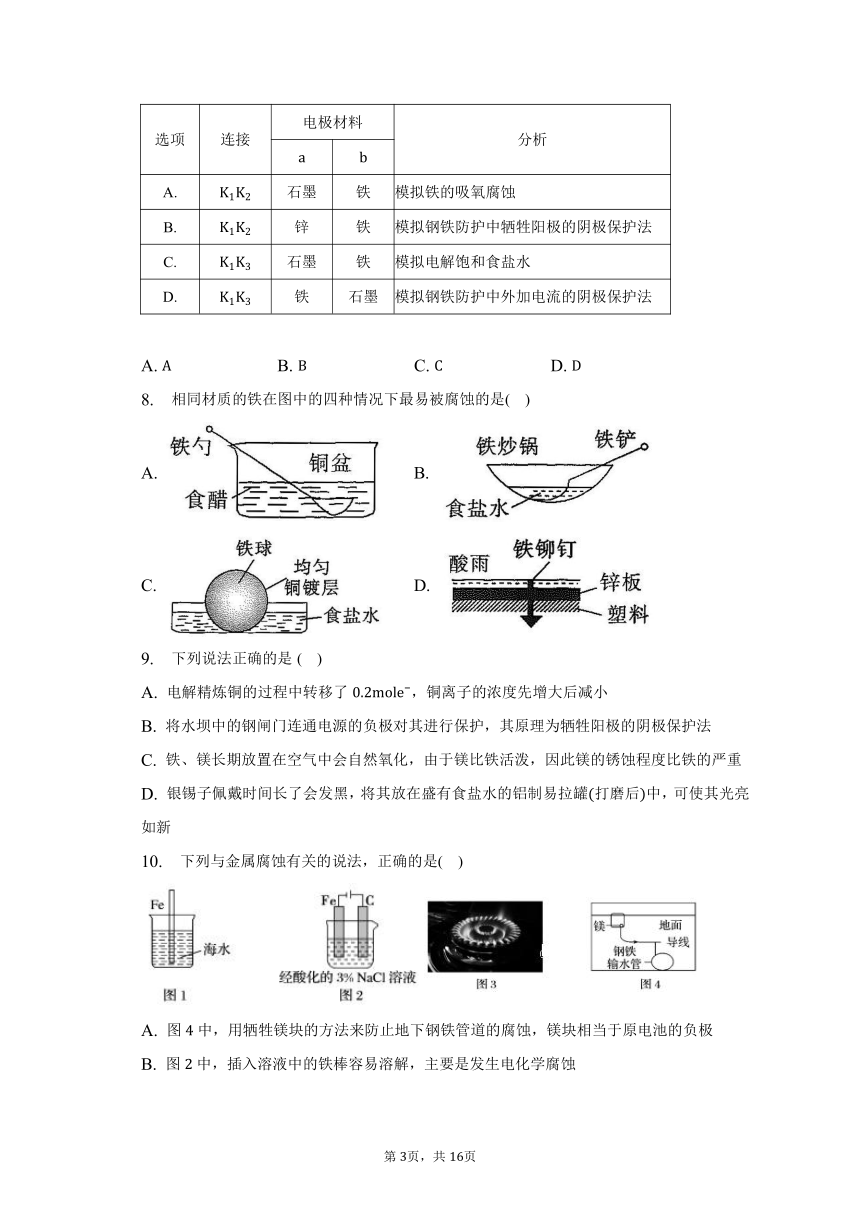
7. 用下图装置研究电化学原理,下列分析中错误的是( )
选项 连接 电极材料 分析
A. 石墨 铁 模拟铁的吸氧腐蚀
B. 锌 铁 模拟钢铁防护中牺牲阳极的阴极保护法
C. 石墨 铁 模拟电解饱和食盐水
D. 铁 石墨 模拟钢铁防护中外加电流的阴极保护法
A. B. C. D.
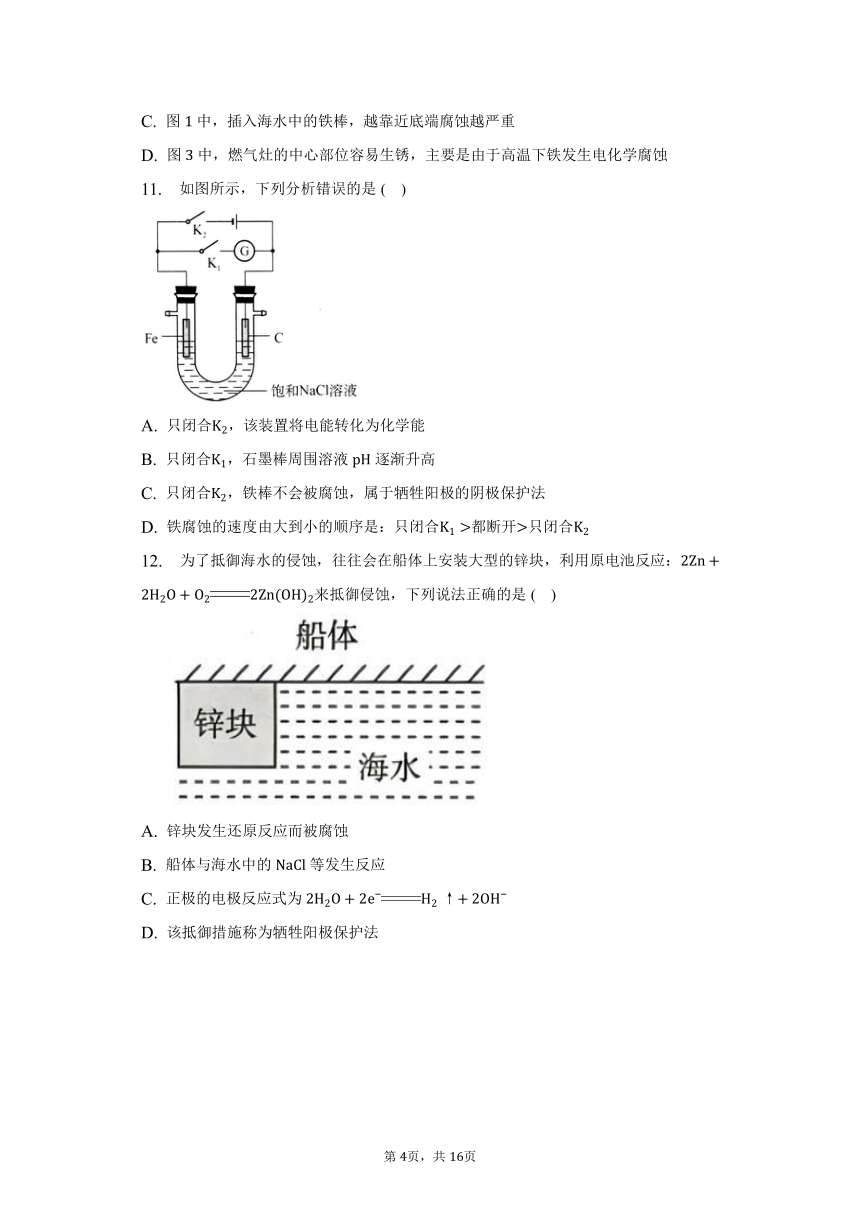
8. 相同材质的铁在图中的四种情况下最易被腐蚀的是( )
A. B.
C. D.
9. 下列说法正确的是( )
A. 电解精炼铜的过程中转移了,铜离子的浓度先增大后减小
B. 将水坝中的钢闸门连通电源的负极对其进行保护,其原理为牺牲阳极的阴极保护法
C. 铁、镁长期放置在空气中会自然氧化,由于镁比铁活泼,因此镁的锈蚀程度比铁的严重
D. 银锡子佩戴时间长了会发黑,将其放在盛有食盐水的铝制易拉罐打磨后中,可使其光亮如新
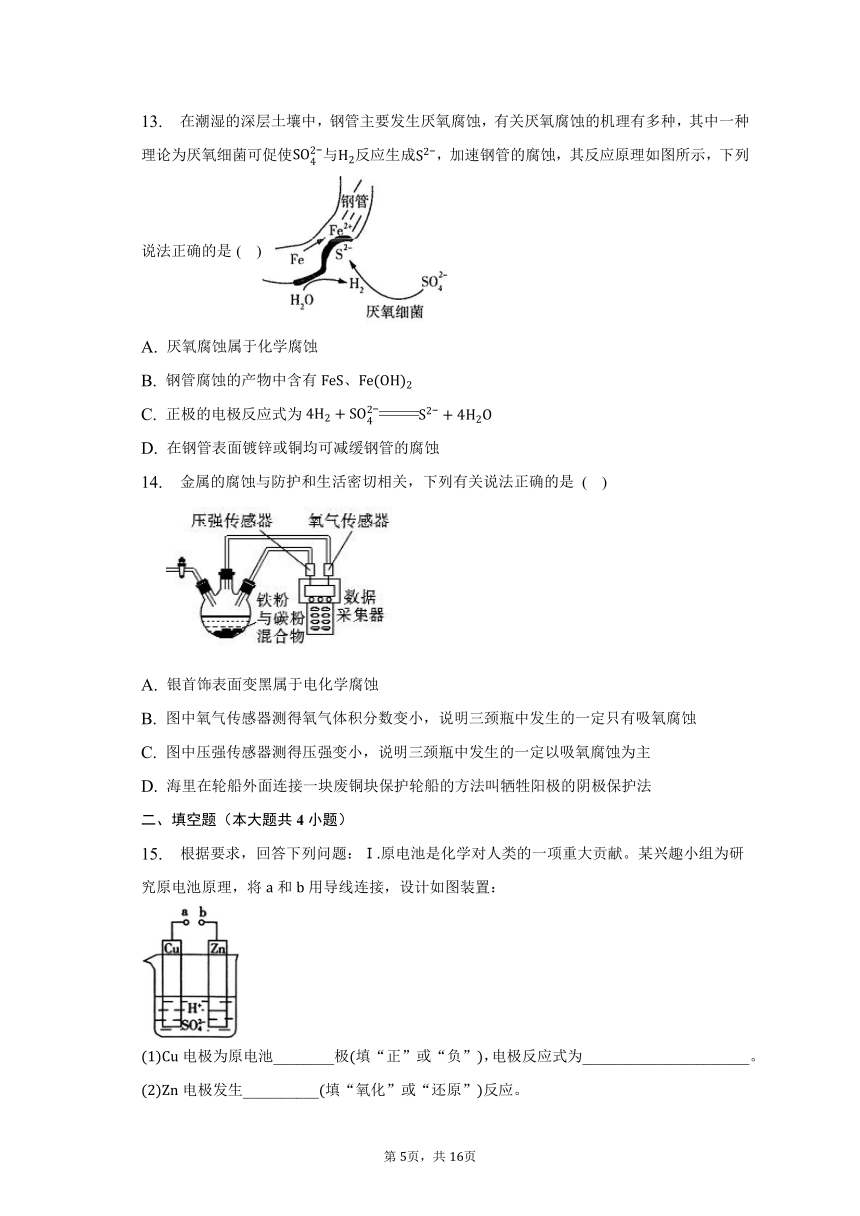
10. 下列与金属腐蚀有关的说法,正确的是( )
A. 图中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
B. 图中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀
C. 图中,插入海水中的铁棒,越靠近底端腐蚀越严重
D. 图中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀
11. 如图所示,下列分析错误的是( )
A. 只闭合,该装置将电能转化为化学能
B. 只闭合,石墨棒周围溶液逐渐升高
C. 只闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. 铁腐蚀的速度由大到小的顺序是:只闭合都断开只闭合
12. 为了抵御海水的侵蚀,往往会在船体上安装大型的锌块,利用原电池反应:来抵御侵蚀,下列说法正确的是( )
A. 锌块发生还原反应而被腐蚀
B. 船体与海水中的等发生反应
C. 正极的电极反应式为
D. 该抵御措施称为牺牲阳极保护法
13. 在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使与反应生成,加速钢管的腐蚀,其反应原理如图所示,下列说法正确的是( )
A. 厌氧腐蚀属于化学腐蚀
B. 钢管腐蚀的产物中含有、
C. 正极的电极反应式为
D. 在钢管表面镀锌或铜均可减缓钢管的腐蚀
14. 金属的腐蚀与防护和生活密切相关,下列有关说法正确的是 ( )
A. 银首饰表面变黑属于电化学腐蚀
B. 图中氧气传感器测得氧气体积分数变小,说明三颈瓶中发生的一定只有吸氧腐蚀
C. 图中压强传感器测得压强变小,说明三颈瓶中发生的一定以吸氧腐蚀为主
D. 海里在轮船外面连接一块废铜块保护轮船的方法叫牺牲阳极的阴极保护法
二、填空题(本大题共4小题)
15. 根据要求,回答下列问题:Ⅰ原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,将和用导线连接,设计如图装置:
电极为原电池________极填“正”或“负”,电极反应式为______________________。
电极发生__________填“氧化”或“还原”反应。
溶液中移向__________填“”或“”极。
当和不连接时,__________填“能”或“不能”形成原电池。
Ⅱ将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。
几分钟后,可观察到导管中的水柱__________。
A.升高 降低
水柱变化的原因是铁钉发生了电化学腐蚀中的__________。
A.析氢腐蚀 吸氧腐蚀
该电化学腐蚀的正极反应式为___________________________________。
16. 钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
利用下图装置,可以模拟铁的电化学防护。
若为碳棒,为减缓铁件的腐蚀,开关应置于________处。
若为锌,开关置于处,该电化学防护法称为________。
上图中若为粗铜,容器中海水替换为硫酸铜溶液,开关置于处,一段时间后,当铁件质量增加时,电极溶解的铜的质量________填“”“”或“”。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:_________________________________________________。
17. 呵护生存环境,共建和谐社会。
年月世界气候大会在坎昆召开,各国共商大计,控制温室气体的排放,下列属于温室气体的是___________________填序号。
自行车的部分构件有:钢圈 轮胎 车灯外壳。其中属于合金的是_________;属于有机合成材料的是_________每空只填一种构件的序号。
废旧的钢圈、轮胎应投入如图所示______填“”或“”标志的垃圾桶中。
某研究性学习小组探究金属锈蚀的条件,进行如下对照实验:
【实验现象】数天后铁钉锈蚀情况:无锈蚀,无锈蚀,有锈蚀:
【实验结论】金属锈蚀的条件是______________、___________________;
【结论分析】铁钉生锈主要属于___________腐蚀填“化学”或“电化学”;
【拓展应用】写出金属防护的一种常用方法____________________________________。
18. 氮氧化物是形成酸雨的成因之一,与其他污染物在一定条件下能产生光化学烟雾,加大对氮氧化物的处理是环境治理的重要研究内容。
催化是目前应用最广泛的烟气氮氧化物脱除技术。
已知:;
;;
则反应 _________用含、和的式子表示。
有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示电极未标出。回答下列有关问题:
电解池的阴极反应式为________。
通入空气一极的电极反应式为________。燃料电池中阳离子的移动方向是________“从左向右”或“从右向左”。
电解池中产生,理论上燃料电池中消耗标准状况下________。
、、由大到小的顺序为:________。
二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,可由在存在下与反应制得。请写出反应的离子方程式________。
下列叙述正确的是
钢铁发生析氢腐蚀时,得电子释放出,钢铁被腐蚀
钢铁发生吸氧腐蚀时,失电子释放出,钢铁被腐蚀
船底镶嵌锌块,锌发生还原反应而被消耗,以保护船体
外加电源的正极连接在海水中的钢铁闸门上,可保护闸门
答案和解析
1.【答案】
【解析】解:、金属无负价,故金属被腐蚀时化合价会升高,即是被氧化,金属失电子发生氧化反应,故A错误;
B、被保护的金属应做正极,此方法为牺牲阳极的阴极保护法,故B错误;
C、外加电流阴极保护法:被保护的金属应与电源负极相连,做电解池的阴极,故C错误;
D、金属表面涂油漆:可避免金属与电解质溶液接触,防止发生腐蚀,故D正确。
2.【答案】
【解答】
锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液后,金属锌可以置换金属铜,形成原电池,能加快反应速率,故正确;
白口铁镀锌的铁中,镀层破损后,为负极,被腐蚀的是,被保护,马口铁镀锡的铁中,为负极,被腐蚀的是,锡被保护,所以镀层破损后,白口铁镀锌的铁比马口铁镀锡的铁铁更耐腐蚀,故错误;
根据电镀原理中,镀件应置于电解槽的阴极,故正确;
用电解法精炼精铜时,纯铜作阴极,连接电源负极,发生还原反应,故正确;
钢铁吸氧腐蚀生成的铁锈的主要成分为,故正确;
一般来说酸性溶液中钢铁发生析氢腐蚀,即酸雨发生后易发生析氢腐蚀;弱酸性、中性和碱性时发生吸氧腐蚀,故炒完菜后铁锅发生吸氧腐蚀,故正确;
在铁闸门上焊接金属铜,形成原电池,铁作负极,加速被腐蚀,故错误。
3.【答案】
【解答】
A.用三氯化铁溶液腐蚀铜箔印刷线路板,直接发生氧化还原反应,是化学腐蚀,项错误;
B.钢铁表面发生吸氧腐蚀时,正极反应为,钢铁表面水膜的增大,项正确;
C.铁钉与电源的正极相连,作阳极,会加快铁钉的腐蚀,项错误;
D. 电解精炼铜时,阳极除了铜失去电子还会有其他活泼金属杂质失去电子,也有不活泼的金属沉降,阳极和阴极的质量变化不相等,项错误。
故选B。
4.【答案】
【解析】解:、在暖气片表面镀锡后,一旦锡层破损,则形成铁锡原电池,暖气片做负极被腐蚀,存在安全隐患,故A正确;
B、在暖气片表面涂漆能隔绝空气和水,故能防止暖气片被腐蚀,无安全隐患,故B错误;
C、在暖气片表面涂铝粉形成铁铝原电池,铁做正极被保护,无安全隐患,故C错误;
D、铁易在酸性或中性的环境下被腐蚀,在弱碱性、无氧的环境下不能被腐蚀,无安全隐患,故D错误。
故选:。
5.【答案】
【解答】
A.钢铁构件表面的镀铜破损后,为负极,为正极,被腐蚀的是,不能保护内部金属不被腐蚀,故A错误;
B.钢铁与电源负极连接作阴极,可以减缓腐蚀,故B正确;
C.钢铁发生吸氧腐蚀时负极发生的反应为,故C错误;
D.海水中发生化学腐蚀的速率小于电化学腐蚀速率,故D错误。
6.【答案】
【解答】
A、当钢铁表面的水膜酸性很弱或显中性时,铁在负极放电,氧气在正极上放电,发生的是钢铁的吸氧腐蚀,故A正确;
B、当钢铁表面的水膜显酸性时,铁在负极放电,水膜中的氢离子在正极放电生成氢气,发生的是析氢腐蚀,故B正确;
C、在原电池中,正极被保护,当将锌板换成铜板后,铜做正极被保护,钢闸门做负极被腐蚀,起不到对钢闸门的保护作用,故C错误;
D、在电解池中,阴极被保护,钢闸门连接电源负极做电解池的阴极,故D正确.
故选C。
7.【答案】
A. 石墨、铁、食盐水构成原电池,模拟铁的吸氧腐蚀,故A正确;
B. 锌、铁、食盐水构成原电池,锌作为负极,对正极的铁起到了保护作用,故可模拟钢铁防护中牺牲阳极的阴极保护法,即B正确;
C. 阳极石墨、阴极铁电解饱和食盐水是可以的,故C正确;
D. 铁做阳极会加快腐蚀,而不能被保护,故D错误。
故选D。
8.【答案】
【解答】
A.食醋为酸性溶液,提供电解质溶液环境,铁勺和铜盆是相互接触的两个金属板,构成原电池的两极,形成原电池,酸性溶液中,铁是活泼金属,作负极,腐蚀快;
B.铁炒锅和铁铲都是铁碳合金,食盐水提供电解质环境,虽然符合原电池形成的条件,但腐蚀相对中酸性溶液较慢;
C.铜镀层将铁球覆盖,使铁被保护,所以铁不易被腐蚀;
D.酸雨提供电解质溶液环境,铁铆钉和锌板分别作正、负极,形成原电池,铁被保护。
综合上述,最易被腐蚀的是。
故选A。
9.【答案】
【解答】
A.电解精炼铜时,阳极上是粗铜,粗铜失电子变成铜离子,阴极上是纯铜,铜离子得电子转化为铜,电解液通常为硫酸铜,粗铜中还含有铁、锌等活动性强于铜的金属,这些金属也会失电子变成离子,故铜离子浓度会有所减小,A错误;
B.将水坝的钢闸门连接电源负极进行保护,原理为“外加电流的阴极保护法”,B错误;
C.镁被空气氧化后可在表面形成一层致密的氧化膜,该氧化膜保护内层金属不被继续氧化,铁不能形成致密的氧化膜,内层金属也会被氧化,所以铁的锈蚀程度更严重,C错误;
D.将发黑的银锡子放入盛有食盐水的铝制易拉罐中,可构成原电池,负极铝失电子,正极硫化银得电子生成银单质,故可使其光亮如新,D正确;
故答案选D。
10.【答案】
【解答】
A.图中,镁比铁活泼,镁块和输水管相连形成原电池时,镁作负极,从而保护钢铁管道不被腐蚀,故A正确。
B.图中,铁与电源的负极相连,为电解池的阴极,溶液中氯离子在石墨棒上放电生成氯气,铁棒不发生放电,不易腐蚀,故B错误;
C.由钢铁的吸氧腐蚀原理可知,图中,插入海水中的铁棒,铁棒在水面的位置处腐蚀越严重,故C错误;
D.图中,燃气灶的中心部位容易生锈,主要是由于高温下铁与氧气发生了反应,发生了化学腐蚀,故D错误。
11.【答案】
【解答】
A.只闭合,构成电解池,该装置将电能转化为化学能,故A正确;
B.闭合,构成原电池,石墨棒是正极,发生氧气得电子的还原反应,该电极附近产生氢氧根离子,所以周围溶液逐渐升高,故B正确;
C.只闭合,构成电解池,铁棒是阴极,被保护,属于外加电源阴极保护法,故C错误;
D.闭合,构成原电池,是负极,腐蚀较快;都断开,金属铁发生化学腐蚀,腐蚀较慢;只闭合构成电解池,铁棒是阴极,铁被保护,金属腐蚀速率:电解池的阳极原电池的负极化学腐蚀原电池的正极电解池的阴极,所以铁腐蚀的速度由大到小的顺序是:只闭合都断开只闭合,故D正确。
故选C。
12.【答案】
【解析】错,在船体上安装大型的锌块可以构成锌铁海水原电池,锌的金属性强于铁,锌作负极,失去电子发生氧化反应而被腐蚀。
错,在船体上安装大型的锌块可以构成锌一铁一海水原电池,反应的实质是锌与海水中溶解的氧气反应,不是船体与海水中的等发生反应。
错,在船体上安装大型的锌块可以构成锌铁海水原电池,氧气在正极上得到电子发生还原反应,电极反应式为。
13.【答案】
【解析】错,厌氧腐蚀时,有新的物质生成,且有电流产生,属于电化学腐蚀;
对,钢铁发生析氢腐蚀,负极反应式是,正极反应式为,与的反应可表示为,亚铁离子和硫离子反应生成硫化亚铁,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,所以钢管腐蚀的直接产物中含有、;
错,在潮湿的深层土壤中钢管主要发生厌氧腐蚀,没有氧气参与反应,正极上水发生还原反应生成,电极反应式为;
错,在钢管表面镀锌时,若表面破损,锌作原电池的负极,则钢管作正极,能减缓钢管的腐蚀,在钢管的表面镀铜,若表面未破损时,能够保护钢管,但表面破损时,钢管作负极,能加快钢管的腐蚀速率。
14.【答案】
【解析】A.银首饰表面变黑,是因为银直接被氧化所致,为化学腐蚀,故A错误;
B.由图可知,构成电化学腐蚀时,正极上氧气得到电子,可使氧气的体积分数减小,但传感器测得氧气体积分数变小也可能与析氢腐蚀生成氢气有关,故B错误;
C.吸氧腐蚀消耗氧气,从而导致压强降低,析氢腐蚀产生氢气,导致压强增大,现在压强变小,说明三颈瓶中发生的一定以吸氧腐蚀为主,故C正确;
D.海里在轮船外面连接一块废铜块,构成原电池,可加快的腐蚀,应连接块保护轮船的方法叫牺牲阳极的阴极保护法,故D错误;
15.【答案】Ⅰ正;
氧化
不能
Ⅱ
【解答】
Ⅰ该装置中比活泼,电极为原电池的正极,溶液中在正极发生还原反应,电极反应为:。
电极为原电池的负极,发生氧化反应。
溶液中移向正极,即极。
当和不连接时,不能形成闭合回路,不能形成原电池。
Ⅱ该装置为金属的吸氧腐蚀,几分钟后,大试管中压强减小,因此可观察到导管中的水柱降低。
水柱变化的原因是铁钉发生了电化学腐蚀中的吸氧腐蚀。
该电化学腐蚀的正极上发生还原反应,电极反应式为。
16.【答案】
牺牲阳极的阴极保护法或牺牲阳极保护法
;在潮湿的环境中构成原电池,铁是负极,加速腐蚀
【解答】
铁锈的成分为,能和盐酸反应生成和水,当铁锈除尽后,溶液中发生的化合反应是和的反应,化学方程式为:,
故答案为:;
若为碳棒,由于比较活泼,为减缓铁的腐蚀,应使为电解池的阴极即连接电源的负极,故K连接处;
故答案为:;
若为锌,开关置于处,为阳极被腐蚀,为阴极被保护,该防护法称为牺牲阳极的阴极保护法;
故答案为:牺牲阳极的阴极保护法或牺牲阳极保护法;
图中若为粗铜,此装置为电解精炼铜装置,阴极反应:,但是阳极上先是比铜活泼的金属失电子,再是铜失电子,铁件质量增加,结合电子守恒,电极溶解的铜的质量小于,镀铜铁在潮湿环境中构成原电池,铁是负极,加速腐蚀,铁不被保护,而镀锌铁在潮湿环境中构成原电池,锌是负极,铁被保护,所以镀铜铁反而更易被腐蚀;
故答案为:;在潮湿的环境中构成原电池,铁是负极,加速腐蚀。
17.【答案】
或
空气 水 电化学 喷漆或其它合理答案
【解答】
二氧化碳属于温室气体,故正确,故填:;
自行车部件中,钢圈是由一种金属与非金属熔合而成的具有金属特性的物质,属于合金;轮胎、车灯外壳都属于有机合成材料,故填:;或;
废旧的钢圈、轮胎都是可以再回收利用的物质,故填:;
【实验结论】通过实验现象:中铁钉与水接触但是与氧气隔绝不被腐蚀;中铁钉与氧气接触但是与水隔绝不被腐蚀;铁钉与氧气、水接触发生腐蚀,可知金属的腐蚀条件是在水和氧同时存在的环境或接触潮湿的空气,故填:空气;水;
【结论分析】铁钉在潮湿的空气中容易发生的腐蚀是电化学腐蚀,电化学腐蚀又分为吸氧腐蚀和析氢腐蚀,在酸性介质中发生析氢腐蚀,在中性或弱碱性环境下发生吸氧腐蚀,铁钉在水中发生吸氧腐蚀,故填:电化学;
【拓展应用】金属防护的方法金属腐蚀的防护主要方法有:改变金属的内部结构.例如,把铬、镍加入普通钢中制成不锈钢.在金属表面覆盖保护层。例如,在金属表面涂漆、电镀或用化学方法形成致密耐腐蚀的氧化膜等。电化学保护法:外加电流的阴极保护法、牺牲阳极的阴极保护法。故填:刷油漆外接电源的阴极保护法。
18.【答案】;
或
;从左向右
【解答】
根据盖斯定律:,故反应热为:;
电解池阴极水电离出的氢离子得电子生成氢气,所以反应式为:或
根据燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,正极是氧气发生得电子得还原反应,则通空气的电极为正极;电极反应式为: 原电池中,阳离子交换膜使阳离子通过,阳离子移向正极,所以阳离子的移动方向是从左向右;
电解池中产生,依据电子守恒,结合电极反应式,,计算得到生成氧气;即在标准状况下的体积为
燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生,所以反应后氢氧化钠的浓度升高,即小于,负极氢气失电子生成氢离子消耗氢氧根离子,所以,得到,即;
在存在下与反应,充当氧化剂,充当还原剂,
故离子方程式为;
钢铁发生析氢腐蚀时,得电子释放出,铁在负极失电子生成而被腐蚀,故选项正确;
吸氧腐蚀,铁在负极失电子生成而被腐蚀,氧气在正极得电子,转化为,故选项错误;
船底镶嵌锌块,锌做负极,失电子,发生氧化反应,故选项错误;
外加电源保护法,应把要保护的金属连接在电源的负极,故选项错误。答案选。
第1页,共1页
一、单选题(本大题共14小题)
1. 对金属腐蚀及防护的表述正确的是( )
A. 金属腐蚀的本质:金属失电子发生还原反应
B. 牺牲阳极的阴极保护法:被保护的金属应做负极
C. 外加电流阴极保护法:被保护的金属应与电源正极相连
D. 金属表面涂油漆:可避免金属与电解质溶液接触
2. 下列叙述正确的是( )
锌跟稀硫酸反应制,加入少量硫酸铜溶液能加快反应速率
镀层破损后,白口铁镀锌的铁比马口铁镀锡的铁更易腐蚀
电镀时,应把镀件置于电解槽的阴极
电解精炼铜时,纯铜连接电源负极,发生还原反应
钢铁表面常易腐蚀生成
酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀
为了降低水库铁闸门被腐蚀的速率,在铁闸门上焊接金属铜
A. 全部 B. C. D.
3. 下列叙述中正确的是( )
A. 电子工业中,用三氯化铁溶液腐蚀铜箔印刷线路板,发生的反应属于电化学腐蚀
B. 钢铁表面发生吸氧腐蚀时,钢铁表面水膜的增大
C. 如图所示的装置可防止铁钉生锈
D. 电解精炼铜时,阳极和阴极的质量变化相等
4. 家用暖气片大多用低碳钢材料制成,一旦生锈不仅影响美观,也会造成安全隐患。下列防止生锈的方法中,存在安全隐患的是( )
A. 在暖气片表面镀锡 B. 在暖气片表面涂漆
C. 在暖气片表面涂铝粉 D. 非供暖期在暖气内充满弱碱性的无氧水
5. 我国有着丰富的海风资源,在海水中建立风电设备,防腐蚀是一个突出问题。下列说法正确的是( )
A. 钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀
B. 可将钢铁构件与电源负极连接臧缓腐蚀发生
C. 钢铁发生吸氧腐蚀时负极发生的反应为
D. 海水中发生化学腐蚀的速率大于电化学腐蚀速率
6. 下列说法中,不正确的是
A. 钢铁发生吸氧腐蚀
B. 钢铁发生析氢腐蚀
C. 将锌板换成铜板对钢闸门保护效果更好
D. 钢闸门作为阴极而受到保护
7. 用下图装置研究电化学原理,下列分析中错误的是( )
选项 连接 电极材料 分析
A. 石墨 铁 模拟铁的吸氧腐蚀
B. 锌 铁 模拟钢铁防护中牺牲阳极的阴极保护法
C. 石墨 铁 模拟电解饱和食盐水
D. 铁 石墨 模拟钢铁防护中外加电流的阴极保护法
A. B. C. D.
8. 相同材质的铁在图中的四种情况下最易被腐蚀的是( )
A. B.
C. D.
9. 下列说法正确的是( )
A. 电解精炼铜的过程中转移了,铜离子的浓度先增大后减小
B. 将水坝中的钢闸门连通电源的负极对其进行保护,其原理为牺牲阳极的阴极保护法
C. 铁、镁长期放置在空气中会自然氧化,由于镁比铁活泼,因此镁的锈蚀程度比铁的严重
D. 银锡子佩戴时间长了会发黑,将其放在盛有食盐水的铝制易拉罐打磨后中,可使其光亮如新
10. 下列与金属腐蚀有关的说法,正确的是( )
A. 图中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
B. 图中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀
C. 图中,插入海水中的铁棒,越靠近底端腐蚀越严重
D. 图中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀
11. 如图所示,下列分析错误的是( )
A. 只闭合,该装置将电能转化为化学能
B. 只闭合,石墨棒周围溶液逐渐升高
C. 只闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. 铁腐蚀的速度由大到小的顺序是:只闭合都断开只闭合
12. 为了抵御海水的侵蚀,往往会在船体上安装大型的锌块,利用原电池反应:来抵御侵蚀,下列说法正确的是( )
A. 锌块发生还原反应而被腐蚀
B. 船体与海水中的等发生反应
C. 正极的电极反应式为
D. 该抵御措施称为牺牲阳极保护法
13. 在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使与反应生成,加速钢管的腐蚀,其反应原理如图所示,下列说法正确的是( )
A. 厌氧腐蚀属于化学腐蚀
B. 钢管腐蚀的产物中含有、
C. 正极的电极反应式为
D. 在钢管表面镀锌或铜均可减缓钢管的腐蚀
14. 金属的腐蚀与防护和生活密切相关,下列有关说法正确的是 ( )
A. 银首饰表面变黑属于电化学腐蚀
B. 图中氧气传感器测得氧气体积分数变小,说明三颈瓶中发生的一定只有吸氧腐蚀
C. 图中压强传感器测得压强变小,说明三颈瓶中发生的一定以吸氧腐蚀为主
D. 海里在轮船外面连接一块废铜块保护轮船的方法叫牺牲阳极的阴极保护法
二、填空题(本大题共4小题)
15. 根据要求,回答下列问题:Ⅰ原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,将和用导线连接,设计如图装置:
电极为原电池________极填“正”或“负”,电极反应式为______________________。
电极发生__________填“氧化”或“还原”反应。
溶液中移向__________填“”或“”极。
当和不连接时,__________填“能”或“不能”形成原电池。
Ⅱ将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。
几分钟后,可观察到导管中的水柱__________。
A.升高 降低
水柱变化的原因是铁钉发生了电化学腐蚀中的__________。
A.析氢腐蚀 吸氧腐蚀
该电化学腐蚀的正极反应式为___________________________________。
16. 钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
利用下图装置,可以模拟铁的电化学防护。
若为碳棒,为减缓铁件的腐蚀,开关应置于________处。
若为锌,开关置于处,该电化学防护法称为________。
上图中若为粗铜,容器中海水替换为硫酸铜溶液,开关置于处,一段时间后,当铁件质量增加时,电极溶解的铜的质量________填“”“”或“”。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:_________________________________________________。
17. 呵护生存环境,共建和谐社会。
年月世界气候大会在坎昆召开,各国共商大计,控制温室气体的排放,下列属于温室气体的是___________________填序号。
自行车的部分构件有:钢圈 轮胎 车灯外壳。其中属于合金的是_________;属于有机合成材料的是_________每空只填一种构件的序号。
废旧的钢圈、轮胎应投入如图所示______填“”或“”标志的垃圾桶中。
某研究性学习小组探究金属锈蚀的条件,进行如下对照实验:
【实验现象】数天后铁钉锈蚀情况:无锈蚀,无锈蚀,有锈蚀:
【实验结论】金属锈蚀的条件是______________、___________________;
【结论分析】铁钉生锈主要属于___________腐蚀填“化学”或“电化学”;
【拓展应用】写出金属防护的一种常用方法____________________________________。
18. 氮氧化物是形成酸雨的成因之一,与其他污染物在一定条件下能产生光化学烟雾,加大对氮氧化物的处理是环境治理的重要研究内容。
催化是目前应用最广泛的烟气氮氧化物脱除技术。
已知:;
;;
则反应 _________用含、和的式子表示。
有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示电极未标出。回答下列有关问题:
电解池的阴极反应式为________。
通入空气一极的电极反应式为________。燃料电池中阳离子的移动方向是________“从左向右”或“从右向左”。
电解池中产生,理论上燃料电池中消耗标准状况下________。
、、由大到小的顺序为:________。
二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,可由在存在下与反应制得。请写出反应的离子方程式________。
下列叙述正确的是
钢铁发生析氢腐蚀时,得电子释放出,钢铁被腐蚀
钢铁发生吸氧腐蚀时,失电子释放出,钢铁被腐蚀
船底镶嵌锌块,锌发生还原反应而被消耗,以保护船体
外加电源的正极连接在海水中的钢铁闸门上,可保护闸门
答案和解析
1.【答案】
【解析】解:、金属无负价,故金属被腐蚀时化合价会升高,即是被氧化,金属失电子发生氧化反应,故A错误;
B、被保护的金属应做正极,此方法为牺牲阳极的阴极保护法,故B错误;
C、外加电流阴极保护法:被保护的金属应与电源负极相连,做电解池的阴极,故C错误;
D、金属表面涂油漆:可避免金属与电解质溶液接触,防止发生腐蚀,故D正确。
2.【答案】
【解答】
锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液后,金属锌可以置换金属铜,形成原电池,能加快反应速率,故正确;
白口铁镀锌的铁中,镀层破损后,为负极,被腐蚀的是,被保护,马口铁镀锡的铁中,为负极,被腐蚀的是,锡被保护,所以镀层破损后,白口铁镀锌的铁比马口铁镀锡的铁铁更耐腐蚀,故错误;
根据电镀原理中,镀件应置于电解槽的阴极,故正确;
用电解法精炼精铜时,纯铜作阴极,连接电源负极,发生还原反应,故正确;
钢铁吸氧腐蚀生成的铁锈的主要成分为,故正确;
一般来说酸性溶液中钢铁发生析氢腐蚀,即酸雨发生后易发生析氢腐蚀;弱酸性、中性和碱性时发生吸氧腐蚀,故炒完菜后铁锅发生吸氧腐蚀,故正确;
在铁闸门上焊接金属铜,形成原电池,铁作负极,加速被腐蚀,故错误。
3.【答案】
【解答】
A.用三氯化铁溶液腐蚀铜箔印刷线路板,直接发生氧化还原反应,是化学腐蚀,项错误;
B.钢铁表面发生吸氧腐蚀时,正极反应为,钢铁表面水膜的增大,项正确;
C.铁钉与电源的正极相连,作阳极,会加快铁钉的腐蚀,项错误;
D. 电解精炼铜时,阳极除了铜失去电子还会有其他活泼金属杂质失去电子,也有不活泼的金属沉降,阳极和阴极的质量变化不相等,项错误。
故选B。
4.【答案】
【解析】解:、在暖气片表面镀锡后,一旦锡层破损,则形成铁锡原电池,暖气片做负极被腐蚀,存在安全隐患,故A正确;
B、在暖气片表面涂漆能隔绝空气和水,故能防止暖气片被腐蚀,无安全隐患,故B错误;
C、在暖气片表面涂铝粉形成铁铝原电池,铁做正极被保护,无安全隐患,故C错误;
D、铁易在酸性或中性的环境下被腐蚀,在弱碱性、无氧的环境下不能被腐蚀,无安全隐患,故D错误。
故选:。
5.【答案】
【解答】
A.钢铁构件表面的镀铜破损后,为负极,为正极,被腐蚀的是,不能保护内部金属不被腐蚀,故A错误;
B.钢铁与电源负极连接作阴极,可以减缓腐蚀,故B正确;
C.钢铁发生吸氧腐蚀时负极发生的反应为,故C错误;
D.海水中发生化学腐蚀的速率小于电化学腐蚀速率,故D错误。
6.【答案】
【解答】
A、当钢铁表面的水膜酸性很弱或显中性时,铁在负极放电,氧气在正极上放电,发生的是钢铁的吸氧腐蚀,故A正确;
B、当钢铁表面的水膜显酸性时,铁在负极放电,水膜中的氢离子在正极放电生成氢气,发生的是析氢腐蚀,故B正确;
C、在原电池中,正极被保护,当将锌板换成铜板后,铜做正极被保护,钢闸门做负极被腐蚀,起不到对钢闸门的保护作用,故C错误;
D、在电解池中,阴极被保护,钢闸门连接电源负极做电解池的阴极,故D正确.
故选C。
7.【答案】
A. 石墨、铁、食盐水构成原电池,模拟铁的吸氧腐蚀,故A正确;
B. 锌、铁、食盐水构成原电池,锌作为负极,对正极的铁起到了保护作用,故可模拟钢铁防护中牺牲阳极的阴极保护法,即B正确;
C. 阳极石墨、阴极铁电解饱和食盐水是可以的,故C正确;
D. 铁做阳极会加快腐蚀,而不能被保护,故D错误。
故选D。
8.【答案】
【解答】
A.食醋为酸性溶液,提供电解质溶液环境,铁勺和铜盆是相互接触的两个金属板,构成原电池的两极,形成原电池,酸性溶液中,铁是活泼金属,作负极,腐蚀快;
B.铁炒锅和铁铲都是铁碳合金,食盐水提供电解质环境,虽然符合原电池形成的条件,但腐蚀相对中酸性溶液较慢;
C.铜镀层将铁球覆盖,使铁被保护,所以铁不易被腐蚀;
D.酸雨提供电解质溶液环境,铁铆钉和锌板分别作正、负极,形成原电池,铁被保护。
综合上述,最易被腐蚀的是。
故选A。
9.【答案】
【解答】
A.电解精炼铜时,阳极上是粗铜,粗铜失电子变成铜离子,阴极上是纯铜,铜离子得电子转化为铜,电解液通常为硫酸铜,粗铜中还含有铁、锌等活动性强于铜的金属,这些金属也会失电子变成离子,故铜离子浓度会有所减小,A错误;
B.将水坝的钢闸门连接电源负极进行保护,原理为“外加电流的阴极保护法”,B错误;
C.镁被空气氧化后可在表面形成一层致密的氧化膜,该氧化膜保护内层金属不被继续氧化,铁不能形成致密的氧化膜,内层金属也会被氧化,所以铁的锈蚀程度更严重,C错误;
D.将发黑的银锡子放入盛有食盐水的铝制易拉罐中,可构成原电池,负极铝失电子,正极硫化银得电子生成银单质,故可使其光亮如新,D正确;
故答案选D。
10.【答案】
【解答】
A.图中,镁比铁活泼,镁块和输水管相连形成原电池时,镁作负极,从而保护钢铁管道不被腐蚀,故A正确。
B.图中,铁与电源的负极相连,为电解池的阴极,溶液中氯离子在石墨棒上放电生成氯气,铁棒不发生放电,不易腐蚀,故B错误;
C.由钢铁的吸氧腐蚀原理可知,图中,插入海水中的铁棒,铁棒在水面的位置处腐蚀越严重,故C错误;
D.图中,燃气灶的中心部位容易生锈,主要是由于高温下铁与氧气发生了反应,发生了化学腐蚀,故D错误。
11.【答案】
【解答】
A.只闭合,构成电解池,该装置将电能转化为化学能,故A正确;
B.闭合,构成原电池,石墨棒是正极,发生氧气得电子的还原反应,该电极附近产生氢氧根离子,所以周围溶液逐渐升高,故B正确;
C.只闭合,构成电解池,铁棒是阴极,被保护,属于外加电源阴极保护法,故C错误;
D.闭合,构成原电池,是负极,腐蚀较快;都断开,金属铁发生化学腐蚀,腐蚀较慢;只闭合构成电解池,铁棒是阴极,铁被保护,金属腐蚀速率:电解池的阳极原电池的负极化学腐蚀原电池的正极电解池的阴极,所以铁腐蚀的速度由大到小的顺序是:只闭合都断开只闭合,故D正确。
故选C。
12.【答案】
【解析】错,在船体上安装大型的锌块可以构成锌铁海水原电池,锌的金属性强于铁,锌作负极,失去电子发生氧化反应而被腐蚀。
错,在船体上安装大型的锌块可以构成锌一铁一海水原电池,反应的实质是锌与海水中溶解的氧气反应,不是船体与海水中的等发生反应。
错,在船体上安装大型的锌块可以构成锌铁海水原电池,氧气在正极上得到电子发生还原反应,电极反应式为。
13.【答案】
【解析】错,厌氧腐蚀时,有新的物质生成,且有电流产生,属于电化学腐蚀;
对,钢铁发生析氢腐蚀,负极反应式是,正极反应式为,与的反应可表示为,亚铁离子和硫离子反应生成硫化亚铁,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,所以钢管腐蚀的直接产物中含有、;
错,在潮湿的深层土壤中钢管主要发生厌氧腐蚀,没有氧气参与反应,正极上水发生还原反应生成,电极反应式为;
错,在钢管表面镀锌时,若表面破损,锌作原电池的负极,则钢管作正极,能减缓钢管的腐蚀,在钢管的表面镀铜,若表面未破损时,能够保护钢管,但表面破损时,钢管作负极,能加快钢管的腐蚀速率。
14.【答案】
【解析】A.银首饰表面变黑,是因为银直接被氧化所致,为化学腐蚀,故A错误;
B.由图可知,构成电化学腐蚀时,正极上氧气得到电子,可使氧气的体积分数减小,但传感器测得氧气体积分数变小也可能与析氢腐蚀生成氢气有关,故B错误;
C.吸氧腐蚀消耗氧气,从而导致压强降低,析氢腐蚀产生氢气,导致压强增大,现在压强变小,说明三颈瓶中发生的一定以吸氧腐蚀为主,故C正确;
D.海里在轮船外面连接一块废铜块,构成原电池,可加快的腐蚀,应连接块保护轮船的方法叫牺牲阳极的阴极保护法,故D错误;
15.【答案】Ⅰ正;
氧化
不能
Ⅱ
【解答】
Ⅰ该装置中比活泼,电极为原电池的正极,溶液中在正极发生还原反应,电极反应为:。
电极为原电池的负极,发生氧化反应。
溶液中移向正极,即极。
当和不连接时,不能形成闭合回路,不能形成原电池。
Ⅱ该装置为金属的吸氧腐蚀,几分钟后,大试管中压强减小,因此可观察到导管中的水柱降低。
水柱变化的原因是铁钉发生了电化学腐蚀中的吸氧腐蚀。
该电化学腐蚀的正极上发生还原反应,电极反应式为。
16.【答案】
牺牲阳极的阴极保护法或牺牲阳极保护法
;在潮湿的环境中构成原电池,铁是负极,加速腐蚀
【解答】
铁锈的成分为,能和盐酸反应生成和水,当铁锈除尽后,溶液中发生的化合反应是和的反应,化学方程式为:,
故答案为:;
若为碳棒,由于比较活泼,为减缓铁的腐蚀,应使为电解池的阴极即连接电源的负极,故K连接处;
故答案为:;
若为锌,开关置于处,为阳极被腐蚀,为阴极被保护,该防护法称为牺牲阳极的阴极保护法;
故答案为:牺牲阳极的阴极保护法或牺牲阳极保护法;
图中若为粗铜,此装置为电解精炼铜装置,阴极反应:,但是阳极上先是比铜活泼的金属失电子,再是铜失电子,铁件质量增加,结合电子守恒,电极溶解的铜的质量小于,镀铜铁在潮湿环境中构成原电池,铁是负极,加速腐蚀,铁不被保护,而镀锌铁在潮湿环境中构成原电池,锌是负极,铁被保护,所以镀铜铁反而更易被腐蚀;
故答案为:;在潮湿的环境中构成原电池,铁是负极,加速腐蚀。
17.【答案】
或
空气 水 电化学 喷漆或其它合理答案
【解答】
二氧化碳属于温室气体,故正确,故填:;
自行车部件中,钢圈是由一种金属与非金属熔合而成的具有金属特性的物质,属于合金;轮胎、车灯外壳都属于有机合成材料,故填:;或;
废旧的钢圈、轮胎都是可以再回收利用的物质,故填:;
【实验结论】通过实验现象:中铁钉与水接触但是与氧气隔绝不被腐蚀;中铁钉与氧气接触但是与水隔绝不被腐蚀;铁钉与氧气、水接触发生腐蚀,可知金属的腐蚀条件是在水和氧同时存在的环境或接触潮湿的空气,故填:空气;水;
【结论分析】铁钉在潮湿的空气中容易发生的腐蚀是电化学腐蚀,电化学腐蚀又分为吸氧腐蚀和析氢腐蚀,在酸性介质中发生析氢腐蚀,在中性或弱碱性环境下发生吸氧腐蚀,铁钉在水中发生吸氧腐蚀,故填:电化学;
【拓展应用】金属防护的方法金属腐蚀的防护主要方法有:改变金属的内部结构.例如,把铬、镍加入普通钢中制成不锈钢.在金属表面覆盖保护层。例如,在金属表面涂漆、电镀或用化学方法形成致密耐腐蚀的氧化膜等。电化学保护法:外加电流的阴极保护法、牺牲阳极的阴极保护法。故填:刷油漆外接电源的阴极保护法。
18.【答案】;
或
;从左向右
【解答】
根据盖斯定律:,故反应热为:;
电解池阴极水电离出的氢离子得电子生成氢气,所以反应式为:或
根据燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,正极是氧气发生得电子得还原反应,则通空气的电极为正极;电极反应式为: 原电池中,阳离子交换膜使阳离子通过,阳离子移向正极,所以阳离子的移动方向是从左向右;
电解池中产生,依据电子守恒,结合电极反应式,,计算得到生成氧气;即在标准状况下的体积为
燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生,所以反应后氢氧化钠的浓度升高,即小于,负极氢气失电子生成氢离子消耗氢氧根离子,所以,得到,即;
在存在下与反应,充当氧化剂,充当还原剂,
故离子方程式为;
钢铁发生析氢腐蚀时,得电子释放出,铁在负极失电子生成而被腐蚀,故选项正确;
吸氧腐蚀,铁在负极失电子生成而被腐蚀,氧气在正极得电子,转化为,故选项错误;
船底镶嵌锌块,锌做负极,失电子,发生氧化反应,故选项错误;
外加电源保护法,应把要保护的金属连接在电源的负极,故选项错误。答案选。
第1页,共1页
